Влияние пролактина на качество ооцитов, полученных методом трансвагинальной пункции фолликулов телок
Автор: Сингина Г.Н., Чинаров Р.Ю., Луканина В.А., Ворожбит Т.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Репродуктивные биотехнологии
Статья в выпуске: 6 т.56, 2021 года.
Бесплатный доступ
Как в молочном, так и в мясном скотоводстве актуально получение как можно большего числа потомков от лучших матерей с целью повышения степени реализации их генетического потенциала в последующих поколениях. Решить эту задачу позволяет разработка и внедрение в практику технологии получения эмбрионов in vitro (in vitro embryo production, IVP) с использованием яйцеклеток от живых животных посредством трансвагинальной пункции фолликулов (ovum-pick-up, OPU). Важный этап технологии IVP - экстракорпоральное созревание ооцитов, моделированием которого можно существенно повысить ее эффективность. В настоящей работе мы впервые выявили положительное действие гипофизарного гормона пролактина на качество донорских OPU-ооцитов коров в процессе их созревания in vitro. Цель работы заключалась в оценке влияния пролактина на завершение ядерного созревания ооцитами, полученными методом трасвагинальной аспирации фолликулов, а также на развитие и качество эмбрионов, полученных после in vitro оплодотворения донорских ооцитов. Донорами ооцитов были половозрелые телки симментальской породы в возрасте от 19 до 25 мес ( n = 4) с естественным половым циклом. Трансвагинальную аспирацию фолликулов проводили каждые 4 сут с использованием системы OPU для крупного рогатого скота («Minitube», Германия). Всего было проведено 28 сессий OPU. Выделенные ооцит-кумулюсные комплексы (ОКК) культивировали в среде ТС-199, дополненной 10 % фетальной бычьей сыворотки, 10 мкг/мл фолликулостимулирующего (ФСГ) и 10 мкг/мл лютеинизирующего (ЛГ) гормонов в отсутствие (контроль) или присутствии пролактина (ПРЛ) (опыт). Через 24 ч созревшие ооциты оплодотворяли для оценки компетенции к эмбриональному развитию. На 2-е сут после оплодотворения оценивали раздробившиеся зиготы, на 7-е сут определяли число эмбрионов, развившихся до стадии бластоцисты. Полученные на 7-е сут эмбрионы также фиксировали и окрашивали DAPI для оценки локализации ядер. Морфологический анализ не выявил влияния условий культивирования на завершение ядерного созревания. Доля созревших ооцитов была сходной в обеих группах и составляла в контроле и опытной группе соответственно 82,8 и 88,9 %. В то же время доля раздробившихся ооцитов после оплодотворения in vitro при их созревании в контроле была ниже (69,7±2,4 %), чем в присутствии ПРЛ (81,7±4,9 %) (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Крупный рогатый скот, трансвагинальная пункция фолликулов, созревание ооцитов in vitro, пролактин, эмбриональное развитие
Короткий адрес: https://sciup.org/142231905
IDR: 142231905 | УДК: 636.2:591.391.1:57.085.23 | DOI: 10.15389/agrobiology.2021.6.1148rus
Текст научной статьи Влияние пролактина на качество ооцитов, полученных методом трансвагинальной пункции фолликулов телок
Как в молочном, так и в мясном скотоводстве актуальной остается задача получения как можно большего количества потомков от лучших матерей с целью повышения степени реализации их генетического потенциала в последующих поколениях. Решить эту задачу позволяет разработка и внедрение в практику технологии получения эмбрионов in vitro (in vitro embryo production, IVP) с использованием яйцеклеток от живых животных посредством трансвагинальной пункции фолликулов (ovum-pick-up, OPU) (1, 2). Показано, что OPU — наиболее гибкий и воспроизводимый метод получения эмбрионов от живых доноров. В отличие от множественной овуляции и трансплантации эмбрионов, OPU не препятствует нормальному
* Работа выполнена при финансовой поддержке РФФИ (проект 20-316-90003) и Министерства науки и высшего образования РФ.
воспроизводству и производственному циклу донора. Подходящим донором может стать любая самка в возрасте от 6 мес до 3-го мес стельности и вскоре после отела (через 2-3 нед) (2). В настоящее время OPU стала реализованной на практике альтернативой традиционной программе получения эмбрионов in vivo (3, 4) и все чаще используется в коммерческих целях во всем мире (5-7).
Как известно, эффективность IVP технологии определяется не только качеством исходной популяции гамет, выделенных из яичников животных (8, 9), но и условиями среды, окружающей ооциты in vitro (10, 11). Наиболее важный этап культивирования — это созревание ооцитов. Посредством его моделирования можно существенно повысить как количественные (доля эмбрионов на стадии бластоцисты), так и качественные (полноценность бластоцист) показатели эффективности IVP метода (12). Подавляющее большинство современных исследований ориентировано в первую очередь на поиск физиологически уместных веществ (факторов роста, гормонов, стероидов, жирных кислот, аминокислот, метаболитов), способных специфически воздействовать на ооциты, повышая или поддерживая их жизнеспособность и компетенцию к развитию, а также на идентификацию механизмов такого влияния (13-16).
К настоящему времени установлено, что гормон гипофиза пролактин (ПРЛ) влияет на овариальную функцию самок и может позитивно модулировать созревание ооцитов и их способность к эмбриональному развитию (17-20). Рецепторы этого гормона или его мРНК выявлены в ооцитах и сопряженных с ними клетках кумулюса у различных видов млекопитающих, включая коров (20-23). В условиях in vitro добавление ПРЛ к среде созревания post mortem ооцитов коров положительно влияет на ядерное созревание и качество яйцеклеток, а также повышает их компетенцию к дальнейшему эмбриональному развитию (20, 24, 25). На модели пролонгированного культивирования ооцитов этого вида показано, что ПРЛ тормозит деструктивные изменения морфологии метафазных хромосом и снижает частоту апоптотической дегенерации стареющих ооцитов (26, 27). Кроме того, пролактин повышает компетенцию зрелых ооцитов к дальнейшему эмбриональному развитию, снижающуюся в процессе старения (27). В целом пролактин можно рассматривать как потенциальный регулятор качества женских половых клеток и использовать для повышения их полноценности в условиях in vitro.
В настоящей работе мы впервые выявили положительное действие гипофизарного гормона пролактина на качество донорских OPU-ооцитов коров в процессе их созревания in vitro.
Цель работы заключалась в оценке влияния пролактина на завершение ядерного созревания ооцитами, полученными методом трасвагиналь-ной пункции фолликулов, а также на развитие и качество эмбрионов после in vitro оплодотворения донорских ооцитов.
Методика. Во всех экспериментах, кроме отдельно указанных случаев, были использованы реагенты фирмы «Sigma-Aldrich» (США).
Ооциты получали от половозрелых телок (Bos taurus taurus) симментальской породы в возрасте от 19 до 25 мес (n = 4) с естественным половым циклом. Пункцию фолликулов выполняли каждые 4 сут с использованием OPU-системы для крупного рогатого скота («Minitube», Германия), включающей ультразвуковой сканер SSD Pro Sound 2, конвекциональный секторный зонд, вакуумный насос и держатель зонда. Аспирацию всех видимых фолликулов проводили иглой диаметром 1,2 мм и длиной 75 мм, соединенной силиконовым шлангом с флаконом объемом 50 мл. В качестве аспирационной жидкости использовали фосфатно-солевой буфер (ФСБ) с добавлением 10 % фетальной бычьей сыворотки (ФБС), 18 МЕ/мл гепарина и 50 мг/мл гентамицина. Аспираты от каждого донора фильтровали индивидуально, промывали с использованием ФСБ, дополненного 1 % ФБС, после чего под стереомикроскопом («Nikon», Япония) искали и оценивали ооцит-кумулюсные комплексы (ОКК). Выделенные ОКК разделяли на пригодные для культивирования in vitro (включая ооциты, лишенные клеток ку-мулюса) и не пригодные для культивирования in vitro (с явными цитоплазматическими аномалиями). Отобранные ОКК в течение 24 ч инкубировали с целью созревания в среде ТС-199, дополненной 10 % ФБС, 10 мкг/мл фолликулостимулирующего (ФСГ) и 10 мкг/мл лютеинизирующего (ЛГ) гормонов в отсутствие (контроль) или присутствии ПРЛ (50 нг/мл) (опыт).
Созревшие ооциты подвергали оплодотворению для оценки компетенции к эмбриональному развитию. ОКК однократно промывали в среде оплодотворения BO-IVF («IVF Bioscience», Великобритания) и помещали в капли той же среды за 30 мин до контакта со сперматозоидами.
Ооциты оплодотворяли с использованием заморожено-оттаянной спермы одного быка симментальской породы. Для этого за 1,5 ч до оплодотворения соломинки с замороженной спермой размораживали, активные сперматозоиды получали методом swim-up (28) с использованием среды Sperm-TALP, содержащей 1 мМ пирувата натрия, 6 мг/мл БСА (27). Cодержимое соломинок подслаивали по 220 мкл в 1,8 мл пробирки («Nunc», Дания), содержащие 1 мл среды Sperm-TALP, и помещали в инкубатор (MCO-18AIC, «Sanyo», Япония) на 50 мин. В конце инкубации из пробирок отбирали 750 мкл верхнего слоя с его последующим разбавлением свежей средой и центрифугированием (центрифуга 3-30KS, «Sigma», Германия) при 300 g в течение 7 мин. Полученный осадок, содержащий подвижные спер-мии, вносили в среду оплодотворения (BO-IVF) с предварительно перенесенными туда ОКК до конечной концентрации 1,5½106 сперматозоидов на 1 мл.
Созревание и оплодотворение ОКК происходило в 4-луночных планшетах («Биомедикал», Россия) в каплях среды объемом 90 мкл, полностью покрытой легким минеральным маслом.
Через 16-18 ч совместной инкубации со спермой ооциты осторожно пипетировали и отмывали в среде CR1aa (29) для освобождения от клеток кумулюса и налипших сперматозоидов. Одновременно с промывом проводили морфологическую оценку изолированных ооцитов, подсчитывая число яйцеклеток с направительными тельцами (первым или первым и вторым) и определяя процент созревания. Предполагаемые зиготы (вне зависимости от наличия или отсутствия полярных телец) переносили в среду CR1aa и культивировали в течение 4,5 сут, после чего развивающиеся эмбрионы помещали в ту же среду, содержащую 5 % ФБС.
Эмбрионы развивались в 4-луночных планшетах («Nunc», Дания) в 90 мкл среды, полностью покрытой легким минеральным маслом. На 2-е сут после оплодотворения ооцитов проводили морфологическую оценку раздробившихся зигот, на 7-е сут определяли число эмбрионов, развившихся до стадии бластоцисты. Оценку выполняли под стереомикроскопом SMZ («Nikon», Япония) при увеличении ½40-60.
Созревание и оплодотворение ооцитов, а также культивирование эмбрионов происходило при температуре 38,5 ° С в атмосфере с 5 % СО 2 при 90 % влажности.
Полученные на 7-е сут эмбрионы фиксировали 4 % раствором параформальдегида (60 мин), пермеабилизировали в 0,1 % растворе цитрата натрия, содержащем 0,5 % Тритона Х-100 (30 мин) и окрашивали DAPI с целью локализации ядер (20 мин). Обработанные таким образом эмбрионы переносили на предметное стекло и заключали в среду Vectashield («Vector Laboratories», Великобритания). Микрофотографирование и оценку препаратов выполняли под микроскопом Axio Imager.M2 («Carl Zeiss», Германия) с использованием программы ZEN 2 pro («Carl Zeiss», Германия).
Статистическую обработку данных проводили методом однофакторного дисперсионного анализа в программе SigmaStat ( « Systat Software, Inc.», США ) . Данные выражали как средние значения ( M) и стандартные ошибки средних (±SEM). Достоверность различий сравниваемых средних значений оценивали с использованием критерия Тьюки.
Результаты. К настоящему времени достигнут существенный прогресс в разработке IVP технологии у крупного рогатого скота с использованием донорских ооцитов, однако полноценность эмбрионов, развившихся in vitro из OPU-ооцитов, по-прежнему остается значительно более низкой, чем развившихся in vivo (5-8). Идентификация биологически уместных факторов, отвечающих за регуляцию качества ооцитов в период их созревания in vitro, будет способствовать решению этой проблемы (12-13, 16).
Поскольку ПРЛ позитивно модулирует созревание post mortem ооцитов коров и их способность к эмбриональному развитию (20, 24, 25), есть вероятность, что аналогичным образом этот гормон может влиять и на донорские ооциты. В настоящей работе ооциты, полученные методом трансвагинальной аспирации фолликулов, культивировали в присутствии или отсутствие ПРЛ (50 нг/мл), после чего оплодотворяли in vitro и культивировали до стадии бластоцисты. Оценивали влияние ПРЛ на завершение ядер-ного созревания OPU-ооцитами, а также на развитие и качество IVP эмбрионов.
Всего у четырех телок симментальской породы за 28 сессий OPU было аспирировано 360 фолликулов, из которых выделено 166 ОКК. Число ооцитов, выделенных от индивидуальных доноров (1 сессия OPU), составило в среднем 5,9 ооцита. ОКК (рис. 1, а) полученные в процессе OPU, за исключением ооцитов с явными аномалиями цитоплазмы (всего 140 ОКК, 5,0 на 1 сессию OPU), культивировали в среде IVM до завершения созревания (см. рис. 1, б) в отсутствие (контроль) либо в присутствии ПРЛ.
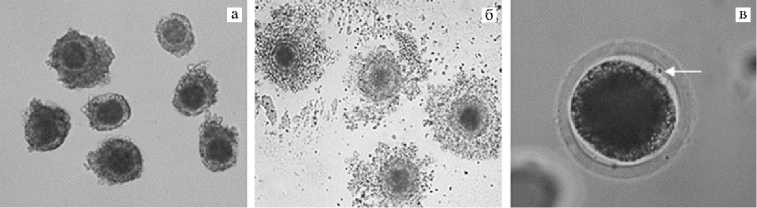
Рис. 1. Микрофотографии ооцитов телок симментальской породы, полученных методом трасва-гинальной пункции фолликулов: а — незрелые ооцит-кумулюсные комплексы (увеличение ½100), б — ооцит-кумулюсные комплексы после 24 ч созревания in vitro (увеличение ½100), в — созревшие ооциты после процедуры оплодотворения in vitro (белой стрелкой обозначены полярные тельца, увеличение ½400) (микроскоп Eclipse Ti-U, «Nikon», Япония).
Морфологический анализ не обнаружил влияния пролактина на завершение ядерного созревания. Доля созревших ооцитов как отношение числа ооцитов с полярными тельцами (см. рис. 1, в) к исходному числу, определяемое после процедуры IVF в процессе освобождения яйцеклеток от кумулюсных клеток и сперматозоидов, была высокой и существенно не различалась между контрольной и опытной группами (табл. 1).
-
1. Способность ооцитов, полученных методом трасвагинальной пункции фолликулов телок симментальской породы и созревающих в присутствии пролактина, к эмбриональному развитию после оплодотворения в условиях in vitro ( M ±SEM)
-
2. Эффективность IVP (in vitro embryo production) технологии и качество IVP эмбрионов при выращивании ооцитов, полученных методом трасвагинальной аспирации фолликулов телок симментальской породы, в присутствии пролактина ( M ±SEM )
Группа
Число сессий OPU, n
Всего эмбрионов на стадии бластоцисты, n
Число бластоцист на одну сессию OPU, n
Число ядер в бластоцисте, n
Контроль
16
9
0,59±0,11
67,3±3,0
Опыт
12
10
0,86±0,09
78,6±5,2
Примечание. OPU —
ovum-pick-up. Описание групп см. в разделе «Методика».
|
Группа |
Число ооцитов, n |
Доля созревших ооцитов, n |
Доля раздробившихся ооцитов, % |
Доля ооцитов, развившихся до стадии бластоцисты, % |
Контроль 80 82,8±3,8 69,7±2,4 11,0±1,8
Опыт 60 88,9±3,9 81,7±4,9* 17,2±2,0*
Примечание. Описание групп см. в разделе «Методика».
* Различия между сравниваемыми группами статистически значимы при p < 0,05.
Компетенцию зрелых ооцитов к развитию после оплодотворения in vitro оценивали по их способности вступать в первое деление дробления (рис. 2, а) и достигать стадии бластоцисты (см. рис. 2, б, табл. 1). Доля раздробившихся ооцитов после оплодотворения in vitro на 2-е сут культивирования в контроле была ниже, чем в опыте (p < 0,05). Также обнаружено положительное влияние гормона на развитие созревших ооцитов до стадии бластоцисты (см. табл. 1). В целом количество бластоцист на одну сессию OPU в опытной группе было выше, чем в контроле, в 1,5 раза (табл. 2).
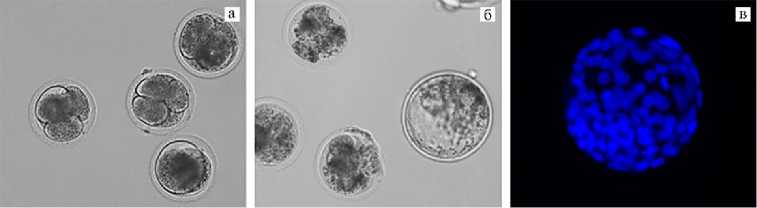
Рис. 2. Микрофотографии эмбрионов крупного рогатого скота симментальской породы, развившихся после in vitro оплодотворения донорских ооцитов, полученных методом трасвагинальной аспиирации фолликулов: а — раздробившиеся ооциты (увеличение ½200), б — эмбрионы, развившиеся до стадии бластоцисты (увеличение ½100) (микроскоп Eclipse Ti-U, «Nikon», Япония); в — окраска ядер в бластоцисте с помощью DAPI (синий цвет), цитологический препарат (увеличение ½400) (микроскоп Axio Imager.M2, «Carl Zeiss», Германия).
Использование пролактина существенно не изменяло качество IVP эмбрионов, которое оценивали по числу ядер на 7-е сут после оплодотворения (см. рис. 2, в), однако при созревании OPU-ооцитов в присутствии ПРЛ наблюдалась тенденция к увеличению этого показателя (табл. 2).
О стимулирующем действии ПРЛ в период IVM на дальнейшее развитие оплодотворенных яйцеклеток до стадии бластоцисты сообщалось ранее для ооцитов кроликов и мышей (30, 19). Также сходный эффект ПРЛ наблюдали при совместном культивировании post mortem ОКК коров с клетками гранулезы (25) и в присутствии гонадотропных гормонов (20). В последнем случае внесение пролактина в среду культивирования ОКК, со- держащую ФСГ и ЛГ, приводило к повышению выхода эмбрионов от общего числа оплодотворенных in vitro ооцитов, 2-кратному повышению выхода бластоцист и увеличению среднего числа ядер на одну бластоцисту. В нашем исследовании внесение ПРЛ в среду IVM с ФСГ и ЛГ хоть и имело сходный эффект на их компетенцию к развитию in vitro, но не обеспечивало столь существенного выхода бластоцист и статистически значимого изменения в количестве их ядерного материала.
Как известно, клетки кумулюса участвуют в поддержании нормальных процессов созревания и оплодотворения ооцитов млекопитающих (31). Кроме того, их присутствие необходимо для реализации описанного выше положительного эффекта ПРЛ в отношении эмбрионального развития post mortem ооцитов (20). В отличии от донорских ооцитов, последние перед культивированием in vitro проходят тщательный отбор по морфологическим признакам, в частности по наличию компактного многослойного кумулюса. В нашей работе для культивирования были использованы не только морфологически нормальные ОКК, но и ооциты, частично окруженные клетками кумулюса, а также практически лишенные клеток кумулюса. Особенности отбора, возможно, повлияли на характер выявленного позитивного эффекта исследуемого гормона.
Таким образом, гормон гипофиза пролактин в среде созревания оказывает стимулирующее влияние на компетентность донорских ооцитов крупного рогатого скота, полученных методом трасвагинальной пункции фолликулов, к последующему эмбриональному развитию. Позитивное влияние проявляется на стадии первого деления дробления и сохраняется в процессе развития эмбрионов до стадии бластоцисты, что свидетельствует о положительном действии гормона на качество ооцитов, а также о возможности его использования на этапе экстракорпорального созревания для повышения эффективности технологии IVP (in vitro embryo production).
Список литературы Влияние пролактина на качество ооцитов, полученных методом трансвагинальной пункции фолликулов телок
- Boni R. Ovum pick-up in cattle: a 25 years retrospective analysis. Animal Reproduction, 2012, 9(3): 362-369.
- Qi M., Yao Y., Ma H., Wang J., Zhao X., Liu L., Tang X., Zhang L., Zhang S., Sun F. Trans-vaginal ultrasoundguided ovum pick-up (OPU) in cattle. Journal of Biomimetics Biomaterials and Tissue Engineering, 2013, 18: 118.
- Sanches B.V., Zangirolamo A.F., Seneda M.M. Intensive use of IVF by large-scale dairy pro-grams. Animal Reproduction, 2019, 16(3): 394-401 (doi: 10.21451/1984-3143-AR2019-0058).
- Viana J. 2019 Statistics of embryo production and transfer in domestic farm animals. Embryo Technology Newsletter, 2020, 38(4): 7-26.
- Sirard M.A. 40 years of bovine IVF in the new genomic selection context. Reproduction, 2018, 156(1): R1-R7 (doi: 10.1530/REP-18-0008).
- van Wagtendonk-de Leeuw A.M. Ovum pick up and in vitro production in the bovine after use in several generations: a 2005 status. Theriogenology, 2006, 65(5): 914-925 (doi: 10.1016/j.theri-ogenology.2005.09.007).
- Baldassarre H., Bordignon V. Laparoscopic ovum pick-up for in vitro embryo production from dairy bovine and buffalo calves. Animal Reproduction, 2018, 15(3): 191-196 (doi: 10.21451/1984-3143-AR2018-0057).
- Aguila L., Treulen F., Therrien J., Felmer R., Valdivia M., Smith L.C. Oocyte selection for in vitro embryo production in bovine species: noninvasive approaches for new challenges of oocyte competence. Animals, 2020, 10(12): 2196 (doi: 10.3390/ani10122196).
- Saini N., Singh M.K., Shah S.M., Singh K.P., Kaushik R., Manik R.S., Singla S.K., Palta P., Chauhan M.S. Developmental competence of different quality bovine oocytes retrieved through ovum pick-up following in vitro maturation and fertilization. Animal, 2015, 9(12): 1979-85 (doi: 10.1017/S1751731115001226).
- Stroebech L., Mazzoni G., Pedersen H.S., Freude K.K., Kadarmideen H.N., Callesen H., Hyt-tel P. In vitro production of bovine embryos: revisiting oocyte development and application of systems biology. Animal Reproduction, 2015, 12(3): 465-472.
- Gilchrist R.B., Thompson J.G. Oocyte maturation: emerging concepts and technologies to im-prove developmental potential in vitro. Theriogenology, 2007, 67(1): 6-15 (doi: 10.1016/j.theri-ogenology.2006.09.027).
- Blanco M.R., Demyda S., Moreno Millán M., Genero E. Developmental competence of in vivo and in vitro matured oocytes: a review. Biotechnology and Molecular Biology Reviews, 2011, 6(7): 155-165 (doi: 10.5897/BMBR2011.0015).
- Lonergan P., Fair T., Forde N., Rizos D. Embryo development in dairy cattle. Theriogenology, 2016, 86(1): 270-277 (doi: 10.1016/j.theriogenology.2016.04.040).
- Lonergan P., Fair T. Maturation of oocytes in vitro. Annual Review of Animal Biosciences, 2016, 4: 255-268 (doi: 10.1146/annurev-animal-022114-110822).
- Abd El-Aziz A.H., Mahrous U.E., Kamel S.Z., Sabek A.A. Factors influencing in vitro production of bovine embryos: a review. Asian Journal of Animal and Veterinary Advances, 2016, 11(12): 737-756 (doi: 10.3923/ajava.2016.737.756).
- Ferré L.B., Kjelland M.E., Strøbech L.B., Hyttel P., Mermillod P., Ross P.J. Review: Recent advances in bovine in vitro embryo production: reproductive biotechnology history and methods. Animal, 2020, 14(5): 991-1004 (doi: 10.1017/S1751731119002775).
- Wise T., Suss U., Stranzinger G., Wuthrich K., Maurer R.R. Cumulus and oocyte maturation and in vitro and in vivo fertilization of oocytes in relation to follicular steroids, prolactin, and glycosaminoglycans throughout the estrous period in superovulated heifers with a normal LH surge, no detectable LH surge, and progestin inhibition of LH surge. Domestic Animal Endocri-nology, 1994, 11(1): 59-86 (doi: 10.1016/0739-7240(94)90036-1).
- Jinno M., Katsumata Y., Hoshiai T., Nakamura Y., Matsumoto K., Yoshimura Y. A therapeutic role of prolactin supplementation in ovarian stimulation for in vitro fertilization: the bromocrip-tine-rebound method. The Journal of Clinical Endocrinology and Metabolism, 1997, 82(11): 3603-3611 (doi: 10.1210/jcem.82.11.4349).
- Bole-Feysot C., Goffin V., Edery M., Binart N., Kelly P.A. Prolactin (PRL) and its receptor: actions, signal transduction pathways and phenotypes observed in PRL receptor knockout mice. Endocrine Reviews, 1998, 19(3): 225-268 (doi: 10.1210/edrv.19.3.0334).
- Lebedeva I.Y., Singina G.N., Volkova N.A., Vejlsted M., Zinovieva N.A., Schmidt M. Prolactin affects bovine oocytes through direct and cumulus-mediated pathways. Theriogenology, 2014, 82(8): 1154-1164.e1 (doi: 10.1016/j.theriogenology.2014.08.005).
- Picazo R.A., García Ruiz J.P., Santiago Moreno J., González de Bulnes A., Muñoz J., Silván G., Lorenzo P.L., Illera J.C. Cellular localization and changes in expression of prolactin receptor isoforms in sheep ovary throughout the estrous cycle. Reproduction, 2004, 128(5): 545-553 (doi: 10.1530/rep.1.00343).
- Nakamura E., Otsuka F., Inagaki K., Miyoshi T., Yamanaka R., Tsukamoto N., Suzuki J., Ogura T., Makino H. A novel antagonistic effect of the bone morphogenetic protein system on prolactin actions in regulating steroidogenesis by granulosa cells. Endocrinology, 2010, 151(11): 5506-5518 (doi: 10.1210/en.2010-0265).
- Kiapekou E., Loutradis D., Patsoula E., Koussidis G.A., Minas V., Bletsa R., Antsaklis A., Michalas S., Makrigiannakis A. Prolactin receptor mRNA expression in oocytes and preimplan-tation mouse embryos. Reproductive BioMedicine Online, 2005, 10(3): 339–346 (doi: 10.1016/s1472-6483(10)61793-2).
- Kuzmina T.I., Lebedeva I.Y., Torner H., Alm H., Denisenko V.Y. Effects of prolactin on intra-cellular stored calcium in the course of bovine oocyte maturation in vitro. Theriogenology, 1999, 51(7): 1363-1374 (doi: 10.1016/S0093-691X(99)00080-1).
- Кузьмина Т.И., Лебедева И.Ю., Торнер Х., Альм Х. Эффекты пролактина в различных системах культивирования на созревание ооцитов коров и их способность к дальнейшему развитию. Онтогенез, 2001, 32(2): 140-147.
- Lebedeva I.Y., Singina G.N., Lopukhov A.B., Shedova E.N., Zinovieva N.A. Prolactin and growth hormone affect metaphase II chromosomes in aging oocytes via cumulus cells using similar signaling pathways. Frontiers in Genetics, 2015, 6: 274 (doi: 10.3389/fgene.2015.00274).
- Singina G.N., Shedova E.N., Lopukhov A.V., Mityashova O.S., Lebedeva I.Y. Delaying effects of prolactin and growth hormone on aging processes in bovine oocytes matured in vitro. Pharma-ceuticals, 2021, 14(7): 684 (doi: 10.3390/ph14070684).
- Parrish J.J., Susko-Parrish J.L., Leibfried-Rutledge M.L., Critser E.S., Eyestone W.H., First N.L. Bovine in vitro fertilization with frozen-thawed semen. Theriogenology, 1986, 25(4): 591-600 (doi: 10.1016/0093-691X(86)90143-3).
- Rosenkrans C.F. Jr., First N.L. Effect of free amino acids and vitamins on cleavage and devel-opmental rate of bovine zygotes in vitro. Journal of Animal Science, 1994, 72(2): 434-437 (doi: 10.2527/1994.722434x).
- Yoshimura Y., Hosoi Y., Iritani A., Nakamura Y., Atlas S.J., Wallach E.E. Developmental po-tential of rabbit oocytes matured in vitro: the possible contribution of prolactin. Biology of Repro-duction, 1989, 41(1): 26-33 (doi: 10.1095/BIOLREPROD41.1.26).
- Tanghe S., Van Soom A., Nauwynck H., Coryn M., de Kruif A. Minireview: functions of the cumulus oophorus during oocyte maturation, ovulation, and fertilization. Molecular Reproduction and Development, 2002, 61(3): 414-424 (doi: 10.1002/mrd.10102).


