Влияние пролонгированного гипокинетического стресса на уровень тревожности и соотношение между липопероксидацией и карбонилированием белков в структурах головного мозга
Автор: Стрельников И.В., Цейликман О.Б., Цейликман В.Э., Манухина Е.Б., Дауни Ф.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 3 т.13, 2013 года.
Бесплатный доступ
Увеличение продолжительности гипокинетического стресса до трех дней отменило анксиолитическое действие однодневного гипокинетического стресса и усугубило нарушения регуляции в системе гипоталамус - гипофиз - кора надпочечников. Это сопровождалось усилением перекисного окисления липидов в коре головного мозга.
Стресс, глюкокортикоиды, тревожность, перекисное окисление липидов
Короткий адрес: https://sciup.org/147153156
IDR: 147153156 | УДК: 576.35
Текст научной статьи Влияние пролонгированного гипокинетического стресса на уровень тревожности и соотношение между липопероксидацией и карбонилированием белков в структурах головного мозга
Введение. Стрессорные нарушения поведения в значительной степени опосредованы глюкокортикостероидами (ГКС), вследствие их способности вызывать угнетение функциональной активности нейронов префронтальной коры, гиппокампа, гипоталамуса, амигдалы и других структур ЦНС, что приводит к расстройству эмоциональной сферы и когнитивных функций [5]. При стрессе поддержание в течение длительного времени повышенного уровня ГКС обусловлено нарушениями регуляции гипоталамо-гипофизарно-адреналовой системы (ГГАС) по механизму длительной петли отрицательной обратной связи [4].
В условиях гипокинетического стресса наблюдается развитие поведенческих расстройств, изменение уровня свободно-радикального окисления в различных отделах ЦНС и увеличение уровня ГКС. Однако не понятно – сопровождается ли повышение содержания глюкокортикоидов при гипокинезии нарушениями регуляции ГГАС по механизму «длинной петли отрицательной обратной связи»? Также неизвестно как нарушения регуляции ГГАС соотносятся с изменениями свободнорадикального окисления в различных структурах головного мозга.
Методика. Исследование выполнено на лабораторных крысах массой 230–250 г обоего пола. Использовались беспородные животные. Гипокинетический стресс моделировали путём помещения животных на 1 сутки (ГК1) или на 3 суток (ГК3) в клетки-пеналы. Для изучения регуляции в ГГАС использовали дексаметазоновый тест, который проводился после завершения гипокинезии по схеме, учитывающей особенности циркадной ритмики ГГАС у лабораторных крыс [4]. В качестве оценочного показателя функционирования механизмов обратной связи использовали изменения уровня кортикостерона в плазме крови до (исходный уровень) и через 6 часов после введения дексаметазона (KRKA, Словения; внутрибрюшинно в дозе 5 мкг/кг). Поведенческие реакции животных изучались с использованием теста «приподнятый крестообразный лабиринт» [7]. Выделение отделов головного мозга крыс производилось в соответствии с рекомендациями, изложенными в работе [8].
Уровень кортикостерона определялся флюорометрическим методом Ю.Г. Балашова [1]. Содержание продуктов перекисного окисления липидов (ПОЛ) оценивали спектрофотометрически в липидном экстракте исследуемых тканей по методике И.А. Волчегорского и соавт. [6]. Окислительную модификацию белков оценивали по уровню образования динитрофенилгидразонов по методу Е.Е. Дубининой и соавт. [3].
Для обработки результатов исследований использовали пакет прикладных программ Statistica 6.0 for Windows. Статистически значимые различия между несколькими группами определялись с помощью критерия Краскелла – Уолиса (Kruskal-Wallis). Для определения статистически значимых различий между двумя сравниваемыми группами использовали критерии Манна – Уитни (U), Вальда – Вольфовица (WW). Различия считали значимыми при р ≤ 0,05. Статистические взаимосвязи изучали при помощи непараметрического корреляционного анализа, выполняя расчёт коэффициентов корреляции рангов по Спирмену (Rs) и Кен-деллу (rk).
Результаты и обсуждение. Установлено, что у интактных животных введение дексаметазона привело к снижению циркулирующего кортикостерона на 51 % по сравнению с исходным уровнем при ГК1 – только на 16 %, а при ГК3 введение дексаметазона не сопровождалось снижением уровня кортикостерона (см. рисунок). При этом содержание кортикостерона в группе «ГК3 + дексаметазон» статистически значимо повышено по сравнению с группой «ГК1+дексаметазон» и группой «дексаметазон».
Анксиолитическое действие односуточной гипокинезии проявлялось в увеличении времени пребывания в светлых рукавах «крестообразного лабиринта» с 98,72 ± 3,49 до 187 ± 5,27 с (Р = 0,036U). Наблюдаемые изменения поведенческой активности имели транзиторный характер и отсутствовали после завершения ГК3. Однодневная и трёхдневная гипокинезия характеризовались одинаковым по выраженности увеличением содержания кортикостерона крови (см. рисунок). Прирост содержания кортикостерона на базальном уровне может быть связан с нарушением регуляции по механизму «длиной петли отрицательной обратной связи», которое проявляется в снижении чувствительности гипоталамических центров типа PVN (паравентри-кулярное ядро) к глюкокортикоид-зависимому торможению продукции кортиколиберина. Через 120 ч после завершения ГК1 в коре головного мозга наблюдалось угнетение ПОЛ. Это проявлялось в снижении содержания изопропанол-растворимых диеновых конъюгатов и в уменьшении содержания Шиффовых оснований (см. таблицу). После завершения ГК3, напротив, наблюдалось усиление ПОЛ. Это проявлялось в увеличении содержания изопропанол-растворимых, а также гептан-раст-воримых кетодиенов и сопряжённых триенов по сравнению с контролем. Важно отметить, что содержание изопропанол-растворимых кетодиенов и сопряжённых триенов при ГК3 имело более высокое значение чем при ГК1. Пролонгирование гипокинетического стресса до трех суток привело к снижению содержания карбонилированных белков в гиппокампе (с 2,762 ± 0,193 мкмоль/г белка до 1,38 ± 0,35 мкмоль/г белка Р = 0,021U), а также в среднем мозге (с 8,254 ± 0,293 мкмоль/г белка до 4,248 ± 0,235 мкмоль/г белка Р = 0,014U). Кроме того, в среднем мозге на фоне повышенного содержания изопропанол-растворимых диеновых конъюгатов (с 0,364 ± 0,024 до 0,464 ± 0,025 у.е.о. Р = 0,014U) наблюдалось уменьшение содержания гептанофильных диеновых конъюгатов (с 0,817 ± ± 0,064 до 0,65 ± 0,035 у.е.о. Р = 0,014U), а также кетодиенов и сопряжённых триенов (с 0,624 ± 0,037 до 0,264 ± 0,025 у.е.о. Р = 0,014U). В связи с этим уместно обратить внимание на наличие положительной корреляции между содержанием изопро-панол-растворимых диеновых конъюгатов и временем пребывания в тёмных рукавах «крестообразного лабиринта» (Rs= 0,9; P = 0,037).
Полученные результаты свидетельствуют о том, что увеличение продолжительности гипокинезии до трёх суток проявляется в более выраженном нарушении регуляции ГГАС по механизму
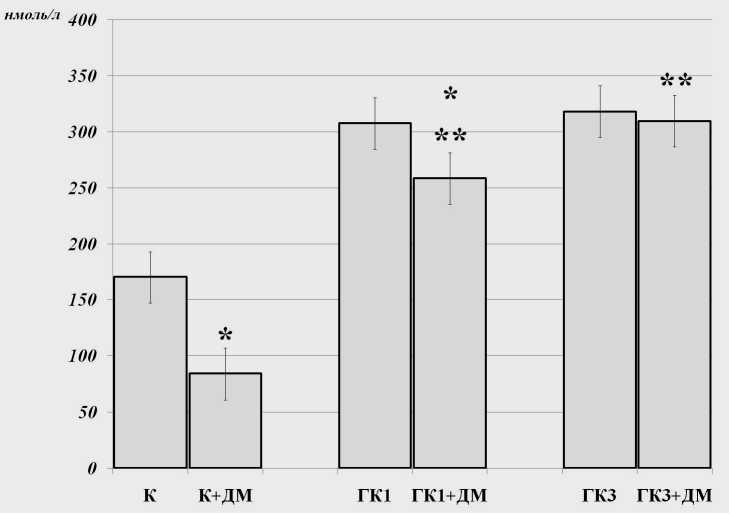
Содержание кортикостерона в плазме крови при гипокинезии после введения дексаметазона (дексаметазоновый тест): К - контроль (интактные животные); К + ДМ -группа «контроль» через 6 ч после введения дексаметазона; ГК (1 или 3) - гипокинезия; ГК + Дм - группа «гипокинезия» через 6 ч после введения дексаметазона; * - статистически значимое снижение содержания кортикостерона по сравнению с исходным уровнем; ** - межгрупповые различия
Проблемы здравоохранения
Содержание продуктов липопероксидации в коре головного мозга при введении глюкокортикоидного препарата после завершения гипокинезии
|
Показатель |
Диеновые конъюгаты (изопропанольная фаза) |
Кетодиены и сопряжённые триены (изопропанольная фаза) |
Шиффовы основания (изопропанольная фаза) |
|
1 Контроль (n = 5) |
0,319 ± 0,008 |
0,179 ± 0,004 |
0,059 ± 0,014 |
|
2 ГК1 (n = 6) |
0,285 ± 0,01 Р 1,2 = 0,036 |
0,17 ± 0,008 |
0,044 ± 0,005 Р 1,2 = 0,044 |
|
3 ГК3 (n = 6) |
0,36 ± 0,033 |
0,216 ± 0,010 Р 1,3 = 0,028 Р 2,3 = 0,016 |
0,05 ± 0,011 |
«длинной петли» отрицательной обратной связи. Это свидетельствует об увеличении порога гипоталамической чувствительности к ингибирующему влиянию глюкокортикоидов. Данный эффект гипокинетического стресса можно рассматривать как проявление гиперадаптоза, с позиций концепции В.М. Дильмана [2], или «аллостатической нагрузки», с точки зрения B. McEwen [9]. Увеличение продолжительности гипокинезии купировало свойственное односуточной гипокинезии анксиолитическое действие. Важно отметить, что это сопровождалось изменениями уровня свободнорадикального окисления в различных отделах головного мозга.
Выводы
-
1. Односуточная и трёхсуточная гипокинезии характеризуются увеличением концентрации кортикостерона в плазме крови на базальном уровне, а также после проведения дополнительного «дек-саметазонового теста». Введение дексаметазона после трёхсуточной гипокинезии вызвало более значительный прирост содержания кортикостерона по сравнению с односуточной.
-
2. В коре головного мозга при односуточной гипокинезии по сравнению с контролем снижено содержание изопропанол-растворимых молекулярных продуктов ПОЛ, а при трёхсуточной – повышено. После трёхсуточной гипокинезии по сравнению с контролем снижено содержание геп-тан-растворимых молекулярных продуктов при одновременном увеличении изопропанол-раство-римых продуктов ПОЛ в среднем мозге.
-
3. Пролонгирование гипокинетического стресса привело к снижению содержания карбонилиро-ванных белков в гиппокампе и в среднем мозге.
Работа выполнена в рамках реализации государственного задания на оказание услуг на 2012 и на плановый период 2013 и 2014 годов в части проведения научно-исследовательских работ № 4.4022.2011.
Список литературы Влияние пролонгированного гипокинетического стресса на уровень тревожности и соотношение между липопероксидацией и карбонилированием белков в структурах головного мозга
- Балашов, Ю.Г. Флюорометрический микрометод определения кортикостероидов: сравнение с другими методами/Ю.Г. Балашов//Физиол. журн. СССР. -1990. -№ 12. -С. 280-283.
- Дильман, В.М. Четыре модели медицины/B.М. Дильман. -М.: Медицина, 1987. -288 с.
- Окислительная модификация белков сыворотки крови человека, метод её определения/Е.Е. Дубинина, С. О. Бурмистров, Д.А. Ходов и др.//Вопр. мед. химии. -1995. -№ 41. -С. 24-26.
- Подвигина, Т.Т. Закономерности реагирования гипофизарно-адренокортикальной системы на повторные стрессорные повреждения/Т.Т. Подвигина//Успехи физиол. наук. -1998. -Т. 29, № 1. -С. 29.
- Филаретов, А.А. Принципы и механизмы регуляции гипофизарно-адренокортикальной системы/А.А. Филаретов. -Л.: Наука, 1987. -164 с.
- Экспериментальное моделирование и лабораторная оценка адаптивных реакций организма/И.А. Волчегорский [и др.]. -Челябинск: Изд-во ЧГПУ, 2000. -167 с.
- Belzung, C. Measuring normal and pathological anxiety-like behaviour in mice: a review/C. Belzung, G. Griebel//Behav. Brain. Res. -2001. -Nov 1;125(1-2). -Р. 141-149.
- Glowinski, J. Regional studies of catecholamines in the rat brain. The diposition of norepinephrine, dopamine and DOPA in varriosus regions of the brain/J. Glowinski, L.L. Iversen//J. Neurochem. -1966. -Vol. 13. -P. 655-669.
- McEwen, B.S. Stress and the individual: mechanisms leading to disease/B.S. McEwen, E. Stellar//Arch. Intern. Med. -1993. -Vol. 153. -P. 2093-2101.
- Rodgers, R.J. Influence of social isolation, gender, strain, and prior novelty on plus-maze behaviour in mice./R.J. Rodgers, J.C. Cole//Physiol. Behav. -1993. -Vol. 54(4). -Р. 729-736.


