Влияние простатических пептидов на трансмембранный перенос ломефлоксацина
Автор: Духанин Александр Сергеевич
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 3 т.15, 2022 года.
Бесплатный доступ
Введение. Применение пептидов, проникающих в клетку без участия мембранных белков и способных осуществлять внутриклеточный транспорт связанных с ними низкомолекулярных веществ, открывает новый этап в разработке целенаправленной доставки лекарственных веществ к терапевтическим мишеням. Цель. Оценка влияния простатических пептидов препарата Витапрост® (экстракт предстательной железы) на трансмембранный транспорт антимикробного препарата ломефлоксацин. Материалы и методы. В первой серии изучены эффекты простатических пептидов на способность ломефлоксацина проходить через искусственные мембраны путем пассивной диффузии (метод PAMPA -parallel artificial membrane permeability assay). Во второй серии изучены эффекты простатических пептидов на клеточную проницаемость ломефлоксацина в модели Сасо-2. Результаты. Сравнительное исследование эффективной проницаемости мембраны (logPe) для ломефлоксацина в отсутствии (контрольная группа) и присутствии простатических пептидов (экстракт предстательной железы в концентрации 10 мг/мл) показало, что сочетанное применение ломефлоксацина и простатических пептидов приводит к достоверному повышению величины logPe, прирост составляет в среднем 29%. Специфический характер выявленного взаимодействия был подтвержден: добавление бета-меркаптоэтанола (BME) в донорный отсек не влияло на проницаемость чистого ломефлоксацина, но подавляло карго-эффект простатических пептидов. Рассчитанный на модели Caco-2 коэффициент проницаемости (Papp) для ломефлоксацина в комплексе с пептидами составил 13,04±1,80х10-6 см/с, в то время как для ломефлоксацина - 10,31±0,76х10-6 см/с. Заключение. Сопоставление полученных данных двух серий экспериментов свидетельствует о наличии прямого карго-эффекта простатических пептидов на трансмембранный транспорт ломефлоксацина в условиях in vitro.
Ломефлоксацин, простатические пептиды, эффективная проницаемость мембраны, caco-2, карго-эффект
Короткий адрес: https://sciup.org/142236638
IDR: 142236638 | DOI: 10.29188/2222-8543-2022-15-3-28-34
Текст научной статьи Влияние простатических пептидов на трансмембранный перенос ломефлоксацина
Цитоплазматическая мембрана – важный барьер на пути эффективной доставки в клетку большинства лекарственных соединений, существенно ослабляющий их лечебный потенциал. Разработка новых перспективных инструментов доставки лекарственных препаратов до терапевтических мишеней является актуальной задачей для профилактики и лечения различных урологических заболеваний. Одним из таких перспективных подходов служит применение проникающих в клетку пептидов (cell-penetrating peptide, СРР), которые обладают карго-эффектом – свойством усиливать трансмембранную проницаемость карго-молекулы (терапевтического или диагностического средства) [1-3]. Целенаправленная транспортировка фармакологически активных веществ на основе СРР характеризуется рядом преимуществ по сравнению с другими способами доставки действующего начала лекарственных препаратов: отсутствие у пептидов (молекулярной массой <10кДа) иммуногенных свойств, низкая цитотоксичность, высокая химическая и физическая стабильность в физиологических условиях [4]. Так, применение CPP для доставки противоопухолевых средств (таксол, метотрексат, доксорубицин) способствует увеличению внутриклеточной концентрации химиотерапевтических агентов за счет повышения проницаемости мембран опухолевых клеток, позволяет повысить конечный период их полувыведения и биодоступность [5]. Низкомолекулярный пептид R8, иммобилизованный с молекулой таксола с помощью ковалентных дисульфидных связей, изменял фармакокинетику и фармакодинамику антинеоплатического препарата, увеличивая растворимость в водной среде, позволяя преодолевать множественную лекарственную резистентность [6]. Механизмы трансмембранного переноса, опосредованные СРР, не требуют затрат энергии, происходят без участия белков-адаптеров клатрин-зави-симого эндоцитоза, практически не зависят от экспрессии углеводной части гликолипидов и гликопротеинов наружной плазмолеммы [7]. Такие CPP, как ТАТ и VP22, обладают способностью транслоцироваться через сеть мембран внутриклеточных компартментов, накапливаясь в ядре клетки [8]. С химической точки зрения класс CPP является гетерогенным, объединяя различные по своей природе пептидные последовательности и/или структуры. В то же время общим для всех СРР представляется достаточно высокое содержание основных (положительно заряженных) аминокислот, которое определяет в целом положительный суммарный заряд пептидной молекулы (катионные свойства) [9]. Экспериментальные данные свидетельствуют, что начальные этапы CPP-опосредованного переноса включают связывание пептидов с отрицательно заряженными радикалами липидов и/или протеогликанов клеточной мембраны [9].
Таким образом, поиск новых способов, обеспечивающих доставку лекарственных препаратов в эффекторные клетки, является актуальной задачей биомедицинских исследований. К числу таких перспективных соединений относятся простатические пептиды, которые могут транслоцироваться через мембраны клеток и могут служить переносчиками антимикробных препаратов, повышая эффективность медикаментозной терапии. Субстанция препарата Витапрост® – комплекс биологически активных пептидов предстательной железы крупного рогатого скота – относится к фармакологически активным веществам, улучшающим метаболизм в предстательной железе, и к корректорам уродинамики [10]. Простатические пептиды имеют основной характер, относятся к катионным пептидам, что позволило нам предположить наличие у них карго-свойств.
Цель данной работы – определение влияния простатических пептидов (экстракт предстательной же-лезы)на трансмембранный транспорт антимикробного препарата ломефлоксацин.
МАТЕРИАЛЫ И МЕТОДЫ
Препараты и реактивы
Ломефлоксацина гидрохлорид содержит не менее 89,2% ломефлоксацина в пересчете на сухое вещество (по результатам испытаний – 89,7%). Действующее начало препарата Витапрост® (предстательной железы экстракт): спектр поглощения испытуемого раствора в ультрафиолетовой области (260-350 нм) имеет максимум при длине волны 275±5 нм. Результаты количественного определения (водорастворимые пептиды): 24,7%, рН 5,9. Размер частиц (≤40 мкм) – 99,4. Линия клеток Сасо-2 (АТСС, кат. № НТВ-37, США).
Дизайн исследования включал проведение двух серий экспериментов. В первой из них изучали эффекты простатических пептидов на способность ломе-флоксацина проходить через искусственные мембраны путем пассивной диффузии (PAMPA-parallel artificial membrane permeability assay) [11]. Для этого был использован 96-луночный планшет, конструкция которого состояла из верхней (акцепторной) и нижней (донорной) частей, разделенных с помощью искусственной мембраны на основе изопропилмиристата (30%) и силиконового масла (70%). Время инкубации варьировало от 3 до 24 часов при комнатной температуре, что необходимо для перераспределения исследуемых соединений между двумя отсеками и мембраной. В предварительной серии экспериментов в качестве контрольных образцов использовали верапамил (высокая проницаемость) и ранитидин (низкая проницаемость) – при определении оптимальных условий проведения РАМРА. В первой серии экспериментов для контрольных образцов использовали кетопрофен и феназон, данные по которым отражены в результатах исследования. Комплекс фосфолипидов различного состава наносили на пористую мембрану акцепторного отсека, лунки которого заполняли растворами исследуемых соединений в смеси ДМСО/фосфат-ный буфер. Для заполнения лунок нижнего (донорного) отсека использовали фосфатный буфер. Собранный планшет помещали в термостат при непрерывном перемешивании. Спустя 1-24 ч. по оптической плотности растворов в УФ-диапазоне определяли концентрацию ломефлоксацина в акцепторном отсеке для последующего расчета значений logPe.
Во второй серии были изучены эффекты простатических пептидов на клеточную проницаемость ло-мефлоксацина в модели Сасо-2. На основе рекомендаций для использования коммерческих наборов MultiScreen® Caco-2 Assay System проводили анализ на клетках линии Caco-2, которые культивировали стандартным способом в среде Дульбекко, модифицированной по способу Исков (IMDM) с добавлением 10% термически инактивированной бычьей сыворотки (FBS) при 37 °C в среде 5% CO 2 (об/об) [12].
Целостность клеточного монослоя оценивали по трансэпителиальному электрическому сопротивлению с использованием Millicell ERS-2 в начале и в конце эксперимента. Исследуемые растворы добавляли в верхнюю часть лунки, нижнюю часть лунки заполняли раствором Хэнкса (HBSS). После этого планшеты инкубировали при 37°C и перемешивании (80 об/мин) на орбитальном шейкере. Пробы по 150 мкл отбирали из нижней части лунки через 15, 30, 45, 60, 90 и 120 мин. После отбора пробы, необходимый объем сразу возмещали свежим раствором HBSS. Концентрацию веществ определяли с помощью высокоэффективной жидкостной хроматографии на Agilent 1200 HPLC с УФ-детектором. Хроматографический анализ был проведен на обращенной фазовой колонке (5 μm, 4.6×50 mm, Zorbax Eclipse SB-C18).
Оцениваемые параметры
Содержание ломефлоксацина гидрохлорида в испытуемых растворах определяли спектрофотометрически при длине волны 286 нм (максимум поглощения) в кювете с толщиной слоя 1 см.
Количественное значение logPe, обозначающее эффективную проницаемость мембраны, рассчитывали по формуле:
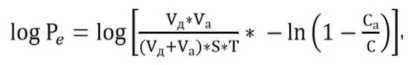
где C – равновесная концентрация вещества в суммарном объеме отсеков, мг/мл; Cа – концентрация вещества в акцепторном отсеке, мг/мл; T – время инкубации, мин.; Vд – объем донорного отсека, см3, S – площадь поверхность мембраны, см2; Vа – объем акцепторного отсека, см3.
Коэффициент клеточной проницаемости рассчитывали согласно формуле [13]:
Papp = Vr*(dC)/(dt)*1/AC0, где Vr – это объем верхней части лунки, dC/dt – это градиент общей концентрации вещества в нижней части лунки в течение времени, А – это площадь мембраны, C0 – это начальная концентрация вещества в верхней части лунки.
Статистическая обработка результатов исследования
Статистическую обработку результатов экспериментов проводили с помощью программ MS Exсel и Sta-tistica 6.0. Полученные экспериментальные данные представляли в виде среднего (mean) и ошибки среднего (standard error of the mean, SEM). Для сравнения количественных данных двух групп применяли двусторонний t-критерий Стьюдента для независимых выборок. Различия считались статистически значимыми при р <0,05.
РЕЗУЛЬТАТЫ
-
I. Изучение влияния простатических пептидов на проницаемость ломефлоксацина с использованием искусственных мембран.
Для определения оптимальной длительности инкубации проведена предварительная серия опытов, в ходе которой оптическую плотность растворов в акцепторных отсеках измеряли спустя 2, 4, 8, 16, 24 и 48 ч. Установлено, что оптимальной продолжительностью инкубации для оценки мембранотропности является интервал в 16 ч.: при уменьшении времени исследуемые активные вещества не успевают в достаточных количествах преодолеть мембрану, при увеличении времени происходит снижение оптической плотности растворов.
В эксперименте PAMPA с использованием фильтр-иммобилизованной искусственной мембраны была оценена способность ломефлоксацина (100 мкг/мл) диффундировать через мембраны при различных значениях рН (диапазон рН от 4 до 10). В качестве препаратов-эталонов были использованы два лекарственных соединения: 1) кетопрофен, как фармакологически активное вещество,хорошо проникающее через
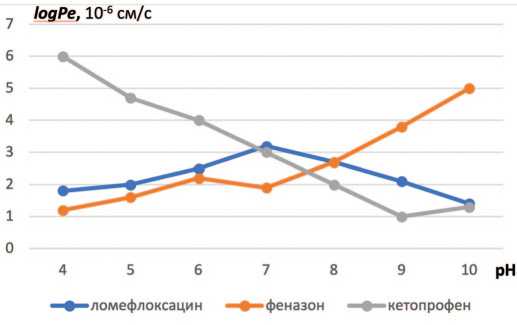
Рис. 1. Влияние рН на эффективную проницаемость мембраны. Ломефлоксацин – 100 мкг/мл, феназон – 50 мкг/мл, кетопрофен – 20 мкг/мл
Fig. 1. Effect of pH on effective membrane permeability. Lomefloxacin – 100 mcg / ml, phenazone – 50 mcg / ml, ketoprofen – 20 mcg / ml биологические мембраны при рН ниже 7,0 (слабая кислота), а также феназон, как лекарственное вещество с низкой проникающей способностью при рН ниже 7 (слабое основание). Результаты исследования приведены на рисунке 1. Видно, что увеличение рН с 4 до 7 существенно снижает проницаемость для кетопрофена, максимальная величина logPe регистрируется при низком уровне рН. Напротив, эффективная проницаемость мембраны для феназона растет с повышением рН, достигая максимальных значений при рН=10. рН-зависимость трансмембранной диффузии ломефлоксацина имеет характерные особенности (рис. 1). При крайних значениях рН величина logPe низкая,высокая проницаемость достигается в интервале рН, равном 6-8. Молекула ломефлоксацина относится к цвиттер-ионам, что, по нашему мнению, лежит в основе установленной нами зависимости проницаемости ломефлоксацина от рН [14].
Изучение влияния липидного состава на трансмембранный перенос включало исследование зависимости проницаемости лекарственных веществ от липидного состава, наносимого на ПВДФ-подложку При выборе экспериментального состава мы исходили из того,что компонентами клеточных мембран чаще всего служат фосфатидилхолин (ФХ) и фосфа-тидилэтаноламин (ФЭ). Особенностью состава липидных экстрактов гистогематических барьеров, в частности ГЭБ,является высокое содержание фосфа-тидилсерина (ФС) [15]. Отталкиваясь от рекомендаций по проведению РАМРА, диапазон концентраций липидного комплекса составлял от 1 до 20 мг/мл. В результате были выбраны и изучены три варианта липидной композиции: 1) 10 мг/мл фосфатидилхолина, 2) 2,52 мг/мл фосфатидилхолина + 6,62 мг/мл фосфа-тидилэтаноламина, 3) 2,52 мг/мл фосфатидилхолина + 6,62 мг/мл фосфатидилэтаноламина + 3,7 мг/мл фос-фатидилсерина. Полученные экспериментальные данные суммированы на рисунке 2.
6 logPe, 106 см/с
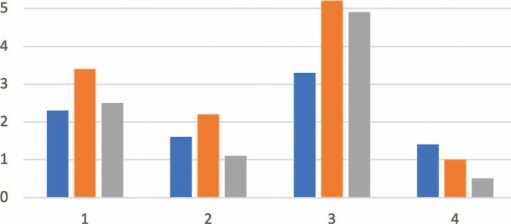
I Состав 1 Состав 2 g Состав 3
Рис. 2. Влияние фосфолипидного состава на эффективную проницаемость мембраны. Обозначения: 1 – ломефлоксацин, 2 – амоксициллин, 3– метронидазол, 4 – нистатин. Концентрация исследуемых соединений составляла 100 мкг/мл Fig. 2. Effect of the phospholipid composition on the effective membrane permeability. Designations: 1 – lomefloxacin, 2 – amoxicillin, 3 – metronidazole, 4 – nystatin. The concentration of the studied compounds was 100 μg/ml
Проведенные исследования позволили нам подобрать оптимальные условия для детекции и количественного определения трансмембранного переноса ломефлоксацина и приступить к главной задаче первой серии экспериментов, а именно, изучению возможности карго-эффекта простатических пептидов в бесклеточной модели. Применимость РАМРА при изучении проницаемости фторхинолонов подтверждена литературными данными [16]. На рисунке 3 представлены значения эффективной проницаемости мембраны для ломефлоксацина в отсутствии (контрольная группа) и присутствии простатических пептидов (экстракт предстательной железы в концентрации 10 мг/мл). Сочетанное применение ломефлоксацина и простатических пептидов приводит к достоверному повышению величины logPe, прирост составляет в среднем 29%.
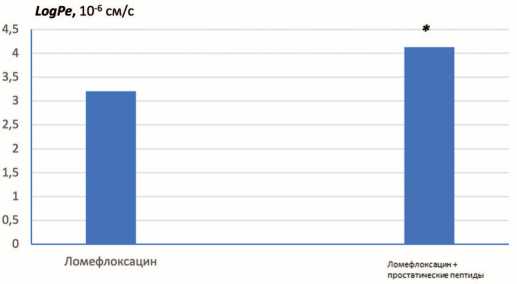
Рис. 3. Влияние простатических пептидов на эффективную проницаемость мембраны для ломефлоксацина (logPe). Условия: рН=7,2; липидный состав включает 2,52 мг/мл фосфатидилхолина + 6,62 мг/мл фосфатидилэтаноламина. *досто-верные отличия при p ≤0,05
Fig. 3. Effect of prostatic peptides on the effective membrane permeability for lomefloxacin (logPe). Conditions: pH=7.2; the lipid composition includes 2.52 mg/ml phosphatidylcholine + 6.62 mg/ml phosphatidylethanolamine. *significant differences at p ≤0.05
С целью доказать специфичность выявленного карго-эффекта был использован метод частичной денатурации пептидов – восстановления дисульфидных связей – с помощью бета-меркаптоэтанола (рис. 4 ). Добавление бета-меркаптоэтанола (BME) (конечная концентрация 200 мкМ) в донорный отсек не влияло на проницаемость чистого ломефлоксацина,но подав- ляло карго-эффект простатических пептидов.
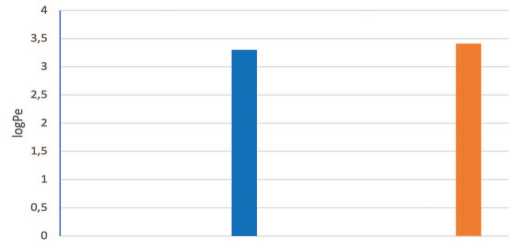
■ Ломефлоксацин + ВМЕ ■ Ломефлоксацин + простатические пептиды + ВМЕ
Рис. 4. Влияние бета-меркаптоэтанола (200 мкМ) на проницаемость ломеф-локсацина в отсутствии и в присутствии простатических пептидов. Условия как на рис. 3
Fig. 4. Effect of beta-mercaptoethanol (200 μM) on the permeability of lomefloxacin in the absence and presence of prostatic peptides. Conditions as in Fig. 3
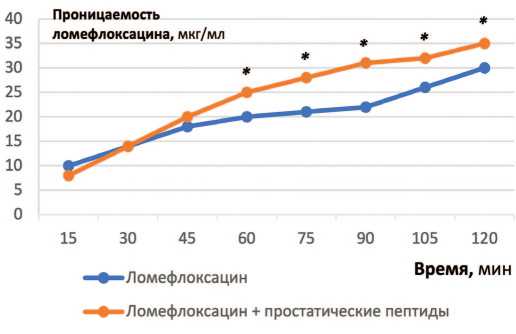
Рис. 5. Проницаемость ломефлоксацина через монослой клеток Сасо-2. * p ≤0,05 по сравнению с ломефлоксацин+пептиды в аналогичной точке. Ломефлоксацин – 20 мкг/мл, простатические пептиды – 10 мг/мл
Fig. 5. Permeability of lomefloxacin through a monolayer of Caco-2 cells. * p ≤0.05 compared to lomefloxacin+peptides at similar point. Lomefloxacin – 20 mcg / ml, prostatic peptides – 10 mg / ml
-
II. Определение клеточной проницаемости ломефлоксацина в модели Сасо-2.
Для выяснения молекулярного механизма повышения биодоступности ломефлоксацина в присутствии простатических пептидов были проведены эксперименты in vitro на клеточной линии Caco-2 (клетки эпителиальной колоректальной аденокарциномы человека) [17, 18]. При изучении сочетанного применения простатических пептидов + ломефлокса-цин было обнаружено значительное увеличение ( p ≤0,05) абсорбции ломефлоксацина по сравнению с чистым препаратом (рис. 5).
Рассчитанный нами коэффициент проницаемости (Papp) для ломефлоксацина в комплексе с пептидами составил 13,04±1,80×10-6 см/сек, в то время, как для ломефлоксацина – 10,31±0,76×10-6 см/сек. Важно отметить,что показатель трансэпителиального электрического сопротивления, который отражает ток ионов через плотные межклеточные контакты,досто-верно не изменялся в исследованном временном диапазоне, что служит подтверждением конфлюэнтности монослоя клеток [19].
ОБСУЖДЕНИЕ
Изучена возможность карго-эффекта активного начала препарата Витапрост® – олигопептидов,выде-ленных из предстательной железы крупного рогатого скота, которые состоят из нескольких аминокислот (от 2 до 100), с низкой молекулярной массой (от 175 до 5000 Да) и высокой специфической активностью.
Подобраны оптимальные условия для детекции и количественного определения трансмембранного переноса и внутриклеточного транспорта ломефлок-сацина; оценена возможность применения культуры клеток для исследования карго-эффекта в терапевтическом диапазоне концентраций активных компонентов препарата Витапрост®;установлены закономер- ности трансмембранного переноса и внутриклеточного транспорта ломефлоксацина в отсутствии (контрольная группа) и присутствии простатических пептидов (экстракт предстательной железы).
На первом этапе исследования был использован метод PAMPA, основанный на применении искусственно сконструированных клеточных мембран [20]. Искусственная мембрана состоит из липидной мембраны, поддерживаемой пористой гидрофобной фильтрующей пластиной. В начале эксперимента тестируемое соединение разводят в буфере и помещают в донорскую ячейку. Скорость проникновения определяют по эффективной проницаемости соединения (Ре). Значения Pe измеряются и рассчитываются с использованием планшетного ридера с интегрированной УФ спектрометрией, что существенно сокращает затраты по сравнению с клеточными моделями [21]. Недавние исследования доказали возможность применения PAMPA для изучения механизмов карго-эффекта [22].
Изучение временной зависимости переноса ло-мефлоксацина с помощью РАМРА показало, что оптимальным интервалом для оценки мембранотроп-ности является интервал в 16 ч. Полученные нами экспериментальные результаты согласуются с литературными данными. H . Yu и соавт., изучая временную зависимость проницаемости различных лекарственных веществ в модели PAMPA, установили, что для представителя фторхинолонов норфлоксацина оптимальным временем является диапазон 14-18 ч. [23]. Чем длиннее гидрофобная цепь, тем лучше проницаемость для лекарственного соединения,при этом для большинства изученных веществ наиболее благоприятной для условий эксперимента была 16-часовая длительность инкубации [24].
Полученные нами данные показали, что роль липидной композиции в эффективной трансмембранной доставке модифицируется в зависимости от химической природы исследуемых соединений. Экспериментальный состав мембраны оказывает сходное влияние на проницаемость ломефлоксацина,метронидазола и амоксициллина.Отличия между ними касается степени проницаемости: проницаемость метронидазола предсказуемо оказалась выше. Наибольшую чувствительность к составу мембраны продемонстрировал амоксициллин,для которого присуща индивидуальная структурная особенность в виде нескольких гидроксильных групп, способных образовывать водородные связи или участвовать в таутомерных равно-весиях.Сочетанное применение ломефлоксацина и простатических пептидов приводило к достоверному повышению величины logPe, прирост составляет в среднем 29%. На специфический характер выявленного карго-эффекта указывает его нивелирование в присутствии бета-меркаптоэтанола, который вызы- вает частичную денатурацию пептидов,не влияя на эффективную проницаемость самого ломефлоксацина.
Адекватной моделью in vitro для оценки проницаемости лекарственного вещества через стенку желудочно-кишечного тракта ЖКТ in vivo заслуженно является клеточная линия Caco-2. Особенностью данных клеток считается способность сохранять практически полные морфо-функциональные свойства, присущие клеткам кишечного эпителия,в том числе экспозиция в клеточных мембранах белков множественной лекарственной устойчивости (таких, как Р-гликопротеин). Как правило, полученные в таких экспериментах данные имеют хорошую корреляцию с биодоступностью лекарственных средств в живых организмах [25]. Оценка влияния простатических пептидов на активность трансмембранного переноса ломефлок-сацина в модели Caco-2 позволила установить достоверное увеличение коэффициента проницаемости (Papp) для ломефлоксацина в комплексе с пептидами по сравнению с пробами, содержащими только ломеф-локсацин. Рассматриваемый феномен может быть следствием как прямого карго-эффекта пептидов, так и опосредован блокированием/снижением активности P-гликопротеина молекулами простатических пептидов. С учетом результатов первой бесклеточной серии экспериментов, следует отдать предпочтение в пользу прямого карго-эффекта простатических пептидов.
ЗАКЛЮЧЕНИЕ
Изучено влияние простатических пептидов препарата Витапрост® на трансмембранный транспорт ломефлоксацина в двух сериях экспериментов: на бесклеточной РАМРА-модели и в культуре клеток Caco-2.
Оценка трансмембранного переноса ломефлокса-цина с помощью РАМРА выявила, что сочетанное применение ломефлоксацина и простатических пептидов приводит к достоверному повышению эффективной проницаемости (Pe), прирост составляет в среднем 29%. Определение клеточной проницаемости ломефлоксацина в модели Сасо-2 показало, что клеточная абсорбция ломефлоксацина в комбинации с простатическими пептидами значительно выше ( p ≤0,05) по сравнению с монопрепаратом ломефлокса-цином. Наблюдаемый эффект может быть следствием как прямого карго-эффекта пептидов, так и опосредованным влиянием – результатом блокирования/сниже-ния активности P-гликопротеина молекулами простатических пептидов.Сопоставляя полученные данные двух серий экспериментов,следует отдать предпочтение прямому карго-эффекту простатических пептидов препарата Витапрост® на трансмембранный транспорт ломефлоксацина.
Список литературы Влияние простатических пептидов на трансмембранный перенос ломефлоксацина
- Liu J, Afshar S. In vitro assays: friends or foes of cell-penetrating peptides. Int J Mol Sci 2020;21(13):4719. https://doi.org/10.3390/ijms21134719.
- Young Kim H, Young Yum S, Jang G, Ahn DR. Discovery of a non-cationic cell penetrating peptide derived from membrane-interacting human proteins and its potential as a protein delivery carrier. Sci Rep 2015(5):11719. https://doi.org/10.1038/srep11719.
- Vasconcelos L, Pärn K, Langel U. Therapeutic potential of cell-penetrating peptides. Ther Deliv 2013;4(5):573-91. https://doi.org/10.4155/ tde.13.22.
- Sawant R, Torchilin V. Intracellular transduction using cell-penetrating peptides. Mol Biosyst 2010;6(4):628-40. https://doi.org/10.1039/b916297f.
- Borrelli A, Tornesello AL, Tornesello ML, Buonaguro FM. Cell penetrating peptides as molecular carriers for anti-cancer agents. Molecules 2018;23(2):295. https://doi.org/10.3390/molecules23020295.
- Dubikovskaya EA, Thorne SH, Pillow TH, Contag CH, Wender PA. Overcoming multidrug resistance of small-molecule therapeutics through conjugation with releasable octaarginine transporters. Proc Natl Acad Sci U S A 2008;105(34):12128-33. https://doi.org/10.1073/pnas.0805374105.
- Madani F, Lindberg S, Langel U, Futaki S, Gräslund A. Mechanisms of cellular uptake of cell-penetrating peptides. J Biophys 2011;2011:414729. https://doi.org/10.1155/2011/414729.
- Richard JP, Melikov K, Vives E, Ramos C, Verbeure B, Gait MJ, Cher-nomordik LV, Lebleu B. Cell-penetrating peptides. A reevaluation of the mechanism of cellular uptake. J Biol Chem 2003;278(1):585-90. https://doi.org/10.1074/jbc.M209548200.
- Patel LN, Wang J, Kim KJ, Borok Z, Crandall ED, Shen WC. Conjugation with cationic cell-penetrating peptide increases pulmonary absorption of insulin. Mol Pharm 2009;6(2):492-503. https://doi.org/10.1021/ mp800174g.
- Khavinson V, Linkova N, Diatlova A, Trofimova S. Peptide Regulation of Cell Differentiation. Stem Cell Rev Rep 2020;16(1):118-125. https://doi.org/10.1007/s12015-019-09938-8.
- Reis JM, Sinko B, Serra CH. Parallel artificial membrane permeability assay (PAMPA) - Is it better than Caco-2 for human passive permeability prediction? Mini Rev Med Chem 2010;10(11):1071-6. https://doi.org/10.2174/1389557511009011071.
- Phillips, A. Arena. Optimization of Caco-2 cell growth and differentiation for drug transport studies. Millipore Corporation Protocol Note PC1060EN00 2003.
- van Breemen RB, Li Y. Caco-2 cell permeability assays to measure drug absorption. Expert Opin Drug Metab Toxicol 2005;1(2):175-85. https://doi.Org/10.1517/17425255.1.2.175.
- Cramariuc O, Rog T, Javanainen M, Monticelli L, Polishchuk AV, Vattulainen I. Mechanism for translocation of fluoroquinolones across lipid membranes. Biochim Biophys Acta 2012;1818(11):2563-71. https://doi.org/10.1016/j.bbamem.2012.05.027.
- van Meer G, Voelker DR, Feigenson GW. Membrane lipids: where they are and how they behave. Nat Rev Mol Cell Biol 2008;9(2):112-24. https://doi.org/10.1038/nrm2330.
- Bermejo M, Avdeef A, Ruiz A, Nalda R, Ruell JA, Tsinman O, González I, Fernández C, Sánchez G, Garrigues TM, Merino V. PAMPA - a drug absorption in vitro model 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. Eur J Pharm Sci 2004;21(4):429-41. https://doi.org/10.1016/j.ejps.2003.10.009.
- Kerns EH, Di L, Petusky S, Farris M, Ley R, Jupp P. Combined application of parallel artificial membrane permeability assay and Caco-2 permeability assays in drug discovery. J Pharm Sci 2004;93(6):1440-53. https://doi.org/10.1002/jps.20075.
- Fujikawa M, Ano R, Nakao K, Shimizu R, Akamatsu M. Relationships between structure and high-throughput screening permeability of diverse drugs with artificial membranes: application to prediction of Caco-2 cell permeability. Bioorg Med Chem 2005;13(15):4721-32. https://doi.org/10.1016/j.bmc.2005.04.076.
- Гребенкин Д.Ю., Станишевский Я.М., Шохин И.Е., Стойнова А.М., Карпова М.А., Корякова А.Г., Рябова А.В., Бровченко Б.В., Смирнов А.А. Исследование кишечной проницаемости и Pgp-транспорта фос-фазида с применением модели Сасо-2. Разработка и регистрация лекарственных средств 2017(4):238-242. [Grebenkin D.Yu., Stanishevskiy Y.M., Shohin I.E., Stoinova A.M., Karpova M.A., Koryakova A.G., Ryabova A.V., Brovchenko B.V., Smirnov A.A. Сасо-2 Intestinal permeability and pgp-affinity of phosphazide. Razrabotka i registratsiya lekarstven-nykh sredstv = Drug development and registration 2017(4):238-242. (In Russian)].
- Di L, Kerns EH, Fan K, McConnell OJ, Carter GT. High throughput artificial membrane permeability assay for blood-brain barrier. Eur J Med Chem 2003;38(3):223-32. https://doi.org/10.1016/s0223-5234(03)00012-6.
- Kansy M, Senner F, Gubernator K. Physicochemical high throughput screening: parallel artificial membrane permeation assay in the description of passive absorption processes. J Med Chem 1998;41(7):1007-10. https://doi.org/10.1021/jm970530e.
- Balimane PV, Pace E, Chong S, Zhu M, Jemal M, Pelt CK. A novel high-throughput automated chip-based nanoelectrospray tandem mass spectrometric method for PAMPA sample analysis. J Pharm Biomed Anal 2005;39(1-2):8-16. https://doi.org/10.1016/j.jpba.2005.03.043.
- Yu H, Wang Q, Sun Y, Shen M, Li H, Duan Y. A new PAMPA model proposed on the basis of a synthetic phospholipid membrane. PLoS One 2015;10(2):e0116502. https://doi.org/10.1371/journal.pone.0116502.
- Kim AV, Shelepova EA, Evseenko VI, Dushkin AV, Medvedev NN, Polyakov NE. Mechanism of the enhancing effect of glycyrrhizin on nifedipine penetration through a lipid membrane. J Mol Liq 2021;344:117759. https://doi.org/10.1016/j.molliq.2021.117759.
- Artursson P, Palm K, Luthman K. Caco-2 monolayers in experimental and theoretical predictions of drug transport. Adv Drug Deliv Rev 2001;46(1-3):27-43. https://doi.org/10.1016/s0169-409x(00)00128-9.


