Влияние противоопухолевых препаратов на первичные культуры клеток больных колоректальным раком
Автор: Голясная Надежда Викторовна, Иванов Юрий Викторович, Жижин Никита Кириллович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2 (26), 2016 года.
Бесплатный доступ
Первичные культуры клеток, использованные в нашей работе, получены из свежих образцов биопсийного и интраоперационного материала больных колоректальным раком (КРР), что позволяет избежать многочисленных изменений клеточных характеристик, которые появляются при пассажах перевиваемых линий клеток. Целью исследования является оценка влияния 5-фторурацила, цисплатина, томудекса, лейковорина и их комбинаций на клетки КРР in vitro. Ответ клеток на действие цитотоксических соединений и иммуномодулирующего препарата оценивали по изменению хромосомных аберраций, скорости роста клеток, пролиферативной и колониеобразующей активностям. Показано, что противоопухолевые препараты влияют на процесс мутагенеза и скорость деления культивируемых клеток. Методом ПЦР-RT анализа выявлены мутации в генах репарации неправильно спаренных оснований.
Колоректальный рак, первичные культуры клеток
Короткий адрес: https://sciup.org/14338553
IDR: 14338553
Текст научной статьи Влияние противоопухолевых препаратов на первичные культуры клеток больных колоректальным раком
Ежегодно в мире регистрируют примерно 600 000 новых случаев колоректального рака (КРР), около 300 000 человек умирают от этого заболевания [5]. В связи с тем, что большинство больных (до 70–80%) поступают в стационар на поздних стадиях развития заболевания, актуальным представляется совершенствование способов диагностики и схем лечения КРР [1, 2]. Расширение сферы применения методов молекулярной биологии в онкологии стимулирует трансформацию дескриптивного этапа развития этого раздела медицины, констатирующего биологические и клинические феномены, в аналитический этап углубленного изучения явлений с целью объяснения механизмов их возникновения. В свою очередь, расшифровка механизмов регуляции пролиферации опухолевых клеток, процессов метастазирования и ангиогенеза, особенностей репликации ДНК, развития и угнетения апоптоза – эти научные достижения последних десятилетий вносят существенный вклад в понимание генетических процессов клетки [4, 6].
Результаты патогенетических исследований стимулируют разработку новых подходов, в частности, генной и, так называемой, таргентной терапии неоплазий кишечника.
Цель исследования
Оценить in vitro влияние препаратов антиканцерогенного действия на опухолевые клетки при колоректальном раке.
Материалы и методы
Проведено исследование трансформированных и нетрансформированных клеток больных КРР. Биопсийный материал нормальной (на расстоянии 10 см от опухоли) и опухолевой эпителиальной ткани, отобранный во время операции 10 больных КРР, использовали для получения первичых неперевиваемых культур клеток. Получение первичных культур клеток. Образцы ткани подвергали механической и ферментативной дезагрегации на шейкере при 100 об/мин в течение 20 мин при 370С в среде культивирования МЕМ (Hyclone, Logan, UT) c добавлением 10% инактивированной эмбриональной сыворотки крупного рогатого скота (ЭС) и антибиотиков (пенициллин 100 Ед, цефазолин 5 Ед, канамицин 5 Ед на 1 мл среды), 15 мкг/мл ДНКазы I (Sigma, St. Louis, MO) [11]. Затем клетки центрифугировали 10 мин при 1 250 об/мин при 40С, помещали в 100 мм чашки для культивирования и инкубировали в термостате при 370С с 5% атмосферой СО 2 . Состав среды культивирования: 6,16 мл среды МЕМ; натрий фосфатный буфер 7,5%; 1,6 мл ЭС; 0,08 мл L-глютамина; 0,08 мл раствора антибиотиков. Метод колоние-образования. Агаризованную 0,6% МЕМ среду объемом 20 мл с 1×105 клеток помещали в 100 мм чашки для культивирования, которые инкубировали в термостате при 370С в 5% атмосфере СО 2 в течение 7 дней. Колониеобразующая активность выражена в процентах по формуле: К/N×100%, где К – количество колоний на чашку, N – количество засеянных на чашку клеток [8].
Оценка резистентности клеток к химиопрепаратам. Суспензии первичных культур клеток в 90 мкл МЕМ среды помещали в 96-луноч-ные стерильные иммунологические планшеты в концентрации 1×103 клеток на лунку и добавляли лекарственные препараты. В контрольном варианте в инкубационную среду с клетками добавляли деионизированную дистиллированную воду в объеме 10 мкл., соответствующем объему раствора лекарственного препарата. Клетки в планшетах инкубировали 24, 48, 72, 96
час. Оптическую плотность клеток в МЕМ среде измеряли на UV-спектрофотометре Biospec-mini (Shimadzu, Япония) при длине волны 630нм. Скорость роста опухолевых клеток рассчитывали по формуле: R=exp(-t)≈∆N/N, где N – ОП суспензии необработанных химическим соединением опухолевых клеток, ∆N – ОП суспензии обработанных химическим соединением опухолевых клеток [7]. Все эксперименты проведены в трех повторностях. Анализ хромосомных аберраций в клетках первичных культур эпителиальных клеток выполняли стандартным методом [3]. Клетки инкубировали в термостате при 370С в течение 48 час. Для блокирования митоза на стадии метафазы за 2 час до окончания инкубации в культуры клеток добавляли 0,002 мкг/ мл колхицина (Sigma). Затем клетки помещали в 0,75 М раствор КCl, и после инкубации в течение 15 мин фиксировали в растворе метилового спирта и ледяной уксусной кислоты (3:1). В каждом приготовленном и окрашенном по методу Гимза препарате анализировали 100 метафаз при помощи микроскопа Leica при увеличении ×1000. Подсчитывали количество клеток с распознаваемыми без кариотипирования хромосомными аберрациями. Митотический индекс рассчитывали по формуле: Р = М/К×100%, где М – количество делящихся клеток в популяции, К –общее количество клеток (не менее 1000) в популяции [3]. Эту же формулу использовали для вычисления количества анеуплоидных клеток. В работе использовали лекарственные препараты в конечных концентрациях мкг/мл: 18 – 5-фтор-дезоксиурацил (5-ФУ), 0,43 – цисплатин (ЦП), 2 – томудекс (ТД) и 0,29 – лейковорин (ЛВ). После обработки препаратами клетки инкубировали в течение 48 час при 370С.
Выделение ДНК и РНК из клеток. К клеткам, суспендированным в буфере LST (29 мМ трис-HCl рН 8.0, 10 мМ NaCl, 1мМ MgCl2, 0.25 М сахароза) добавляли равный объем буфера 4× TNLB (29 мМ трис-HCl рН 8.0, 10 мМ NaCl, 3 мМ MgCl2, 5% сахароза, 4% Np-40). Затем суспензию клеток центрифугировали при 5 000 об/мин в течение 10 мин. Осадок клеток дважды промывали буфером LST, затем ресуспендиро-вали в буфере TNE (10 мМ трис-HCl рН 8,0, 10 мМ NaCl, 10 мМ ЭДТА), 1% СДС (лаурилсульфат натрия) с протеиназой К в конечной концентрации 100 мкг/мл. Выделение РНК из клеток проводили с помощью набора TRIzol (Life Technologies, Inc.) согласно прилагаемой инструкции. Полимеразная цепная реакция с обратной транскрипцией (ПЦР-RT). Метод ПЦР с обратной транскрипцией использовали для получения продуктов, которые анализировали в 1% агарозном геле с добавлением 0,5 мкг/мл бромистого этидия (EtBr).Температуру отжига праймеров (табл. 1) с мишенью рассчитывали по формуле: 40С (G+C)+20С×(A+T)–4. Реакцию проводили в 30 мкл инкубационной смеси следующего состава: 2 мкг РНК, 1 µl M-MulV (обратная транскриптаза, СибЭнзим), 300 нM (5,0 пмоль) прямого и обратного праймера, 0,1 µM (2,5 пмоль), 5,0 нM MgCl2, SYBR Green, 10 мM трис–HCl pH 8,0, 3,5 нМ TaqMan ДНК-полимеразы (Sigma), 200 µM каждого из четырех дезоксинуклеотид-трифосфатов и 50 мM KCl. Цикл начинался нагреванием смеси до 250C в течение 5 мин. Проводили 40 циклов при 950C в течение 15 сек, при 520C - 20 сек и при 720C – 25 сек. Реакцию заканчивали охлаждением инкубационной смеси до 40C.
Электрофоретическое разделение ДНК в агарозном геле. Разделение ДНК осуществляли в 0,8% агарозном геле в ТАЕ буфере (40 мM трис– HCl pH 8,5, 5,71% ледяной уксусной кислоты, 0,04 мМ ЭДТА) в присутствии EtBr. Электрофорез проводили при 10–15 В/см в течение 120 мин. Результаты протоколировали с помощью BioRad. Статистический анализ результатов проводили с использованием методов описательной статистики, парного t-критерия Стьюдента и парного T-критерия Вилкоксона для двух попарно связанных выборок, непараметрического U-теста Манна-Уитни (Mann-Whitney U Test), метода линейного корреляционного анализа Пирсона. Результаты представлены в виде средней арифметической и ее стандартной ошибки (М±m) с указанием стандартного отклонения SD. Различия или показатели связи считались статистически значимыми при p<0,05. Расчеты выполнены при помощи компьютерной программы Excel 2003.
Результаты иccледования
Биопсийный материал отобран по 10 морфо-типам аденокарцином (низкодифференцированная, НД - 3, умеренно-дифференцированная, УД – 6, высоко-дифференцированная, ВД – 1), которым в дальнейшем проводилось 5 курсов химиотерапии в режиме Мейо (5-фторурацил –425 мг/м2 и лейковорин 20 мг/м2 в течение 5 дней, каждые 4–5 недель). Из биопсийного материала получены первичные культуры клеток, в которых определяли уровень мутагенеза, пролиферативной активности и резистентности к противоопухолевым препаратам. Установлено, что в первичных культурах клеток аденокарцином по сравнению с культурами нормальных эпителиальных клеток больше количество ане-уплоидных клеток (соответственно от 2,8±0,2% до 15,2±0,2%, SD 0,36 и 1,87, и 1,6±0,04%,SD 0,7, p<0,05), клеток с хромосомными аберрациями (соответственно от 5.7±0.9 до 15,1±3,7%, SD 2,4 и 9,8, и 0,2±0,002%, SD 0,007, p<0,05). Статистически не значимы уровни митотического индекса в культурах клеток, полученных из био-птатов аденокарцином и нормальных эпителиальных тканей (соответственно от 25,5±2,0% до 41,7±7,3, SD 4,5 и 17,9 и 22,3±0,3%, SD 0,6,p>0,05). Отсутствует корреляционная зависимость уровня клеток с хромосомными аберрациями (2,1±0,01%) и уровня митотического индекса (5,2±0,02%, r=0,2, p>0,05) в первичных культурах клеток ВД аденокарцином, основными характеристиками которых являются большое количество митозов и ядрышек в клетках. Корреляционная зависимость уровня клеток с хромосомными аберрациями (2,9±0,1%) и митотического индекса (36,6±0,2%, r=0,5, p<0,05) обнаружена в культурах клеток, полученных из УД аденокарцином, в которых есть перстневидные и атипичные клетки, некрозы, ядерный полиморфизм. Максимальный коэффициент корреляции между уровнем клеток с хромосомными аберрациями (5,6±0,02%) и митотическим индексом (20,8±0,2%, r=0,9, p<0,05) характерен для культур клеток НД аденокарцином с инвазивным ростом, массивными некрозами, большим количеством митозов, атипичными клетками и ядерным полиморфизмом. Основными типами хромосомных аберраций в опухолевых клетках являются дицентрические хромосомы (0,57±0,03%), парные и непарные хроматидные делеции (0,71±0,01%), количество которых в нормальных эпителиальных клетках соответственно 0,01±0,001% и 0,02±0,004%. Концентрации исследуемых противоопухолевых препаратов, соответствующие их терапевтическим дозам, максимально эффективно снижают количество анеуплоидных клеток, клеток с хромосомными аберрациями и митотический индекс в первичных культурах клеток, полученных из ВД аденокарциномы (рис. 1 А–Г). Цисплатин, лейковорин и 5-фторурацил вызывают снижение количества анеуплоидных клеток в первичных культурах клеток, полученных из НД или УД аденокарцином (рис. 1 А, В, Г). Максимально эффективное влияние на геном-
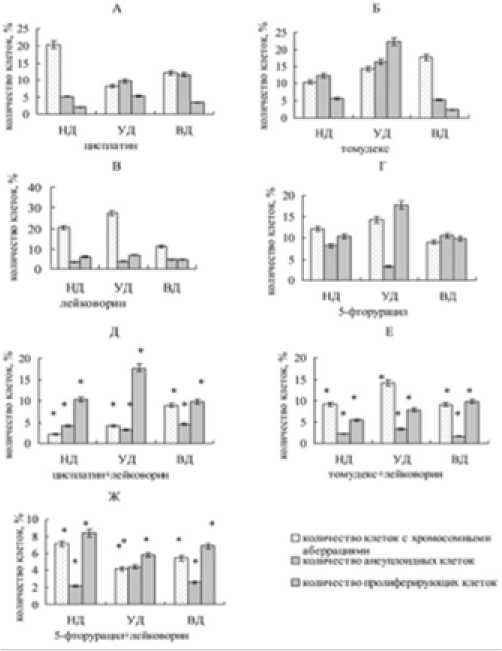
Рис. 1. Количество клеток с хромосомными аберрациями, полиплоидных и пролиферирующих клеток в культурах клеток, полученных из аденокарцином и обработанных противоопухолевыми препаратами (%) низко- (НД), умеренно- (УД) и высокодифференцированных (ВД)
* – р < 005 по отношению к монопрепарату
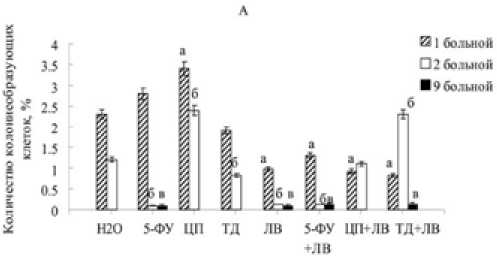
й 1 больной
□ 4 больной
□ 6 больной
□ ЮбольмоА
□ К больной
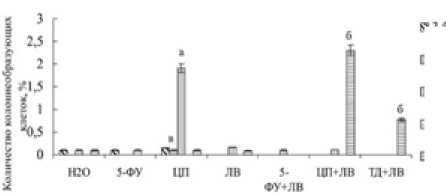
Рис. 2. Влияние 5-фторурацила (5-ФУ), цисплатина (ЦП), томудекса (ТД), лейковорина (ЛВ) и комбинаций 5-фторура-цила (5-ФУ+ЛВ), цисплатина (ЦП+ЛВ), томудекса (ТД+ЛВ) с лейковорином на колониеобразующую активность опухолевых клеток больных колоректальным раком.
А: больные «1», «2» и «9» с низкодифферен цированной аденокарциномой.
Б: больные «3» , «4», «6», «10» с умереннодифференцирован-ной,«8» – с высокодифференцированной аденокарциномами. а – р < 0.05 по отношению к деионизированной воде субкультур клеток больных «1» и «6»;
б – р < 0.05 по отношению к деионизированной воде субкультур клеток больных «2» и «8»;
в – р < 0.05 по отношению к деионизированной воде субкультур клеток больных «9» и «4».

Рис. 3. Влияние лекарственных препаратов и их комбинаций на динамику роста культур клеток, полученных из аденокарцином А,Г низкодифференцированных, Б,Д – умереннодифференцированных, В,Ж – высокодифференцированных.

Рис. 4. Мутация в генах hMSH6 и hMSH2 больных колоректальным раком. Экспрессия генов А – hMSH3 в опухолевых клетках, мутантных по гену hMSH6 – пациенты «4» и «6» с УД и «10» пациент с ВД аденокарциномами; Б – hMSH6 в опухолевых клетках, мутантных по гену hMSH2 – «2», «5», «7» и «9» пациенты с УД аденокарциномами.
ную стабильность и деление клеток всех подгрупп первичных культур клеток аденокарцином показала комбинация 5-фторурацила с лейковорином (рис. 1 Ж). Необходимо отметить, что цисплатин, 5-фторурацил и их комбинации с лейковорином вызвали повышение в 1,4–1,8 раза количества клеток с хромосомными аберрациями в культурах клеток, полученных из УД аденокарцином. Первичные культуры опухолевых клеток отличаются по уровню колониеобразующей активности. Обработка 5-ФУ, ЛВ и 5-ФУ+ЛВ ингибирует колониеобразующую активность опухолевых клеток НД аденокарцином больных «2» и «9» (рис. 2А), а также УД аденокарциномы больного «4» (рис. 2 Б). Цисплатин стимулирует образование колоний в культурах клеток НД аденокарциномы больных «1» и «2», а также УД аденокарциномы больных «3», «4» и «6». Инкубация в течение 7 дней клеток с томудексом и комбинацией этого цитостатика с лейковорином не влияет на колониеобразующую активность клеток НД аденокарциномы больного «1», УД аденокарцином больных «4», «5», «7» и «10». Динамика роста опухолевых клеток, обработанных препаратами in vitro, имеет индивидуальные особенности (рис. 3). Клетки первичных культур, полученные из НД аденокарцином, не чувствительны к цитотокси- ческому действию лекарственных препаратов. Исключением является высокая чувствительность к томудексу клеток, полученных из УД и ВД аденокарцином. Максимально чувствительными к цитотоксическому действию противоопухолевых препаратов являются клетки, полученные из ВД аденокарцином.
Экспериментально выявлено, что комбинации противоопухолевых препаратов эффективнее подавляют развитие опухолевых клеток. Гипермутагенез и снижение чувствительности клеток к цитостатическому действию противоопухолевых препаратов являются признаками мутаторного фенотипа клеток, который возникает в результате мутаций в генах системы репарации ошибочно спаренных оснований и является одной из причин развития КРР [10]. В клетках, мутантных по гену hMSH6, – высокая экспрессия белка Msh3, а в клетках, мутантных по гену hMSH2, не экспрессируются белки Msh3 и Msh6 [9]. Анализ продуктов ПЦР реакции свидетельствует о присутствии мутаций в генах hMSH6 (два пациента с УД и один пациент с ВД аденокарциномами) и hMSH2 (четыре пациента с УД аденокарциномой) (рис. 4). В качестве контроля в анализе использованы праймеры к гену, продуктом которого является β-актин. Высокая пролиферативная активность, геномная нестабильность, низкая чувствительность к противоопухолевым препаратам опухолевых клеток являются показателями отсутствия аллелей дикого типа MSH2 и MSH6 в соматических клетках. Работы по созданию новых стратегий доклинических исследований резистентности опухолевых клеток направлены на создание модели, которая позволит унифицировать химиотерапевтическое лечение и выбрать индивидуальные схемы лечения пациентов [12, 13]. Модели доклинического скрининга цитостатиков с использованием панели музейных переви-
Таблица 1
Праймеры
|
Ген |
F-праймер |
R-праймер |
|
β-актин |
5’-GCTCACCATGGATGATGATATCGC-3’ |
5’-GGAGGAGCAATGATCTTGATCTTC-3’ |
|
MSH6 |
5’-GATGGCATTTTCACAAGGATGGG-3’ |
5’-CTGGCGGATAATGGGTGACAAAC-3’ |
|
MSH2 |
5’-ACAAGGGGCTGGGTTAGCAAAAG-3’ |
5’-AGTCACCATTCTCTTCCGCTTTCG-3’ |
|
PMS2 |
5’-TTCTCAGGTTATCGGAGCCAGCAC-3’ |
5’-CTTCGTCCCAATTCACCTCAGTGG-3’ |
|
MLH1 |
5’-CAGGTTTCATTTCACAATGCACGC-3’ |
5’-TTACCTTCAACATCCAGCAGTGGC-3’ |
|
MSH3 |
5’-GGCAACAGTTCGACTCCTTTCAAG-3’ |
5’-TTGATACCCTCCCCGTTATCTCGC-3’ |
ваемых культур неопластических клеток позволяют разработать схему противоопухолевой терапии, но не дают возможность осуществлять индивидуальную прогностическую оценку развития химиорезистентности опухолевых клеток [14].
На наш взгляд, необходим принципиально новый подход к выбору схем лечения больных.
Экспозиция индивидуальных первичных культур клеток с различными молекулярными механизмами действия противоопухолевых препаратов дает возможность оценить генетически детерминированную химиорезистентность клеток и апробировать комбинацию химиопрепаратов, оптимально эффективную для подавления роста и развития опухоли.
Список литературы Влияние противоопухолевых препаратов на первичные культуры клеток больных колоректальным раком
- Барсуков Ю.А., Кныш В.И. Современные возможности лечения колоректального рака. Современная онкология. 2014. Т. 8. № 2. С. 7-16.
- Имянитов Е.Н. Клинико-молекулярные аспекты колоректального рака: этиопатогенез, профилактика, индивидуализация лечения. Практическая онкология. 2015. № 6. С. 65-70.
- Клаус Дж. Лимфоциты. Методы. M. 2006.
- Cai G., Xu Y., Lu H. Clinicopathologic and molecular features of sporadic microsatelliteand chromosomal-stable colorectal cancers. Int J Colorectal Dis. 2016. V. 23. N 4. P. 365-373.
- Cheng K.C., Loeb L.A. Hereditary colorectal cancer. J Clin Oncol. 2014. V. 22. N 16. P. 3284-3292.
- Davies R.J., Miller R., Coleman N. Colorectal cancer screening: prospects for molecular stool analysis. Nat. Rev. Cancer. 2015. V. 5. P. 199-209.
- Deisboeck T.S., Berens M.E., Kansal A.R. Pattern of self-organization in tumour systems: complex growth dynamics in a novel brain tumor spheroid model. Cell. Prolif. 2014. V. 34. N 1. Р. 115-134.
- DiPersio J.F., Brennan J.K.,Lichtman M.A. Human cell lines that elaboratecolony-stimulating activity for the marrow cells of man and other species. Exp. Hematol. 2013. V. 6. N 8. P. 661-672.
- Fishel R., Lescoe M., Rao M. The humanmutator gene homolog MSH2 and its association with hereditary nonpolyposis colon cancer. Cell. 2013. V. 75. N 3. P. 1027-1038.
- Genschel J. Littman S., Drummond J.,Modrich P. Isolation of MutS beta from human cells and comparison of the mismatch repair specificities of MutS beta and MutS alpha.J. Biol. Chem. 2016. V. 273. N 31. P. 19895-19901.
- Giavazzi R., Campbell D., Jessup J. Metastatic behavior of tumor cells isolated from primary and metastatic human colorectal carcinomas implanted into different sites in nude mice. Cancer Res. 2015. V. 46. N 5. Р. 1928-1933.
- Lievre A., Laurent-Puig P. Molecular biology in clinical cancer research: the example of digestive cancers. Rev. Epidemiol. Sante Publique. 2015. V. 53. N 3. P. 267-282.
- Vogel I., Soeth E., Ruder C. Disseminated tumor cells in the blood and/or bone marrow of patients with colorectal carcinoma are an independent prognostic factor. Annual Oncol. 2014. V. 11. N 4. P. 43-183.
- Worthley D.L., Whitehall V.L., Spring K.J. Colorectal carcinogenesis: Road maps to cancer. World J. Gastroenterol. 2012. Vol. 3.N 28.P.3784-3791.


