Влияние раствора пептидов на процессы ангиогенеза роговицы крыс в эксперименте
Автор: Кодунов А. М., Терещенко А. В., Трифаненкова И. Г., Темнов А. А., Склифас А. Н., Ерохина Е. В., Демьянченко С. К., Шацких А. В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.17, 2021 года.
Бесплатный доступ
Цель: определить влияние раствора пептидов на процессы патологического ангиогенеза в модели постожогового неоваскулярного бельма роговицы крыс. Материал и методы. Исследование выполнено на 24 крысах (48 глаз). Через 30 суток после формирования химического ожога роговицы проводили лечение постожогового неоваскулярного бельма. Один глаз каждого животного был контрольным, другой — опытным. В опытной группе 1 (12 животных, 12 глаз) проводилось лечение общей фракцией пептидного препарата, в опытной группе 2 (12 животных, 12 глаз) — фракцией пептидного препарата до 30 кДа. На контрольных глазах применяли инстилляции культуральной среды, которая используется в производстве пептидного препарата. Методы исследования включали офтальмоскопию с фоторегистрацией, оптическую когерентную томографию (ОКТ) переднего отрезка глаза, оценку морфологических изменений в тканях роговицы до и после лечения. Сроки наблюдения составили до 30 суток. Результаты. Лечение постожогового бельма роговицы пептидным препаратом в опытных группах имело антиангиогенный эффект, что прослеживалось в отсутствии неоваскулогенеза роговицы после 30 дней инстилляций препарата. В контрольной группе сформировалось бельмо, приведшее к истончению роговицы, в котором имелись разные по функциональному состоянию сосуды. Заключение. Полученные результаты свидетельствуют о перспективности применения препарата раствора пептидов для лечения постожогового неоваскулярного бельма роговицы.
Раствор пептидов, патологический ангиогенез, постожоговое неоваскулярное бельмо роговицы
Короткий адрес: https://sciup.org/149135634
IDR: 149135634 | УДК: 611.013
Текст научной статьи Влияние раствора пептидов на процессы ангиогенеза роговицы крыс в эксперименте
каждый год [1]. По данным эпидемиологического анализа, больные с патологией роговицы составляют от 10 до 50% среди общего числа слепых и слабовидящих, что во многом зависит от уровня экономического развития страны [2, 3].
В связи с увеличением числа заболеваний, в основе которых лежит развитие новообразованных сосудов, в последние десятилетия возрос интерес к проблеме патологического ангиогенеза в различных тканях глаза. Известно более ста офтальмологических заболеваний, приводящих к развитию неоваскуляризации. Наиболее частые из них: сахарный диабет, инфекционный кератит, возрастная макулярная дегенерация, осложненная миопия, липидная кератопатия, а также травма глаза [4].
Традиционные консервативные методы лечения неоваскуляризации роговицы на современном этапе недостаточно эффективны [4–8]. Местное применение кортикостероидов способно подавлять региональную неоваскуляризацию. Несмотря на то что ан-тиангиогенный эффект кортикостероидов в роговице не до конца изучен, полагают, что он связан с их противовоспалительным действием. Однако как в клинических, так и в экспериментальных условиях эффективность кортикостероидов при подавлении васкуляризации роговицы оказалась недостаточной. Из-за неполного подавления васкуляризации роговицы кортикостероидами, а также в связи с побочными эффектами как местных, так и системных кортикостероидов в настоящее время ведутся поиски препаратов, лишенных этих недостатков.
Другими зарегистрированными средствами для подавления васкуляризации роговицы являются нестероидные противовоспалительные препараты (НПВП): флурбипрофен, индометацин и кеторолак. Антиангиогенный эффект от применения НПВП в роговице изменчив и непредсказуем, поэтому они обычно не используются в клинической практике для этой цели [7, 8].
В настоящее время существуют сведения о влиянии VEGF на развитие новообразованных сосудов роговицы при различных ее заболеваниях. Эти данные представлены в немногочисленных публикациях и требуют дальнейшего изучения и анализа [8, 9].
Таким образом, антиангиогенная терапия новообразованных сосудов роговицы является серьезной и важной проблемой офтальмологии. В связи с этим актуальной следует признать разработку новых подходов к решению данной проблемы путем не только создания оригинальных антиангиогенных препаратов, но и поиска возможностей комбинированного использования уже известных методов.
Одним из перспективных направлений в лечении неоваскуляризации роговицы может быть использование стволовых или прогениторных клеток, получаемых как из костного мозга, так из лимбаль-ной области. Паракринные факторы, выделяемые стволовыми клетками, обладают противовоспалительным, антиапоптотическим и прорегенираторным действием [10].
Однако в литературе отсутствуют данные об эффективности применения мезенхимальных стволовых клеток (МСК) при уже сформированных сосудах в роговице.
Возможным путем решения проблемы лечения неоваскуляризации роговицы может быть использование пептидов (паракринных факторов МСК), полученных из культивированных в условиях особого микроокружения стволовых клеток, что влияет на спектр и концентрацию паракринных факторов [10].
Цель: определить влияние раствора пептидов на процессы патологического ангиогенеза в модели постожогового неоваскулярного бельма роговицы крыс.
Материал и методы. Исследование проведено на 24 крысах (48 глаз). Предварительно, до моделирования химического ожога роговицы, получали препарат пептидов следующим образом. Выделяли стволовые клетки костного мозга кроликов, находящихся под общим наркозом. Далее из клеток костного мозга животных выделяли мононуклеар-ную фракцию на градиенте плотности с использованием стандартного раствора Lympholyte-H (фирма Cedarlane, Canada). После получения суспензию мононуклеарных клеток высевали на чашки Петри и культивировали в среде DMEM c добавлением 10% эмбриональной телячьей сыворотки. Для подтверждения, что используемые клетки обладают свойствами МСК, проводили их остеогенную, хондрогенную и адипогенную дифференцировку по стандартной методике [11]. Остеогенная дифференцировка (с добавлением 10% эмбриональной телячьей сыворотки, 100 мкМ дексаметазона, 0,1 мМ аскорбиновой кислоты и 10 нМ β-глицерофосфата) была подтверждена наличием щелочной фосфатазы в культуре клеток с использованием стандартных реактивов (Sigma-Aldrich, USA). Хондрогенная дифференцировка (с добавлением 10% эмбриональной телячьей сыворотки, 100 мкМ дексаметазона и 0,1 мкг/мл TGF-в) была подтверждена с использованием окраски аль-циановым голубым. Адипогенная дифференцировка (с добавлением 10% эмбриональной телячьей сыворотки, 10 мкМ дексаметазона, 10 мкг/мл инсулина и 100 мкг/мл IBMX) была подтверждена окрашиванием с использованием Oil Red-O.
После получения клеточного монослоя проводили полную смену культуральной среды и через трое суток кондиционированную культуральную среду объединяли с лизатом МСК. Культуру клеток разрушали, используя физико-химические методы [12].
Готовый препарат пептидов представлял собой прозрачную гомогенизированную жидкость малинового цвета.
Для получения экспериментальной модели химического ожога роговицы применяли метод Обенбер-гера [13].
Химический ожог формировали на оба глаза под местной анестезией (0,4%-м инокаином) аппликацией фильтровальной бумаги (в виде круга диаметром 5 мм), смоченной 90%-м этанолом, с экспозицией 60 секунд на роговицу и конъюнктиву. Предварительно перед моделированием ожога животных наркотизировали препаратом Золетил®100 (ВИРБАК, Франция).
Через 30 суток после формирования химического ожога роговицы проводили лечение постожогового неоваскулярного бельма. Один глаз каждого животного был контрольным, другой опытным — для нивелирования индивидуализации анализа. В опытной группе 1 (12 животных, 12 глаз) проводилось лечение общей фракцией пептидного препарата. В опытной группе 2 (12 животных, 12 глаз) лечение проводилось фракцией пептидного препарата до 30 кДа. На контрольных глазах применяли инстилляции культуральной среды, которая используется в производстве пептидного препарата.
Методы исследования включали офтальмоскопию с фоторегистрацией, оптическую когерентную томографию (ОКТ) переднего отрезка глаза, оценку состояния прозрачности роговицы на приборе Pentacam: степень прозрачности определялась в центральной зоне и измерялась в условных единицах от 100 (абсолютная непрозрачность) до 0 (абсолютная прозрачность роговицы), оценку морфологических изменений в тканях роговицы выполняли до и после лечения.
Данные оптической когерентной томографии переднего отрезка глаза крыс с моделью химического ожога роговицы
|
3-и сутки |
7-е стуки |
14-е сутки |
30-е сутки |
|
Отек роговицы до 310 мкм. Отслойка десцеметовой мембраны. |
Увеличение толщины роговицы (до 280 мкм). Увеличение площади отслойки десцеметовой мембраны. Преципитаты. |
Неравномерная толщина роговицы (до 216 мкм). Сохранение отслоек десцеме-товой мембраны. Фибриновая мембрана на эндотелии. Иридокорнеальные синехии. |
Неравномерная толщина роговицы (от 124 мкм до 204 мкм). Кистозная дегенерация роговицы. Фибриновая мембрана на эндотелии. Иридокорнеальные синехии. |
Сроки наблюдения составили 1, 3, 7, 14, 30 суток.
Результаты. Моделирование химического ожога роговицы. По данным офтальмоскопии переднего отрезка глаза, в первые часы после химического воздействия у крыс наблюдались: выраженная инъекция сосудов конъюнктивы, блефароспазм, эпители-опатия в виде его выраженного отека.
На 1-е сутки отмечалось усиление блефароспазма, светобоязнь и выраженная конъюнктивальная инъекцию сосудов. Эпителий роговицы был практически полностью слущен с сохранением отдельных «островков» в парацентральной зоне.
К 3-м суткам к сохраняющимся блефароспазму, конъюнктивальной инъекции и слущенному эпителию присоединилась расширенная сеть лимбальных сосудов с единичным прорастанием новообразованных сосудов в направлении центральной зоны роговицы.
На 7-е сутки блефароспазм уменьшился, эпителий закрыл эрозированную поверхность, но у отдельных животных наблюдалось сохранение деэ-пителизированных участков в центральной области диаметром не более 1,5 мм. По всей паралимбаль-ной зоне роговицы наблюдалось врастание паннуса из новообразованных сосудов в толщу стромы на 1–2 мм.
К 14-м суткам блефароспазма и конъюнктивальной инъекции сосудов не наблюдалось. Отмечалась полная эпителизация поверхности роговицы с формированием васкуляризированного помутнения. Сосуды имели различный ход. Отдельные стволы были направлены к центральной зоне с образованием анастомозов, другие сосуды оканчивались в парацентральной зоне и имели меньший диаметр.
К 30-м суткам офтальмологический статус оставался без изменений по сравнению с 14-ми сутками.
По данным ОКТ переднего отрезка, в 1-е сутки наблюдалось утолщение роговицы до 407 мкм в центральной зоне и 420 мкм перилимбально по сравнению с исходными данными (97 мкм и 110 мкм соответственно).
В процессе дальнейшего наблюдения проанализирована динамика толщины роговицы крыс с моделью ожога. Оказалось, что с 14-х до 30-х суток у всех животных отмечалась неравномерная толщина роговицы в центральной зоне (формировалось центральное «плато», где роговица была истонченной).
Данные ОКТ переднего отрезка глаза представлены в таблице.
В итоге к 30-м суткам толщина эпителиального слоя была неравномерной, в назальном сегменте па-раоптической области в толще стромы определялось гиперрефлективное помутнение, в его проекции преимущественно в поверхностных слоях стромы визуализировались множественные гипорефлективные полости (кисты). Угол передней камеры был тотально закрыт за счет плоскостной иридокорнеальной синехии (рис. 1).
Таким образом, уже к 14-м суткам после химического поражения образуется стойкое неоваскулярное бельмо роговицы (прозрачность роговицы — 100, по данным Pentacam).
По данным гистологического исследования, на 3-и сутки процесс эпителизации поврежденного участка был уже завершен, однако в центральной зоне новообразованный эпителий был отслоен от подлежащей стромы с формированием псевдокисты, заполненной прозрачной экссудативной жид-
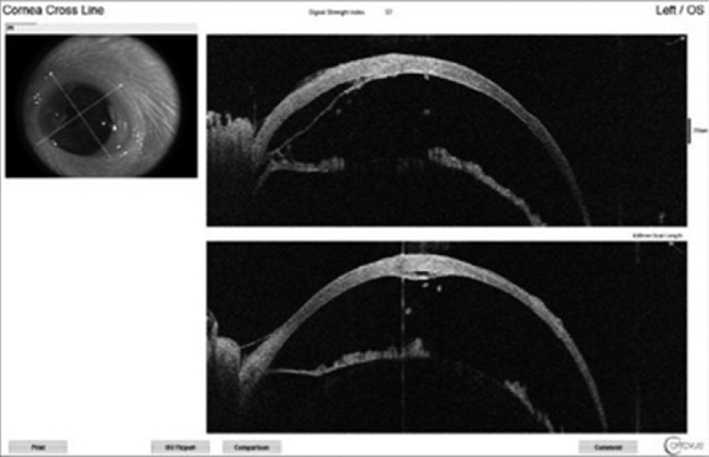
Рис. 1. Данные оптической когерентной томографии переднего отрезка. Модель ожога роговицы, 30-е сутки
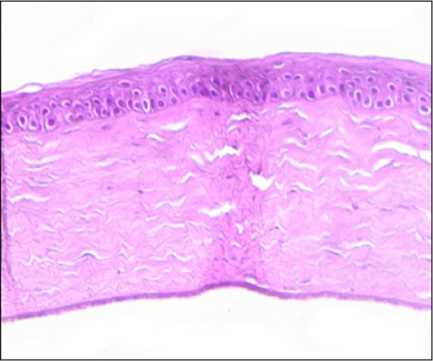
Рис. 2. Данные гистологии. Результаты лечения сосудистого бельма роговицы препаратом пептидов в опытной группе 1, 30-е сутки. Окраска гематоксилин-эозин, ув. X400.
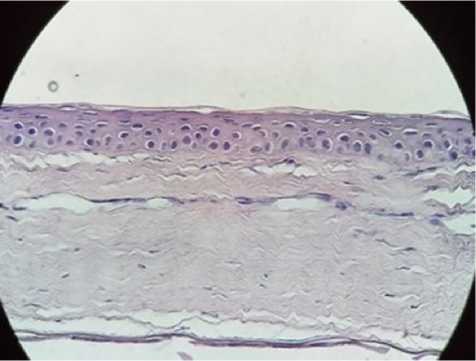
Рис. 3. Данные гистологии. Результаты лечения сосудистого бельма роговицы в контрольной группе, 30-е сутки. Окраска гематоксилин-эозин, ув. X400.
костью. В строме центральной зоны обнаруживался диффузный пластинчатый умеренный лифоцитар-но-плазмоцитарный инфильтрат. На периферии клеточный компонент инфильтрата был перемещен в передние слои стромы (субэпителиально), в его составе обнаруживались единичные эозинофильные гранулоциты, возможно эозинофилы (аллергический компонент), имелся активный неоваскулогенез с тенденцией прорастания капилляров по направлению к центру.
К 7-м суткам в центральной зоне под эпителием сохранялись псевдокисты, заполненные прозрачной экссудативной жидкостью, на фоне субэпителиальной фиброплазии. В строме наблюдался диффузный пластинчатый умеренный лимфоцитарно-плазмоцитарный инфильтрат на фоне неоваскуляризации с диапедезными кровоизлияниями.
На 14-е сутки субэпителиальные кисты отсутствовали, активной фиброплазии не наблюдалось. В строме обнаруживалась слабая клеточная инфильтрация в передних слоях, неоваскуляризация также затрагивала только передние слои роговицы, с единичными экстравазальными эритроцитами. Эндотелий был без особенностей.
На 30-е сутки наблюдалось истончение роговицы с признаками сформированного васкуляризированного бельма. Сосуды были эктазированы, полнокровны, строма — умеренно отечна, задний эпителий роговицы — без особенностей.
Лечение постожогового неоваскулярного бельма роговицы. По данным офтальмоскопии переднего отрезка глаза, к 14-м суткам инстилляций в конъюнктивальную полость пептидного препарата наблюдалось уменьшение количества новообразованных сосудов, помутнение роговицы в проекции запустевших сосудов исчезло. Сохранявшиеся новообразованные комплексы имели меньший диаметр. Эпителий оставался сохранным. Различий в опытных группах, где в качестве лечения применялся пептидный препарат общей фракции и фракции до 30 кДа, не наблюдалось (улучшение прозрачности роговицы до 60 единиц, по данным Pentacam).
На 30-е сутки лечения в опытных группах животных у большинства крыс новообразованных сосудов обнаружено не было, сохранялись лишь отдельные сосудистые стволы, которые ранее образовывали мощные анастамозы. Помутнений в зонах остав- шихся новообразованных сосудов не наблюдалось (улучшение прозрачности роговицы до 30 единиц).
В контрольных глазах на 14-е и 30-е сутки кера-топротективной терапии динамики не наблюдалось: отмечалось сформированное неоваскулярное помутнение роговицы (прозрачность роговицы — 100).
По данным гистологического исследования, в опытных группах к 30-м суткам эпителий был не изменен, строма — без отека и малоклеточна, субэпителиально выявлялись запустевшие единичные сосуды капиллярного типа без эритроцитов (рис. 2).
В контрольной группе к 30-м суткам также отмечался неизмененный эпителий роговицы, однако сама роговица была истончена. Наблюдалось сформированное васкуляризированное бельмо роговицы с субэпителиальной фиброплазией и неоваскуляризацией. Обнаруживались как запустевшие сосуды с признаками облитерации, так и полностью функционирующие (рис. 3).
Обсуждение. В основе роста новообразованных сосудов лежат сложные биохимические и иммунологические механизмы [14–16]. Нарушение баланса между проангиогенными и антиангиогенными медиаторами неоваскуляризации на местном уровне в сторону доминирования первых может обусловливать или сопровождать развитие различных патофизиологических процессов [9, 17]. Такой сдвиг обеспечивает постоянную индукцию процесса неоваскуляризации.
Неоваскулогенез роговицы многие авторы рассматривают как защитную реакцию на воспалительный агент [5, 7, 18]. Данный процесс является повторением физиологического ангиогенеза, и одной из задач современной офтальмологии является исследование факторов, индуцирующих процесс нео-васкулогенеза роговицы, а также поиск эффективных методов лечения неоваскуляризации роговицы.
Целью данной работы было определение влияния раствора пептидов на процессы патологического ангиогенеза в модели постожогового неоваскуляр-ного бельма роговицы крыс. Применяемая в настоящем исследовании модель химического ожога роговицы позволила уже к 7-м суткам получить обильное прорастание сосудов лимбальной сети в ткани роговицы, к 14-м суткам было сформировано стойкое неоваскулярное бельмо роговицы.
По данным морфологического анализа, клеточная пролиферация была представлена воспалитель- ным и фибробластическим звеном. Лимфоцитар-но-плазмоцитаный клеточный инфильтрат за счет присутствия возможного аллергического компонента на начальных сроках эксперимента равномерно распространялся между волокон стромы на всю ее толщину в центре и ближе к передним слоям на периферии. Нейтрофилы и макрофаги были единичны, так как деструктивные явления к 3-м суткам были завершены и, возможно, некротические массы с поверхности поврежденной роговицы элиминировались. К 14-м суткам воспалительный процесс при моделировании химического ожога был практически завершен.
Пролиферативный процесс был представлен в виде субэпителиальной фиброплазии, проявляющейся к концу 1-й недели эксперимента, и неоваскуляризацией — на протяжении всех сроков наблюдения. К 30-м суткам диагностировалось васкуляризированное бельмо с истончением роговицы.
Лечение постожогового бельма роговицы пептидным препаратом имело антиангиогенный эффект, что прослеживалось в отсутствии неоваскулогенеза роговицы после 30 дней инстилляций препарата. Этот факт подтверждался наличием субэпителиально единичных запустевших капилляров в опытных группах, свидетельствующих о предсуществующем повреждении роговицы (химический ожог), которое посредством лечения скомпенсировано. В контрольной группе, где применяли культуральную среду в качестве инстилляций, сформировалось бельмо, приведшее к истончению роговицы, в котором имелись разные по функциональному состоянию сосуды (активные и с признаками облитерации).
Следует отметить, что используемый нами препарат, помимо подавляющих ангиогенез белков, содержит достаточно высокие концентрации VEGF (до 1200 пг/мл), что было показано в наших предыдущих работах [19]. Однако при столь высоких концентрациях фактора роста сосудов мы наблюдали подавление неоваскулогенеза роговицы. Это может быть связано с инактивацией рецепторов к VEGF высокими концентрациями лиганда (препарата раствора пептидов) или с воздействием других факторов, секретируемых стволовыми клетками. Кроме того, данный препарат содержит достаточно большое количество антиапоптотических цитокинов [19].
Заключение. Полученные результаты свидетельствуют об антиангиогенном влиянии раствора пептидов на сформированные в результате ожогового повреждения роговицы новообразованные сосуды. Это, в свою очередь, говорит о перспективности применения препарата раствора пептидов для лечения постожогового неоваскулярного бельма роговицы. Инстилляции пептидного препарата как общей фракции, так и фракции до 30 кДа имели антиангиоген-ный эффект, о чем свидетельствовало отсутствие новообразованных сосудов в роговице через 30 дней после начала лечения. Необходимо проведение дальнейших исследований по оценке эффективности и безопасности предложенного метода лечения с обоснованием возможности его применения в клинической практике.
Список литературы Влияние раствора пептидов на процессы ангиогенеза роговицы крыс в эксперименте
- Prokofyeva E, Zrenner E. Epidemiology of major eye diseases leading to blindness in Europe: A literature review. Ophthalmic Res 2012; 47: 171–88. DOI: 10.1159 / 000329603.
- Libman ES. 120 years of the Society of Ophthalmologists of Russia. In: VIII Congress of Russian Ophthalmologists: Materials. Moscow, 2005; p. 3–5. Russian (Либман Е. С. 120 лет Обществу офтальмологов России. В кн.: VIII съезд офтальмологов России: материалы. M., 2005; c. 3–5).
- Maychuk YuF. New in the epidemiology and pharmacotherapy of eye infections. Clinical Ophthalmology 2000; 1 (2): 48–51. Russian (Майчук Ю. Ф. Новое в эпидемиологии и фармакотерапии глазных инфекций. Клиническая офтальмология 2000; 1 (2): 48–51).
- Yuzhakov AM, Bykov VP, Zyurnyaeva ID, Gogadze MG. New perspectives in the treatment of intraocular infection. Bulletin of Ophthalmology 2000; 2: 20–22. Russian (Южаков А. М., Быков В. П., Зюрняева И. Д., Гогадзе М. Г. Новые перспективы в лечении внутриглазной инфекции. Вестник офтальмологии 2000; 2: 20–2).
- Kopaeva VG, Andreev YuV, Ponomarev GV, et al. The first experience in the treatment of neovascularization of the corneal graft by photochemical vascular destruction. In: Actual problems of ophthalmology: Collection of scientific papers. Ufa, 1996; p. 40–2. Russian (Копаева В. Г., Андреев Ю. В., Пономарев Г. В. и др. Первый опыт лечения неоваскуляризации роговичного трансплантата методом фотохимической деструкции сосудов. В кн.: Актуальные проблемы офтальмологии: сб. науч. трудов. Уфа, 1996; с. 40–2).
- Maklakova IA. Corneal neovascularization: Modern aspects of pathogenesis and treatment. Bulletin of Ophthalmology 1993; 109 (5): 35–8. Russian (Маклакова И. А. Неоваскуляризация роговицы: современные аспекты патогенеза и лечения. Вестник офтальмологии 1993; 109 (5): 35–8).
- Zhao G, Yan W, Chen E, et al. Numerical simulation of the inhibitory effect of angiostatin on metastatic tumor angiogenesis and microenvironment. Bull Math Biol 2013; 75 (2): 274–87. DOI: 10.1007 / s11538‑012‑9805‑2.
- Haep L, Britzen-Laurent N, Weber TG, et al. Interferon gamma counteracts the angiogenic switch and induces vascular permeability in dextran sulfate sodium colitis in mice. Inflamm Bowel Dis 2015; 21 (10): 2360–71. DOI: 10.1097 / MIB. 0000000000000490.
- O’Reilly MS, Holmgren L, Shing Y, et al. Angiostatin: a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma. Cell 1994; 79 (2): 315–28. DOI: 10.1016 / 0092–8674 (94) 90200–3.
- Hubutiya MSh, Temnov AA, Vagabov AV, et al. Low molecular weight peptide drugs derived from cultured stem cells for the treatment of acute renal failure. Transplantology 2011; (4): 20–5. Russian (Хубутия М. Ш., Темнов А. А., Вагабов А. В. и др. Низкомолекулярные пептидные препараты, полученные из культивированных стволовых клеток, при лечении острой почечной недостаточности. Трансплантология 2011; (4): 20–5). URL: https://doi.org / 10.23873 / 2074‑0506‑2011‑0‑4‑20‑25.
- Yagi H, Soto-Gutierrez A, Navarro-Alvarez N, et al. Reactive bone marrow stromal cells attenuate systemic inflammation via sTNFR1. Molecular Therapy 2010; 18 (10): 1857–64. DOI: 10.1038 / mt. 2010.155.
- Composition for stimulating cell growth and regeneration, as well as methods for its preparation: Patent 234170 (RF) / A. S. Botin, N. A. Onishchenko, A. A. Temnov (RF); publ. 20.12.2008, Bull. № 35. Russian (Композиция для стимулирования роста и регенерации клеток, а также способы ее получения: пат. 2341270 (РФ) / А. С. Ботин, Н. А. Онищенко, А. А. Темнов (РФ); опубл. 20.12.2008, Бюл. № 35).
- Obenberger J. Paper strips and rings as simple tools for standartization of experimental eye injuries. Ophthalmol Res 1975; 7: 363–6.
- Mertvetsov NP, Stefanovich LE. Angiogenin and the mechanism of angiogenesis. Novosibirsk: Nauka, 1997; 78 p. Russian (Мертвецов Н. П., Стефанович Л. Е. Ангиогенин и механизм ангиогенеза. Новосибирск: Наука, 1997; 78 c.).
- Kim I, Ryan AM, Rohan R, et al. Constitutive expression of VEGF, VEGFR-1, and VEGFR-2 in normal eyes. Invest Ophthalmol Vis Sci 1999; 40: 2115–21.
- Ma X, Ottino P, Bazan H E, Bazan N G. Platelet-activating factor (PAF) induces corneal neovascularization and upregulates VEGF expression in endothelial cells. Invest Ophthalmol Vis Sci 2004; 45: 2915–21. DOI: 10.1167 / iovs. 04–0128.
- Usui T, Sugisaki K, Iriyama A, et al. Inhibition of corneal neovascularization by blocking the angiotensin II type 1 receptor. Invest Ophthalmol Vis Sci 2008; 49 (10): 4370–76. DOI: 10.1167 / iovs. 07–0964.
- Tammela T, Zarkada G, Nurmi H, et al. VEGFR-3 controls tip to stalk conversion at vessel fusion sites by reinforcing Notch signaling. Nat Cell Biol 2011; 13 (10): 1202–13. DOI: 10.1038 / ncb2331.
- Khubutiya MSh, Temnov AA, Vagabov VA, et al. Effect of Conditioned Medium and Bone Marrow Stem Cell Lysate on the Course of Acetaminophen-Induced Liver Failure. Bull Exp Biol Med 2015; 159 (1): 118–23. DOI: 10.1007 / s10517‑015‑2905‑x.


