Влияние ренальной денервации на диастолическую функцию левого желудочка у больных резистентной артериальной гипертензией в сочетании с сахарным диабетом 2-го типа
Автор: Манукян М.А., Фальковская А.Ю., Пекарский С.Е., Зюбанова И.В., Солонская Е.И., Рябова Т.Р., Вторушина А.А., Хунхинова С.А., Скомкина И.А., Евтух А.А., Мордовин В.Ф.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.38, 2023 года.
Бесплатный доступ
Цель: оценить изменение диастолической функции (ДФ) левого желудочка (ЛЖ) у больных резистентной артериальной гипертонией (РАГ) в сочетании с сахарным диабетом 2-го типа (СД2) через 6 мес. после ренальной денервации (РДН) по данным эхокардиографии (ЭхоКГ) во взаимосвязи с изменением гемодинамических показателей.Материал и методы. В одноцентровое проспективное интервенционное исследование с выполнением РДН были включены 30 больных РАГ в сочетании с СД2. Всем пациентам проводили измерение офисного и 24-часового артериального давления (АД-24), ЭхоКГ по стандартной методике с оценкой ДФ ЛЖ.Результаты. Через 6 мес. после РДН был отмечен выраженный антигипертензивный эффект (p
Диастолическая дисфункция левого желудочка, сердечная недостаточность с сохраненной фракцией выброса, сахарный диабет 2-го типа, резистентная артериальная гипертония, ренальная денервация
Короткий адрес: https://sciup.org/149143640
IDR: 149143640 | УДК: 616.124.2:616.12-008.331.1-089:616.379-008.64 | DOI: 10.29001/2073-8552-2023-39-3-201-208
Текст научной статьи Влияние ренальной денервации на диастолическую функцию левого желудочка у больных резистентной артериальной гипертензией в сочетании с сахарным диабетом 2-го типа
Диастолическая дисфункция (ДД) левого желудочка (ЛЖ) занимает центральное место в патофизиологии хронической сердечной недостаточности с сохраненной фракцией выброса (ХСНсФВ), которая встречается у половины госпитализированных больных по поводу ХСН и ассоциируется с высокой кардиоваскулярной смерт- ностью [1]. В современном обществе ХСНсФВ стала доминирующим фенотипом ХСН, что обусловлено старением населения, увеличением распространенности артериальной гипертензии (АГ), сахарного диабета 2-го типа (СД2) и ожирения. Высокая полиморбидность служит отличительной чертой ХСНсФВ [2], и распространенность АГ и СД2 при ХСНсФВ составляет до 90 и 40% соответственно [2]. Наличие резистентных форм АГ ассоциируется с трехкратным увеличением риска ХСН [3], а сочетание резистентной АГ (РАГ) с СД2 еще более ускоряет развитие ХСНсФВ, что обусловлено не только комбинацией негативного влияния на сердечную мышцу гемодинамической нагрузки и метаболических нарушений [4, 5], но и существенным возрастанием симпатической активности [6].
Понимание значимости повышения симпатического тонуса в патогенезе ДД ЛЖ и ХСНсФВ [7] послужило концептуальной основой использования нейромодулирующих стратегий лечения. Поскольку фармакологические методы симпатической супрессии не позволили добиться значительного улучшения прогноза при ХСНсФВ [7], исследовательский интерес сместился в сторону инвазивных методик, наиболее изученной из которых является ренальная денервация (РДН) [8]. В основе этой процедуры лежит разрушение эфферентных и афферентных симпатических нервных окончаний в адвентиции почечных артерий, что не только уменьшает гемодинамическую нагрузку на миокард в результате усиления диуреза и натрийуреза, но и снижает глобальный симпатический тонус [9]. Эти эффекты РДН могут быть наиболее привлекательны для больных с сочетанием РАГ и СД. Вместе с тем особенности влияния РДН на состояние диастолической функции (ДФ) ЛЖ у данной категории больных изучены недостаточно, а вопросы, касающиеся возможных механизмов улучшения ДФ, остаются открытыми.
Цель исследования: оценить изменение ДФ ЛЖ у больных РАГ в сочетании с СД2 через 6 мес. после РДН по данным ЭхоКГ во взаимосвязи с изменением гемодинамических показателей.
Материал и методы
Оценка ДФ ЛЖ через 6 мес. после РДН была выполнена у 30 больных РАГ в сочетании с СД2, госпитализированных в НИИ кардиологии Томского НИМЦ в период с 2013 по 2021 гг. Критерием включения было наличие истинной РАГ в сочетании с СД2 у лиц обоего пола в возрасте от 40 до 80 лет, подписавших информированное согласие. Критериями РАГ cчитали отсутствие контроля артериального давления (АД), несмотря на прием трех и более антигипертензивных препаратов, включая диуретик, в максимальных или максимально переносимых дозах.
Критерии невключения: псевдорезистентность, вторичные формы АГ, уровень гликированного гемоглобина (HbA1c) > 10 %, СД 1-го типа, расчетная скорость клубочковой фильтрации (СКФ) < 30 мл/мин/1,73 м2, беременность, фибрилляция предсердий, стенозы митрального и аортального клапанов, фракция выброса (ФВ) ЛЖ < 50%, анафилактические реакции на рентгеноконтрастные препараты, значимый стеноз почечной артерии, неудовлетворительная визуализация при эхокардиографии (ЭхоКГ) и любые другие клинически значимые заболевания, препятствующие участию в исследовании (по оценке исследователя). Информация о медикаментозной терапии была получена по данным опроса.
Исходная клинико-демографическая характеристика исследуемых пациентов представлена в таблице 1.
Количество и спектр антигипертензивной и сопутствующей терапии отражены в таблице 2.
Таблица 1. Клиническая характеристика пациентов ( M ± SD ), n (%)
Table 1 . Clinical characteristic ( M ± SD ), n (%))
|
Показатели Parameters |
РАГ+СД RHTN +T2DM n = 30 |
|
Возраст, лет Age, years |
61,5 ± 6,6 |
|
Пол, женщины Sex, female |
21 (70,0) |
|
Продолжительность АГ, лет Hypertension duration, years |
25,4 ± 10,6 |
|
Продолжительность СД2, лет T2DM duration, years |
10,5 ± 6,8 |
|
Ишемическая болезнь сердца Coronary artery disease |
19 (63,3) |
|
Инфаркт миокарда в анамнезе History of myocardial infarction |
5 (16,7) |
|
Инсульт в анамнезе History of stroke |
8 (26,7) |
|
Периферический атеросклероз Peripheral atherosclerosis |
30 (100) |
|
Дислипидемия Dyslipidemia |
30 (100) |
|
Ожирение Obesity |
25 (83,3) |
|
ГЛЖ LVH |
26 (86,7) |
|
Офисное CАД/ДАД, мм рт. ст. Office SBP/DBP, mm Hg |
169,0 ± 19,9/ 85,9 ± 17,3 |
|
Офисное ЧСС, уд/мин Оffice Heart rate, beat/min |
68,9 ± 10,0 |
|
САД/ДАД-24, мм рт. ст. 24h mean SBP/DBP, mm Hg |
158,3 ± 15,6/ 79,0 ± 12,7 |
|
ЧСС-24, уд/мин Heart rate-24, beat/min |
67,0 ± 10,4 |
|
ПАД-24, мм рт. ст. 24h mean PBP, mm Hg |
79,3 ± 12,1 |
|
Базальная гликемия, ммоль/л Basal glycemia, mmol/L |
8,6 ± 2,5 |
|
HbA1c, % |
7,6 ± 1,3 |
|
рСКФ (CKD-EPI), мл/мин/1,73м2 eGFR (CKD-EPI), ml/min/1,73m2 |
66,1 ± 22,2 |
|
ФВ ЛЖ (В-режим), % LV EF (B-mode), % |
68,2 ± 5,6 % |
Примечание: АГ – артериальная гипертензия, ГЛЖ – гипертрофия левого желудочка, РАГ – резистентная АГ, рСКФ – расчетная скорость клубочковой фильтрации, САД/ДАД – систолическое/диасто-лическое АД, ПАД – пульсовое АД; СД2 – сахарный диабет 2-го типа, уд/мин – ударов в минуту, ФВ ЛЖ – фракция выброса левого желудочка, ЧСС – частота сердечных сокращений, HbA1c – гликированный гемоглобин, 24 – среднесуточные показатели.
Note: eGFR – estimated glomerular filtration rate, HTN – hypertension, HbA1c – glycated hemoglobin, LV EF – left ventricular ejection fraction, LVH – left ventricular hypertrophy, RHTN – resistant hypertension, SBP/ DBP/ – systolic/diastolic/ blood pressure, PBP – pulse blood pressure, T2DM – type 2 diabetes mellitus, 24 – average daily levels.
Таблица 2. Характеристика антигипертензивной и сахароснижающей терапии ( M ± SD), n (%)
Table 2 . Characteristics of antihypertensive and antidiabetic therapy ( M ± SD ), n (%))
|
Число антигипертензивных препаратов Number of antihypertensive drugs |
4,5 ± 1,0 |
|
Бета-адреноблокаторы Beta-blockers |
25 (83,3) |
|
Блокаторы РААС RAAS inhibitors |
30 (100) |
|
Диуретики Diuretics |
30 (100) |
Окончание табл. 2
End of table 2
|
Антагонисты кальция Calcium channel blockers |
23 (76,7) |
|
Спиронолактон Spironolactone |
16 (53,3) |
|
Агонисты имидазолиновых рецепторов I1-imidazoline receptor agonists |
4 (13,3) |
|
Альфа-адреноблокаторы Alpha-blockers |
5 (16,7) |
|
Сахароснижающая терапия Glucose-lowering treatment |
|
|
Диета Dietotherapy |
1 (2,6) |
|
Монотерапия ПССТ Oral monotherapy |
9 (30,0) |
|
Комбинированная ПССТ Combined oral therapy |
9 (30,0) |
|
Инсулин Insulin |
12 (40,0) |
|
Статины Statins |
30 (100) |
Примечание: РААС – ренин-ангиотензин-альдостероновая система, ПССТ – пероральная сахароснижающая терапия.
Note: RAAS – renin-angiotensin-aldosterone system.
Исходно и через 6 мес. после вмешательства у всех пациентов проводили клинико-инструментальное обследование.
ЭхоКГ ЛЖ с оценкой ДФ ЛЖ выполняли на аппарате ультразвуковой системы экспертного класса Philips ie33 (Нидерланды) согласно стандартному протоколу и рекомендациям по количественному определению камер сердца с помощью ЭхоКГ у взрослых [10]. Данные по скорости трикуспидальной регургитации были доступны для 23 (76,7%) больных, из них повышение этого показателя отмечалось лишь у 5 (16,7%) пациентов. Критерием улучшения ДФ ЛЖ считали снижение отношения E/e` более чем на 1 усл. ед., учитывая неблагоприятную прогностическую значимость повышения этого показателя [11].
Всем пациентам проводили рутинные лабораторные тесты согласно стандартам обследования больных с АГ и СД2, измерение офисного и среднесуточного АД с использованием системы автоматического измерения АД АВРМ-04 (Meditech, Венгрия), BPLab (ООО «Петр Телегин», Россия). По результатам суточного мониторирования АД (СМАД) рассчитывали суточный индекс (СИ) АД согласно формуле:
СИ = 100% × ((АДд - АДн)÷АДд).
Для повышения точности определения времени ночного отдыха, наряду со стандартным методом, использовали математический алгоритм определения периода ночного сна по результатам мониторирования частоты сердечных сокращений (ЧСС). Суть метода заключается в трансформации последовательности реальных измеренных показателей ЧСС в накопительную сумму этих значений после вычитания среднего. Полученная последовательность имеет экстремумы, соответствующие точкам начала и конца низких значений ЧСС в период ночного отдыха. Данная последовательность нарастает в течение периода бодрcтвования пациента, затем снижается в периоде ночного отдыха.
Ренальную денервацию выполняли с использованием катетеров Symplicity Fleх ( n = 10) и Symplicity Spyral ( n = 20) в соответствии с инструкцией производителя за исключением того, что аппликации наносились как в основных, так и в дистальных ветвях почечных артерий, а в случаях невозможности выполнить аблации в ветвях, в дистальном отделе общего ствола почечной артерии дополнительно выполняли не менее двух воздействий.
Исследование было выполнено на базе отделения артериальных гипертоний (НИИ кардиологии Томского НИМЦ) в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом. До включения в исследование у всех участников было получено письменное информированное согласие на обработку персональных данных. Пациенты были инструктированы не менять режим антигипертензивной и сопутствующей терапии.
Статистический анализ полученных данных проводили в пакетах STATISTICA 10.0 и SPSS 26 for Windows. Согласие с нормальным законом распределения количественных показателей проверяли с помощью критерия Шапиро – Уилка. Нормально распределенные количественные показатели представляли средним значением и стандартным отклонением, M ± SD . Категориальные показатели описывали абсолютными и относительными частотами – n (%). При сравнении категориальных показателей на двух этапах наблюдения применяли критерий Мак-Немара. Оценку корреляций количественных показателей осуществляли с использованием параметрического коэффициента корреляции Пирсона. Произведен расчет размеров эффекта РДН и их доверительных интервалов для 5 исследуемых количественных показателей, связанных с АД, а также для гликированного гемоглобина и базальной глюкозы. Построена модель парной логистической регрессии с выявленным значимым предиктором развития АГ, проведен ее ROC-анализ, найдена диагностическая точка разделения групп риска. Критическим уровнем значимости p для всех используемых процедур статистического анализа считали 0,05.
Результаты
Исходный клинико-демографический профиль обследованных больных соответствовал типичному фенотипу пациента с СД2 в сочетании с РАГ, характеризующемуся средним возрастом более 60 лет, продолжительным течением АГ, большой частотой гипертрофии ЛЖ, ожирения, периферического атеросклероза, дислипидемии и высоким уровнем пульсового АД (ПАД). Большинство больных были лицами женского пола. Исходно показатели среднего Е/е` соответствовали 13,7 ± 4,45 и были напрямую взаимосвязаны с уровнем ПАД-24 ( r = 0,51; p = 0,001) в отсутствии значимых связей с другими параметрами СМАД.
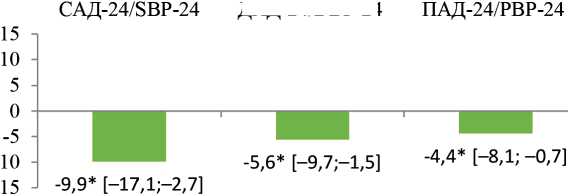
Через 6 мес. после РДН был отмечен выраженный антигипертензивный ответ (рис. 1). Целевой уровень САД < 140 мм рт. ст. достигли 16 человек (53%) в отсутствии изменения среднего количества антигипертензивных препаратов ( р = 0,746).
Дополнительно было отмечено увеличение СИ САД, измеренного с учетом фактического времени бодрствования и ночного отдыха. Значимого изменения СИ САД, измеренного стандартным способом, мы не обнаружили (см. рис. 1) и в дальнейшем анализе его не использовали.
ДАД-24/ПВР-24
СИ САД (оптимиз.)/ СИ САД ( nocturnal SBP fall стандарт.)/ nocturnal (optim.) SBP fall (stand.)
3,7*[0,3;7,l] r---■■---,-----------,
-0,1* [-2,3;2,3]
Рис. 1. Изменение показателей СМАД через 6 мес. после РДН, M [95 % ДИ], * – p < 0.05.
Примечание: САД/ДАД/ПАД – систолическое/диастолическое/ пульсовое артериальное давление; СИ САД – суточный индекс систолического артериального давления; оптимиз. – оптимизированный метод; стандарт. – стандартный метод
Fig. 1. Changes in 24-hour blood pressure monitoring at 6 months after renal denervation, M [95% CI], * – p < 0.05.
Note: SBP/DBP/PBP – systolic/diastolic/pulse blood pressure, optim. – optimized method; stand. – standard method.
Через 6 мес. улучшение ДФ ЛЖ в виде снижения Е/е` на 1 усл. ед. было отмечено у 50% (15) больных. Динамика показателей ДФ ЛЖ отражена в таблице 3, демонстрирующей значимое снижение Еmitr усредненного отношения E/e`.
Документированное снижение усредненного E/e` напрямую зависело от уменьшения гемодинамической на- грузки и нормализации СИ САД, измеренного с учетом фактического времени ночного отдыха (рис. 2). По данным регрессионного анализа, снижение среднесуточного САД на 3 мм рт. ст. и увеличение степени ночного снижения САД на 1,6% сопровождались уменьшением усредненного E/e` на 1 единицу.
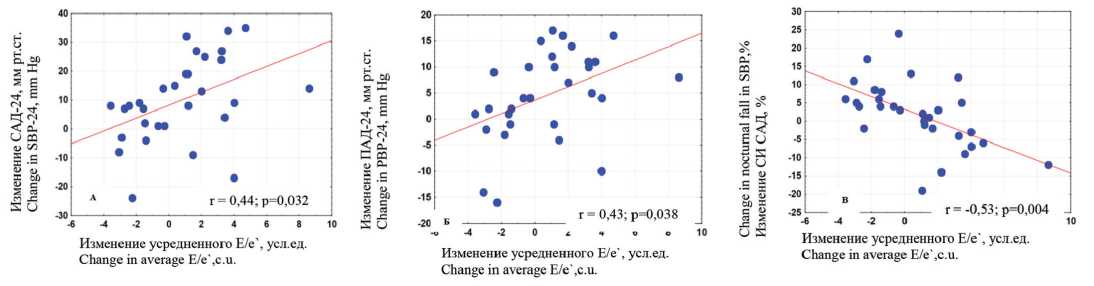
Рис. 2. Корреляционные взаимосвязи изменений E/e` и показателей суточного мониторирования артериального давления через 6 мес. после ренальной денервации: А) – с динамикой CАД-24 (систолического артериального давления), Б) – с динамикой ПАД-24 (пульсового артериального давления), В) – с динамикой суточного индекса САД
Fig. 2. Correlations between changes in E/e` and indicators of daily monitoring of blood pressure after 6 months after renal denervation: A) – with the dynamics of SBP-24 (systolic blood pressure), B) – with the dynamics of PBP-24 (pulse blood pressure), C) – with the dynamics of the daily SBP index (systolic blood pressure)
Таблица 3. Изменение показателей диастолической функции левого желудочка через 6 мес. после ренальной денервации ( M ± SD) , n (%))
Table 3. Changes in parameters of left ventricular diastolic dysfunction at 6 months after renal denervation (M ± SD), n (%))
|
Показатели Parameters |
Исходно Baseline |
Через 6 мес. 6 months after |
р |
|
ИОЛП, мл/м2 LAVI, ml/m2 |
42,6 ± 8,6 |
42,6 ± 10,2 |
0,940 |
|
ИММ ЛЖ, г/м2 LVMI, g/m2 |
129,7 ± 25,2 |
131,6 ± 26,7 |
0, 306 |
|
Еmitr, см/с Emitr, cm/s |
73,4 ± 20,8 |
67 ± 19,9 |
0,018 |
|
Amitr, см/с A , cm/s mitr , |
79,5 ± 17,3 |
79,7 ± 17,3 |
0,956 |
|
Отношение Е /А mitr mitr Е mitr /А mitr ratio |
1 ± 0,4 |
0,9 ± 0,3 |
0,190 |
|
DT, мс DT, mc |
237,7 ± 41 |
232,8 ± 40,1 |
0,611 |
|
ВИР, мс IVRT, mc |
100,7 ± 20,1 |
103,4 ± 19,7 |
0,371 |
|
Септальный e`, см/с Septal e`, cm/s |
5,2 ± 1,5 |
5,1 ± 1,4 |
0,723 |
|
Латеральный e`, см/с Lateral e`, cm/s |
6,3 ± 1,7 |
6,6 ± 2,1 |
0,369 |
Окончание табл. 3
End of table 3
|
Показатели Parameters |
Исходно Baseline |
Через 6 мес. 6 months after |
р |
|
Септальный E/e`, усл. ед. Septal E/e` |
14,9 ± 5,1 |
13,9 ± 5,0 |
0,164 |
|
Латеральный E/e` Lateral E/e` |
12,3 ± 4,2 |
10,8 ± 3,7 |
0,024 |
|
Усредненный E/e` Average E/e` ratio |
13,6 ± 4,5 |
12,3 ± 4,1 |
0,038 |
|
ДД ЛЖ LVDD |
30(100%) |
30 (100%) |
0,248 |
|
ДД ЛЖ 1-й степени LVDD grade 1 |
13 (43,3%) |
16 (53,3%) |
|
|
ДД ЛЖ 2-й степени LVDD grade 2 |
17 (56,6%) |
14 (46,6%) |
Примечание: ИОЛП – индексированный объем левого предсердия, ИММ ЛЖ – индекс массы миокарда левого желудочка, DT – ВИР – время изоволюмического расслабления, ДД ЛЖ – диастолическая дисфункция левого желудочка.
Note: LAVI – left atrial volume index, LVMI – left ventricular mass index, DT – deceleration time, IVRT – isovolumic relaxation time, LVDD – left ventricular diastolic dysfunction.
Построена модель логистической регрессии с бинарным зависимым показателем «снижение отношения E/e более чем на 1 усл. ед./ не менее чем на 1 усл. ед.» и единственным значимым предиктором уменьшения усредненного Е/е – СИ САД. Согласно результатам ROC-анализа, пороговое значение исходного СИ САД, ассоциирующегося со снижением отношения E/e` более чем на 1 усл. ед., составило 5,5% и менее (чувствительность – 73,0%, специфичность – 67,7%, AUC – 0,802; p < 0,001) (рис. 3).
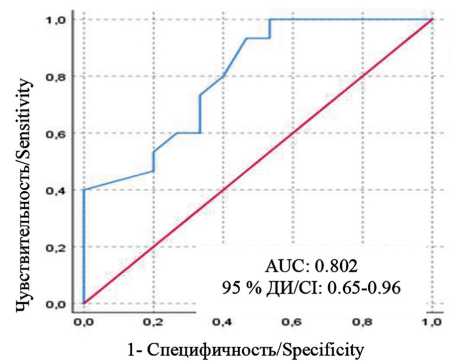
Рис. 3. ROC-кривая, характеризующая зависимость снижения отношения E/e` более чем на 1 усл. ед. через 6 мес. после ренальной денервации от исходного уровня суточного индекса систолического артериального давления
Fig. 3. ROC-curve characterizing the dependence of the decrease in the ratio E/e` by more than 1 units 6 months after renal denervation from the baseline level of SBP nocturnal fall
Существенного изменения уровня гликированного гемоглобина (–0,19 [95 ДИ: –0,94; 0,55], р = 0,609), а также базальной гликемии (0,8 [95 ДИ: –0,94; 0,55], р = 0,295) отмечено не было.
Обсуждение
Особенностью представленного исследования стал анализ влияния РДН на ДФ ЛЖ в селективной группе больных РАГ в сочетании с СД2. Следует отметить, что сведения по этому вопросу ранее отсутствовали. Нами было установлено, что РДН сопровождается не только выраженным антигипертензивным эффектом, но и улучшением ДФ ЛЖ в виде значимого снижения отношения Е/е через 6 мес. Уменьшения объемов левого предсердия мы не обнаружили, что может быть обусловлено относительно небольшим сроком наблюдения. Наши данные согласуются с результатами метаанализа обсервационных исследований у больных РАГ [12], а также рандомизированных исследований у больных РАГ с ХСНсФВ [13, 14], в которых принимали участие и больные СД2.
Примечательно, что по данным M.C. Brandt и со-авт. [15], улучшение ДФ ЛЖ не зависело от выраженности антигипертензивного эффекта, тогда как в работе
K.-P. Kresoja и соавт., так же как и в нашем исследовании, напротив, между этими изменениями была отмечена прямая корреляционная зависимость.
Хорошо известно, что увеличение пульсирующих компонентов АД (САД и ПАД), характерного для РАГ, является основным фактором риска развития сердечной недостаточности в целом и ХСНсФВ в частности [5]. Документированная в настоящем исследовании прямая взаимосвязь исходных значений Е/е` и ПАД, а также снижения этих показателей после РДН подтверждает значимую роль сосудистой жесткости и пульсатильной нагрузки на ЛЖ в патофизиологии диастолической дисфункции. К настоящему времени подавление процессов коллагенообразования и сосудистой жесткости относится к одним из установленных плейотропных эффектов РДН, в том числе обусловленных уменьшением активности иммунного воспаления и оксидативного стресса [16]. Ранее взаимосвязь увеличения растяжимости стенки аорты с улучшением ДФ у больных РАГ с ХСНсФВ была отмечена K.P. Kresoja с соавт. [14].
Согласно современным представлениям, существенное значение в развитии сердечно-сосудистых осложнений, в том числе и ХСН, придается нарушению циркадного ритма АД, которое ассоциируется с ухудшением механических свойств миокарда [17] и во многом обусловлено повышением сосудистой жесткости, а также увеличением тонуса симпатической нервной системы [18]. В связи с этим недостаточная степень ночного снижения АД может быть маркером симпатической гиперактивации. В данном контексте обнаруженное нами улучшение суточного профиля САД после РДН, тесно связанное с уменьшением значений Е/е, представляется вполне закономерным. При этом предикторная роль исходного нарушения суточного ритма АД как возможного маркера симпатической активности в отношении снижения Е/еˊ после РДН подтверждает вовлеченность симпатической нервной системы в развитие ДД ЛЖ. К механизмам положительного влияния РДН на суточный профиль АД относят прежде всего улучшение почечного кровотока с восстановлением циркадности выделения натрия и снижение объема циркулирующей крови, обусловленных уменьшением симпатической активности почек и ограничением пульсатиль-ной нагрузки на сосудистое русло [19].
Таким образом, РДН у больных РАГ в сочетании с СД2 через 6 мес. после вмешательства сопровождается благоприятным влиянием на ДД ЛЖ, тесно связанным с гемодинамическими эффектами процедуры в виде снижения САД, уменьшения пульсатильной нагрузки на ЛЖ, а также улучшения суточного ритма АД.
Наше исследование было ограничено небольшим количеством больных, относительно коротким сроком наблюдения, оценкой приверженности к лечению по данным опроса, а также невозможностью оценки снижения симпатической активности.
Предметом будущих исследований может стать изучение отдаленных эффектов РДН в отношении диастолический функции и ХСНсФВ, в том числе с учетом показателей продольной деформации левых камер сердца, принимая во внимание позитивные результаты опубликованного нами ранее пилотного исследования [20].
Список литературы Влияние ренальной денервации на диастолическую функцию левого желудочка у больных резистентной артериальной гипертензией в сочетании с сахарным диабетом 2-го типа
- Shah K.S., Xu H., Matsouaka R.A., Bhatt D.L., Heidenreich P.A., Hernandez A.F. et al. Heart failure with preserved, borderline, and reduced ejection fraction: 5-year outcomes. J. Am. Coll. Cardiol. 2017;70(20):2476–2486. DOI: 10.1016/j.jacc.2017.08.074.
- Dunlay S.M., Roger V.L., Redfield M.M. Epidemiology of heart failure with preserved ejection fraction. Nat. Rev. Cardiol. 2017;14(10):591–602. DOI: 10.1038/nrcardio.2017.65.
- Brant L.C.C, Passaglia L.G., Pinto-Filho M.M., de Castilho F.M., Ribeiro A.L.P., Nascimento B.R. The burden of resistant hypertension across the world. Curr. Hypertens. Rep. 2022;24(3):55–66. DOI: 10.1007/s11906-022-01173-w.
- Сваровская А.В., Гарганеева А.А. Сахарный диабет 2 типа и сердечная недостаточность – современный взгляд на механизмы развития. Сахарный Диабет. 2022;25(3):267–274. [Svarovskaya A.V., Garganeeva A.A. Diabetes mellitus and heart failure – a modern look at the mechanisms of development. Diabetes mellitus. 2022;25(3):267–274. (In Russ.)]. DOI: 10.14341/DM12648.
- Chirinos J.A., Segers P., Hughes T., Townsend R. Large artery stiffness in health and disease: JACC state-of-the-art review. J. Am. Coll. Cardiol. 2019;74(9):1237–1263. DOI: 10.1016/j.jacc.2019.07.012.
- Huggett R.J., Scott E.M., Gilbey S.G., Stoker J.B., Mackintosh A.F., Mary D.A. Impact of type 2 diabetes mellitus on sympathetic neural mechanisms in hypertension. Circulation. 2003;108(25):3097–3101. DOI: 10.1161/01.CIR.0000103123.66264.FE.
- Seravalle G., Quarti-Trevano F., Dell’Oro R., Gronda E., Spaziani D., Facchetti R. et al. Sympathetic and baroreflex alterations in congestive heart failure with preserved, midrange and reduced ejection fraction. J. Hypertens. 2019;37(2):443–448. DOI: 10.1097/HJH.0000000000001856.
- Bergland O.U., Larstorp A.C.K., Søraas C.L., Høieggen A., Rostrup M., Kjaer V.N. et al. Changes in sympathetic nervous system activity after renal denervation: results from the randomised Oslo RDN study. Blood Press. 2021;30(3):154–164. DOI: 10.1080/08037051.2020.1868286.
- Böhm M., Ewen S., Kindermann I., Linz D., Ukena C., Mahfoud F. Renal denervation and heart failure. Eur. J. Heart Fail. 2014;16(6):608–613. DOI: 10.1002/ejhf.83.
- Lang R.M., Badano L.P., Mor-Avi V., Afilalo J., Armstrong A., Ernande L. et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 2015;28(1):1–39.e14. DOI: 10.1016/j.echo.2014.10.003.
- Zhou D., Huang Y., Fu M., Cai A., Tang S., Feng Y. Prognostic value of tissue Doppler E/e’ ratio in hypertension patients with preserved left ventricular ejection fraction. Clin. Exp. Hypertens. 2018;40(6):554–559. DOI: 10.1080/10641963.2017.1407332.
- Kordalis A., Tsiachris D., Pietri P., Tsioufis C., Stefanadis C. Regression of organ damage following renal denervation in resistant hypertension: a meta-analysis. J. Hypertens. 2018;36(8):1614–1621. DOI: 10.1097/HJH.0000000000001798.
- Patel H.C., Rosen S.D., Hayward C., Vassiliou V., Smith G.C., Wage R.R. et al. Renal denervation in heart failure with preserved ejection fraction (RDT-PEF): a randomized controlled trial. Eur. J. Heart Fail. 2016;18(6):703–712. DOI: 10.1002/ejhf.502.
- Kresoja K.P., Rommel K.P., Fengler K., von Roeder M., Besler C., Lücke C. et al. Renal Sympathetic denervation in patients with heart failure with preserved ejection fraction. Circ. Heart Fail. 2021;14(3):e007421. DOI: 10.1161/CIRCHEARTFAILURE.120.007421.
- Brandt M.C., Mahfoud F., Reda S., Schirmer S.H., Erdmann E., Böhm M. et al. Renal sympathetic denervation reduces left ventricular hypertrophy and improves cardiac function in patients with resistant hypertension. J. Am. Coll. Cardiol. 2012;59(10):901–909. DOI: 10.1016/j.jacc.2011.11.034.
- Фальковская А.Ю., Мордовин В.Ф., Рюмшина Н.И., Пекарский С.Е., Рипп Т.М., Манукян М.А. и др. Влияние ренальной денервации на МРТ-признаки повреждения сосудистой стенки у больных резистентной артериальной гипертензией в сочетании с сахарным диабетом 2-го типа. Артериальная гипертензия. 2020;26(5):552–563. [Falkovskaya A.Yu., Mordovin V.F., Rumshina N.I., Pekarskiy S.E., Ripp T.M., Manukyan M.A. et al. Renal denervation may attenuate the severity of MRI-signs of vascular wall damage in diabetic patients with resistant hypertension due to the anti-inflammatory effect. Arterial Hypertension. 2020;26(5):552–563. (In Russ.)]. DOI: 10.18705/1607-419X-2020-26-5-552-563.
- Tadic M., Cuspidi C., Pencic B., Grassi G., Celic V. Myocardial work in hypertensive patients with and without diabetes: An echocardiographic study. J. Clin. Hypertens. 2020;22(11):2121–2127. DOI: 10.1111/jch.14053.
- Kario K., Hoshide S., Mizuno H., Kabutoya T., Nishizawa M., Yoshida T. et al. Nighttime blood pressure phenotype and cardiovascular prognosis: Practitioner-based nationwide JAMP study. Circulation. 2020;142(19):1810–1820. DOI: 10.1161/CIRCULATIONAHA.120.049730.
- Kario K. Proposal of a new strategy for ambulatory blood pressure profile-based management of resistant hypertension in the era of renal denervation. Hypertens. Res. Off. J. Jpn. Soc. Hypertens. 2013;36(6):478–484. DOI: 10.1038/hr.2013.19.
- Рипп Т.М., Пекарский С.Е., Баев А.Е., Рябова Т.Р., Ярославская Е.И., Фальковская А.Ю. и др. Сравнительное исследование кардиопротективных эффектов двух способов ренальной денервации. Российский кардиологический журнал. 2020;25(12):3994. [Ripp T.M., Pekarskiy S.E., Baev A.E., Ryabova T.R., Yaroslavskay E.I., Falkovskaya A.Yu. et al. Comparative analysis of cardioprotective effects of two renal denervation techniques. Russian Journal of Cardiology. 2020;25(12):3994. (In Russ.)]. DOI: 10.15829/1560-4071-2020-3994.


