Влияние сапропелевых нитрагинов на проростки сортов фасоли омской селекции при выращивании в условиях гидросветокультуры
Автор: Пухальский Я.В., Казыдуб Н.Г., Лоскутов С.И., Митюков А.С., Лактионов Ю.В., Воробьев Н.И., Кожемяков А.П.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Агрономия
Статья в выпуске: 4 (44), 2021 года.
Бесплатный доступ
Показан эффект от применения органо-бактериальной композиции, обладающий стимулирующим и адаптогенным действием на развитие проростков фасоли, культивируемой в условиях закрытой гидросветокультуры. Лабораторные опыты проведены на сортах Омского ГАУ, различающихся по соотношению урожайности семян к массе их клубеньков - сорт Маруся, овощного использования, и сорт Лукерья, зернового назначения. Повторность в опыте 3-кратная. На каждый вариант приходилось по 18 семян. В работе использованы методы визуального анализа: наблюдение, подсчет и измерение над- и подземных органов растений. Полученные результаты свидетельствуют о том, что данная биокомпозиция оказала выраженное стимулирующее воздействие на развитие биомассы проростков фасоли на начальном этапе онтогенеза. Наблюдались различия по показателям длины. Так, у сорта Лукерья инокуляция сделала растения более низкорослыми. У сорта Маруся подобного эффекта не наблюдалось.
Фасоль, сорт, нитрагины, удгсс, гидропоника, светокультура
Короткий адрес: https://sciup.org/142231241
IDR: 142231241 | УДК: [635.652, | DOI: 10.48136/2222-0364_2021_4_53
Текст научной статьи Влияние сапропелевых нитрагинов на проростки сортов фасоли омской селекции при выращивании в условиях гидросветокультуры
Среди зернобобовых культур фасоль ( Phaseolus vulgaris L.) занимает особое место благодаря ее важной роли в обеспечении продовольственной безопасности РФ. В уникальном биохимическом составе содержится до 3% липидов, 46% углеводов и 34% белков, близких по консистенции к полноценным пищевым волокнам животного происхождения. Значение последнего показателя делает культуру равной чечевице ( Lens culinaris ). Также фасоль богата витаминами, важными биофильными элементами (особенно калием, магнием и железом), органическими и аминокислотами. Кроме того, в отличие, например, от сои ( Glycine max ), она не обладает аллергенными свойствами [1].
По данным ФАО за 2016 г., фасоль занимала наибольшие площади в мире – 29,2 млн га [2]. В России посевы достигают лишь 3,9 тыс. га, а валовый сбор зерна не превышает 6,0 тыс. т., конечно, это недостаточно для обеспечения самодостаточного и полноценного рациона питания населения страны данной культурой [3; 4].
Благодаря изменению климата, связанному с глобальным потеплением, ареал ее возможного возделывания расширился на центральную и северо-западные части Рос-
сийской Федерации. Однако сдерживающий фактор ее нормального культивирования заключается в недостатке степени освещенности данных климатических зон. С учетом зональных особенностей конкретных регионов проблему повышения урожайности в современном интенсивном сельском хозяйстве необходимо совмещать с селекционными работами, направленными на выведение новых скороспелых адаптационных сортов, а также с использованием технологий возделывания культуры с помощью инокуляции семян микробиологическими препаратами и органическими биостимуляторами. Вопрос относительно совместного применения нитрагинов, созданных на основе штаммов полезных клубеньковых бактерий, с различными микробными препаратами (на основе штаммов ассоциативных PGPB-ризобактерий и AMF-грибов арбускулярной микоризы) подробно рассматривался в диссертациях С.Н. Белобровой и М.В. Барбашова [5; 6]. Было показано, что наибольший эффект, связанный с повышением продуктивности фасоли, выращиваемой в условиях северной части Центрально-Черноземного и СевероЗападного регионов РФ, оказывало бинарное или смешанное внесение биопрепаратов. В случае же моноинокуляции только клубеньковыми бактериями различных родов надежность образования эффективного симбиоза напрямую зависела от сортовой отзывчивости макросимбионта. Появились результаты исследований, которые говорят об отсутствии нодуляции на отдельных сортах фасоли [7]. Несмотря на высокую пластичность и симбиотрофность растения к данным эндосимбионтам [8], традиционно среди них выделяют комплементарные штаммы Rhizobium [9]. Так, на примере штаммов Bra-dyrhizobium diazoefficiens и Bradyrhizobium elkanii показана их малая эффективность при одиночной колонизации меристемы корней культивара. Однако отмечено небольшое увеличение симбиотического взаимодействия при совместном внесении Rhizobium tropici [10].
Исследований, сочетающих изучение интегральных связей между агрономически полезными свойствами клубеньковых бактерий со стабилизирующими особенностями использования органических биостимулирующих соединений, еще недостаточно. Можно выделить работу по описанию методики создания стабильных форм биопрепаратов [11], где на примере клубеньковых бактерий для сои и козлятника ( Galega officinalis ) ‒ Bradyrhizobium japonicum и Rhizobium galegae показано изменение динамики их титра под влиянием дополнительного внесения в питательную среду стабилизирующих добавок в виде полигуматов на основе сапропеля.
Традиционно фасоль выращивают в условиях открытого грунта. Отмечено, что выращивание культуры через рассаду ведет к увеличению общего и раннего урожая зеленых бобов [12]. Поэтому здесь актуален способ использования вертикальных многоярусных фитоферм или закрытых гроубоксов с системой поддержания внутреннего микроклимата и возможностью культивирования растений в условиях гидропоники (рис. 1).
Подобные методы уже активно практикуют при выращивании фасоли в зимних теплицах в Польше, Турции, США, Мексике, Греции и Израиле [13–17]. В данных фитокомплексах семена рассаживают в пластиковые стаканчики (заполненные минеральной ватой или кокосовым субстратом), установленные в отверстия крышек пластиковых поддонов, наполненных питательным раствором с добавкой бактериальной суспензии. При выращивании в закрытых гроубоксах семена раскладывают на ровные плотики с отверстиями, сделанные из поливинилхлорида (ПВХ), или на сетчатые мостики из нержавеющей стали, которые затем погружают в пластиковые стаканчики, также заполненные жидким питательным раствором. Данная модель – аналог гнотобиотической системы и может быть использована для стерильных опытов. Такие способы бессуб- стратного культивирования с использованием клубеньковых бактерий – основной резерв для оптимизации условий роста, позволяют растению уже на раннем этапе онтогенеза (ювенильной фазе роста) быстрее сформировать бобово-ризобиальную симбиосисте-му. Также вследствие отсутствия адсорбирующей способности почв [18] это позволяет лучше подбирать необходимые концентрации солей минеральных удобрений и органических биостимулирующих веществ при их дополнительной интродукции в среду.

Рис. 1. Примеры фитотехсистем для выращивания фасоли методом гидросветокультуры
Поскольку фасоль – весьма свето- и теплолюбивая культура, в данных условиях можно осуществлять функции подогрева субстрата, а также подбора и оптимизации энергоспектрального состава инсоляции. Как отмечено ранее, фактор света весьма важен для данной культуры при возделывании в северных регионах, особенно в фазе цветения и при закладке генеративных органов. Таким образом, в подобных фитотехком-плексах можно проводить исследовательские работы, направленные на выведение новых сортов (например – получение гибридов) или повышение адаптационного потенциала у существующих путем акклиматизации и закаливания.
Целью данной работы являлась оценка применения защитно-стимулирующей биокомпозиции на основе совместного использования клубеньковых бактерий и поли-гуматов при выращивании семян фасоли в условиях гидропоники и интенсивной светокультуры. Задача исследования – изучение изменения морфобиометрических показателей растений фасоли (длины и веса/массы) в фазу всходов и активного роста над- и подземной биомассы в зависимости от применения органо-бактериальной композиции.
Материалы и методы
Лабораторный опыт проведен на базе научно-образовательного центра НОЦ «Зимний сад», созданного при ЛГУ им. Пушкина (СПб. – г. Пушкин). Для экспериментов выбраны два контрастных сорта фасоли омской селекции, различающихся по соотношению урожайности семян к массе их клубеньков [19] ‒ сорт овощного использования Маруся и сорт зернового назначения Лукерья. Для эксперимента отбирали хорошо выровненные и выполненные семена, без механических повреждений, не пораженные болезнями и вредителями.
Семена растений высаживали в пластиковые сосуды объемом 0,3 л, заполненные питательным раствором, приготовленным на основе дистиллированной воды, при добавлении солей до следующего композиционного состава: Ca(NO 3 ) 2 × 4H 2 O (100 µM); K 2 HPO 4 × 3H 2 O (600 µM); MgSO 4 × 7H 2 O (300 µM); CaCl 2 × 2H 2 O (100 µM); KCl (300 µM); KNO 3 (1000 µM); FeC 4 H 4 O 6 × 2.5H 2 O (10 µM); H 3 BO 3 (2 µM); MnSO 4 (4 µM); ZnSO 4 (3 µM); NaCl (6 µM); Na 2 MoO 4 (0,06 µM); CuCl 2 (0,06 µM); NiCl 2 (0,06 µM); KJ (0,06 µM); KBr (0,06 µM); pH = 5,5. Выбор питательного раствора обоснован работой с выращиванием растений гороха на гидропонике [20]. Данный вариант в опыте был контрольным.
Параллельно были заложены варианты с совместным внесением в субстрат ульт-радисперсной фракции гумато-сапропеля в концентрации 300 ppm, и/или 1,0% суспензии штаммов клубеньковых бактерий – Rhizobium phaseoli , специально отселектиро-ванных под растения фасоли. Жидкий экстракт ультрадисперсной гумато-сапропелевой суспензии (УДГСС) получен из Института озероведения (ИНОЗ РАН), филиала ФИЦ СПб. РАН. Экологически чистый сапропель доставлен из месторождения деревни Ер-молино Псковской области.
В таблице приведен качественный и количественный состав биофильных элементов и низкомолекулярных соединений полигуматов сапропеля, полученный с помощью масс-спектрометра Agilent 7500 (США) и ВЭЖХ LC 1200 (Agilent Technologes, США). Анализ проведен в лаборатории НПО ООО «БиоЭкоТех» (Санкт-Петербург).
Комплементарные штаммы ризобий предоставлены компанией «ЭКОС» (Санкт-Петербург), филиалом Института сельскохозяйственной микробиологии (ФГБНУ ВНИИСХМ).
Схема опыта представлена ниже:
-
1) Контроль (минеральные соли)
-
2) Соли + УДГСС
-
3) Соли + Rhizobium phaseoli
-
4) Соли + УДГСС + Rhizobium phaseoli
Элементный и композиционный состав низкомолекулярных фракций УДГСС
|
Сахара, мг/л |
Аминокислоты, мкг/л |
Органические кислоты, мг/л |
Ароматические кислоты, мкг/л |
||||
|
Мелибиоза |
168,30 |
Метионин |
1,20 |
Фумаровая |
0,13 |
Феруловая |
16,10 |
|
Мальтоза |
534,00 |
Валин |
22,80 |
Уксусная |
51,24 |
Паракумаровая |
13,77 |
|
Ксилоза |
87,87 |
Гистидин |
4,60 |
Щавелевая |
0,56 |
Сиреневая |
15,58 |
|
Рибоза |
223,10 |
Глицин |
1,41 |
Винная |
0,38 |
Ванилиновая |
18,10 |
|
Глюкоза |
0,61 |
Глутаминовая |
15,81 |
Янтарная |
0,24 |
Тирозин |
5,00 |
|
Галактоза |
2,48 |
Серин |
26,40 |
Галловая |
0,02 |
Фенилаланин |
0,90 |
|
Арабиноза |
23,00 |
Лейцин |
10,80 |
Яблочная |
0,05 |
||
|
Изолейцин |
7,07 |
Адипиновая |
0,08 |
||||
|
Аспарагин |
4,73 |
||||||
|
Аланин |
1,47 |
||||||
|
Триптофан |
0,18 |
||||||
|
Треонин |
7,50 |
||||||
|
Лизин |
15,00 |
||||||
|
Аргинин |
10,00 |
||||||
|
Элементный состав УДГСС, мг/г |
||||||||||||||
|
Ca |
Na |
K |
Mg |
Ba |
B |
Zn |
Fe |
Co |
Mo |
Cu |
Ni |
Al |
Cd |
Pb |
|
12,3 |
5,5 |
10,4 |
1,3 |
0,1 |
0,02 |
0,05 |
9,4 |
0,0 |
0,0 |
0,02 |
0,0 |
2,8 |
0,0 |
0,0 |
Перед посевом семена каждого сорта поверхностно стерилизовали 3%-ным пероксидом водорода в течение 5 мин. Имеются сведения, что, помимо выполнения функции поверхностной элиминации, данная молекула является вторичным мессенджером при передаче сигнальной реакции в растительных клетках и опосредованно влияет на запуск физиолого-биохимических процессов для прорастания семян [21–26]. После обработки семена были разложены в пластиковые контейнеры с сетками для проращивания в темноте при температуре 20°С (рис. 2).

Рис. 2 . Процесс стерилизации и проращивания семян для их последующей рассады в пластиковые сосуды, заполненные питательной биосуспензией
Проклюнувшиеся семена (6 шт.) раскладывали на сетки из нержавеющей стали, помещенные сверху сосудов. Эксперименты проведены в 3-кратной повторности. На каждый вариант, таким образом, приходилось по 18 растений.
Растения культивировали в климатической камере (гроубоксе) – 0,6×0,4×0,6 м производства НПО ООО «БиоЭкоТех» (t = 24–26°С, φ = 80%) в течение 10 сут (рис. 3). Рабочая площадь для прихода фотосинтетической активной радиации (ФАР) – 0,24 м2.
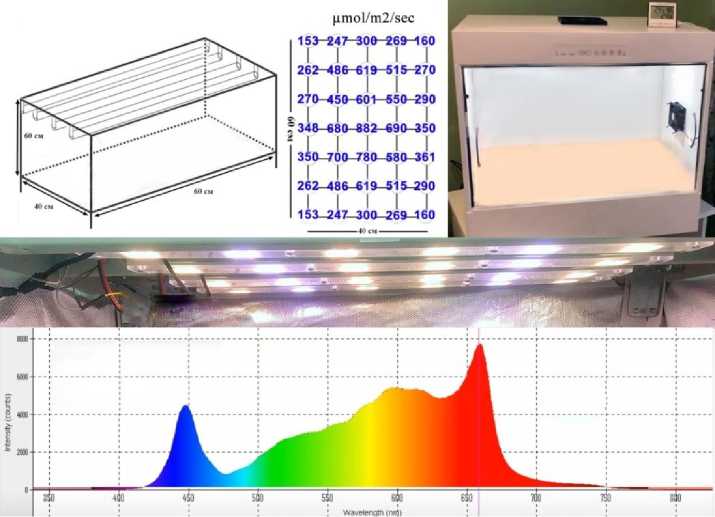
Рис. 3. Схематичное изображение внешнего вида закрытого гроубокса с фитолампами полного спектра. Приведена спектрограмма режима инсоляции
В качестве единственного источника освещения использовали пять светодиодных фитоламп полного спектра общей мощностью 90 Вт производства компании SpecLED (Ra = 88,3; PPFD (PAR) = 387,0/мкмоль·м-2 ·с-1 (25 800 Lx); Ee (ФАР) = 109,1 Ватт/м2). Пересчитывали люксы в мкмоли согласно формуле для белого света [27]. Высота подвеса LED-светильников в гроубоксе до апикальной точки роста равнялась 45 см. Срок фотопериодизма составил 16 ч день / 8 ч ночь.
Все статистические расчеты проводены с использованием программы PAST (версия 4.04).
Результаты исследований
Всхожесть сортов составила 80%. Отмечено, что во время прорастания у сорта Лукерья зернового использования процесс набухания семян при насыщении их влагой происходил более интенсивно по сравнению с сортом овощного назначения Маруся.
Изменения биометрических параметров на 10-е сут выращивания у разных сортов под воздействием различных биостимуляторов приведены на рис. 4–5.
Наибольшие статистические различия (˂0,0001) обнаружены по длине побегов у сорта фасоли Маруся между вариантами: УДГСС и Контроль; Rhizobium phaseoli и Контроль; УДГСС + Rhizobium phaseoli и Контроль. Также найдены различия (˂0,0001) по биомассе корней у сорта Лукерья между вариантами: УДГСС + Rhizobium phaseoli и Контроль; УДГСС + Rhizobium phaseoli и + УДГСС; Rhizobium phaseoli и Контроль; Rhizobium phaseoli и + УДГСС.
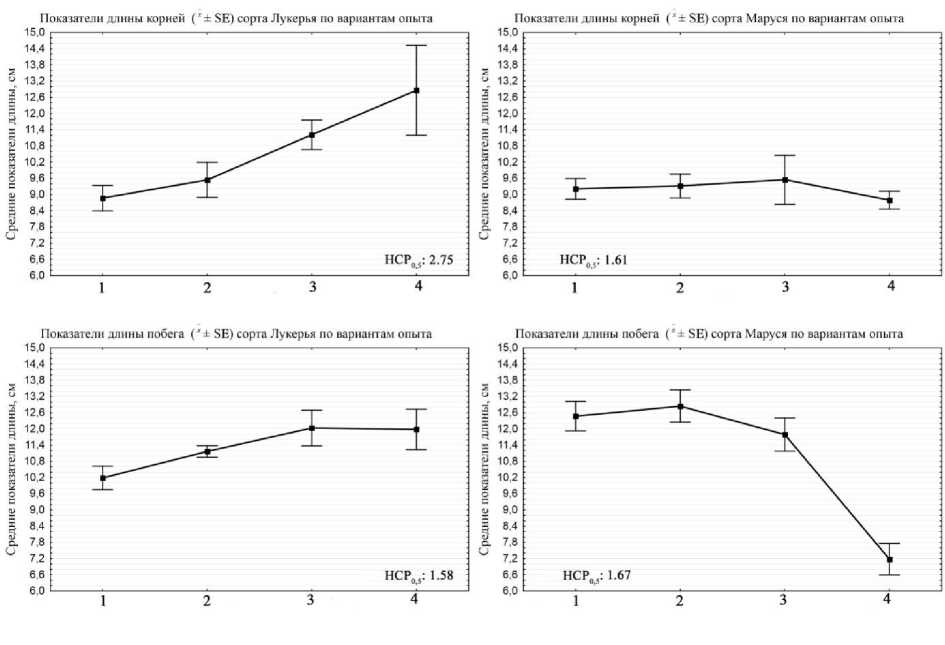
Рис. 4. Показатели изменения длины фасоли в зависимости от внесения в питательный субстрат биокомпозиционных добавок в виде УДГСС и/или суспензии клубеньковых бактерий (10-е сут проращивания): 1 – Rhizobium phaseoli ; 2 – УДГСС; 3 – УДГСС + Rhizobium phaseoli ; 4 – Контроль
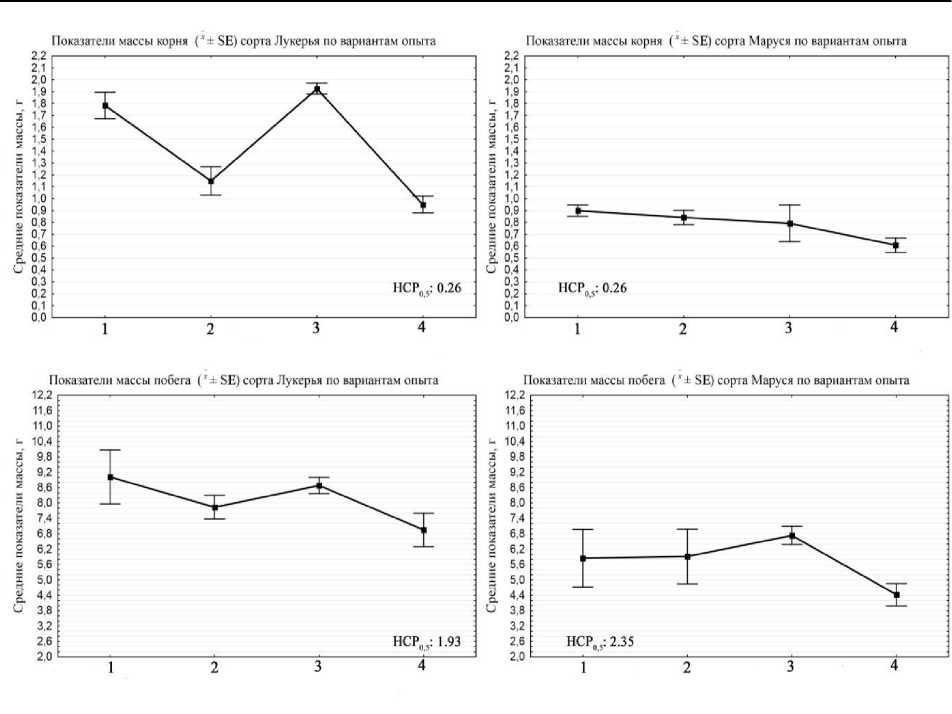
Рис. 5. Показатели изменения биомассы фасоли в зависимости от внесения в питательный субстрат биокомпозиционных добавок в виде УДГСС и/или суспензии клубеньковых бактерий (10-е сут проращивания): 1 – Rhizobium phaseoli ; 2 – УДГСС; 3 – УДГСС + Rhizobium phaseoli ; 4 – Контроль
Инокуляция обоими биостимуляторами на сорте Лукерья повысила биомассу органов, однако сделала растения более низкорослыми. Вероятно, у растений произошли активизация фотоассимиляционного аппарата и увеличение режима питания, за счет чего культура переключилась с активного роста на режим запасания мобилизационного резерва для дальнейшего развития и противодействия возможным стрессам. На сорте Маруся эффект от внесения биопрепарата и регулятора роста также проявился в увеличении над- и подземной биомассы. Кроме того, растения резко набирали в высоте побега. Увеличение длины в среднем по вариантам составило 60% от контроля. По изменению длины корней эффект был статистически не достоверен.
Синергентный эффект от совместного внесения ризобий и полигуматов сапропеля проявился в максимальном увеличении длины растения и биомассы корневой системы обоих сортов. Можно утверждать, что низкомолекулярные соединения, входящие в состав УДГСС, благодаря проявлению гормоноподобной активности стимулировали рост растений при нормализации биохимических процессов метаболизма (фотосинтез, дыхание), а также способствовали увеличению титра клубеньковых бактерий в питательной суспензии, улучшению их способности к колонизации корней. Благодаря этому последние также больше продуцировали в среду своих собственных активных веществ, стимулирующих рост корневой системы. Визуально изменения в развитии культур приведены на рис. 6.

Рис. 6. Развитие растений фасоли сорта Лукерья (А) и Маруся (Б) в зависимости от варианта обработки (на 10-й день выращивания): 1 – Контроль; 2 – УДГСС; 3 – Rhizobium phaseoli ; 4 – УДГСС + Rhizobium phaseoli. Масштаб (линия справа) – 5 см
Заключение и выводы
Таким образом, испытуемый раствор с добавками различных биостимуляторов в виде ризобий и/или полигуматов сапропеля оказал выраженное стимулирующее воздействие на развитие проростков фасоли на начальном этапе онтогенеза, что, несомненно, отразится и на всех последующих фазах роста. Как и ожидалось, максимальной эффект у обоих сортов проявился в варианте со смешанной инокуляцией. Данный вариант более предпочтителен для использования аграриями в полном цикле вегетации, поскольку отдельная интродукция УДГСС без инокуляции ризобий не позволит растению полностью раскрыть свой потенциал при образовании клубеньков на корнях, которые затем будут фиксировать молекулярный азот, особенно необходимый фасоли в последующем при образовании семян. Полигуматы, помимо снижения количества внесения минеральных солей, позволят также уменьшить использование фунгицидов, поскольку сами обладают антифунгальной активностью.
Ya.V. PUHALSKIY1, 2, N.G. KAZYDUB3, S.I. LOSKUTOV2, 4, A.S. MITYUKOV1,
Yu.V. LAKTIONOV5, N.I. VOROBYEV5, A.P. KOZHEMYAKOV5
-
1Institute of Limnology of the Russian Academy of Sciences (IL RAS), Saint-Petersburg 2Pushkin Leningrad State University, Saint-Petersburg
-
3Omsk State Agrarian University named after P.A. Stolypin, Omsk
-
4Branch of V.M. Gorbatov Federal Research Centre for Food Systems of RAS, Saint-Petersburg
-
5All-Russian Research Institute for Agricultural Microbiology, Pushkin, Saint-Petersburg
Effect of sapropel nitragines on seedlings of bean varieties of Omsk breeding when growing under the conditions of hydro-light culture
Список литературы Влияние сапропелевых нитрагинов на проростки сортов фасоли омской селекции при выращивании в условиях гидросветокультуры
- Романова Х.С. Разработка технологии фасолевого матрикса и функциональных продуктов на его основе: Специальность 05.18.15 «Технология и товароведение продуктов функционального и специализированного назначения и общественного питания» : диссертация на соискание ученой степени кандидата технических наук / Романова Христина Сергеевна. – Саратов, 2019. – 166 с. – Текст : непосредственный.
- Зернобобовые культуры в структуре функционального питания (фасоль зерновая и овощная, горох овощной, нут) / Н.Г. Казыдуб, С.П. Кузьмина, О.А. Коцюбинская [и др.]. – Текст : непосредственный // Бюллетень Государственного Никитского ботанического сада. – 2019. – № 133. – С. 157–167.
- Волобуева О.Г. Влияние биопрепаратов и регуляторов роста на эффективность бобово-ризобиального симбиоза фасоли / О.Г. Волобуева, М.П. Мирошникова, Т.С. Наумкина. – Текст : непосредственный // Зернобобовые и крупяные культуры. – 2016. – № 3(19). – С. 56–62.
- Зернобобовые культуры – важный фактор устойчивого экологически ориентированного сельского хозяйства / В.И. Зотиков, Т.С. Наумкина, Н.В. Грядунова [и др.]. – Текст : непосредственный // Зернобобовые и крупяные культуры. – 2016. – № 1(17). – С. 6–13.
- Белоброва С.Н. Продуктивность фасоли обыкновенной (Phaseolus vulgaris l.) при обработке семян микробными препаратами: Специальность 06.01.01 «Общее земледелие, растениеводство» : автореферат диссертации кандидата сельскохозяйственных наук / Белоброва Светлана Николаевна. – Санкт-Петербург, 2012. – 20 с. – Текст : непосредственный.
- Барбашов М.В. Оценка исходного материала фасоли обыкновенной (Phaseolus vulgaris L.) для создания высокоэффективных растительно-микробных систем: Специальность 06.01.05 «Селекция и семеноводство сельскохозяйственных растений» : автореферат диссертации на соискание ученой степени кандидата сельскохозяйственных наук / Барбашов Максим Вячеславович. – Орел, 2012. – 21 с. – Текст : непосредственный.
- Гурьев Г.П. Эффективность инокуляции семян фасоли препаратами клубеньковых бактерий и синтетическим регулятором роста «Мелафен» / Г.П. Гурьев, А.Г. Васильчиков. – Текст : непосредственный // Зернобобовые и крупяные культуры. – 2018. – № 4(28). – С. 33–38.
- Shamseldin A. The promiscuity of Phaseolus vulgaris L. (common bean) for nodulation with Rhizobia: a review / A. Shamseldin, E. Velázquez. – Text : direct // World Journal of Microbiology and Biotechnology. – 2020. – № 36(5). doi:10.1007/s11274-020-02839-w
- Samago T.Y. Grain yield of common bean (Phaseolus vulgaris L.) varieties is markedly increased by rhizobial inoculation and phosphorus application in Ethiopia / T.Y. Samago, E.W. Anniye, F.D. Dakora. – Text : direct // Symbiosis. – 2017. – № 75(3). – P. 245–255. doi:10.1007/s13199-017-0529-9
- Co-inoculation of Bradyrhizobium stimulates the symbiosis efficiency of Rhizobium with common bean / E.da C. Jesus, R.de A. Leite, R.da A. Bastos, O.O.da S. Aragão, A.P. Araujo. – Text : direct // Araújo. Plant and Soil. – 2018. – № 425(1-2). – P. 201–215. doi:10.1007/s11104-017-3541-1
- Создание стабильной формы ростстимулирующих микробиологических препаратов и их эффективность / Ю.В. Лактионов, Т.А. Попова, О.А. Андреев [и др.]. – Текст : непосредственный // Сельскохозяйственная биология. – 2011. – № 3. – С. 116–118.
- Зернобобовые культуры в Западной Сибири (фасоль и бобы овощные, нут): биология, генетика, селекция, использование : монография / Н.Г. Казыдуб, С.П. Кузьмина, М.А. Боровикова [и др.]. – Омск : ФГБОУ ВО Омский ГАУ, 2020. – 251 c. – ISBN 978-5-89764-879-5. – Текст : непосредственный.
- Фасоль в теплицах – беспочвенное выращивание. – URL: http://government.ru (дата обращения: 03.01.2020), https://www.podoslonami.pl/artykuly-reklamowe/fasola-tyczna-tunelach-uprawa-bezglebowa/. – Текст : электронный.
- Application and Fate of Cyromazine in a Closed-Cycle Hydroponic Cultivation of Bean (Phaseolus vulgaris L.) / G. Patakioutas, D. Savvas, C. Matakoulis, T. Sakellarides, T. Albanis. – Text : direct // Journal of Agricultural and Food Chemistry. – 2007. – № 55(24). – P. 9928–9935. doi:10.1021/jf071726i
- Bayram D. Differential Response of Bean (Phaseolus vulgaris L.) Roots and Leaves to Salinity in Soil and Hydroponic Culture / D. Bayram, B.S. Dinler, E. Tasci. – Text : direct // Notulae Botanicae Horti Agrobotanici Cluj-Napoca. – 2014. – № 42(1). – P. 219–226. doi:10.15835/nbha4219286
- Hopkinson S. Effect of pH on Hydroponically Grown Bush Beans (Phaseolus vulgaris) / S. Hopkinson, M.P. Harris. – Text : direct // International Journal of Environment Agriculture and Biotechnology. – 2019. – № 4(1). – P. 142–145.
- Yíeld and dynamics of growth in bean (Phaseolus vulgaris L.) grown in soil or in hydroponics / A. García-Esteva, J. Kohashi-Shibata, G.A. Baca Castillo, J.A.S. Escalante-Estrada. – Text : direct // 1996. – P. 225–226.
- Кисленко В.Н. Адсорбция бактерий почвой и ее эпидемиологическое значение / Н.Г. Кисленко. – Москва : ИНФРА-М, 2018. – 156 с. – Текст : непосредственный.
- Оценка клубенькообразующей способности образцов зернобобовых культур в условиях южной лесостепи Западной Сибири / Н.Г. Казыдуб, Т.В. Маракаева, Д.А. Золкин [и др.]. – Текст : непосредственный // Вестник Омского государственного аграрного университета. – 2015. – № 1(17). – С. 23–27.
- Multiple impacts of the plant growthpromoting 298 rhizobacterium Variovorax paradoxus 5C-2 on nutrient and ABA relations of Pisum sativum / F. Jiang, L. Chen, A.A. Belimov, A.I. Shaposhnikov, F. Gong, X. Meng, W. Hartung, D.W. Jeschke, W.J. Davies, I.C. Dodd. – Text : direct // Journal of experimental botany. – 2012. – V. 63(18). – P. 6421–6430.
- Гамалей И.А. Перекись водорода как сигнальная молекула / И.А. Гамалей, И.В. Клюбин. – Текст : непосредственный // Цитология. – 1996. – № 38(1). – С. 1233–1247.
- Аверьянов А.А. Активные формы кислорода и иммунитет растений / А.А. Аверьянов. – Текст : непосредственный // Успехи современной биологии. – 1991. – № 111(5). – С. 722–737.
- Niu L. Hydrogen Peroxide Signaling in Plant Development and Abiotic Responses: Crosstalk with Nitric Oxide and Calcium / L. Niu, W. Liao. – Text : direct // Front Plant Sci. – 2016. – № 7. – P. 230.
- Neill S.J. Hydrogen peroxide and nitric oxide as signalling molecules in plants / S.J. Neill, R. Desikan, A. Clarke, R.D. Hurst, J.T. Hancock. – Text : direct // J. Exp. Bot. – 2002. – № 53(372). – P. 1237–1247.
- Reth M. Hydrogen peroxide as second messenger in lymphocyte activation / M. Reth. – Text : direct // Nat. Immunol. – 2002. – № 3(12). – P. 1129–1134.
- Пероксид водорода как новый вторичный посредник / В.А. Ткачук, П.А.Тюрин-Кузьмин, В.В. Белоусов [и др.]. – Текст : непосредственный // Биологические мембраны. – 2012. – Т. 29. – № 1–2. – С. 21.
- Sharakshane A. An easy estimate of the PFDD for a plant illuminated with white LEDs:1000 lx = 15 μmol/s/m2 / A. Sharakshane. – Text : direct // BioRxiv. – 2018. DOI: 10.1101/289280


