Влияние саркопении на осложнения после эзофагэктомии с одномоментной пластикой пищевода
Автор: Ковалерова Наталья Борисовна, Ручкин Дмитрий Валерьевич, Струнин Олег Всеволодович, Оконская Диана Евгеньевна, Мазурок Алина Вадимовна
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.16, 2025 года.
Бесплатный доступ
Обоснование. Крупные метаанализы доказали негативное влияние саркопении на частоту послеоперационных осложнений и летальности, длительность послеоперационного пребывания в стационаре и 1-, 3- и 5-летнюю выживаемость пациентов. Однако если в колопроктологии и экстренной хирургии влияние саркопении на исходы не вызывает сомнения, то в хирургии пищевода результаты крайне противоречивы. Цель исследования - оценить влияние саркопении на осложнения у пациентов после эзофагэктомии с одномоментной эзофагопластикой.
Саркопения, эзофагэктомия, эзофагопластика, ускоренная реабилитация
Короткий адрес: https://sciup.org/143184133
IDR: 143184133 | DOI: 10.17816/clinpract646054
Текст научной статьи Влияние саркопении на осложнения после эзофагэктомии с одномоментной пластикой пищевода
Ковалерова Н.Б., Ручкин Д.В., Струнин О.В., Оконская Д.Е., Мазурок А.В. Влияние саркопе-нии на осложнения после эзофагэктомии с одномоментной пластикой пищевода. Клиническая прак тика. 2025;16(1):16–29. doi:
BACKGROUND: Large meta-analyses have proven the negative effects of sarcopenia on the rates of postoperative complications and mortality, on the duration of the postoperative stay at the In-Patient Department and on the 1-, 3- and 5-year survival of the patients. However, given that in coloproctology and emergency surgery, the effects of sarcopenia on the outcomes are undoubtful, in the esophageal surgery the results are extremely controversial. AIM: to evaluate the effects of sarcopenia on the complications in patients after esophagectomy with simultaneous esophageal plasty. METHODS: At the National Medical Research Center of Surgery named after A.V. Vishnevsky (NMRCS), a retrospective computed-tomographic diagnostics of sarcopenia was carried out among the patients (n=111) before undergoing esophagectomy with simultaneous esophageal plasty due to the presence of benign or malignant diseases of the esophagus. The perioperative management of all the patients was carried out within the framework of the programs of rationally accelerated perioperative rehabilitation. For the purpose of quantitative evaluation of sarcopenia, the musculoskeletal index was measured. Using the logistic regression, we have evaluated the effects of preoperational sarcopenia on the postoperative complications. RESULTS: Sarcopenia of various degree of intensity was diagnosed in 95 (85.6%) patients. The analysis of the adjusted odds ratios did not reveal any statistically significant relation between sarcopenia and postoperative complications. CONCLUSION: The experience gained at the NMRCS has shown that high-quality surgical technique together with competent perioperative management are able to alleviate the negative effects of sarcopenia on the postoperative complications.
Kovalerova NB, Ruchkin DV, Strunin OV, Okonskaya DE, Mazurok AV. The effects of sarcopenia on the complications after esophagectomy with simultaneous plasty of the esophagus. Journal of Clinical Practice. 2025;16(1):16–29. doi:
Submitted 14.01.2025 Accepted 21.03.2025 Published online 09.04.2025
развития осложнений при эзофагэктомии и их профилактика — перспективное направление научного поиска, однако если в колопроктологии [9] и экстренной хирургии [8] влияние саркопении на исходы не вызывает сомнения, то в хирургии пищевода результаты крайне противоречивы [12, 13].
Цель исследования — оценить влияние сарко-пении на осложнения у пациентов после эзофагэктомии с одномоментной эзофагопластикой.
МЕТОДЫ
Дизайн исследования
Проведено одноцентровое ретроспективное исследование 500 первичных эзофагэктомий с одномоментной пластикой пищевода. На первом этапе после оценки осложнений пациентов разделили на две группы с целью определения факторов риска развития осложнений. На втором этапе исследования те же параметры оценили у пациентов, которым измеряли скелетно-мышечный индекс и исключали саркопению. Дополнительно попытались составить предсказательную модель, косвенно оценивающую скелетно-мышечный индекс, на основании базовых антропометрических и клинико-лабораторных показателей.
Критерии соответствия
Критерии включения. Исходно в исследование включили всех пациентов, которым выполнили первичную эзофагэктомию с одномоментной плас-


тикой пищевода в рамках программы рационально ускоренной периоперационной реабилитации (РУПОР). Критерием включения в исследование саркопении было наличие в базе центра предоперационных КТ-изображений, выполненных как минимум за 3 месяца до вмешательства, без артефактов, затрудняющих интерпретацию.
Критерии невключения : низкое качество предоперационных КТ-изображений, отсутствие КТ-архива.
Критерии исключения: экстренные хирургиче- ские вмешательства.
Условия проведения
Исследование проведено в ФГБУ «Национальный медицинский исследовательский центр хирургии имени А.В. Вишневского» Минздрава России (НМИЦХ).
Продолжительность исследования
Продолжительность ретроспекции с 2012 по 2024 год.
Описание медицинского вмешательства
Программа РУПОР включала в себя обязательный осмотр пациента междисциплинарной командой на догоспитальном этапе. Всем пациентам измеряли индекс массы тела (ИМТ), определяли индекс коморбидности Чарлсона (Charlson Comorbidity Index, CCI), степень анестезиологического риска оценивали по стандартам Американского общества анестезиологов (American Society of Anesthesiologists, ASA), риск кардиальных осложнений — по шкале Ли (Lee Criteria), риск нутритивной недостаточности — по шкале скрининговой оценки (Nutrition Risk Screening 2002, NRS-2002), а также изучали клинико-лабораторные и инструментальные данные. При необходимости пациентам проводили предоперационную подготовку. В интраоперационном периоде поддерживали нормотермию, нормоволемию, проводили протективную вентиляцию лёгких, профилактику послеоперационной тошноты и рвоты, тромбоэмболических и инфекционных осложнений.
Всем больным исследуемой группы выполнили суб-/тотальную эзофагэктомию с одномоментной эзофагопластикой. Утром первого послеоперационного дня больных переводили в профильное отделение, удаляли мочевой катетер и плевральный дренаж при условии аэростаза и поступления менее 400 мл отделяемого. Стандартно всем пациентам запрещали пероральный приём воды до пятого послеоперационного дня (дня первого рентгенологического или КТ-контроля); назначали инфузионную терапию и полное парентеральное питание. При удовлетворительном качестве шейного соустья (положительная интраоперационная оценка жизнеспособности желудочного трансплантата и культи пищевода), отсутствии аспирации и несостоятельности анастомоза при рентгенологическом контроле пациентам разрешали пить воду с первого и сиппинг со второго послеоперационного дня. Приём протёртой пищи был возможен с третьего послеоперационного дня после удовлетворительного второго рентген-конт-роля. Послеоперационные осложнения оценивали согласно унифицированному регистру Консенсусной группы по осложнениям при эзофагэктомии (Esophagectomy Complications Consensus Group, ECCG) [14]. Изолированный гидроторакс, связанный с ранним удалением плеврального дренажа (в первый послеоперационный день), мы не считали за осложнение.
Исходы исследования
Основной исход исследования. Оценка послеоперационных осложнений после эзофагэктомии с эзофагопластикой; оценка влияния саркопении на послеоперационные осложнения.
Дополнительные исходы исследования. Создание предсказательной модели, косвенно оценивающей скелетно-мышечный индекс на основании базовых антропометрических (масса тела, рост, ИМТ) и клинико-лабораторных (уровень гемоглобина, железа, альбумина, трансферрина и общего белка в крови) показателей.
Анализ в подгруппах
Для количественной оценки саркопении измеряли скелетно-мышечный индекс при помощи КТ-саркометрии. Измерения проводили по аксиальным КТ-сканам на уровне L3-позвонка. Пороговый диапазон коэффициента ослабления варьировал от -29 до +150 единиц Хаунсфилда (Hounsfield units, HU). Рассчитывали объём всех скелетных мышц в зоне сканирования (параспи-нальные, большие поясничные, косые и прямые мышцы живота) с исключением прочих структур. Измерения проводили полуавтоматическим методом в программе Slicer 5.6.2. Сегментацию изображения в пределах заданных денситометри-ческих показателей проводили автоматически, иническая
эактика
Том 16 № 1
а структуры, не относящиеся к мышечной ткани, удаляли вручную (рис. 1, 2). Скелетно-мышечный индекс вычисляли как отношение показателя площади скелетных мышц (см 2 ) к квадрату показателя роста пациентов (м 2 ). За пороговое значение скелетно-мышечного индекса, ниже которого состояние мышечной ткани расценивали как саркопению, принимали классические критерии Prado — 52,4 см 2 /м 2 для мужчин и 38,5 см 2 /м 2 для женщин [15]. Для упрощения интерпретации полученных показателей их представили не в абсолютных цифрах, а в виде отношения полученного показателя к нижней границе референсных значений для данного пола (скелетно-мышечный индекс). Кроме того, у всех пациентов на доопера-ционном этапе оценивали ИМТ, массу тела, рост, а также содержание гемоглобина, железа, альбумина, трансферрина и общего белка в крови.
Методы регистрации исходов
Для диагностики послеоперационных осложнений (пневмония, несостоятельность анастомоза и некроз трансплантата) проводили КТ-исследование органов грудной клетки и брюшной полости с пероральным контрастированием на первый и пятый, либо третий и седьмой послеоперационные дни. Кроме того, исследование выполняли при резком ухудшении состояния пациента. Другие осложнения подозревались на основании клинических данных с последующей верификацией с помощью лабораторных и инструментальных методов.
Статистический анализ
Размер выборки предварительно не рассчитывался.
Описательную статистику для категориальных переменных представили абсолютной и относительной частотой, для количественных переменных — средним (стандартное отклонение, СО), медианой ([min; max]); в табл. 1, 3 также приведены значения p для тестов нулевой гипотезы об отсутствии ассоциации между факторами и развитием осложнений. Для категориальных факторов использовали тест χ 2 (хи-квадрат), для количественных — t-тест.
Была составлена базовая модель логистической регрессии для оценки вероятности развития осложнений, включающая основные факторы развития осложнений. Отбор факторов для базовой модели проводили на основе доменных знаний. Статистические процедуры построения модели (например, пошаговую регрессию) не использовали. Возраст и пол включили в модель в качестве «универсальных конфаундеров». Оценку нутритивного статуса пациента, тяжести сопутствующей патологии и сложности вмешательства косвенно отразили через ИМТ, индекс коморбидности и длительность операции соответственно.
Основной анализ ассоциации интересующих нас факторов с развитием осложнений после операции проводили с помощью логистической регрессии; к базовой модели добавляли фактор интереса. Для отношений шансов, рассчитанных с помощью логистической регрессии, приводи-
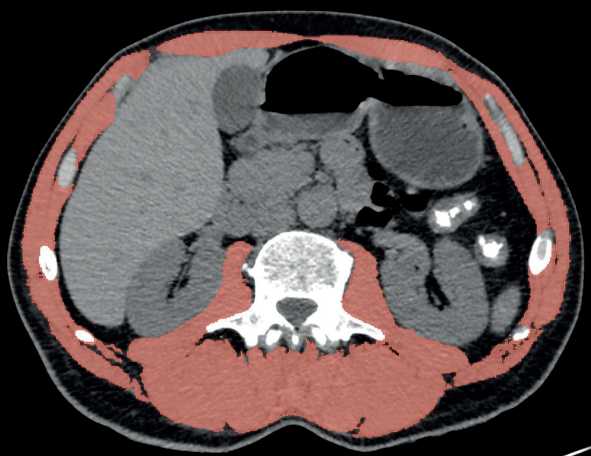
Рис. 1. Предоперационная компьютерная томограмма пациента без саркопении (площадь мышц 215,5 см 2 , скелетно-мышечный индекс 63 см 2 /м 2 ). Мышечная ткань выделена красным цветом. Аксиальная проекция, мягкотканное окно.
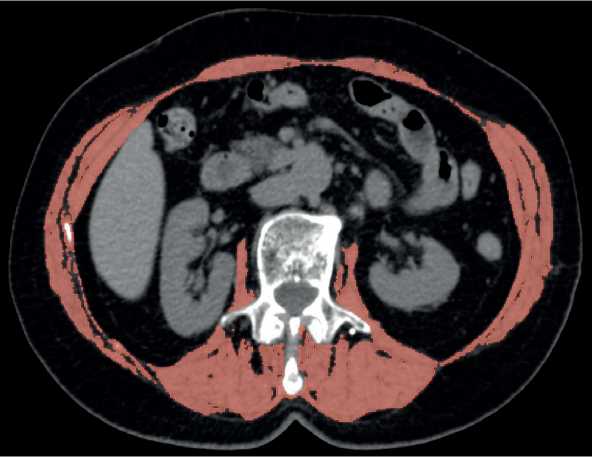
Рис. 2. Предоперационная компьютерная томограмма пациентки с саркопенией (площадь мышц 44,5 см 2 , скелетно-мышечный индекс 17 см 2 /м 2 ). Мышечная ткань выделена красным цветом. Аксиальная проекция, мягкотканное окно.
kV ГА
ли p -значения и 95% доверительные интервалы, рассчитанные по методу Вальда с использованием робастных оценок стандартных ошибок (HC4 sandwich estimator). Анализ корректности моделей проводили визуально с помощью QQ-графиков для остатков, графиков «остаток-предска-занное значение» (residuals vs. fitted), диаграмм «масштаб-сдвиг» (scale-location) и «остаток-рычаг» (residuals vs. leverage), а также диаграмм «частных остатков» (partial residuals plots). Во всех случаях качество моделей было удовлетворительным.
Для оценки предсказательной силы статистической связи между переменными использовали корреляцию Пирсона. Для построения предсказательной модели использовали многофакторную линейную регрессию. Оценку предсказательного качества полученной модели производили с помощью скорректированного коэффициента детерминации (adjusted R 2).
Поправки на множественные сравнения не использовали. Применяли анализ доступных случаев (available case analysis) без восполнения пропусков в данных. Тесты проводили на уровне значимости α =0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В НМИЦХ провели анализ 500 историй болезней пациентов, которым выполнили первичную эзофагэктомию с одномоментной пластикой пищевода по поводу его доброкачественных (54%) и злокачественных (46%) заболеваний в рамках программы РУПОР в период с 2012 по 2024 год. Предоперационную подготовку провели 27,8% пациентов, из них коррекция нутритивного статуса потребовалась в 21,8% случаев, а сопутствующей патологии — в 7%.
С 2017 года 97,4% пациентов экстубировали в операционной и переводили в отделение реанимации и интенсивной терапии (ОРИТ) для дальнейшего наблюдения. Медиана пребывания пациентов в ОРИТ составила 0,67 суток.
По программе раннего перорального питания прошли 96 (19,2%) пациентов. Послеоперационные осложнения выявили у 146 (29,2%) пациентов. У 50 (10%) пациентов развилась послеоперационная пневмония. Несостоятельность пищеводного анастомоза диагностировали в 11 (2,2%) случаях, также у 11 (2,2%) пациентов верифицировали апикальный некроз кондуита, ещё у 11 (2,2%) — субтотальный некроз трансплантата. Медиана пребывания в стационаре составила 9 послеоперационных дней, а госпитальная летальность — 1,4%.
В подгруппе пациентов с проведённой КТ-диагностикой саркопении 33 (30%) провели предоперационную подготовку, из них 19 (17%) корригировали нутритивный статус (зондовое/парентеральное/ком-бинированное питание), 13 (11,7%) провели диагностическую коронарографию, после которой 3 (3%) выполнили чрескожное коронарное вмешательство, 2 (2%) — аортокоронарное шунтирование. До плановой эзофагэктомии 2 (2%) пациентам сделали каротидную эндартерэктомию, 1 (1%) установили постоянный электрокардиостимулятор. После операции всех больных экстубировали в операционной и перевели в ОРИТ. Медиана пребывания в ОРИТ составила 0,7 суток, медиана послеоперационного пребывания в стационаре — 9 суток. Осложнения после операции отметили в 34% случаев. Послеоперационную пневмонию диагностировали у 14 (13%) пациентов. Несостоятельность пищеводного анастомоза выявили у 3 (3%) пациентов, апикальный некроз желудочной трубки — у 2 (2%). Госпитальная летальность в исследуемой подгруппе составила 0%.
Основные результаты исследования
На первом этапе исследования после оценки осложнений пациентов ( n =500) разделили на две группы — с наличием и отсутствием осложнений (табл. 1).
Послеоперационные осложнения статистически значимо чаще диагностировали у пациентов старшего возраста ( р =0,0011). Длительность вмешательства и анестезии, вариант доступа, ASA,
Таблица 1
Базовая описательная статистика пациентов, включённых в исследование
|
Параметр |
Пациенты |
Всего ( n =500) |
p |
|
|
без осложнений ( n =354) |
с осложнениями ( n =146) |
|||
|
Возраст, лет |
||||
|
Среднее (СО) |
55,0 (13,7) |
59,4 (13,3) |
56,3 (13,7) |
0,0011 |
|
Медиана [min; max] |
57,0 [18,0; 89,0] |
61,0 [19,0; 89,0] |
59,0 [18,0; 89,0] |
|
|
Пол: |
||||
|
• мужской |
202 (57,1%) |
97 (66,4%) |
299 (59,8%) |
0,065 |
|
• женский |
152 (42,9%) |
49 (33,6%) |
201 (40,2%) |
|
|
Вес, кг |
||||
|
Среднее (СО) |
69,7 (16,3) |
70,2 (15,5) |
69,8 (16,1) |
0,71 |
|
Медиана [min; max] |
68,0 [34,0; 125] |
69,0 [37,0; 105] |
69,0 [34,0; 125] |
|
|
Индекс массы тела: |
||||
|
Среднее (СО) |
24,1 (5,19) |
24,0 (4,84) |
24,0 (5,09) |
0,89 |
|
Медиана [min; max] |
23,7 [14,4; 40,0] |
22,8 [15,1; 37,2] |
23,5 [14,4; 40,0] |
|
|
Классификация индекса массы тела: |
||||
|
<18,5 кг/м 2 |
54 (15,3%) |
20 (13,7%) |
74 (14,8%) |
0,57 |
|
18,5–24,9 кг/м 2 |
161 (45,5%) |
74 (50,7%) |
235 (47,0%) |
|
|
>25 кг/м 2 |
139 (39,3%) |
52 (35,6%) |
191 (38,2%) |
|
|
Курение: |
||||
|
• нет |
268 (75,7%) |
98 (67,1%) |
366 (73,2%) |
0,063 |
|
• да |
86 (24,3%) |
48 (32,9%) |
134 (26,8%) |
|
|
NRS-2002: |
||||
|
Среднее (СО) |
2,70 (0,826) |
2,80 (0,902) |
2,73 (0,849) |
0,25 |
|
Медиана [min; max] |
3,00 [1,00; 5,00] |
3,00 [1,00; 5,00] |
3,00 [1,00; 5,00] |
|
|
Нет данных |
1 (0,3%) |
1 (0,7%) |
2 (0,4%) |
|
|
Индекс коморбидности: |
||||
|
Среднее (СО) |
3,12 (2,42) |
4,22 (2,49) |
3,44 (2,49) |
<0,001 |
|
Медиана [min; max] |
3,00 [0; 10,0] |
4,00 [0; 10,0] |
3,00 [0; 10,0] |
|
|
Шкала Lee: |
||||
|
Среднее (СО) |
1,20 (0,490) |
1,32 (0,610) |
1,24 (0,530) |
0,034 |
|
Медиана [min; max] |
1,00 [0; 3,00] |
1,00 [0; 3,00] |
1,00 [0; 3,00] |
|
|
ASA: |
||||
|
Среднее (СО) |
2,57 (0,666) |
2,80 (0,650) |
2,64 (0,669) |
<0,001 |
|
Медиана [min; max] |
3,00 [1,00; 4,00] |
3,00 [2,00; 4,00] |
3,00 [1,00; 4,00] |
|
|
Потеря массы тела >10% за 6 мес: |
||||
|
• нет |
256 (72,3%) |
102 (69,9%) |
358 (71,6%) |
0,66 |
|
• да |
98 (27,7%) |
44 (30,1%) |
142 (28,4%) |
|
|
Общий объём интраоперационной инфузионной терапии с учётом возмещения потерь, мл/кг в час |
||||
|
Среднее (СО) |
4,45 (1,67) |
4,36 (1,69) |
4,42 (1,68) |
0,61 |
|
Медиана [min; max] |
4,30 [-0,751; 14,0] |
4,28 [0; 9,93] |
4,29 [-0,751; 14,0] |
|
|
Длительность операции, мин |
||||
|
Среднее (СО) |
391 (99,9) |
437 (111) |
404 (105) |
<0,001 |
|
Медиана [min; max] |
370 [230; 755] |
438 [240; 780] |
390 [230; 780] |
|
Таблица 1


Продолжение
|
Параметр |
Пациенты |
Всего ( n =500) |
p |
|
|
без осложнений ( n =354) |
с осложнениями ( n =146) |
|||
|
Длительность анестезии, мин |
||||
|
Среднее (СО) |
484 (109) |
529 (125) |
497 (116) |
<0,001 |
|
Медиана [min; max] |
463 [300; 850] |
520 [300; 880] |
480 [300; 880] |
|
|
Доступ: |
||||
|
• трансторакальный |
132 (37,3%) |
90 (61,6%) |
222 (44,4%) |
<0,001 |
|
• трансхиатальный |
222 (62,7%) |
56 (38,4%) |
278 (55,6%) |
|
|
Тип трансплантата: |
||||
|
• желудочная трубка |
329 (92,9%) |
134 (91,8%) |
463 (92,6%) |
0,9 |
|
• кишечная трубка |
21 (5,9%) |
10 (6,8%) |
31 (6,2%) |
|
|
• комбинированный |
4 (1,1%) |
2 (1,4%) |
6 (1,2%) |
|
|
Несостоятельность анастомоза или суб-/тотальный некроз кондуита: |
||||
|
• да |
0 (0%) |
33 (22,6%) |
33 (6,6%) |
<0,001 |
|
• нет |
354 (100%) |
113 (77,4%) |
467 (93,4%) |
|
|
Скелетно-мышечный индекс до операции (с поправкой на пол): |
||||
|
Среднее (СО) |
0,704 (0,317) |
0,633 (0,250) |
0,680 (0,297) |
0,2 |
|
Медиана [min; max] |
0,592 [0,193; 2,24] |
0,551 [0,321; 1,20] |
0,589 [0,193; 2,24] |
|
|
Нет данных |
281 (79,4%) |
108 (74,0%) |
389 (77,8%) |
|
|
Скелетно-мышечный индекс до операции: |
||||
|
Среднее (СО) |
32,3 (14,6) |
29,7 (13,1) |
31,4 (14,1) |
0,36 |
|
Медиана [min; max] |
28,8 [10,1; 86,4] |
24,6 [14,5; 63,0] |
27,4 [10,1; 86,4] |
|
|
Нет данных |
281 (79,4%) |
108 (74,0%) |
389 (77,8%) |
|
Примечание . Здесь и в табл. 3: СО — стандартное отклонение; min; max — минимальное и максимальное значение соответственно.
индекс коморбидности также достоверно отличались в группе с послеоперационными осложнениями ( р <0,001). Результаты, полученные на основе базовой регрессионной модели, представлены в табл. 2. Модель включала возраст и пол как «универсальные конфаундеры», ИМТ (оценка нутри-
тивного статуса пациента), индекс коморбидности (оценка тяжести сопутствующей патологии) и длительность операции (оценка сложности операции). Анализ скорректированных отношений шансов не выявил статистически значимой ассоциации между вероятностью развития осложнений и возрастом,
Таблица 2
Факторы риска развития осложнений (500 пациентов)
|
Параметр |
Скорректированные отношения шансов (ОШ) |
|||
|
ОШ |
p |
95% ДИ |
||
|
Н |
В |
|||
|
Константа |
0,0794 |
0,003 |
0,0151 |
0,417 |
|
Возраст, лет |
1,01 |
0,489 |
0,984 |
1,03 |
|
Женщины |
0,809 |
0,333 |
0,526 |
1,24 |
|
Индекс массы тела |
0,975 |
0,209 |
0,937 |
1,01 |
|
Индекс коморбидности |
1,13 |
0,062 |
0,994 |
1,28 |
|
Время операции, мин |
1,00 |
0,001 |
1,00 |
1,01 |
Примечание . Значение p для теста типа «модель–субмодель»: отношение правдоподобия составляет 0,44. Здесь и в табл. 4, 5: ДИ — доверительный интервал; Н — нижний; В — верхний.
Таблица 3
Базовая описательная статистика (111 пациентов): оценка саркопении в группах с/без осложнений
На втором этапе те же параметры описательной статистики оценили на подгруппе пациентов, которым измеряли объём мышечной массы (табл. 3), при этом саркопению разной степени выраженности диагностировали у 95 (85,6%) пациентов.
Послеоперационные осложнения статистически значимо чаще диагностировали у пациентов с более высокой степенью анестезиологического риска ( р =0,0042) при длительных ( р =0,046) трансторакальных вмешательствах ( p =0,017), при этом возраст и индекс коморбидности статистически значимо не отличались в группах. Несмотря на то, что среднее значение ИМТ в обеих группах сопо-
ставимо, распределение пациентов с дефицитом массы тела и её избытком статистически значимо различалось ( p =0,049). Среднее значение скелетно-мышечного индекса до операции также было сопоставимым между группами и статистически значимо не различалось.
Для более детального анализа влияния скелетно-мышечного индекса на риск развития осложнений построили однофакторную (табл. 4) и многофакторную (табл. 5) регрессионные модели с включением базовых параметров, протестированных на большой выборке пациентов. Обе модели не показали статистически значимой ассоциации индекса скелетно-мышечного индекса с вероятностью развития послеоперационных осложнений, тем не менее, учитывая широкие доверительные интервалы для ОШ (как скорректированных, так и нескорректированных), нельзя исключить наличие клинически значимой ассоциации скелетномышечного индекса с развитием осложнений. Исходя из полученных данных, в рамках программы РУПОР скелетно-мышечный индекс и саркопения не ассоциированы с развитием послеоперационных осложнений статистически значимым образом.
Таблица 3

Продолжение
|
Параметр |
Пациенты |
Всего ( n =111) |
p |
|
|
без осложнений ( n =73) |
с осложнениями ( n =38) |
|||
|
NRS-2002: |
||||
|
Среднее (СО) |
2,67 (0,728) |
2,84 (0,718) |
2,73 (0,725) |
0,24 |
|
Медиана [min; max] |
3,00 [1,00; 4,00] |
3,00 [2,00; 5,00] |
3,00 [1,00; 5,00] |
|
|
Индекс коморбидности: |
||||
|
Среднее (СО) |
3,82 (2,67) |
4,29 (2,40) |
3,98 (2,58) |
0,35 |
|
Медиана [min; max] |
4,00 [0; 10,0] |
4,00 [0; 10,0] |
4,00 [0; 10,0] |
|
|
Шкала Lee: |
||||
|
Среднее (СО) |
1,33 (0,554) |
1,42 (0,599) |
1,36 (0,569) |
0,43 |
|
Медиана [min; max] |
1,00 [1,00; 3,00] |
1,00 [1,00; 3,00] |
1,00 [1,00; 3,00] |
|
|
ASA: |
||||
|
Среднее (СО) |
2,64 (0,609) |
2,95 (0,462) |
2,75 (0,579) |
0,0042 |
|
Медиана [min; max] |
3,00 [1,00; 4,00] |
3,00 [2,00; 4,00] |
3,00 [1,00; 4,00] |
|
|
Потеря массы тела >10% за 6 мес: |
||||
|
• нет |
55 (75,3%) |
25 (65,8%) |
80 (72,1%) |
0,4 |
|
• да |
18 (24,7%) |
13 (34,2%) |
31 (27,9%) |
|
|
Общий объём интраоперационной инфузионной терапии с учётом возмещения потерь, мл/кг в час |
||||
|
Среднее (СО) |
4,44 (1,82) |
4,30 (1,24) |
4,39 (1,64) |
0,63 |
|
Медиана [min; max] |
4,29 [1,55; 14,0] |
4,21 [2,17; 7,24] |
4,22 [1,55; 14,0] |
|
|
Длительность операции, мин |
||||
|
Среднее (СО) |
399 (93,1) |
442 (113) |
414 (102) |
0,046 |
|
Медиана [min; max] |
390 [240; 625] |
438 [260; 780] |
405 [240; 780] |
|
|
Длительность анестезии, мин |
||||
|
Среднее (СО) |
491 (101) |
539 (127) |
507 (112) |
0,044 |
|
Медиана [min; max] |
480 [300; 730] |
533 [330; 880] |
495 [300; 880] |
|
|
Доступ: |
||||
|
• трансторакальный |
33 (45,2%) |
27 (71,1%) |
60 (54,1%) |
0,017 |
|
• трансхиатальный |
40 (54,8%) |
11 (28,9%) |
51 (45,9%) |
|
|
Тип трансплантата: |
||||
|
• желудочная трубка |
65 (89,0%) |
34 (89,5%) |
99 (89,2%) |
1 |
|
• кишечная трубка |
6 (8,2%) |
3 (7,9%) |
9 (8,1%) |
|
|
• комбинированный |
2 (2,7%) |
1 (2,6%) |
3 (2,7%) |
|
|
Несостоятельность анастомоза или субтотальный некроз кондуита: |
||||
|
• да |
0 (0%) |
5 (13,2%) |
5 (4,5%) |
0,0072 |
|
• нет |
73 (100%) |
33 (86,8%) |
106 (95,5%) |
|
|
Скелетно-мышечный индекс до операции(с поправкой на пол): |
||||
|
Среднее (СО) |
0,704 (0,317) |
0,633 (0,250) |
0,680 (0,297) |
0,2 |
|
Медиана [min; max] |
0,592 [0,193; 2,24] |
0,551 [0,321; 1,20] |
0,589 [0,193; 2,24] |
|
|
Скелетно-мышечный индекс до операции: |
||||
|
Среднее (СО) |
32,3 (14,6) |
29,7 (13,1) |
31,4 (14,1) |
0,36 |
|
Медиана [min; max] |
28,8 [10,1; 86,4] |
24,6 [14,5; 63,0] |
27,4 [10,1; 86,4] |
|
Таблица 4
Однофакторная регрессионная модель: оценка влияния саркопении на вероятность развития послеоперационных осложнений
|
Параметр |
Нескорректированное отношение шансов (ОШ) |
|||
|
ОШ |
p |
95% ДИ |
||
|
Н |
В |
|||
|
Константа |
0,954 |
0,929 |
0,339 |
2,69 |
|
Скелетно-мышечный индекс до операции |
0,402 |
0,227 |
0,0918 |
1,76 |
Таблица 5
Многофакторная регрессионная модель: оценка влияния саркопении на послеоперационные осложнения
|
Параметр |
Скорректированное отношение шансов (ОШ) |
|||
|
ОШ |
p -значение |
95% ДИ |
||
|
Н |
В |
|||
|
Константа |
0,239 |
0,421 |
0,00734 |
7,80 |
|
Возраст, лет |
1,02 |
0,591 |
0,961 |
1,07 |
|
Женщины |
0,803 |
0,628 |
0,331 |
1,95 |
|
Индекс массы тела |
0,932 |
0,145 |
0,848 |
1,02 |
|
Индекс коморбидности |
0,990 |
0,947 |
0,730 |
1,34 |
|
Время операции, мин |
1,01 |
0,032 |
1,00 |
1,01 |
|
Скелетно-мышечный индекс до операции |
0,506 |
0,467 |
0,0809 |
3,17 |
Дополнительные результаты исследования
Мы попытались составить предсказательную модель, косвенно оценивающую скелетно-мышечный индекс на основании базовых антропометрических и клинико-лабораторных показателей. Для её создания исследовали взаимосвязь скелетно-мышечного индекса с ИМТ, массой тела, ростом, содержанием гемоглобина, железа, альбумина, трансферрина и общего белка в крови. Наиболее тесную связь обнаружили между скелетно-мышечным индексом и ИМТ (r=0,37), массой тела (r=0,35) и альбумином (r=0,3), где r — коэффициент корреляции Пирсона. Для остальных факторов коэффициент корреляции по модулю не превысил 0,18.
После построения многофакторной линейной модели ни один из факторов (пол, ИМТ, масса тела, рост, содержание гемоглобина, железа, альбумина, трансферрина и общего белка в крови), включённых в модель, статистически значимо не ассоциировался со скелетно-мышечным индексом (рис. 3). Общее p-значение для всей модели составило 0,07, скорректированное значение коэффициента детерминации R2 — 0,12. Следовательно, потенциал рассмотренных факторов для предсказания скелетно-мышечного индекса слабо выражен. Данные факторы плохо описывают вариабельность индекса. Базовые антропометрические и клинико-лабораторные показатели не предсказывают саркопе-нию у пациентов с заболеваниями пищевода.
Нежелательные явления
Послеоперационные осложнения отметили у 146 (29,2%) пациентов. Самым частым осложнением была послеоперационная пневмония — у 50 (10%) больных. Нарушения ритма в виде фибрилляции предсердий диагностировали в 30 (6%) случаях, несостоятельность пищеводного соустья — в 11 (2,2%), некроз трансплантата — в 22 (4,4%), из них у 11 (2,2%) пациентов был апикальный некроз кондуита, потребовавший консервативного лечения, а у 11 (2,2%) — суб-/тотальный некроз трансплантата, что сопровождалось его экстирпацией и выведением эзофаго- и гастро-/еюностом.
ОБСУЖДЕНИЕ
В статье представлен одноцентровой опыт пе-риоперационного обеспечения эзофагэктомии
(Л o'
ф ф X
ф
0.51.01.52.0 0369 0369 20 30 40 50 75 1001251.51.61.71.81.92.00 90 1201501800 10 20 30 40 50 30 40 50 60 70405060708090100200300400
Рис. 3. Попарные диаграммы рассеяния и коэффициенты корреляции Пирсона для факторов риска развития осложнений в целом. sm index before — скелетно-мышечный индекс; sex — пол; bmi — индекс массы тела; weight — масса тела; height — рост; haemoglobin — гемоглобин; iron — железо; albumin — альбумин; total protein — общий белок; transferrin — трансферрин.
с одномоментной эзофагопластикой в рамках программы РУПОР. Ретроспективно с помощью лучевых методов исследования саркопению диагностировали у 85,6% пациентов. Несмотря на столь высокую частоту встречаемости, она не оказала влияния на осложнения после эзофагэктомии в НМИЦХ.
В мировой литературе данные о влиянии сар-копении на послеоперационные осложнения противоречивы. В 2019 году был опубликован первый метаанализ, отражающий влияние саркопении на исходы лечения больных раком пищевода [16]. Авторы пришли к выводу, что саркопения ухудшает долгосрочный прогноз пациентов (3- и 5-летнюю выживаемость). Спустя 4 года другие метаанализы на основании обновлённых мировых данных заключили, что саркопения является независимым фактором риска послеоперационных осложнений в целом, несостоятельности анастомоза и респираторных осложнений в частности, и достоверно снижает общую и безрецидивную выживаемость больных раком пищевода [17, 18].
При детальном изучении работ, входящих в метаанализ, бросается в глаза разнородность исследуемых пациентов. Частота встречаемости сарко-пении в группах варьирует от 15–16,5% [19, 20] до 70–75% [13, 21], что частично связано с отсутствием единого стандарта КТ-диагностики саркопе-нии. Исследователи оценивали разные мышечные массивы и количественные показатели, при этом чаще определяли скелетно-мышечный индекс, но в некоторых работах измеряли индекс поясничной мышцы [21–23] и даже объём жевательной мускулатуры [24]. При оценке скелетно-мышечного индекса использовали различные референсные значения. Одни исследователи применяли классические критерии Prado (52,4 см 2 /м 2 для мужчин и 38,5 см 2 /м 2 для женщин) [15], некоторые снижали нижнюю границу нормы у мужчин до 43 см 2 /м 2 при ИМТ <25 кг/м 2 [25, 26] и незначительно варьировали её для женщин. Однако интереснее сами результаты исследований, используемые для доказательства влияния саркопении на послеоперационные осложнения. Так, в исследовании В. Soma и соавт. [26], включившем 109 пациентов, саркопению диагностировали у 44% из них. У пациентов с саркопенией длительность пребывания в ОРИТ увеличивалась с 5 до 6, госпитализации — с 33 до 46 послеоперационных дней, частота несостоятельности анастомоза — с 17,5% до 20%, а послеоперационной пневмонии — с 11% до 33%. В работе сделали вывод, что саркопения достоверно повышает частоту респираторных осложнений. В другом исследовании саркопения увеличивала частоту осложнений с 36% до 63% [27], при этом всем пациентам интраоперационно накладывали питательную еюно-стому, устанавливали декомпрессионный назогастральный зонд, а плевральный дренаж удаляли на восьмой послеоперационный день. U. Fehrenbach и соавт. [12] оценили результаты лечения 85 пациентов и диагностировали осложнения в 72% случаев, а несостоятельность анастомоза — в 12,8%. В исследовании у больных саркопенией достоверно удлинялась госпитализация с 19 до 32, а при саркопеническом ожирении — с 24 до 71 послеоперационного дня, при этом S.R. Siegal и соавт. [28] не выявили связи между саркопенией и повышением заболеваемости, смертности и безрецидивной выживаемости на большой выборке пациентов ( n =173) и частотой встречаемости саркопении (73,4%).
Благодаря качественной хирургической технике оператора, адекватному периоперационному обеспечению и предоперационной подготовке пациен- тов даже при наличии саркопении (85,6%) удаётся сохранять относительно низкую частоту послеоперационных осложнений (34%) в целом, пневмонии (13%) и несостоятельности анастомоза (3%) в частности, при этом длительность послеоперационного периода составляет до 9 послеоперационных дней.
Ограничения исследования
Стоит отметить, что во всех исследованиях оценивали исключительно больных раком пищевода. В НМИЦХ лишь 54% операций провели в связи с онкологическим заболеванием. У остальных пациентов вмешательство выполнили по поводу доброкачественных заболеваний пищевода (стриктура пищевода, ахалазия кардии IV стадии, короткий пищевод II степени, свищ). Возможно, именно с этим связана столь массовая распространённость саркопении, ведь при доброкачественных заболеваниях средняя потеря массы тела выше, а анамнез заболевания дольше. Для статистической обработки информации мы использовали логистическую регрессию, а не стандартную дихото-мизацию непрерывного показателя, применяемую в других работах. Логистическая регрессия позволяет с большей вероятностью обнаружить связи в данных и исключить влияние саркопении на исходы лечения пациентов [29, 30].
ЗАКЛЮЧЕНИЕ
Эзофагэктомия с одномоментной пластикой пищевода — операция, ассоциированная с высоким риском осложнений и летальности. Благодаря внедрению программы РУПОР, разработанной в НМИЦХ, частота жизнеугрожающих осложнений (пневмония, несостоятельность анастомоза, некроз трансплантата) и летальности после реконструктивных вмешательств значительно меньше общемировых показателей. Саркопению диагностировали у 85,6% пациентов НМИЦХ — это значимый и доказанный фактор, ухудшающий результаты лечения пациентов, однако на основании анализа наших данных, саркопения не влияет на развитие послеоперационных осложнений. Опыт НМИЦХ показал, что качественная хирургическая техника вкупе с грамотным периоперационным обеспечением способны нивелировать негативное влияние саркопении.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. Н.Б. Ковалерова — лечение пациентов, сбор данных, написание текста статьи;
kV ГА
Д.В. Ручкин — техническое исполнение всех хирургических вмешательств, руководство лечением пациентов, написание текста статьи; О.В. Струнин — поисково-аналитическая работа, обсуждение результатов исследования; Д.Е. Оконская — рентгенологическая диагностика, написание текста статьи; А.В. Мазурок — рентгенологическая диагностика. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Этическая экспертиза. Организация исследования одобрена локальным этическим комитетом ФГБУ «Национальный медицинский исследовательский центр хирургии имени А.В. Вишневского» Минздрава России (протокол № 008-2024 от 29.11.2024).
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.


