Влияние состава культуральной среды на развитие Leuconostoc lactis на этапе предварительного ферментирования
Автор: Кондратенко В.В., Лялина О.Ю., Посокина Н.Е., Терешонок В.И.
Журнал: Овощи России @vegetables
Рубрика: Физиология и биохимия растений
Статья в выпуске: 5 (38), 2017 года.
Бесплатный доступ
Исследована закономерность влияния культуральной среды (субстрата) на развитие микрофлоры на этапе предварительного ферментирования модельной среды на основе капусты белокочанной сорта Парус. В процессе исследований использовали штаммы молочнокислых микроорганизмов Leuconostoc lactis. Проведена поэтапная математическая обработка экспериментальных данных. Получены функциональные зависимости, наиболее адекватно аппроксимирующие экспериментальные данные для модифицированной (ММС) и базовой (БМС) модельных сред. Анализ экспериментальных данных показал, что в зависимости от вида (состава) среды один и тот же вид микроорганизмов проявляет различную динамику нарастания титра. В связи с этим был разработан алгоритм определения оптимальной продолжительности предферментирования - «стоп-точки». В результате исследований видно, что модификация модельной среды с внесением в нее поваренной соли и аскорбиновой кислоты способствует формированию положительной динамики показателя сравнения. Данная динамика имеет три выраженных экстремума, однако практический смысл имеют только экстремумы, которые находятся в интервале периода монотонного убывания титра. Для успешного развития стартовой культуры этапа основной ферментации одним из условий является относительно малая величина титра первой культуры по завершению этапа предварительной ферментации для исключения конкуренции. Таким образом, место положения «стоп-точки» соответствует периоду после последнего пика показателя сравнения. Исследованная закономерность влияния предварительного культивирования грамположительных микроорганизмов на активность молочнокислых микроорганизмов в процессе ферментации является актуальной, так как от этого подхода в полном объеме зависит протекание всего процесса и получение высококачественной продукции.
Капуста белокочанная, предварительное ферментирование, культуральная среда, базовая и модифицированная модельные среды, монокультура, штаммы молочнокислых микроорганизмов, математическая обработка данных, динамика нарастания титра, скорость нарастания монокультур, показатель сравнения
Короткий адрес: https://sciup.org/140223736
IDR: 140223736 | УДК: 664.843.52 | DOI: 10.18619/2072-9146-2017-5-92-95
Текст научной статьи Влияние состава культуральной среды на развитие Leuconostoc lactis на этапе предварительного ферментирования
Процесс ферментации капусты зависит от последовательного развития и смены пулов микроорганизмов, которые естественным образом присутствуют в сырье [1]. Некоторые появляются на ранних стадиях ферментации, выполняя опреде- ленную функцию, а затем погибают, другие начинают свое раз- витие позже и остаются на средних и высоких уровнях на протяжении всего процесса, в том числе и после его окончания. Рост их зависит от условий начальной стадии процесса, создаваемых ранее продуцирующими микроорганизмами [2]. Сам процесс происходит в серии перекрывающихся этапов или последовательностей. Каждому этапу соответствует определенная последовательность микроорганизмов. На рисунке 1 представлен процесс спонтанного ферментирования, который состоит из 3-х последовательных этапов и почти всегда соответствует представленной модели (каждый этап выделен цветом) [3].
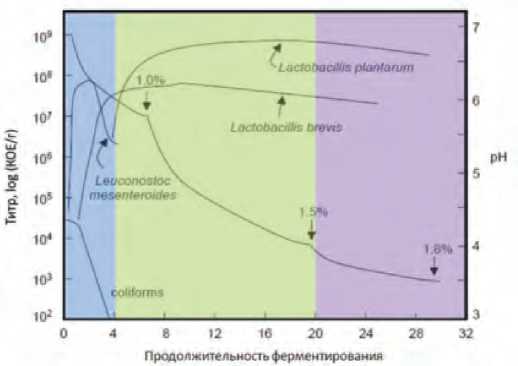
Рис. 1. Идеализированная последовательность процесса ферментации капусты белокочанной [3]
Молочная кислота является основным соединением, которое образуется в процессе ферментации, однако имеются и другие метаболические конечные продукты. Важно отметить, что многие из них вносят вклад в общий вкус квашеной капусты. В частности, конечные продукты, производимые Leuconostoc sр. и другими гетероферментативными молочнокислыми бактериями, имеют важное значение для получения продукта с хорошими органолептическими показателями. Установлено, что в готовой квашеной капусте может присутствовать до 0,3 % уксусной кислоты и 0,5 % этанола [2].
Кроме того, в процессе ферментации могут синтезироваться небольшие количества маннита, диацетила, ацетальдегида и других летучих ароматических соединений. И, наконец, CO2, накопленный на стадии инициирования ферментации, усиливает вкус [2].
Качество готовой продукции в большой мере зависит от качества исходного сырья. Низкое содержание сахаров делает невозможным комфортное размножение молочнокислых микроорганизмов и, как следствие, накопление в продукте достаточного количества органических кислот, гарантирующих требуемый уровень кислотности [4]. Для получения готового продукта хорошего качества и с целью интенсификации процесса ферментации, рекомендуется применение чистых или смешанных культур молочнокислых бактерий (заквасок) при соблюдении оптимальных условий процесса. Это позволит направленно использовать биохимическую активность микроорганизмов для быстрого и максимального накопления молочной кислоты и исключить развитие нежелательной микрофлоры [4].
Цели и задачи
Целью наших исследований являлось изучение закономерности влияния культуральной среды (субстрата) на развитие микрофлоры на этапе предварительного ферментирования модельной среды на основе капусты белокочанной сорта Парус.
В процессе исследований основная задача состояла в том, чтобы провести поэтапную математическую обработку и анализ экспериментальных данных, и получить функциональные зави- симости, наиболее адекватно аппроксимирующие экспериментальные данные для модифицированной (ММС) и базовой (БМС) модельных сред. Разработать алгоритм определения оптимальной продолжительности предферментирования – «стоп-точки».
Материалы и методы
В качестве объектов исследования использовали штамм микроорганизмов рода Leuconostoc вида L. lactis , предоставленные ФГУП ГосНИИгенетика.
Монокультуры культивировали на двух модельных питательных средах на основе капусты белокочанной сорта Парус, предоставленной ФГБНУ ВНИИССОК (ФГБНУ ФНЦО).
Базовую модельную среду готовили последовательными операциями, включающими мойку, шинкование, гомогенизацию капусты белокочанной до получения однородной кашицеобразной массы. Отдельно готовили модифицированную модельную среду внесением в базовую модельную среду NaCl в количестве 1,5% от массы базовой среды, с последующим перемешиванием до полного растворения соли. Для сохранения модельных сред, их фасовали в стеклянные банки объёмом 0,1 дм3 (л) с винтовым типом укупорки, герметично укупоривали и стерилизовали при противодавлении 1 бар в течение 20 мин с последующим охлаждением до комнатной температуры. В модифицированную модельную среду в стерильных условиях добавляли аскорбиновую кислоту в количестве 35 мг на 100 г среды (доводя её массовую долю до таковой в исходном сырье), перемешивали до полного растворения и вторично укупоривали также в стерильных условиях.
Регенерацию культуры L. lactis проводили в боксе по следующей схеме: посев культуры, находящейся на хранении, в жидкую питательную среду MRS; термостатирование при температуре 30°С в течение 72 ч., определение начального титра культуры. Культивирование монокультур в модельных средах проводили путём их введения в количестве 1 % инокулята от объёма среды. Начальный титр соответствовал следующим значениям: в L. lactis БМС – 4*104 КОЕ/г, в L. lactis ММС – 2*105 КОЕ/г.
Активную фазу ферментирования осуществляли в термостате при температуре +30°С для L. lactis на БМС в течение 3 суток (72 ч), для L. lactis на ММС – 7 суток (168 ч). Далее осуществляли ежесуточный выборочный контроль титра микроорганизмов в модельной среде в процессе культивирования на протяжении всего процесса ферментации по [5].
Обработку экспериментальных данных осуществляли в несколько последовательных этапов: 1) первичная статистическая обработка экспериментальных данных (Microsoft Excel, Statistica); 2) определение функциональных зависимостей вида y=f(x) , адекватно аппроксимирующих экспериментальные данные (SYSTAT TableCurve 2D); 3) аналитический расчёт функции скорости нарастания значений исследуемого показателя в вариантах с культивированием микроорганизмов в базовой и модифицированной модельных средах.
Результаты
Анализ экспериментальных данных показал, что функциональные зависимости, наиболее адекватно аппроксимирующие экспериментальные данные, имеют вид:
-
• для базовой модельной среды (БМС)
Tb= e (ab+cb+eb • T2 )/( 1 +bb • T + db • T 2 ) , (1)
-
• для модифицированной модельной среды (ММС)
Tm= e ^m- T )/( 1 +bm • T + d m • T 2 ) , (2)
где a - константа; b, c, d, e - коэффициенты; e - основание натурального логарифма; τ – продолжительность культивирования, ч.
Характеристики аппроксимирующих функций представлены в таблице 1.
Анализ экспериментальных данных показывает, что в зависимости от состава среды (БМС или ММС) один и тот же вид микроорганизмов проявляет различную динамику нарастания титра. В связи с этим был разработан алгоритм определения оптимальной продолжительности ферментирования – «стоп-точки», основанный на логике сравнения скоростей
Таблица 1. Данные по аппроксимирующим функциям динамики нарастания биомассы по вариантам исследований
|
Модельная среда L. lactis |
Константа и коэффициенты |
||||
|
a |
b |
c |
d |
e |
|
|
БМС |
10,65886480 |
-0,03372082 |
-0,36574324 |
0,000296762 |
0,003296312 |
|
ММС |
12,97189228 |
-0,01027122 |
0,060187622 |
0,000120787 |
– |
Зависимости титра от продолжительности ферментирования при культивировании монокультуры L. lactis в БМС и ММС представлены на рисунке 2.
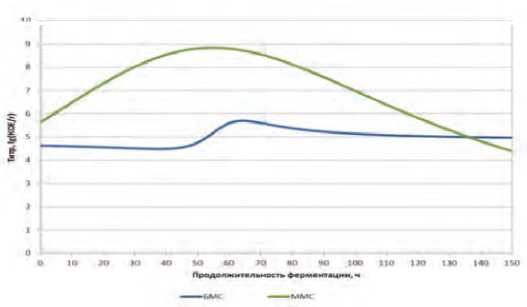
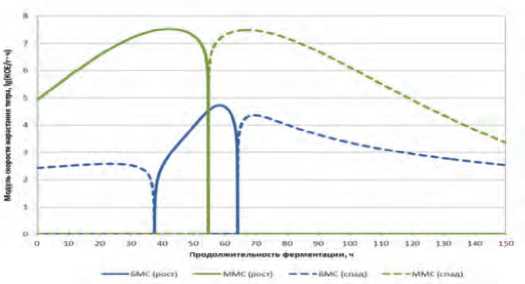
Рис. 2. Динамика нарастания титра монокультуры L. lactis в БМС и Рис. 3. Скорость нарастания монокультуры L. lactis в ММС и БМС. ММС.
нарастания титра в БМС и ММС, где в качестве контрольного выбран вариант с БМС. Алгоритм включает три последовательных этапа:
-
1) расчёт динамики скорости нарастания титра в ММС и БМС;
-
2) расчёт показателя сравнения k;
-
3) определение граничных условий выявления параметра τ «стоп-точки».
Скорости нарастания титра вида v=fv(T) определяли дифференцированием функций титра (1) и (2) по их аргументу:
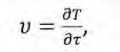
где v - скорость нарастания титра, КОЕ/г-ч.
Наличие локальных экстремумов у функций титра предполагает существование как минимум двух интервалов продолжительности ферментации для каждой соответствующей функции скорости - где v >0 и где v <0.
Для удобства графического представления логики дальнейших рассуждений, функции скоростей были преобразованы следующим образом:
-
1) vm>0 и vb> 0;
-
2) vm>0 и vb<0;
-
3) vm< 0 и v b > 0;
-
4) v”m< 0 и vb< 0.
Условно в качестве оптимума культивирования принимали, что титр культуры должен быстро нарастать и также быстро снижаться после достижения локального экстремума. В этом случае, чем выше скорость нарастания культуры в ММС по сравнению с БМС, а также – чем выше скорость уменьшения титра, тем лучше. Условиям сравнения для данного варианта удовлетворяют 1 и 4 частные случаи соотношения интервалов.
Кроме того, следствием первого условия является второе условие, согласно которому преимущество сравнения даёт нарастание титра культуры в ММС на интервале периода ферментации, на котором титр культуры в БМС уменьшается, равно как и наоборот. Условиям сравнения для данного варианта удовлетворяют 2 и 3 частные случаи соотношения интервалов.
Таким образом, учитывая логику подхода, формула расчёта показателя сравнения k имеет вид:
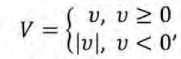
Динамики скоростей нарастания титров в ММС и БМС в формате V=fv( T ) представлены на рисунке 3.
Анализ полученных данных показывает, что внесение в модельную среду поваренной соли и аскорбиновой кислоты способствовали визуальному улучшению динамики нарастания титра в ММС по сравнению с БМС.
Логика следующего этапа включала следующие положения. Одновременное существование у двух функций (функциональных зависимостей) интервалов со значениями скоростей больше и меньше нуля предполагает существование четырёх частных случаев соотношения этих интервалов при сравнении зависимостей:
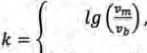
lg(.\Vm"»»\).
vm > 0 и vb > 0
Vm< 0 U Vb < 0
vm > 0 и vb < 0' vm< 0 и vb > 0
Рассчитанная динамика показателя сравнения условий культивирования на исследованных средах, а также динамика титра культуры на ММС представлены на рисунке 4.
В зависимости от целей, стоящих при культивировании, можно анализировать либо период культивирования на всей области определения продолжительности ферментации, либо одну или несколько её отдельных интервалов с расчётом соответствующих границ, что сравнительно можно осуществить графически, аналитически
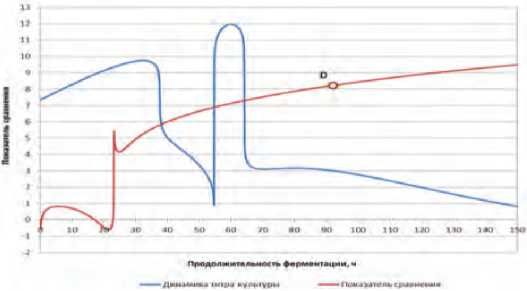
Рис. 4. Динамика показателя сравнения.
вающей скорости нарастания титра в ММС; 2) как минимум соответствие интервалу монотонного снижения положительного влияния поваренной соли и аскорбиновой кислоты в модельной среде; 3) достаточно малое значение титра микроорганизмов (для создания условий введения микроорганизмов для второго этапа ферментации).
Анализ динамики показателя сравнения позволил сделать вывод, что всем указанным граничным условиям соответствует период после 80 ч культивирования.
Определение местоположения «стоп-точки» осуществляли численными методами при обязательно граничном условии, чтобы в данной точке прирост показателя сравнения был не более 1 % в течение последующих 3 ч ферментации. Это является приемлемым минимумом прироста показателя сравнения и технологически оправданным. Таковым условиям составляет точка, соответствующая продолжительности ферментирования 92 ч.
или численными методами, в зависимости от требуемой точности.
Так, при ферментации модельной среды на основе белокочанной капусты сорта «Парус» с применением культур рода Leuconostoc lactis наблюдался выраженный положительный эффект в модифицированной модельной среде. При этом в интервале продолжительности культивирования, соответствующем области определения аргумента, имеют место три локальных экстремума: первый – по истечении ~ 32 ч культивирования; второй – по истечении ~ 60 ч; и третий – по истечении ~ 80 ч.
«Стоп-точка» (точка D) показывает продолжительность ферментации с использованием определенного штамма молочнокислых микроорганизмов и остаточный титр, который показывает количество молочнокислых микроорганизмов. Эта точка является отправной для определения стартового титра для следующей культуры и времени внесения.
Поскольку для практических целей наиболее важным является первый период культивирования в ММС, диапазон второго этапа культивирования (диапазон убывания титра) можно рассматривать, как область нахождения «стоп-точки» – оптимального момента внесения в среду следующей плановой культуры микроорганизмов для второго этапа культивирования.
Таким образом, основными граничными условиями задания области нахождения «стоп-точки» являются следующие: 1) как минимум соответствие интервалу убы-
Выводы
По результатам проведенных исследований видно, что модификация модельной среды c L. lactis с внесением в неё поваренной соли и аскорбиновой кислоты показала положительную динамику показателя сравнения. Данная динамика имеет три выраженных экстремума, однако практический смысл имеют только экстремумы, которые находятся в интервале периода монотонного убывания титра. Поскольку одним из условий для успешного развития стартовой культуры второго этапа является относительно малая величина титра первой культуры в конце этапа предварительной ферментации для исключения конкуренции, следовательно, «стоп-точка», соответствует периоду после последнего пика показателя сравнения. Так как на этом интервале значение показателя монотонно и почти линейно, следовательно, необходимо ввести ещё одно граничное условие, которым является заданная степень замедления прироста кислотности при заданном приросте продолжительности культивирования.
Исходя из этого, следует, что закономерность влияния культуральной среды (субстрата) на развитие микрофлоры или активность молочнокислых микроорганизмов на этапе предварительного ферментирования является актуальной, так как от этого подхода в полном объеме зависит протекание всего процесса и, следовательно, получение готового продукта хорошего качества.
-
• Литература
-
1. Stamer J. R. Growth rates of fermentation patterns of lactic- acid bacteria associated with the sauerkraut fermentation / J. R. Stamer, В. O. Stoyla, B.A. Dunckel // J. Milk Food Technol. – 1971. – V.34. – Pp.521-525.
-
2. Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. - 473 p.
-
3. Stamer J.R. Recent developments in the fermentation of sauerkraut / J. R. Stamer // Lactic Acid Bacteria in Beverages and Foods: Carr J. G., Cutting С. V., Whitting G. S. (eds): Fourth Long Ashton Symposium, 1973. – London: Academic Press. – 1975. – Pp.267-280.
-
4. Настольная книга производителя и переработчика плодоовощной продукции. Под редакцией Н.К. Синха, И.Г. Хью. Перевод с англ. яз. – СПб.: Профессия, 2014. – С. 467-485.
-
5. ГОСТ 10444.11-2013 «Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов».
-
-
• References
-
1. Stamer J. R. Growth rates of fermentation patterns of lactic- acid bacteria associated with the sauerkraut fermentation / J. R. Stamer, В. O. Stoyla, B.A. Dunckel // J. Milk Food Technol. – 1971. – V.34. – Pp.521-525.
-
2. Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. - 473 p.
-
3. Stamer J.R. Recent developments in the fermentation of sauerkraut / J. R. Stamer // Lactic Acid Bacteria in Beverages and Foods: Carr J. G., Cutting С. V., Whitting G. S. (eds): Fourth Long Ashton Symposium, 1973. – London: Academic Press. – 1975. – Pp.267-280.
-
4. Nastol'naya kniga proizvoditelya i pererabotchika plodoovoshchnoj produkcii. Pod redakciej N.K. Sinha, I.G. H'yu. Perevod s angl. yaz. – SPb.: Professiya, 2014. – S. 467485.
-
5. GOST 10444.11-2013 «Mikrobiologiya pishchevyh produktov i kormov dlya zhivotnyh. Metody vyyavleniya i podscheta kolichestva mezofil'nyh molochnokislyh mikroorganiz-mov».
-
Список литературы Влияние состава культуральной среды на развитие Leuconostoc lactis на этапе предварительного ферментирования
- Stamer J. R. Growth rates of fermentation patterns of lactic-acid bacteria associated with the sauerkraut fermentation/J. R. Stamer, В. O. Stoyla, B.A. Dunckel//J. Milk Food Technol. -1971. -V.34. -Pp.521-525.
- Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. -473 p.
- Stamer J.R. Recent developments in the fermentation of sauerkraut/J. R. Stamer//Lactic Acid Bacteria in Beverages and Foods: Carr J. G., Cutting С. V., Whitting G. S. (eds): Fourth Long Ashton Symposium, 1973. -London: Academic Press. -1975. -Pp.267-280.
- Настольная книга производителя и переработчика плодоовощной продукции. Под редакцией Н.К. Синха, И.Г. Хью. Перевод с англ. яз. -СПб.: Профессия, 2014. -С. 467-485.
- ГОСТ 10444.11-2013 «Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов».


