Влияние сверхэкспрессии гена Са 2+-зависимой протеинкиназы VaCPK13 на устойчивость культур клеток винограда амурского Vitis amurensis Rupr. к абиотическим стрессам
Автор: Христенко В.С., Дубровина А.С., Алейнова О.А., Киселев К.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Сельскохозяйственные науки: Агрономия
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
Полученные в результате исследования данные показали, что сверхэкспрессия гена VaCPK13 не влияла на устойчивость клеток V. amurensis к температурному, осмотическому и солевому стрессам. Полученные результаты свидетельствуют, что ген VaCPK13 не является сильным позитивным регулятором ответа растений на проанализированные абиотическиие стрессы.
Са 2+-зависимые протеинкиназы, абиотический стресс, клеточные культуры растений, cа 2+dependent protein kinase
Короткий адрес: https://sciup.org/14084129
IDR: 14084129 | УДК: 581.1
Текст научной статьи Влияние сверхэкспрессии гена Са 2+-зависимой протеинкиназы VaCPK13 на устойчивость культур клеток винограда амурского Vitis amurensis Rupr. к абиотическим стрессам
Понимание молекулярно-генетических механизмов ответа растений на неблагоприятные условия окружающей среды поможет понять, как растения справляются со стрессом. Приобретение растениями устойчивости к абиотическому стрессу нуждается в различных биохимических и физиологических изменениях, и большинство из них зависит от изменений в экспрессии генов. Исследования последних двух десятилетий показали, что различные стрессы влекут за собой сигнал-специфичные изменения уровня цитоплазматического Са2+, который функционирует как передатчик в модуляции разнообразных физиологических процессов, важных для адаптации к стрессам [4, 5].
Работа выполнена при поддержке Российского научного фонда (проект №14-14-00366).
Известно, что увеличение концентрации Ca2+ в цитозоли сигнализирует об изменениях в окружающей среде через связывание ионов Ca2+ с белками-сенсорами Ca2+, которые активируют дальнейшие события в сигнальной цепи. Одним из важнейших сенсорных белков в растительной клетке являются Ca2+-зависимые протеинкиназы (СDPK). CDPK играют важную роль в поддержании мембранного потенциала, регуляции углеводного и азотного обмена, устьичных движений и ответа клеток растений на абиотические и биотические стрессы [6]. Известно, что экспрессия генов и активность различных изоформ CDPK могут значительно возрастать в ответ на воздействие абиотических стрессов [7]. Кроме того, некоторые из идентифицированных белков-мишеней CDPK участвуют в защитном ответе клеток растений на абиотический стресс [8].
Особый интерес представляет изучение экспрессии генов CDPK в дикорастущих растениях с высоким уровнем устойчивости к стрессам, поэтому объектом нашего исследования был выбран виноград амурский Vitis amurensis Rupr., произрастающий на Дальнем Востоке России и обладающий высоким адаптивным потенциалом и устойчивостью к неблагоприятным условиям внешней среды. Ранее нами была изучена экспрессия генов CDPK под воздействием таких абиотических стрессовых факторов, как солевой стресс, водный дефицит, осмотический и температурные стрессы в дикорастущем V. amurensis. Согласно полученным данным, экспрессия гена VaCPK13 значительно увеличивалась при холодовом стрессе в растениях V. amurensis [9].
Цель работы . Изучение роли гена VaCPK13 в устойчивости дикорастущего винограда V. amurensis к абиотическим стрессам.
Материалы и методы исследования
Растительный материал и клеточные культуры. Каллусная культура V2 была получена в 2002 году из молодого стебля взрослого дикорастущего растения V. amurensis ( Vitaceae ), которое было собрано на Дальнем Востоке России (юг Приморского края) и определено в отделе ботаники Биолого-почвенного института ДВО РАН.
Для проведения экспериментов на культуре клеток винограда мы использовали W B/A агаризо-ванную питательную среду [10] с добавлением 0.5 мг/л 6-бензиламинопурина (БАП) и 2 мг/л α-нафтилуксусной (АНУ) кислоты, которую разливали в пробирки 150∙16 мм по 8 мл. Интервал субкультивирования составлял 30 дней в темноте при 23 ±1oС.
Получение трансгенных культур клеток винограда V. amurensis, сверхэкспресси-рующих ген VaCPK13, c помощью агробактериальной трансформации . Комплементарная (кДНК) гена VaCPK13 (номер доступа в ГенБанк KC488320) была амплифицирована после выделения РНК из листьев V. amurensis . Для амплификации полноразмерной кодирующей последовательности кДНК VaCPK13 использовали пару праймеров 5'ATG GGG AAC TGT TGC AGA T, 5'TTA CTC ATT CCC CAA GTT TAG. Полученный ОТ-ПЦР продукт VaCPK13 был выделен из геля при помощи набора Cleanup Mini kit (Евроген, Москва, Россия), клонирован в вектор pTZ57R/T согласно протоколу фирмы-производителя (Fermentas, Вильнюс, Литва). Затем, используя пару праймеров 5'GCT C GA GCT C AT GGG GAA CTG TTG CAG AT и 5'TCG A GG TAC C TT ACT CAT TCC CCA AGT TTA G, содержащих в своей последовательности сайты рестрикции для рестриктаз Sac I and Kpn I, мы ам-плифицировали полную последовательность VaCPK13. В качестве матрицы использовали предварительно полученную генетическую конструкцию pTZ57- VaCPK13 . Полученные ПЦР-продукты перенесли по рестрикционным сайтам Sac I and Kpn I в вектор pSAT1. В этой конструкции ген VaCPK13 находится под контролем двойного СаМV 35S промотора. После этого мы перенесли кассету, содержащую VaCPK13 , из вектора pSAT1 в вектор pZP-RCS2-nptII [11], используя сайт рестриктазы Pal AI (СибЭнзим, Новосибирск, Россия). Далее генетическая конструкция pZP-RCS2- VaCPK13-npt II была перенесена в агробактерии Agrobacterium tumefaciens GV3101::pMp90.
Суспензионную культуру клеток винограда V. amurensis V2 трансформировали полученными штаммами агробактерий по методике, описанной ранее [12]. После трансформации каллусы культивировали в течение 3 месяцев в присутствии 250 мг/л цефотаксима для подавления роста агробактерий. Отбор трансгенных клеток проводили на канамицине (Km) в концентрации 10–15 мг/л в течение 3–4 месяцев.
Воздействие абиотических стрессов на культуры клеток V. amurensis. Для анализа воздействия абиотических стрессовых факторов на устойчивость VaCPK13-трансгенных культур клеток мы исследовали влияние пониженной и повышенной температуры на рост трансгенных кле- точных культур (культивирование в течение 30 дней при температурах +16°C и +33°C) и влияние солевого стресса (культивирование в течение 30 дней при +23оС на питательных средах, содержащих NaCl в концентрации 60 и 120 мМ). NaCl добавляли в питательные среды после измерения pH. Также исследовали влияние осмотического стресса на рост трансгенных клеточных культур, сверх-экспрессирующих ген VaCPK13. Для этого эксперимент проводили при температуре +23оС, используя среду WB/A, содержащую маннитол в концентрации 200 и 300 мМ.
Выделение нуклеиновых кислот и получение комплементарной ДНК (кДНК) . Выделение РНК из культур клеток V.amurensis осуществляли на основе CTAB протокола по Bekesiova и др. [13]. кДНК была синтезирована, как описано ранее [12, 14].
Количественная оценка экспрессии гена VaCPK13 . Доказательство экспрессии экзогенного и эндогенного VaCPK13 , а также тотальной экспрессии VaCPK13 проводили с помощью ПЦР в реальном времени (ПЦР РВ). ПЦР РВ для гена был выполнен согласно методике, описанной Giulietti и др. [15]. Тотальную экспрессию гена VaCPK13 анализировали с помощью пары праймеров, подобранных к последовательности киназного домена гена VaCPK13 (табл.1). Эндогенную экспрессию VaCPK13 изучали, используя праймеры, один из которых был комплементарен концу последовательности киназного домена VaCPK13 , а другой к последовательности 3'-нетранскрибируемой области (3'UTR) VaCPK13 . Экспрессию дополнительной вставки гена VaCPK13 определяли, используя пару праймеров, подобранных к концу белок-кодирующей последовательности гена VaCPK13 и к последовательности CaMV 35S терминатора, находящегося в бинарной конструкции pZP-RCS2- npt II- VaCPK13 . Геноспецифичные пары праймеров представлены в таблице 1.
Праймеры для определения суммарной, эндогенной экспрессии и экспрессии трансгена VaCPK13
Таблица 1
кДНК амплифицировали с реактивом EvaGreen (Biotium, Хейвард, США). Для амплификации использовали амплификатор с функцией детекции результатов в реальном времени (ДНК Технология, Москва, Россия). Уровень экспрессии генов был определен по формуле 2-ΔΔCT. Полученное наивысшее значение экспрессии, накопленное отдельным образцом, было принято за единицу относительно количества мРНК. Гены VaActin1 (ГенБанк DQ517935) и VaGAPDH (ГенБанк GU585870) были использованы в качестве внутренних контролей для нормализации количества кДНК в каждой реакции ПЦР РВ. Данные ПЦР РВ были получены из 8 независимых реакций ПЦР РВ [16].
Статистический анализ полученных результатов. Результаты были обработаны при помощи программы Statistica, версия 10.0. Все данные представлены как среднее значение ± стандартная ошибка (СО). Полученные данные проверены по спаренному критерию Стьюдента. Уровень значимости в 0,05 был выбран как минимальное значение статистической разницы во всех экспериментах.
Результаты исследования. Трансгенные по гену VaCPK13 клеточные культуры КА-15-I, КА-15-II, КА-15-III и КА-15-IV были получены в результате независимых трансформаций суспензионной культуры V2 штаммом A. tumefaciens GV3101:pMp90, несущим векторную конструкцию pZP-RCS2- VaCPK13 - npt II. В конструкции ген VaCPK13 находится под контролем CaMV 35S промотора вируса мозаики цветной капусты [11]. Конструкция также несет ген устойчивости к Km ( npt II) под контролем
35S промотора. Сходным способом была получена контрольная клеточная линия КА-0, которая не содержала в конструкции ген VaCPK13 , а содержала только ген npt II .
Селекцию трансгенных клеточных агрегатов проводили в течение 3 месяцев на средах, содержащих 10–15 мг/л Km, и затем отобрали несколько устойчивых к Кm линий. В течение первого месяца трансформации мы отобрали быстрорастущие каллусы из отдельных маленьких агрегатов, которые обладали устойчивостью к Кm, и несколько Km-устойчивых независимых клональных линий KA-0, KA15-I, II, III, IV. Клеточная линия КА-0 идентична родительской клеточной культуре V2 по ростовым и морфологическим признакам. Это свидетельствует о том, что трансформация пустым вектором не вызвала значительных изменений в клеточных культурах. Клеточная линия КА-0 была использована далее как контрольная в ходе экспериментов. Четыре трансгенные клеточные линии KA15-I, II, III, и IV, активно экспрессирующие ген VaCPK13 , были получены в результате четырех независимых трансформаций. Данные ПЦР РВ показали, что трансген VaCPK13 активно экспрессируется во всех полученных клеточных линиях (рис.1, A), а экспрессия эндогенного гена VaCPK13 в трансгенных клеточных линиях КА15 не отличалась значительно от его экспрессии в контрольной клеточной линии КА-0 (рис.1, Б). Уровень тотальной экспрессии гена VaCPK13 увеличился в 1,6–4,8 раза по сравнению с контрольной клеточной линией КА-0 (рис.1, В).
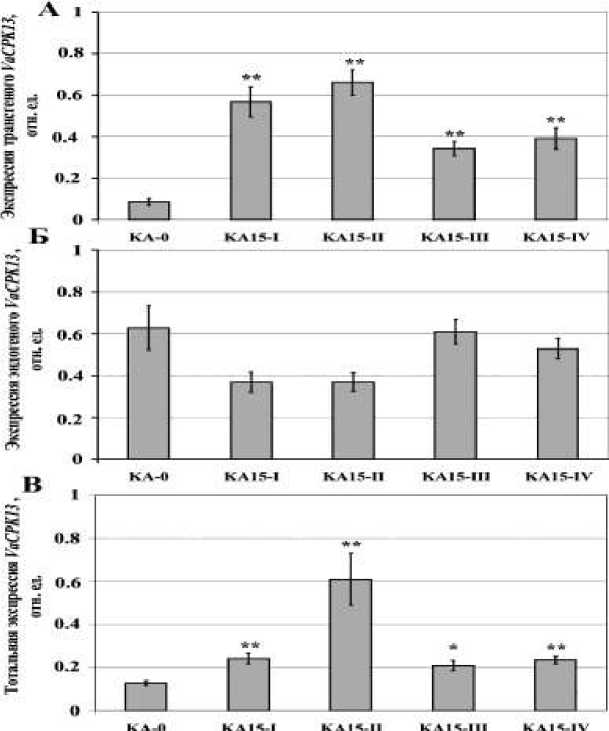
Рис.1. Экспрессия трансгена VaCPK13 (А), эндогенного VaCPK13 (Б), суммарная экспрессия эндогенного и экзогенного VaCPK13 (В) в клеточных линиях V. amurensis: КА-0 – контрольная клеточная культура, содержащая ген nptII (устойчивость к Кm); КА15-I, KA15-II, KA15-III и KA15-IV – трансгенные клеточные линии, сверхэкспрессирующие ген VaCPK13. Данные представлены как среднее значение ± СО; ** P < 0,01; * P < 0,05 по сравнению с уровнем флюоресценции для КА-0
Мы проанализировали эффект солевого, осмотического, теплового и холодового стрессов на рост четырёх VaCPK13- трансгенных клеточных линий V. amurensis . Сверхэкспрессия гена VaCPK13 незначительно увеличила устойчивость одной трансгенной клеточной линии V. amurensis (КА15-III) из четырёх к солевому стрессу (рис. 2, А).
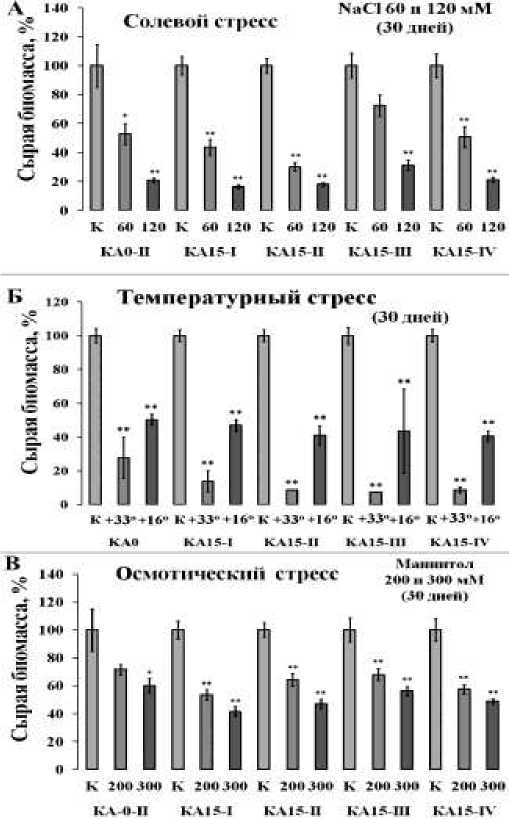
Рис.2. Накопление сырой биомассы клеточными линиями под влиянием солевого стресса, индуцированного 60 и 120 мМ NaCl при культивировании в течение 30 дней (А), теплового (+33о С) и холодового стрессов +16оС при культивировании в течение 30 дней (Б), осмотического стресса, индуцированного маннитолом 200 и 300 мМ в течение 30 дней (В): КА-0 – контрольная клеточная культура, содержащая ген nptII (устойчивость к Кm);
КА15-I, KA15-II, KA15-III и KA15-IV – трансгенные клеточные линии, сверхэкспрессирующие ген VaCPK13. Данные представлены как среднее значение ± СО; ** P < 0,01; * P < 0,05 по сравнению с накоплением биомассы клеточной линией КА-0
Устойчивость проанализированных трансгенных культур клеток к холодовому стрессу не отличалась от устойчивости контрольной клеточной линии КА-0 (рис. 2, Б). Сверхэкспрессия гена VaCPK13 ингибировала рост КА15-II и КА15-III трансгенных клеточных линий при действии теплового стресса (рис. 2, Б). Сверхэкспрессия гена VaCPK13 не вызывала значительных изменений роста клеточных линий при действии маннитола в концентрациях 200 и 300 мМ относительно роста контрольной клеточной линии КА-0 (рис. 2, В).
Заключение. В литературе присутствует информация о функциях и свойствах ближайших гомологов VaCPK13 у других растений (табл. 2). Известно, что ближайший гомолог VaCPK13 из Vitis vinifera, VvCPK10 активируется в период роста и развития растения [17]. Наибольшая экспрессия гена OsCPK3 в рисе наблюдалась в меристематических тканях [18]. Известно, что большое количество мРНК генов OsCPK3 и OsCPK16 образовывалось в каллусной культуре и в метёлках риса [19]. Также известно, что ген OsCPK16 является позитивным регулятором ответа риса на засуху и солевой стресс, а ген OsCPK3 – отрицательным регулятором при солевом воздействии [17]. Стоит отметить, что экспрессия гена PtCDPK14 из Populus trichocarpa увеличивалась при механическом воздействии в листьях и в корневых волосках [20].
Таблица 2
Сравнение выведенных аминокислотных последовательностей VaCPK13 (KC488320) c другими известными CDPK растений
|
Показатель |
I,% |
S,% |
|
VvCPK10 (VIT_08s0105g00390) |
99 |
99 |
|
AtCPK13 (NM115044) |
88 |
94 |
|
OsCPK3 (AP004366) |
80 |
87 |
|
OsCPK16 (AC108503) |
80 |
88 |
|
PtCDPK14 (POPTR_0016s12460) |
91 |
95 |
Примечание. I – аминокислотная идентичность; S – аминокислотная гомология.
В настоящем исследовании показано, что сверхэкспрессия гена VaCPK13 значительно не влияет на устойчивость клеток V. amurensis к солевому, тепловому, холодовому и осмотическому стрессам. Данные показывают, что ген VaCPK13 не является сильным позитивным регулятором ответа V. amurensis на проанализированные абиотические стрессы (холодовой, тепловой, осмотический и солевой стрессы) . Поскольку известно, что экспрессия гена VaCPK13 значительно возрастала при воздействии холодового стресса [14], можно предположить, что ген VaCPK13 не влияет на устойчивость растений напрямую как позитивный регулятор, но может участвовать в ответе винограда на холодовой стресс опосредованно либо в небольшой степени.


