Влияние тестостерон-заместительной терапии на симптомы нижних мочевых путей (СНМП) у мужчин
Автор: Греков Е.А., Казаченко А.В., Калинченко С.Ю.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 1 т.18, 2025 года.
Бесплатный доступ
Введение. В настоящее время существует точка зрения, что симптомы нарушения функции нижних мочевых путей (СНМП) и возрастной дефицит тестостерона (гипогонадизм) у мужчин следует рассматривать как патогенетически взаимосвязанные, ассоциированные с возрастом хронические заболевания, характеризующиеся прогрессирующим течением. Эти состояния могут существенно снижать качество и продолжительность жизни мужчин при отсутствии адекватной медикаментозной коррекции. За последние десятилетия сформировалось новое понимание ключевой роли тестостерона в обеспечении нормального анатомо-функционального состояния нижних мочевых путей у мужчин. Это привело к пересмотру места препаратов тестостерона в терапии СНМП. Цель исследования - изучить клиническую эффективность и простатическую безопасность тестостерон-заместительной терапии (ТЗТ) у мужчин с дефицитом тестостерона (гипогонадизмом) и СНМП. Материал и методы. Представлены результаты обследования и лечения 45 мужчин 40-70 лет (средний возраст 56,3±3,2 лет) с дефицитом тестостерона (гипогонадизмом) и СНМП (основная группа) и результаты обследования 30 здоровых мужчин аналогичного возраста (контрольная группа). Всем мужчинам проводилось анкетирование по опросникам IPSS-QL (International Prostate Symptom Score - Суммарная оценка симптомов заболеваний простаты - индекс качества жизни) и AMS (Aging Male Screening - опросник возрастных симптомов мужчины); лабораторное определение в крови уровней общего ПСА, общего тестостерона, глобулина, связывающего половые гормоны (ГСПС), расчет уровня свободного тестостерона по номограмме Вермюллена; урофлоуметрия с определением объема мочеиспускания (Voided volume - VV) и максимальной объемной скорости мочеиспускания (Qmax); ультразвуковое исследование с определением объема предстательной железы и остаточной мочи с последующей статистической обработкой результатов по стандартным методикам.
Тестостерон, дефицит тестостерона (гипогонадизм), симптомы нижних мочевых путей (снмп), тестостерон-заместительная терапия (тзт), эффективность, безопасность
Короткий адрес: https://sciup.org/142245472
IDR: 142245472 | DOI: 10.29188/2222-8543-2025-18-1-50-59
Текст научной статьи Влияние тестостерон-заместительной терапии на симптомы нижних мочевых путей (СНМП) у мужчин
экспериментальная и клиническая урология № 1 2025
В настоящее время существует распространенная и небезосновательная точка зрения, что симптомы нижних мочевых путей (СНМП) и возрастной дефицит тестостерона (гипогонадизм) у мужчин следует рассматривать патогенетически связанными между собой возраст-ассоциированными заболеваниями с хроническим прогрессирующим течением, которые без соответствующей медикаментозной коррекции резко снижают качество и продолжительность жизни мужчин [1-5]. По мере старения у большинства мужчин уровень тестостерона постепенно снижается, а частота и выраженность СНМП при этом с возрастом увеличивается, таким образом, дефицит тестостерона (гипогонадизм) может быть вовлечен в патогенез СНМП у мужчин [6, 7]
Новое понимание важной роли тестостерона в обеспечении нормального анатомо-функционального состояния нижних мочевых путей у мужчин,сформи-ровавшееся в последние десятилетия,привело к переоценке места препаратов тестостерона в терапии СНМП [8-10].
В 2008 году появились первые работы, демонстрирующие положительные эффекты тестосте-рон-заместительной терапии (ТЗТ) на СНМП. В работе S. Kalinchenko и соавт. оценивали результаты терапии препаратами тестостерона 30 мужчин с СНМП и гипогонадизмом (средний возраст 51 год), разделив их на 2 группы лечения (10 – гелем тестостерона и 20 – тестостерона ундеканоатом). Через 26 недель терапии авторы отметили существенные улучшения баллов по опроснику IPSS (International Prostate Symptom Score – Суммарная оценка симптомов заболеваний простаты в баллах) в обеих группах [11].
-
S. Karazindiyanoğlu и соавт. опубликовали данные своего исследования, включив в него 25 мужчин (возраст 38-73 года) с СНМП на фоне возрастного гипогонадизма [12]. Все пациенты получали ТЗТ в виде трансдермального геля тестостерона по 50-100 мг/сутки ежедневно в течение 1 года. По окончании курса терапии существенно уменьшилась выраженность симптоматики дефицита тестостерона по шкале AMS (Aging Male Screening – опросник возрастных симптомов мужчины) ( p =0,001), достоверно увеличилась максимальная емкость мочевого пузыря ( p =0,007), а среднее детрузорное давление достоверно уменьшилось ( р =0,017). Данное исследование продемонстрировало способность ТЗТ не только улучшать клиническую симптоматику дефицита тестостерона, но и оказывать позитивное влияние на уродинамику нижних мочевых путей,способствуя уменьшению клинических проявлений СНМП у мужчин [13].
-
А. Haider и соавт. провели исследование, в котором участвовали мужчины с гипогонадизмом (средний возраст – 59,5 лет), где отметили существенное уменьшение баллов по шкале IPSS и объема остаточной мочи после 9 месяцев лечения тестостерона ундеканоатом [13].
В исследовании японских авторов приняла участие группа из 21 гипогонадного пациента с СНМП, получавшая в течение 3 месяцев ТЗТ. По окончании лечения общий суммарный балл по шкале IPSS-QL достоверно не отличался от исходного,на основании чего авторы сделали выводы, что короткие курсы ТЗТ могут оказаться неэффективными у пациентов с СНМП на фоне гипогонадизма [14].
Несмотря на это, Т. Amano и соавт. смогли доказать высокую эффективность препаратов тестостерона в терапии СНМП у мужчин. В их исследовании 41 пациент с СНМП и гипогонадизмом получал и ТЗТ (6 мг/сутки геля тестостерона) в течение 3 месяцев. По окончании терапии было отмечено достоверное улучшение четырех параметров шкалы AMS, всех параметров шкалы IPSS-QL, а также позитивные изменения по шкалам МИЭФ-5 (Международный Индекс Эректильной Функции) и SF-36 (The Short Form-36 – Оценка общего состояния здоровья). При этом симптомы опорожнения улучшались более выраженно по сравнению с симптомами наполнения мочевого пузыря [15].
Аналогичные положительные результаты получили K. Shigehara и соавт., в исследовании которых 52 гипогонадных пациента с СНМП получали по 250 мг тестостерона энантата 1 раз в 4 недели на протяжении года. На фоне терапии отмечена достоверная положительная динамика симптоматики по шкале IPSS-QL по сравнению с исходной и группой контроля ( p <0,05) Основная группа также продемонстрировала увеличение максимальной объемной скорости мочеиспускания (Qmax) и объема мочеиспускания (Voided volume – VV) ( p <0,05), чего не наблюдалось в группе интактного контроля. Объем остаточной мочи достоверно не изменился в обеих группах [16].
В исследование Y.H. Ko и соавт. вошло 246 гипо-гонадных мужчин с СНМП,которые получали инъекции тестостерона ундеканоата в дозе 100 мг в течение 1 года, при этом 17 пациентов имели тяжелые СНМП (Qmax<10 мл/с), являющиеся в настоящее время относительным противопоказанием к ТЗТ [18]. Тем не менее, пациенты, получавшие ТЗТ, после года ее применения показали лучшие результаты,чем пациенты, ее не получавшие, а в течение всего курса ТЗТ не было зафиксировано ни одного случая острой задержки мочеиспускания (ОЗМ) и не возникло ни одного показания к хирургическому лечению. Авторы исследования сделали вывод не только о высокой эффективности ТЗТ в отношении симптомов накопления и опорожнения у мужчин с СНМП, но и ее высокой безопасности, так как в течение всего периода ТЗТ не отмечалось повышения уровня простат-специфического антигена (ПСА) крови [17].
Доступные зарубежные литературные данные последних лет свидетельствуют о патогенетической обоснованности, целесообразности и относительной безопасности назначения ТЗТ пациентам с СНМП/ноктурией при выявлении у них дефицита тестостерона (гипогонадизма) [18-23].
В отечественной литературе отмечается явный дефицит публикаций по данной тематике, что и послужило поводом для проведения настоящего исследования.
Цель исследования – изучить клиническую эффективность и простатическую безопасность тестостерон-заместительной терапии у мужчин с дефицитом тестостерона (гипогонадизмом) и симптомами нижних мочевых путей.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 45 гипогонадных мужчин с симптомами нижних мочевых путей (СНМП) в возрасте 40-70 лет (средний возраст 56,3±3,2 лет) (основная группа) и 30 здоровых мужчин аналогичного возраста (средний возраст 54,4±4,9 года), составивших контрольную группу. Все мужчины основной и контрольной групп были информированы о целях и задачах исследования, и каждый из них заполнил информированное согласие об участии в данном исследовании и использовании его результатов в научных целях.
Критерии включения в исследование:
-
• возраст старше 40 лет;
-
• наличие клинико-лабораторных критериев дефицита тестостерона (гипогонадизма);
-
• клинические СНМП легкой и средней степени выраженности, которые подлежат консервативной терапии (суммарный балл по шкале IPSS <19);
-
• объем остаточной мочи <150 мл;
-
• отсутствие в анамнезе перенесенных операций на нижних мочевых путях, а также травм тазовой области и промежности;
-
• отсутствие в анамнезе ОЗМ, в том числе, однократной и/или купированной медикаментозными средствами.
Критерии исключения из исследования:
-
• непереносимость препаратов экзогенного тестостерона;
-
• тяжелые СНМП (суммарный балл по шкале IPSS >20), являющиеся показанием к хирургическому лечению;
-
• наличие «средней доли» предстательной железы;
-
• осложненные СНМП (гематурия, камни мочевого пузыря, стриктура уретры, почечная недостаточ-ность,рецидивирующая инфекция мочевой системы, дивертикулы мочевого пузыря и др.), требующие дополнительного обследования и лечения;
-
• клиническая картина неврологического заболевания или нейропатии любого генеза;
-
• наличие сахарного диабета;
-
• проводившаяся ранее (6 и менее месяцев назад), терапия по поводу СНМП,не принесшая положительных результатов;
-
• прием медикаментов,способных воздействовать на мочевой пузырь и/или предстательную железу (6 и менее месяцев назад) до начала исследования;
-
• прием препаратов тестостерона в течение не менее 6 месяцев до начала исследования;
-
• имеющийся или подозреваемый рак предстательной железы (уровень ПСА>4 нг/мл) или грудных желез.
Для уточнения характера СНМП и их влияния на качество жизни применялся валидный международный опросник IPSS-QL [24], для выявления клинических симптомов дефицита тестостерона использовали валидный международный опросник AMS [25].
После анкетирования выполнялось полное физикальное и урологическое обследование мужчин обеих групп, включая проведение пальцевого ректального исследования (ПРИ) по общепринятым методикам. Всем пациентам основной группы и здоровым мужчинам контрольной группы выполнялось гормональное исследование для оценки их андрогенного статуса (общий тестостерон, глобулин, связывающий половые гормоны (ГСПС), свободный тестостерон). Уровень общего тестостерона (Т общ ) в крови, полученной из кубитальной вены с 7:00 до 10:00 часов утра, определяли методом хроматографической масс-спектрометрии, за нижнюю границу нормального референтного значения его уровня принимали показатель не менее 12,1 нмоль/л [26]. Уровень ГСПС в крови (норма 12,9-71,2 нмоль/л) определяли на автоматическом хемилюминесцентном анализаторе «Autodelfia» (фирмы Wallac (Финляндия). Уровень свободного тестостерона (Т своб. ) рассчитывали у пациентов с погранично-низким уровнем общего тестостерона крови (8,0-12,1 нмоль/л) по номограмме Вермюллена [27]. В качестве нормальных значений принимали показатель Т своб. >243 пкмоль/л [26].
Диагноз «Дефицит тестостерона (гипогонадизм)» устанавливался на основании выявления его клинических симптомов по шкале AMS (суммарный балл>27) с двукратным подтверждением лабораторно снижения уровня общего и/или свободного тестостерона в крови [26].
Для объективной оценки суммарной функции опорожнения мочевого пузыря проводили двукратную урофлоуметрию на установке Flowmapper FM-100 (Lund Instruments, Швеция) с определением основных параметров мочеиспускания – объема мочеиспускания (VV, мл) и Qmax (мл/с), за норму которой принимали показатель>15 мл/с [28].
Всем пациентам выполнялось трансректальное ультразвуковое исследование (ТРУЗИ) предстательной железы и мочевого пузыря ректальным биплановым датчиком частотой 5,5-7 МГц (ультразвуковой аппарат «Ultramark-9») на ультразвуковом комплексе Logiq 500 proseries. Объем предстательной железы (см3) рассчитывали в автоматическом режиме по формуле Terris-Stamey (V=а*b*с*0,52, где a, b, c – толщина, длина и ширина предстательной железы (см) соответственно). В ходе стандартного протокола ТРУЗИ при естественном наполнении мочевого пузыря определялся размер предстательной железы,оценивались ее структура и макроскопические особенности,а после естественного мочеиспускания трансабдоминальным датчиком определяли объем остаточной мочи (R, мл) [29].
Для исключения рака предстательной железы всем больным выполнялось определение в крови уровня общего ПСА при помощи гетерогенного двухступенчатого иммуноферментного анализа с помощью стандартных наборов Enzymun-Test ПСА фирмы «Boehringer Mannheim» (Германия). Во избежание ложноположительного результата определение уровня ПСА крови проводили до начала всех диагностических манипуляций на предстательной железе. За норму общего ПСА принимали показатель в крови <4 нг/мл [27].
Все гипогонадные мужчины с СНМП в основной группе (n=45) для коррекции дефицита тестостерона (гипогонадизма) получали ТЗТ препаратом тестостерона ундеканоата пролонгированного действия по 4,0 мл внутримышечно по схеме: вторая инъекция препарата выполнялась через 6 недель после первой инъекции для создания депо тестостерона, третья и последующие инъекции выполнялись в индивидуальном режиме в зависимости от клинико-лабораторной динамики с интервалом 8-12 недель. Выбор препарата тестостерона осуществлялся на основании принятия согласованного и обоснованного решения лечащим врачом и информированным пациентом. Общая длительность ТЗТ составила 12 месяцев. Контрольные исследования выполнялись всем пациентам основной группы и здоровым мужчинам контрольной группы через 3, 6 и 12 месяцев, при этом показатели контрольной группы принимали за условную норму.
Полученные в ходе обследования результаты обрабатывали на IBM-PC с помощью систем EXCELL, XP SP2 на базе стандартной программы Statistica for Window v.6.0. Для оценки межгрупповых различий значений признаков,имеющих непрерывное распределение, применяется t-критерий Стьюдента. Анализ зависимости между количественными признаками в исследовании проводили с помощью коэффициента корреляции (r–критерий Пирсона). Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых межгрупповых различий или факторных влияний) принимали равным 0,05 [30].
РЕЗУЛЬТАТЫ
ТЗТ в течение 12 месяцев сопровождалась положительной лабораторной динамикой показателей общего и свободного тестостерона на фоне недостоверного снижения уровня ГСПС у всех пациентов основной группы, которые через 6 месяцев лечения приближались к аналогичным показателя здоровых мужчин контрольной группы, а к 12 месяцу ТЗТ статистически не отличались от них (р>0,05). Отмечено статистически достоверное увеличение уровня общего и свободного тестостерона по сравнению с исходными данными (табл. 1).
На фоне нормализации показателей андрогенного статуса у мужчин основной группы отмечалась одновременная положительная динамика со стороны СНМП (табл. 2).
Таблица 1. Динамика показателей андрогенного статуса у мужчин контрольной и основной групп в течение 12 месяцев ТЗТ
Table 1. Dynamics of androgen status indicators in men of the control and main groups during 12 months of TRT
|
Показатель Indicator |
Контрольная группа (n=30) Control group (n=30) |
Основная группа (n=45) Main group (n=45) |
|||
|
До ТЗТ Before TRT |
Через 3 месяца ТЗТ After 3 month TRT |
Через 6 месяцев ТЗТ After 3 month TRT |
Через 12 месяцев ТЗТ After 3 month TRT |
||
|
Общий тестостерон крови (Тобщ), нмоль/л Total blood testosterone (Ttot), nmol/l |
18,6±1,5 |
9,2±2,4* |
13,6±2,3* |
15,6±3,6 |
19,6±0,8** |
|
ГСПС, нмоль/л SHBG, nmol/l |
45,3±8,5 |
53,3±8,5 |
51,4±4,5 |
51,3±8,5 |
50,9±6,5 |
|
Свободный тестостерон (Тсвоб.), пкмоль/л Free testosterone (Tf), pmol/l |
386,2±21,4 |
261,0±21,4* |
323,2±11,8* |
355±18,4 |
373,2±15,8** |
*– различия статистически достоверны при сравнении с показателями контрольной группы ( р <0,05)
** – различия статистически достоверны при сравнении с показателями до ТЗТ ( р <0,05)
* – differences are statistically significant when compared with the control group indicators ( p <0,05)
** – differences are statistically significant when compared with the indicators before TRT ( p <0,05)
Таблица 2. Динамика показателей мочеиспускания и параметров предстательной железы у гипогонадных пациентов с СНМП на фоне ТЗТ
Table 2. Dynamics of urination parameters and prostate parameters in hypogonadal patients with LUTS on the background of TRT
|
Параметры Parameters |
Контрольная группа (n=30) Control group (n=30) |
Основная группа (n=45) Main group (n=45) |
||||
|
До ТЗТ Before TRT |
Через 3 месяца ТЗТ After 3 month TRT |
Через 6 месяцев ТЗТ After 3 month TRT |
Через 12 месяцев ТЗТ After 3 month TRT |
|||
|
IPSS, балл, (прирост) IPSS, points (growth) |
4,9±0,2 |
14,5±1,8* |
12,1±0,8 (-16,5%) |
10,7±0,2*,** (-26,2%) |
8,5±0,6*,** |
(-41,3%) |
|
QоL, балл, (прирост) Quality of life index (QoL), points, growth |
2,3±0,3 |
3,9±1,2* |
3,4±0,4 (-12,8%) |
2,2±0,3** (-43,6%) |
2,0±0,4** |
(-48,7%) |
|
Qmax, мл/с, (прирост) Maximal urinary flow rate (Qmax), ml/s, (growth) |
14,6±0,6 |
9,2±0,1* |
10,1±0,4* (+9,7%) |
10,9±0,7* (+18,5%) |
12,2±0,4*,** (+32,6%) |
|
|
Oбъем мочеиспускания (VV), мл, (прирост) Voided volume (VV), ml, (growth) |
235,3±16,2 |
182,8±12,2* |
200,2±4,2 (+9,5%) |
211,4±7,1* (+15,6%) |
229,3±7,6** |
(+25,4%) |
|
Объем предстательной железы, см3, (прирост) Prostate volume, cm3, (growth) |
26,7±4,7 |
46,6±2,5* |
45,9±1,5 (-1,5%) |
44,7±1,3* (-4,0%) |
39,3±0,8* ( |
-15,6%) |
|
Объем остаточной мочи, мл, (прирост) Residual urine volume, ml, (growth) |
15,3±6,6 |
56,9±16,7* |
49,5±4,5 (-13,0%) |
47,8±2,2*,** (-16,0%) |
38,6±1,1*,** |
(-32,2%) |
|
Уровень общего ПСА, нг/мл, (прирост) Total PSA, ng/ml, (growth) |
2,1±0,6 |
2,7±0,4 |
2,8±0,2 (+3,70%) |
2 ,8±0,3 (+3,7%) |
2,9±0,5 (+7,4%) |
|
*– различия статистически достоверны при сравнении с показателями контрольной группы ( р <0,05)
** – различия статистически достоверны при сравнении с показателями до ТЗТ ( р <0,05)
* – differences are statistically significant when compared with the control group indicators ( p <0,05)
** – differences are statistically significant when compared with the indicators before TRT ( p <0,05)
Статистически недостоверные позитивные изменения со стороны СНМП и морфофункциональных параметров предстательной железы и мочевого пузыря у гипогонадных мужчин при адекватном восполнении у них дефицита тестостерона начинали развиваться через 3 месяца ТЗТ, при этом средний уровень Т общ . у них еще не достигал показателей группы здорового контроля. Только начиная с 6 месяца ТЗТ и далее до 12 месяца лечения у больных основной группы отмечалось достоверное прогрессивное улучшение большинства изучаемых параметров,совпав-шее по времени с лабораторной нормализацией андрогенного статуса у них до уровня контрольной группы здоровых мужчин <0,1.
Обращала на себя внимание определенная последовательность нормализации характеристик СНМП в ходе ТЗТ, в частности, их субъективные параметры (оценка симптомов и качества жизни по шкале IPSS-QL)несколько «отставали» в своей положительной достоверной (в сравнении с исходной) динамике от объективных параметров СНМП, оцениваемых с помощью применявшихся инструментальных методов исследования. Так, на фоне ТЗТ уже через 3 месяца выявлялось достоверное увеличение Qmax на 9,7% от исходного значения (р<0,05), хотя при этом субъективная симптоматика по шкале IPSS-QL, несмотря на свой регресс на 16,5% от исходного, уменьшилась по сравнению с исходной недостоверно (р>0,05 ). И только начиная с 6 месяца ТЗТ и вплоть до ее окончания на фоне улучшения субъективной оценки восприятия СНМП пациентами по опроснику у них начинали выявляться достоверные положительные объективные изменения морфофункционального состояния предстательной железы и мочевого пузыря: через 6 и 12 месяцев имело место достоверное увеличение Qmax на фоне ТЗТ на 18,5% и 32,6% от исходного, соответственно (р<0,05 ), и на фоне достоверного уменьшения объема остаточной мочи на 15,9% и 32,2% от исходного, соответственно (р<0,05), что рассматривалось как результат улучшения сократительной способности детрузора в условиях нормализации андрогенного статуса пациентов. Кроме того, через 6 и 12 месяцев ТЗТ средний объем предстательной железы уменьшился на 4,0% и 15,6% (р<0,05) от исходного до лечения,что мы связываем с ликвида- цией застойных явлений (простатостаза) вследствие улучшения метаболизма в предстательной железе и повышения сексуальной активности пациентов на фоне ТЗТ.
Одним из наиболее тяжелых СНМП, согласно общепринятой точке зрения,является ноктурия,кото-рая в настоящем исследовании исходно была выявлена у 30/45 (66,7%) гипогонадных мужчин с СНМП,а к моменту окончания курса ТЗТ – только у 15/45, т.е. у 33,3% пациентов (табл. 3).
Таким образом, по полученным нами данным, при проведении ТЗТ в течение 12 месяцев средняя частота ноктурии у гипогонадных пациентов с СНМП достоверно уменьшалась с 66,7% до 33,3%, т.е., практически в 2 раза ( р <0,05). При этом наиболее выраженный положительный эффект длительной ТЗТ отмечался у пациентов с наиболее тяжелой формой ноктурии (многократной ноктурией), частота которой достоверно снизилась с 24,4% до 6,6%, т.е., практически в 4 раза ( р <0,05), в то время, как частота однократной ноктурии уменьшилась с 42,2 % до 26,7%, т.е., примерно только в 1,6 раза ( р <0,05). Достоверных корреляций между частотой ноктурии и объемом предстательной железы нами не выявлено, однако, установлена достоверная отрицательная связь между уровнем свободного тестостерона и частотой нокту-рии (n=45; r=–0,302; р <0,001), что позволяет рассматривать низкий уровень свободного тестостерона крови как новый потенциальный маркер развития ноктурии у мужчин ( р <0,05).
Проводимая в течение 12 месяцев ТЗТ продемон-стировала высокую простатическую безопасность: годовой прирост уровня общего ПСА на ее фоне составил к концу лечения не более +7% от исходного уровня, что можно рассматривать как следствие ТЗТ, но ни в одном случае не зафиксировано превышение абсолютного уровня общего ПСА крови выше общепринятого референтного значения нормы (4 нг/мл) ( р >0,05).
Следует обязательно отметить,что,кроме описанной выше положительной динамики со стороны СНПМ и морфофункциональных параметров предстательной железы и мочевого пузыря, ожидаемым сопутствующим положительным моментом ТЗТ явилась ликвидация клинических симптомов дефицита тесто-
Таблица 3. Динамика ноктурии у гипогонадных пациентов с СНМП на фоне ТЗТ
Table 3. Dynamics of nocturia in hypogonadal patients with LUTS on the background of TRT
До лечения (n=45)
Before TRT (n=45)
Через 12 месяцев ТЗТ (n=45) After 12 months TRT (n=45)
Однократная ноктурия, n (%) Single nocturia, n (%)
Многократная ноктурия n (%) Multiple nocturia n (%)
Однократная ноктурия, n (%) Single nocturia, n (%)
Многократная ноктурия n (%) Multiple nocturia n (%)
19 (42,2%)
11 (24,4%)
12 (26,7%)
3 (6,6%)
*– различия статистически достоверны при сравнении показателей между собой до лечения и через 12 месяцев ТЗТ ( р <0,05)
** – differences are statistically significant when comparing the indicators before treatment and after 12 months of TRT ( p <0,05)
стерона (гипогонадизма) у всех гипогонадных мужчин с СНМП, наступившая в среднем через 6-12 месяцев ТЗТ с улучшением целого ряда тестостерон-зависимых экстрауринарных показателей здоровья (табл. 4).
ОБСУЖДЕНИЕ
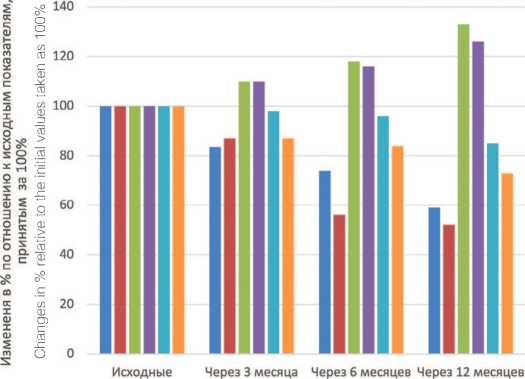
Полученные результаты исследования позволяют утверждать,что при адекватном индивидуальном режиме компенсации дефицита тестостерона (гипогонадизма) у мужчин с СНМП уже в течение первых 3 месяцев ТЗТ недостоверно улучшались субъективные и объективные параметры функционирования нижних мочевых путей.В это же время уже отмечалось увеличение Qmax (на 9,7% от исходного) и объема мочеиспускания (на 9,5% от исходного) на фоне снижения объема предстательной железы (на 1,5% от исходного) и объема остаточной мочи (на 13,0% от исходного) ( р <0,05). По мере продолжения ТЗТ каждый из указанных параметров улучшался по-разному, но в целом положительное влияние ТЗТ на морфофункциональное состояние предстательной железы и мочевого пузыря достоверно усиливалось,на-чиная с 6 месяца и далее вплоть до времени окончания ТЗТ у всех мужчин ( р <0,05) (рис. 1).
Полученные результаты обосновывают необходимость проведения ТЗТ для купирования СНМП у гипогонадных мужчин длительное время – не менее
показатели ТЗТ ТЗТ ТЗТ
Baseline After 3 months After 6 months After 12 months of TRT of TRT of TRT
-
■ Суммарный балл IPSS
Total IPSS score
-
■ Индекс качества жизни QL
Quality of life index QL
-
■ Qmax
-
■ Эффективный объем мочеиспускания
Effective voiding volume
-
■ Объем предстательной железы
Prostate volume
-
■ Объем остаточной мочи
Residual urine
Рис. 1. Динамика СНМП и морфофункциональных параметров мочевого пузыря и предстательной железы в ходе 12-месячного курса ТЗТ у гипогонадных мужчин Fig. 1. Dynamics of LUTS and morpho-functional parameters of the bladder and prostate during a 12-month course of TRT in hypogonadal men
Таблица 4. Сопутствующие (экстрауринарные) позитивные эффекты ТЗТ у гипогонадных мужчин с СНМП
Table 4. Concomitant (extraurinary) positive effects of TRT in hypogonadal men with LUTS
|
Наблюдаемый клинический эффект Observed clinical effect |
Число больных, n (%) Number of patients, n (%) |
|
Улучшение общего самочувствия Improvement of general well-being |
42 (93,3) |
|
Повышение жизненной энергии Increase in vital energy |
40 (88,9) |
|
Снижение утомляемости Reduction in fatigue |
41 (91,1) |
|
Стабилизация настроения Mood stabilization |
38 (84,4) |
|
Улучшение памяти Improvement in memory |
24 (53,3) |
|
Улучшение сна Improvement in sleep |
25 (55,5) |
|
Повышение либидо Increase in libido |
27 (60,0) |
|
Повышение частоты половых актов Increase in frequency of sexual intercourse |
32 (71,1) |
|
Уменьшение депрессии и тревожности Reduction in depression and anxiety |
23 (51,1) |
3 месяцев, а лучше не менее 6-12 месяцев при наличии такой возможности.
Исследование также показало,что ТЗТ у гипого-надных мужчин с СНМП достоверно уменьшает выраженность (частоту)ноктурии независимо от объема предстательной железы,поскольку достоверных корреляций между частотой ноктурии и объемом предстательной железы нами не выявлено. Однако, выявленная достоверная отрицательная связь между уровнем свободного тестостерона и частотой ноктурии (n=45; r=–0,302; р <0,001) позволяет, с одной стороны, утверждать, что дефицит тестостерона (гипогонадизм) является важным механизмом в мультифакторном патогенезе СНМП у мужчин, и рассматривать уровень свободного тестостерона крови как новый потенциальный предиктор развития ноктурии у мужчин ( р <0,05), а с другой стороны, трактовать ноктурию как потенциальный симптом дефицита тестостерона (гипогонадизма) с самостоятельным клиническим значением ( р <0,05).
ТЗТ у гипогонадных мужчин с СНМП в течение 12 месяцев продемонстрировала высокий уровень простатической безопасности, достоверно не влияя на уровень общего ПСА крови,который весь период терапии находился в пределах общепринятых референсных значений.
Существенный вклад в ликвидацию СНМП и улучшение общего состояния пациентов,безусловно, был привнесен еще за счет того,что на фоне ТЗТ не только улучшалось анатомо-функциональное состояние нижних мочевых путей,но,прежде всего,ликви-дировались важные экстрауринарные симптомы дефицита тестостерона у мужчин, что проявлялось улучшением общего самочувствия, снижением утомляемости, стабилизацией настроения, улучшением сна и повышением сексуальной активности, снижением частоты тревожно-депрессивных проявлений, что позволяло говорить о комплексном положительном влиянии ТЗТ на весь организм мужчины.
Несмотря на то, что имеющиеся литературные данные о влиянии ТЗТ на СНМП/ноктурию у гипого-надных мужчин достаточно неоднородные,а иногда и противоречивые,проведенное нами исследование продемонстрировало высокую фармакотерапевтическую эффективность и простатическую безопасность коррекции дефицита тестостерона (гипогонадизма)у данной категории пациентов независимо от объема предстательной железы.Это позволяет утверждать, что дефицит тестостерона (гипогонадизм)вносит существенный негативный вклад в патогенез нарушений функции нижних мочевых путей,поэтому его раннее выявление и соответствующая коррекция должна рассматриваться как важная лечебно-диагностическая опция в современной тактике ведения таких пациентов. К сожалению, до сих пор в имеющихся клинических рекомендациях урологических научных сообществ разного уровня не регламентированы диагностические и лечебные мероприятия у мужчин с СНМП/ноктурией в зависимости от их андрогенного статуса, но мы надеемся, что это очень скоро произойдет, поскольку к настоящему времени накоплен значительный объем доказательных данных о позитивном влиянии ТЗТ на СНМП/нокутрию у мужчин, игнорировать который уже не представляется возможным. По нашему мнению,соответствующий пересмотр клинических рекомендаций по ведению мужчин с ненейрогенными СНМП уже давно назрел,поскольку только комплексный и междисциплинарный подход к данной проблеме может способствовать ее эффективному патогенетическому решению.
Несмотря на отсутствие на данный момент результатов крупных рандомизированных контролируемых исследований по оценке эффективности препаратов тестостерона при лечении СНМП у мужчин,эти препараты уже зарекомендовали себя как эффективные и безопасные при лечении целого ряда урологических и соматических заболеваний у мужчин. Очевид-но,что уровень доказательной базы для этих препаратов при СНМП/ноктурии будет довольно быстро накапливаться в ближайшие годы,что связано с повышенным интересом к данной проблеме, однако, даже имеющиеся данные позволяют дать этим уникальным препаратам высокую оценку и ожидать от них фарма-котерапевтического прорыва в фармакотерапии СНМП/ноктурии у гипогонадных мужчин, частота которых неуклонно прогрессирует с возрастом и которые вкупе с возрастным гипогонадизмом, на фоне которого они развиваются,оказывают выраженное негативное влияние на качество и продолжительность жизни мужчин.
ЗАКЛЮЧЕНИЕ
Дефицит тестостерона (гипогонадизм)у мужчин находится в тесной патогенетической связи с СНМП/ноктурией,а ТЗТ способна эффективно и безопасно уменьшить их выраженность при условии проведения достаточно длительных курсов (не менее 3 месяцев).
ЛНТЕРАТУРА/REFERENOES
1. Traish AM, Johansen V. Impact of Testosterone Deficiency and Testosterone World J Mens Health 2018;36(3):199-222.
Therapy on Lower Urinary Tract Symptoms in Men with Metabolic Syndrome. 2. Дедов И.И., Калинченко С.Ю. Возрастной андрогенный дефицит у муж-
HTmiyPA/REFEREmS чин. М.: Практическая медицина 2006; 240 с. [Dedov I.I., Kalinchenko S.Yu. Age-related androgen deficiency in men. Moscow: Practical Medicine 2006; 240 р. (In Russian)].
Сведения об авторах:
Казаченко А.В. – д.м.н., заместитель директора по лечебной работе НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиала ФГБУ «НМИЦ радиологии» Минздрава России, профессор кафедры урологии и оперативной нефрологии с курсом онкоурологии ФГАОУ ВО «Российский университет дружбы народов»; Москва, Россия; РИНЦ Author ID 334714,
Вклад авторов:
Греков Е.А. – обзор публикаций по теме статьи, обработка материалов, написание текста статьи, 50%
Казаченко А.В. – концепция и дизайн исследования, научное редактирование, 25% Калинченко С.Ю. – концепция и дизайн исследования, научное редактирование, 25%
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Исследование проведено без финансовой поддержки.


