Влияние тетрациклинов на патологию митоза в клетках образовательной ткани корней Allium cepa L.
Автор: Концевая Ирина Ильинична, Минина Анастасия Викторовна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 2 т.8, 2022 года.
Бесплатный доступ
Исследуется влияние тетрациклинов (тетрациклина и доксициклина) на повреждения генетического аппарата в клетках корневой меристемы Allium cepa L. в первой метафазе после обработки и после завершения восстановительного периода. Методы исследования : Allium тест, цитогенетический анализ, статистический анализ. Опыт был выполнен на партии луковиц лука обыкновенного (сорт Штуттгартен), которая по итогам микроядерного теста характеризовалась как генетически нестабильный материал. Установлено, что реакция тестируемого материала на действие тетрациклинов зависит от концентрации и длительности действия антибиотиков. В делящихся клетках преобладали аберрации анеугенного типа, такие как к-митоз, слипание хромосом, вплоть до образования комков. Для данного генотипа после восстановительного периода установлено возрастание доли ПМ (слипание хромосом, множественные мосты), исходом которых является пикноз ядер и гибель клеток. Выявлено, что после восстановительного периода при действии тетрациклина в концентрации 20,0 мг/л при экспозиции 24 и 48 часов существенно возрастала доля клеток с к-митозом. Отмечено негативное действие тетрациклина в концентрации 100,0 мг/л, значение ПМ достигало 64,2%; после восстановительного периода уменьшение доли клеток с ПМ не отмечено. В обоих вариантах доминировали клетки с к-митозом и слипанием хромосом. Эффект доксициклина при тестируемых концентрациях (20,0 и 100,0 мг/л) вызывал увеличение значений ПМ более чем в 2 раза по сравнению с контролем. После восстановительного периода независимо от опытной концентрации доксициклина число клеток с ПМ возрастало за счет увеличения числа клеток с к-митозом и слипанием хромосом. Следует указать на разную реакцию меристематических клеток корешков лука при действии структурных изомеров, каковыми являются тетрациклин и доксициклин. Необходимо учитывать, что повышение концентрации антибиотиков бактериостатического действия (тетрациклина, доксициклина), с одной стороны, необходимо для максимальной инактивации бактерий, с другой стороны, в клетках эукариотических организмов возрастают негативные процессы при прохождении клеточного цикла, в частности митоза.
Allium тест, тетрациклины, патология митоза
Короткий адрес: https://sciup.org/14123350
IDR: 14123350 | УДК: 577.182.24:577.182.26 | DOI: 10.33619/2414-2948/75/03
Текст научной статьи Влияние тетрациклинов на патологию митоза в клетках образовательной ткани корней Allium cepa L.
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 577.182.24:577.182.26
Порой бесконтрольное применение антибиотиков на практике переводит в ранг актуальности вопрос об изучении влияния побочных воздействий антибиотиков, оказываемых на эукариотический организм. В частности, побочные эффекты тетрациклинов связаны с неизбирательностью действия антибиотиков на синтез белка как в клетках микро-, так и макроорганизмов [1].
В настоящее время существует ряд современных молекулярно-биологических тестов, но из-за высокой технологической сложности и стоимости их применение ограничено. Наблюдения за особенностями корневой системы лука обыкновенного ( Allium cepa L.) показали, что это растение может быть использовано как тест-система для обнаружения потенциально генотоксичных соединений [2]. В качестве показателей цито- и генотоксичности корневой меристемы лука, согласно методике, предлагаемой ВОЗ [3], были выбраны длина и количество корешков, митотическая активность, доля аберрантных клеток. Результаты тестов с A. cepa имеют корреляцию с другими тестами на животных, растениях и микроорганизмах, а также могут быть экстраполированы на человека [3].
Тетрациклины (тетрациклин, доксициклин) относятся к группе антибиотиков, которые блокируют синтез белка прокариот. Они являются ингибиторами элонгации белковой цепи и препятствуют связыванию аа-тРНК с А-участком рибосомы 70S [4; 5]. В обычно применяемых дозах тетрациклины функционируют бактериостатически [6].
Понятия бактерицидности и бактериостатичности относительны, поскольку ряд препаратов могут быть бактерицидными по отношению к одним микроорганизмам и бактериостатическими — к другим [7]. Помимо этого, эффект зависит от дозы.
Цель работы: выявление повреждений генетического аппарата в клетках корневой меристемы Allium cepa L. в первой метафазе после обработки в течение одного-трехклеточных циклов тетрациклинами и после завершения восстановительного периода.
Материал и методы исследований
Исследование ответных реакций растений лука обыкновенного в условиях действия водных растворов антибиотиков выполняли с помощью Allium теста [2] на сорте «Штуттгартен». В качестве негативного контроля использовали дистиллированную воду.
Тестировали следующие антибиотики: тетрациклин (РУП «Белмедпрепараты», Беларусь) и доксициклин (РУП «Белмедпрепараты», Беларусь). Варианты опыта с указанием концентраций, длительности действия и способа действия указаны в таблице 1 раздела «Результаты исследований». Согласно рекомендации ВОЗ [3], в эксперименте дополнительно выдерживали период восстановления длительностью 24 часа, в течение которого тестируемое вещество не воздействует (вариант последействия, восстановительный период), и только затем выполняли фиксацию корешков. Во всех вариантах опыта фиксация производилась с 6.30 до 7.00 утра.
Давленые препараты для цитогенетического анализа, окрашенные ацетогематоксилином, изготавливали по общепринятой методике [8]. Просмотр препаратов осуществляли на компьютеризированной кариологической станции, оснащенной микроскопом Leica DMR при увеличении 40×10×1,5. Цитогенетический анализ выполняли по [8, 9].
Статистическую обработку результатов исследований проводили с помощью пакета прикладного программного обеспечения Microsoft Excel и Statsoft (USA) Statistica v.7.0. Для данных, подчиняющихся нормальному закону распределения, использовали t-критерий Стьюдента. Нулевую гипотезу отклоняли при уровне статистической значимости p <0,05 [10].
Результаты исследований
При микроскопировании препаратов в вариантах опыта наблюдали в апикальной меристеме некоторых придаточных корней лука практически отсутствие деления (Таблица). У них митотический индекс был близок к нулю и большинство клеток находились в профатическом состоянии. Однако следует отметить, что повышение концентрации тетрациклина с 20,0 до 100,0 мг/л и увеличение времени экспозиции антибиотика (вариант 10) не повлияло существенно на протекание митоза в придаточных корнях лука. В то же время доксициклин в концентрации 20,0 мг/л приводил практически к полному снижению процесса деления клеток на момент пика митотической активности клеток, при этом клетки и ядра были на вид нормальными. Увеличение концентрации доксициклина до 100,0 мг/л не подавляло процесс митоза в образовательной ткани корней, но при этом наблюдали свыше 80,0% атипичных по форме и виду ядер. Анализ восстановления процесса деления в меристематических клетках корешков показал в группе вариантов более жесткого воздействия (варианты 5, 9, 11) подавление митоза и увеличение количества атипичных ядер. В наибольшей степени это проявилось в варианте 9 (Таблица).
Таблица
ВЛИЯНИЕ ТЕТРАЦИКЛИНОВ НА ЧИСЛО КОРЕШКОВ С МИТОЗОМ
|
№ варианта опыта |
Тестируемые вещества, концентрация в мг/л |
Число корешков с митозом, % |
|
1 |
контроль (вода дистиллированная) |
100,0 |
|
2 |
тетрациклин, 20,0 - 24 часа |
88,5 |
|
3 |
последействие варианта 2 |
91,6 |
|
4 |
тетрациклин, 20,0 - 48 часов |
100,0 |
|
5 |
последействие варианта 4 |
60,0 |
|
6 |
тетрациклин, 100,0 - 24 часа |
88,5 |
|
7 |
последействие варианта 6 |
47,4 |
|
8 |
доксициклин, 20,0 - 24 часа |
2,8 |
|
9 |
последействие варианта 8 |
50,0 |
|
10 |
доксициклин, 100,0 - 24 часа |
96,6 |
|
11 |
последействие варианта 10 |
2,2 |
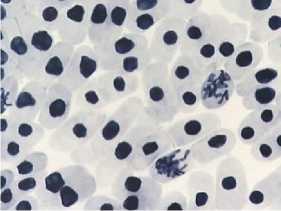
При анализе данных, полученных в результате микроядерного теста (Рисунок 1), наблюдали наличие микроядер в контрольном варианте, число клеток с микроядрами достигало 0,29%. Более чем в 3–4 раза увеличивалось число клеток с микроядрами в варианте применения доксициклина (20 мг/л — 24 часа) и в варианте его последействия. В остальных вариантах было установлено либо увеличение клеток с микроядрами в 2 раза по сравнению с контролем, либо отмечены единичные клетки с микроядрами. Необходимо подчеркнуть, что микроядра были очень маленького размера. Таким образом, на основании результатов микроядерного теста можно констатировать, что для луковиц из партии тестируемого в опыте лука характерна геномная нестабильность.
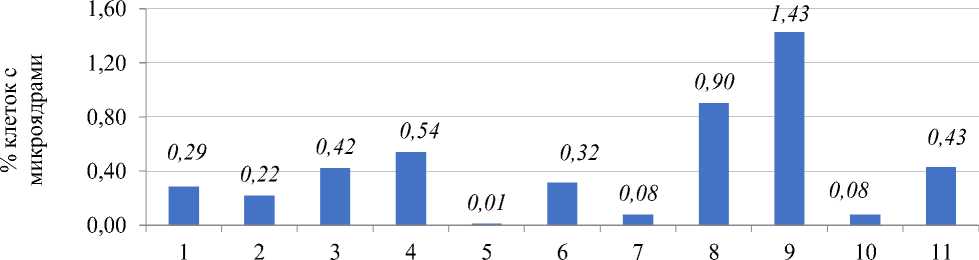
варианты опыта
Рисунок 1. Влияние тетрациклинов на процент клеток с микроядрами. Варианты опыта: 1 – вода дистиллированная, 2 – тетрациклин, 20,0 мг/л – 24 часа, 3 – восстановительный период варианта 2; 4 – тетрациклин, 20,0 мг/л – 48 часов; 5 – восстановительный период варианта 4; 6 – тетрациклин, 100,0 мг/л – 24 ч; 7 – восстановительный период варианта 6; 8 – доксициклин, 20,0 мг/л – 24 ч; 9 – восстановительный период варианта 8; 10 – доксициклин, 100,0 мг/л – 24 ч, 11 – восстановительный период варианта 10
При действии тетрациклинов наблюдали существенное возрастание значений ПМ, с 6,1% — в контроле до 11,0–63,0% — в большинстве опытных вариантах и до 100% после восстановительного периода действия доксициклина (при концентрации 100,0 мг/л в течение 24 ч) (Рисунок 2).
Повышение концентрации тетрациклина и доксициклина с 20,0 мг/л до 100,0 мг/л инициировало увеличение количества патологических митозов в клетках. Пролонгированный эффект тетрациклина не усиливал негативную реакцию на образование патологических митозов (Рисунок 2, вариант 10) по сравнению с более кратковременным действием антибиотика (вариант 2).
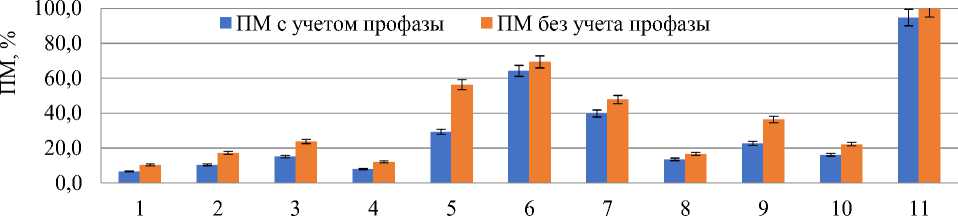
варианты опыта
Рисунок 2. Влияние тетрациклинов на патологию митоза. Обозначения вариантов – те же, что для Р исунка 1
В вариантах «последействия» существенное снижение патологических митозов наблюдали при обработке тетрациклином в концентрации 100,0 мг/л (варианты 4 и 5), что свидетельствует о работе механизмов адаптации и репарации. В остальных опытных вариантах, наоборот, отмечали возрастание патологических митозов в клетках после восстановительного периода.
Эффект тетрациклина в концентрации 20,0 мг/л, независимо от времени экспозиции: 24 и 48 часов, имел практически один и тот же состав и спектр патологий митоза (Рисунок 3: вариант 2 и 10). Однако в вариантах «последействия» наблюдали к-митоз с незначительно развитой липкостью хромосом.
Повышение концентрации тетрациклина до 100,0 мг/л инициировало появление в 50,0% случаев к-митоза и в 30,1% — слипание хромосом. Этот же эффект сохранялся и спустя 2–3 клеточных циклов после снятия действия стрессового фактора (вариант 4 и 5).
Действие доксициклина в концентрации 20,0 мг/л индуцировало появление в митозе у 20,1% клеток выброс хромосом и одиночные и множественные мосты (вариант 6). В варианте «последействия» у 60,0% клеток отмечали к-митоз (вариант 7). Увеличение концентрации доксициклина инициировало появление слипания хромосом у 40,2% клеток (вариант 8).
° 100%
с ^ и о И о
Я
80%
60%
40%
20%
0%
||.и .1
варианты опыта
9 10 11
-
■ АсВер
-
■ з/отст хр
-
■ фрагменты ■ слипание
-
■ выбр хр
-
■ к-митоз
-
■ мосты
-
■ разное
-
■ рассеив
Рисунок 3. Влияние тетрациклинов
вариантов – те же, что для Рисунка 1
на состав и спектр патологий митоза. Обозначения
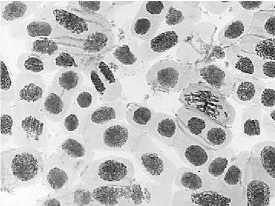
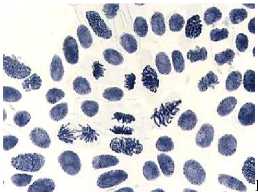
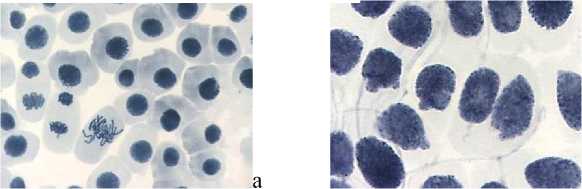
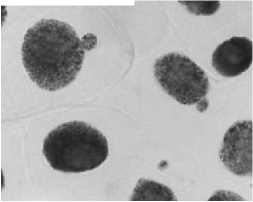
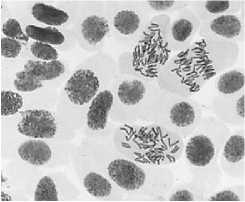
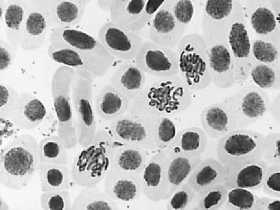
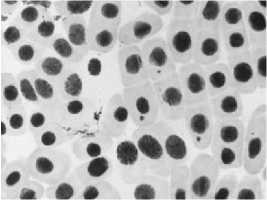
Влияние тетрациклинов на типы патологий митоза представлено на Рисунке 4. Во всех препаратах при действии тетрациклинов наблюдали из-за набухания хромосом формирование странных фигур в метафазе, регистрировали рассеивание хромосом, их слипание (вплоть до образования комков), мосты одиночные и двойные, в частности, вариант «тетрациклин, 100,0 мг/л — 24 ч» (Рисунок 5, 3а, 3б). Повышение концентрации тетрациклина и доксициклина до 100,0 мг/л индуцировало появление до 30–40,0% клеток с липкими хромосомами, что свидетельствует о возможной гибели клеток. Этот же эффект сохранялся и спустя 2–3 клеточных циклов после снятия действия стрессового фактора.
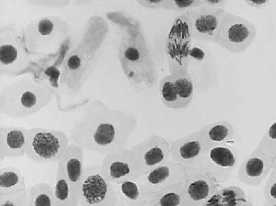
а
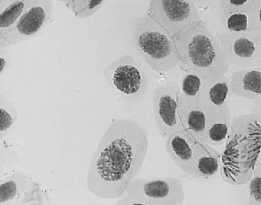
в
-
1) тетрациклин, 20,0 мг/л – 24 ч: а – забегание хромосом; б, в – асинхронное веретено деления; в –
выбросы хромосом за веретено деления
-
2) последействие (тетрациклин, 20,0 мг/л – 24 ч): а – выбросы хромосом за веретено деления; б –
ядерные почки; в – асинхронное веретено деления
а
б
в
-
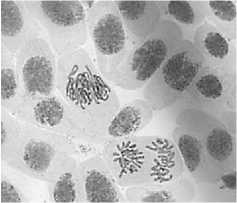
3) тетрациклин, 20,0 мг/л – 48 ч: а – выброс хромосомы; б – ядерные почки и микроядра в
– рассеивание хромосом
а
б
в
-
4) последействие (тетрациклин, 20,0 мг/л – 48 ч): а, б – рассеивание хромосом; б – асинхронное веретено деления; в – интерфазные клетки (в норме)
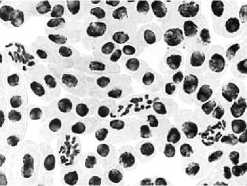
5) тетрациклин,
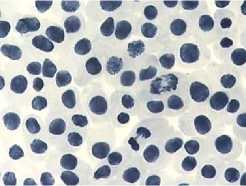
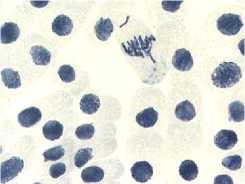
в
хромосом; б – одиночные и
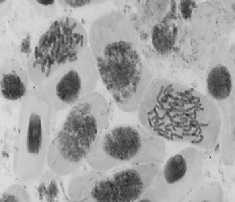
100,0 мг/л – 24 ч: а – комки + рассеивание
множественные мосты; в – выбросы хромосом за веретено деления
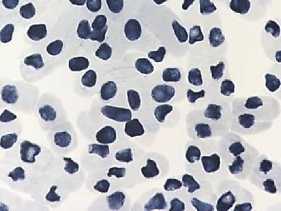
а
б
в
-
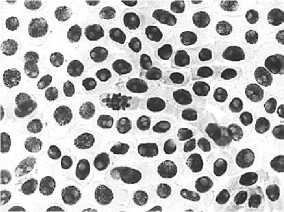
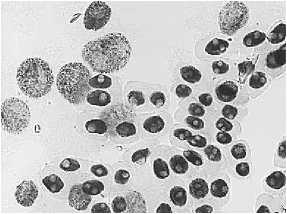
6) последействие (тетрациклин, 100,0 мг/л – 24 ч): а – пикноз; б – слипание хромосом; в – наличие
ядер большого размера
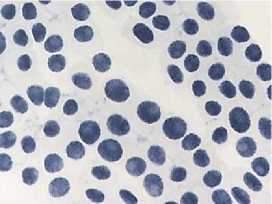
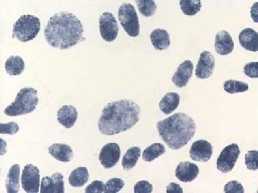
а
в
-
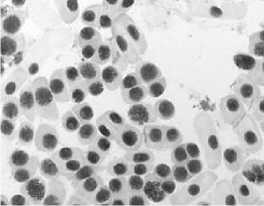
7) доксициклин, 20,0 мг/л – 24 ч: а – отсутствие митоза, ядра в норме; б – отсутствие митоза, есть
атипичные
ядерные протрузии); в – атипичная метафаза ' A A ”i ’ * *
а
в
{^аь ■ б
8) последействие (доксициклин, 20,0 мг/л – 24 ч): а – рассеивание хромосом; б – асинхронное ве
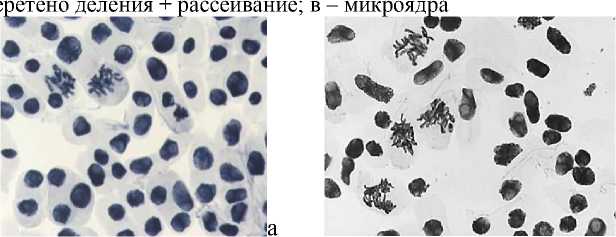
9) доксициклин, 100,0 мг/л – 24 ч: а–в – атипичная метафаза + мост
Рисунок 4. Влияние тетрациклинов на типы патологий митоза (увеличение микроскопа 400×, 100×)
в
-
Следует акцентировать внимание на более токсичном действии доксициклина по сравнению с тетрациклином в данном эксперименте. Несмотря на то, что и тетрациклин и доксициклин, являясь структурными изомерами, имеют одинаковую молекулярную массу и химическую суммарную формулу, по номенклатуре IUPAC у них есть отличия [1; 5]. Необходимо напомнить, что ранее при работе с партией луковиц сорта «Стурон», который по результатам микроядерного теста характеризовался как генетически стабильный материал, наоборот, была установлена большая токсичность именно тетрациклина [11].
Заключение
Таким образом, опыт был выполнен на партии луковиц лука обыкновенного сорта Штуттгартен, которая по итогам микроядерного теста характеризовалась как генетически нестабильный материал.
Установлено, что реакция тестируемого материала на действие тетрациклинов зависит от концентрации и длительности действия антибиотиков. В делящихся клетках преобладали аберрации анеугенного типа, такие как к-митоз, слипание хромосом, вплоть до образования комков. Для данного генотипа после восстановительного периода установлено возрастание доли ПМ (слипание хромосом, множественные мосты), исходом которых является пикноз ядер и гибель клеток.
Выявлено, что после восстановительного периода при действии тетрациклина в концентрации 20,0 мг/л при экспозиции 24 и 48 часов существенно возрастала доля клеток с к-митозом.
Отмечено негативное действие тетрациклина в концентрации 100,0 мг/л, значение ПМ достигало 64,2%; после восстановительного периода уменьшение доли клеток с ПМ не отмечено. В обоих вариантах доминировали клетки с к-митозом и слипанием хромосом.
Эффект доксициклина при тестируемых концентрациях (20,0 и 100,0 мг/л) вызывал увеличение значений ПМ более чем в 2 раза по сравнению с контролем. После восстановительного периода независимо от опытной концентрации доксициклина число клеток с ПМ возрастало за счет увеличения числа клеток с к-митозом и слипанием хромосом.
Следует указать на разную реакцию меристематических клеток корешков лука при действии структурных изомеров, каковыми являются тетрациклин и доксициклин. Необходимо учитывать, что повышение концентрации антибиотиков бактериостатического действия (тетрациклина, доксициклина), с одной стороны, необходимо для максимальной инактивации бактерий, с другой стороны, в клетках эукариотических организмов возрастают негативные процессы при прохождении клеточного цикла, в частности митоза.
Список литературы Влияние тетрациклинов на патологию митоза в клетках образовательной ткани корней Allium cepa L.
- Селизарова Н. О. Антибиотики, нарушающие синтез макромолекул // Обзоры по клинической фармакологии и лекарственной терапии. 2003. Т. 1. №1. С. 71-79.
- Fiskesjo G. Allium test for Screening chemicals; evaluation of cytological parameters // Plants for environmental studies. 1997. V. 11. P. 307-333.
- Руководство по краткосрочным тестам для выявления мутагенных канцерогенных химических соединений. Гигиенические критерии окружающей среды. Женева: ВОЗ, 1989. №51. 212 с.
- Коротяев А. И., Бабичев С. А. Медицинская микробиология, иммунология и вирусология. СПб., 2012. 760 с.
- Машковский М. Д. Лекарственные средства. М.: Новая волна, 2012. 1216 с.
- WHO. Model List of Essential Medicines 18th list (April 2013) (Final Amendments -October 2013) 2013. https://clck.ru/apgGE
- Остерман И. А. Поиск и изучение новых антибиотиков ингибиторов синтеза белка: дисс. ... д-ра хим. наук. М., 2018. 291 с.
- Калаев В. Н., Карпова С. С. Цитогенетический мониторинг: методы оценки загрязнения окружающей среды и состояния генетического аппарата организма. Воронеж: ВГУ, 2004. 80 с.
- Алов И. А. Цитофизиология и патология митоза. М.: Медицина, 1972. 264 с.
- Лакин Г. Ф. Биометрия. М.: Высш. шк., 1990. 352 с.
- Концевая И. И., Жадько С. В., Алексеенко О. Г. Тестирование антибиотиков бактериостатического действия в Allium тесте // Разнообразие растительного мира. 2020. №1 (4). С. 81-88. https://doi.org/ 10.22281/2686-9713-2020-1-81-88


