Влияние типа коронарного стента на отдаленные результаты аортокоронарного шунтирования после стентирования клинико-зависимой артерии по поводу острого коронарного синдрома у больных с многососудистым поражением
Автор: Бочаров А.В., Попов Л.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.34, 2019 года.
Бесплатный доступ
Обоснование. Результаты эндоваскулярной реваскуляризации во многом определяются типом применяемых стентов. Применение голометаллических стентов значимо ухудшает отдаленные результаты эндоваскулярного лечения ишемической болезни сердца (ИБС). Учитывая их широкое применение в Российской Федерации при лечении ИБС и острого коронарного синдрома (ОКС) в частности, не теряет актуальности вопрос о влиянии вышеназванных эндоваскулярных вмешательств на отдаленные результаты аортокоронарного шунтирования (АКШ), выполненного после эндоваскулярной реваскуляризации клинико-зависимой артерии (КЗА) у больных ОКС и многососудистым поражением.Цель: сравнить отдаленные результаты этапных стратегий реваскуляризации коронарного русла - АКШ, выполненного после стентирования КЗА по поводу ОКС стентами с лекарственным покрытием 3-го поколения с сиролимусом и биодеградируемым полимером, и АКШ, выполненного после стентирования КЗА по поводу ОКС голометаллическими стентами.Материал и методы. В анализе использованы данные двухлетнего наблюдения за больными, которым на первом этапе было выполнено стентирование КЗА по поводу ОКС и вторым этапом - АКШ, проведенное не позднее 90 суток от даты стентирования. В исследование были включены 218 пациентов с многососудистым поражением коронарного русла, поступивших с клиникой ОКС. Срок долгосрочного наблюдения за пациентами составил 24 мес. Анализировали следующие конечные точки: сердечно-сосудистая смертность, инфаркт миокарда, повторная реваскуляризация, комбинированную конечную точку MACCE (сердечно-сосудистая смертность, инфаркт миокарда, острое нарушение мозгового кровообращения, повторная реваскуляризация). Наблюдение осуществлялось на госпитальном этапе и затем амбулаторно с периодичностью 1 раз в 3 мес.Результаты. Статистически значимых различий между группами выявлено не было. Частота повторной реваскуляризации, в том числе повторной реваскуляризации стентированной артерии, и возврата клиники стенокардии были статистически значимо выше в группе с голометаллическими стентами. Значимых различий между группами по сердечно-сосудистой смертности, нефатальным инфаркту миокарду и острому нарушению мозгового кровообращения не было. Частота событий MACCE была статистически значимо выше в группе голометаллических стентов, преимущественно за счет частоты повторных реваскуляризаций.Заключение. АКШ, выполненное в ранние сроки после стентирования КЗА с использованием голометаллических стентов у больных с ОКС и многососудистым поражением, ассоциируется с большим количеством повторных реваскуляризаций коронарного русла и частоты возврата стенокардии по сравнению с аналогичной стратегией, но с применением современных стентов 3-го поколения с лекарственным покрытием сиролимус и биодеградируемым полимером.
Острый коронарный синдром, голометаллический коронарный стент, аортокоронарное шунтирование
Короткий адрес: https://sciup.org/149125314
IDR: 149125314 | УДК: 616.132.2-007.272-089.191.1:615.472.5.032.13 | DOI: 10.29001/2073-8552-2019-34-3-144-152
Текст научной статьи Влияние типа коронарного стента на отдаленные результаты аортокоронарного шунтирования после стентирования клинико-зависимой артерии по поводу острого коронарного синдрома у больных с многососудистым поражением
Сегодня ни у кого не возникает сомнений в преимуществе инвазивного подхода в лечении ишемической болезни сердца (ИБС) перед медикаментозной терапией [1], однако следует учитывать, что инвазивный подход и оптимальная медикаментозная терапия взаимодополня-ют друг друга [2].
В настоящее время приоритетной стратегией реваскуляризации у больных с острым коронарным синдромом (ОКС) является выполнение чрескожных коронарных вмешательств (ЧКВ) [1]. Снижение смертности от острого инфаркта миокарда и заболеваний системы кровообращения в целом связано с широким внедрением в клиническую практику первичного ЧКВ [3]. Несмотря на доказанные преимущества эндоваскулярной реваскуляризации клинико-зависимой артерии (КЗА) при ОКС [4– 6], у многих пациентов с многососудистым поражением в дальнейшем требуется выполнение полной реваскуляризации коронарного русла, которая может проводиться как эндоваскулярным, так и хирургическим способами [7–9]. По настоящее время «золотым» стандартом для выполнения полной реваскуляризации остается аортокоронарное шунтирование (АКШ), однако с появлением новых поколений стентов результаты эндоваскулярной реваскуляризации приблизились к результатам хирургической реваскуляризации [10, 11], поэтому вопрос выбора оптимальной стратегии реваскуляризации миокарда не теряет своей актуальности.
Результаты эндоваскулярной реваскуляризации, как было отмечено выше, во многом определяются типом применяемых стентов. Использование голометаллических стентов значимо ухудшает отдаленные результаты эндоваскулярного лечения ИБС [12–14]. Учитывая их широкое проименение в Российской Федерации при лечении ИБС и ОКС в частности, вопрос о влиянии вышеназванных эндоваскулярных вмешательств на отдаленные результаты АКШ, выполненного после эндоваскулярной реваскуляризации клинико-зависимой артерии (КЗА) у больных ОКС и многососудистым поражением, остается крайне важным [15, 16]. Таким образом, задачей исследования явилось сравнение отдаленных результатов этапных стратегий реваскуляризации коронарного русла – АКШ, выполненного после стентирования КЗА по поводу ОКС стентами с лекарственным покрытием (DES) 3-го поколения с сиролимусом и биодеградируемым полимером, и АКШ, выполненного после стентирования КЗА по поводу ОКС голометаллическими стентами (BMS).
Материал и методы
В анализе использованы данные двухлетнего наблюдения за больными, которым на первом этапе было выполнено стентирование КЗА по поводу ОКС и вторым этапом – АКШ, проведенное не позднее 90 суток от даты стентирования. Первый этап и непосредственно наблюдение осуществлялись на базе ОГБУЗ «Костромская областная клиническая больница имени Е.И. Королева», крупнейшего медицинского учреждения Костромской области, оказывающего круглосуточную специализированную, в том числе высокотехнологичную, медицинскую помощь. Второй этап выполнялся в ФГБУ «Национальный медико-хирургический Центр имени Н.И. Пирогова».
В исследование были включены 218 пациентов с многососудистым поражением коронарного русла, поступивших с клиникой ОКС, которым было выполнено стентирование КЗА по экстренным показаниям и в срок до 90 дней – АКШ. Срок долгосрочного наблюдения за пациентами составил 24 мес. (минимальный срок – 3 мес., максимальный – 24 мес.), при наступлении любого значимого сердечно-сосудистого события наблюдение за пациентом прекращалось. В обеих группах стентирование выполнялось у всех больных радиальным доступом. Тип имплантируемого коронарного стента определялся случайным образом.
Основную группу исследования (группа BMS) составили 97 пациентов, которым по поводу ОКС проведено стентирование КЗА стентами BMS («СИНУС», Ангиолайн, Россия), а затем АКШ.
Контрольная группа (группа DES) состояла из 121 пациента, которым выполнено стентирование КЗА по поводу ОКС стентами DES 3-го поколения с сиролимусом и биодеградируемым полимером («КАЛИПСО», Ангиолайн, Россия) и не позднее 90 дней от даты стентирования – АКШ.
Длину стента определяли из расчета перекрытия не менее чем на 5 мм атеросклеротической бляшки, диаметр – согласно дистальному референсному диаметру КЗА.
Критерии исключения: возраст менее 18 и более 80 лет, ранее имплантированные коронарные стенты, отсутствие приверженности или противопоказания к при- ему назначаемых препаратов, онкологические заболевания, заболевания системы крови, хроническая почечная недостаточность, фракция выброса левого желудочка менее 30%, сопутствующая патология, требующая оперативного лечения, невозможность выполнения АКШ, тяжесть поражения коронарного русла по шкале Syntax менее 22 баллов и более 33 баллов, поражение ствола коронарной артерии.
По данным холтеровского мониторирования, у всех пациентов после стентирования КЗА имелись ишемические изменения миокарда, что являлось показанием к выполнению хирургической реваскуляризации.
АКШ выполнялось в одной клинике по единой методике – наложением маммарного шунта на переднюю нисходящую артерию и венозных шунтов на другие артерии при наличии показаний.
Наблюдение за пациентами после выполнения АКШ проводилось в течение 24 мес. В обеих группах анализировали следующие конечные точки сердечно-сосудистая смертность, инфаркт миокарда, повторная реваскуляризация, комбинированную конечную точку MACCE (сердечно-сосудистая смертность, инфаркт миокарда, острое нарушение мозгового кровообращения, повторная реваскуляризация). Наблюдение осуществлялось на госпитальном этапе и затем амбулаторно с периодичностью 1 раз в 3 мес.
Критериями успеха стентирования являлись кровоток TIMI III, резидуальный стеноз не более 10%, исчезновение объективных и субъективных симптомов острой ишемии миокарда после интервенции. Перед выполнением ЧКВ пациенты получили нагрузочную дозу клопи-догреля, также назначались ацетилсалициловая кислота, клопидогрель, бета-блокаторы, статины и ингибиторы ангиотензинпревращающего фермента. Успех стентирования в обеих группах составил 100%.
Статистическую обработку данных выполняли с использованием программного продукта для анализа данных Statistica версии 13 (TIBCO Software Inc., 2017, . Полученные результаты представлены в виде среднего значения и стандартного отклонения (M ± SD) при нормальном распределении, медианой с интерквартильным размахом в виде 25%- и 75%-го перцентилей при асимметричном распределении. Нормальность распределения количественных переменных проверялась по критерию Колмогорова – Смирнова с поправкой Лиллиефорса. При сравнении количественных данных применяли U-критерий Манна – Уитни с поправкой непрерывности. Для сопоставления качественных переменных использовали двусторонний критерий Фишера. Отношение шансов развития больших сосудистых событий и возврата клиники стенокардии рассчитывали по четырехпольным таблицам. Статистически значимыми различия между группами считались при p < 0,05.
Результаты
Анализ клинической и ангиографической характеристик групп не выявил статистически значимых различий между ними (табл. 1, 2).
Таблица 1. Клиническая характеристика пациентов
Table 1. Clinical characteristics of patients
|
Показатели Parameters Возраст, лет Age, years |
Группа BMS Group BMS .......( n = 97)......... 59,8 ± 6,5 |
Группа DES Group DES ......( n = 121)...... 59,5±6,3 |
p 0,44 |
|
Индекс массы тела Body mass index |
28,3 ± 3,6 |
29,8±4,6 |
0,36 |
|
Женский пол, n (%) Female, n (%) |
14 (14,4%) |
19 (15,7%) |
0,85 |
|
Гиперлипидемия, n (%) Hyperlipidemia, n (%) |
92 (94,8%) |
118 (97,5%) |
0,92 |
|
Артериальная гипертензия, n (%) Hypertension, n (%) |
94 (96,9%) |
119 (98,3%) |
1,0 |
|
Стенокардия напряжения III–IV класса по классификации Канадского кардиологического общества, n (%) Class III–IV angina according to the classification of the Canadian Society of Cardiology, n (%) |
26 (26,8%) |
32 (26,5%) |
1,0 |
|
Сахарный диабет, n (%) Diabetes mellitus, n (%) |
18 (18,6%) |
21 (17,4%) |
0,86 |
|
Генерализованный атеросклероз, n (%) Generalized atherosclerosis, n (%) |
46 (47,4%) |
61 (50,4%) |
0,81 |
|
Табакокурение, n (%) Smoking, n (%) |
29 (29,9%) |
35 (28,9%) |
1,0 |
|
Инфаркт миокарда в анамнезе, n (%) History of myocardial infarction, n (%) |
30 (30,9%) |
39 (32,2%) |
0,89 |
|
Острое нарушение мозгового кровообращения в анамнезе, n (%) History of acute cerebrovascular accident, n (%) |
7 (7,2%) |
8 (6,6%) |
1,0 |
|
Фракция выброса левого желудочка после стентирования клинико-зависимой артерии, n (%) Left ventricular ejection fraction after stenting of clinically related artery, % |
56±8 |
58±7 |
0,42 |
|
Острый коронарный синдром с подъемом сегмента ST при поступлении на ЧКВ, n (%) Acute coronary syndrome with ST-segment elevation upon admission for PCI, n (%) |
44 (36,4%) |
47 (38,8%) |
0,62 |
Примечание: n - число больных, ЧКВ – чрескожное коронарное вмешательство. Note : n – number of patients, PCI – percutaneous coronary intervention.
Таблица 2. Ангиографическая характеристика пациентов
Table 2. Angiographic characteristics of patients
|
Показатели Parameters |
Группа BMS Group BMS ( n = 97) |
Группа DES Group DES ( n = 121) |
p |
|
Локализация клинико-зависимой артерии: Localization of clinically related artery: Передняя нисходящая артерия , n (%) Anterior descending artery , n (%) |
33 (34%) |
42 (34,7%) |
1,0 |
|
Огибающая артерия , n (%) Circumflex artery , n (%) |
31 (32%) |
40 (33,1%) |
1,0 |
|
Правая коронарная артерия , n (%) Right coronary artery , n (%) |
33 (34%) |
39 (32,2%) |
0,89 |
|
Тяжесть поражения коронарного русла по шкале SYNTAX Severity of coronary lesions according to SYNTAX score |
25 [24; 29] |
27 [25,5; 30,5] |
0,41 |
|
Среднее количество имплантированных стентов, n Mean number of implanted stents, n |
1,16±0,5 |
1,13±0,4 |
0,71 |
|
Средняя длина стентированного участка, мм Mean length of stented segment, mm |
27 ± 8,8 |
25 ± 8,9 |
1,0 |
|
Средний диаметр имплантированных стентов, мм Mean diameter of implanted stents, mm |
3,1±0,3 |
3,1±0,5 |
1,0 |
Статистически значимых различий по времени от момента выполнения ЧКВ КЗА до АКШ между основной и контрольной группами не было: 55 [48; 83] и 66 [54; 84] соответственно ( p = 0,74).
При анализе результатов (табл. 3) было определено, что частота повторной реваскуляризации, в том числе повторной реваскуляризации стентированной артерии, и возврата клиники стенокардии статистически значимо были выше в группе BMS. У всех пациентов, потребовавших повторной реваскуляризации, отмечался воз- врат клиники стенокардии (III класс по классификации Канадского кардиологического общества) в сроки от 3 до 18 мес. после выполнения АКШ, связанный с развитием рестеноза в стенте у 12 пациентов и, вероятно, с прогрессированием атеросклеротического процесса у 2 больных. Всем этим пациентам выполнено повторное стентирование с использованием стентов 3-го поколения с лекарственным покрытием, после повторной реваскуляризации клиники стенокардии и/или больших сердечно-сосудистых событий у них не наблюдалось.
Таблица 3. Результаты исследования
Table 3. Study results
|
Показатели Parameters |
Группа BMS Group BMS ( n = 97) |
Группа DES Group DES ( n = 121) |
p |
|
Госпитальная летальность, n (%) In-hospital mortality, n (%) |
0 |
1 (0,83%) |
1,0 |
|
Сердечно-сосудистая смертность, n (%) Cardiovascular mortality, n (%) |
2 (2,1%) |
2 (1,65%) |
1,0 |
|
Нефатальный инфаркт миокарда, n (%) Non-fatal myocardial infarction, n (%) |
2 (2,1%) |
0 |
0,2 |
|
Нефатальное острое нарушение мозгового кровообращения, n (%) Non-fatal acute cerebrovascular disease, n (%) |
1 (1,03%) |
0 |
0,45 |
|
Повторная реваскуляризация, n (%), в том числе Repeated revascularization, n (%) Повторная реваскуляризация в зоне стентированного участка, n (%) |
14 (14,43%) |
0 |
0,001 |
|
Repeated revascularization in the stented area, n (%) |
12 (12,37%) |
0 |
0,001 |
|
Возврат клиники стенокардии, не требующей повторной реваскуляризации (не тяжелее II класса по классификации Канадского кардиологического общества, n (%) Recurrence of clinical manifestation of angina pectoris that did not require re-revascularization (class II or less according to the classification of the Canadian Cardiovascular Society), n (%) |
18 (18,56%) |
2 (1,65%) |
0,001 |
|
MACCE, n (%) |
19 (19,6%) |
2 (1,7%) |
0,001 |
Примечание: n – число больных.
Note: MACCE – major adverse cardiac and cerebrovascular event, n – number of patients.
При этом значимых различий между группами по сердечно-сосудистой смертности, нефатальным инфаркту миокарду и острому нарушению мозгового кровообращения не было. Частота событий MACCE также была статистически значимо выше в группе BMS, пре- имущественно за счет частоты повторных реваскуляризаций.
Отношение шансов суммарного возникновения больших сосудистых событий (MACCE) и возврата стенокардии в группе BMS представлено на рисунке 1.

0,01
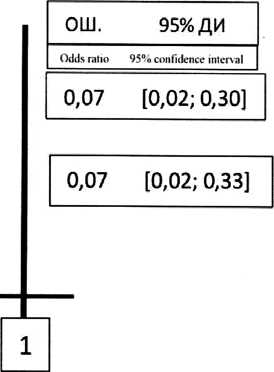
Рис. 1. Отношение шансов возникновения MACCE и возврата стенокардии в основной группе
Fig. 1. The odds ratio of MACCE occurrence and recurrence of angina in the study group
Обсуждение
Полученные в нашем исследовании результаты показали, что выполнение реваскуляризации КЗА при ОКС с использованием голометаллических стентов и затем полной функциональной реваскуляризации методикой АКШ ассоциируется с большим количеством повторных реваскуляризаций коронарного русла и частоты возврата стенокардии по сравнению с аналогичной стратегией, но с применением современных стентов 3-го поколения с лекарственным покрытием сиролимус и биодеградируемым полимером.
Результаты многочисленных рандомизированных исследований и метаанализов доказали преимущество стентов с лекарственным покрытием как 1-го, так и 2-го поколений перед голометаллическими стентами по частоте повторных реваскуляризаций, возврату стенокардии, и соответственно, комбинированной конечной точке MACCE у больных ИБС. Также доказано, что тип стента при выполнении ЧКВ у больных с ОКС не влияет на сердечно-сосудистую смертность и частоту возникновения нефатальных острого инфаркта миокарда и острого нарушения мозгового кровообращения [17–20]. Полученные нами данные не противоречат всему вышесказанному.
Имеются работы, доказывающие, что ранее выполненное стентирование коронарных артерий осложняет выполнение АКШ и ухудшает его результаты по основным показателям, таким как смертность, возникновение инфаркта миокарда, проходимость шунтов и другим [21–24]. Практически все подобные работы выполнены в начале 2000-х гг. и скорее отражали тенденцию, когда на ЧКВ отбирали пациентов, которые не смогли бы перенести АКШ по тем или иным причинам. Сегодня с усовершенствованием инструментария, использованием современных типов стентов, накоплением опыта выполнения АКШ кардиохирургами у данной категории пациентов вышеназванная проблема практически решена [10, 25, 26], что косвенно подтверждается и данными нашего исследования, где отдаленные результаты в контрольной группе практически не отличаются от результатов АКШ по данным литературы.
В некоторое противоречие с вышесказанным вступают результаты нашего исследования, где результаты основной группы статистически значимо хуже по комбинированной конечной точке MACCE и частоте возврата стенокардии по сравнению с контрольной группой. Принимая во внимание, что обе группы были идентичны по клинико-демографическим и ангиографическим показателям, и единственное различие было в типе используемого для реваскуляризации КЗА стента, голометаллический и стент с лекарственным покрытием соответственно, можно сделать вывод о том, что использование голометаллических стентов ухудшает отдаленные результаты полной функциональной реваскуляризации, выполненной методом АКШ.
Несмотря на выраженный временной тренд, демонстрирующий уменьшение доли голометаллических стентов, частота их применения в Российской Федерации остается довольно высокой. Конечно, решением данной проблемы может быть использование исключительно стентов с лекарственным покрытием у больных ИБС и ОКС в частности, однако данное не всегда выполнимо вследствие региональных особенностей территориаль- ных программ государственных гарантий оказания медицинской помощи, несовершенства нормативно-правовой базы и федеральных законов о государственных закупках и иных факторов. Другим вариантом решения проблемы может быть обязательное наложение анастомоза дистальнее стентированных с использованием голометаллических стентов участков коронарного русла во время выполнения АКШ, однако данное утверждение носит предположительный характер и требует подтверждения дальнейшими исследованиями.
Заключение
Хирургическая реваскуляризация коронарного русла (АКШ) в ранние сроки после стентирования КЗА с использованием голометаллических стентов у больных с ОКС и многососудистым поражением ассоциируется с большим количеством повторных реваскуляризаций коронарного русла и частоты возврата стенокардии по сравнению с аналогичной стратегией, но с применением современных стентов 3-го поколения с лекарственным покрытием сиролимус и биодеградируемым полимером.
Список литературы Влияние типа коронарного стента на отдаленные результаты аортокоронарного шунтирования после стентирования клинико-зависимой артерии по поводу острого коронарного синдрома у больных с многососудистым поражением
- Neumann F.J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U. et al. ESC/EACTS Guidelines on myocardial revascularization. Eur. Heart J. 2019;40(2):87-165. DOI: 10.1093/eurheartj/ehy394
- Абугов С.А., Саакян Ю.М., Пурецкий М.В., Поляков Р.С., Пиркова А.А., Болтенков А.В. и др. Сравнение медикаментозной и эндоваскулярной тактики лечения больных ишемической болезнью сердца с хроническими окклюзиями. Кардиология и сердечно-сосудистая хирургия. 2013;6(3):4-9.
- Кузнецов В.А., Ярославская В.И., Пушкарев Г.С., Зырянов И.П., Бессонов И.С., Горбатенко Е.А. и др. Взаимосвязь чрескожных коронарных вмешательств при острых формах ишемической болезни сердца и показателей смертности населения Тюменской области. Российский кардиологический журнал. 2014;19(6):42-46. DOI: 10.15829/1560-4071-2014-6-42-46
- Keeley E.C., Boura J.A., Grines C.L. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction a quantitative review of 23 randomized trials. Lancet. 2003;361(9351):13-20. DOI: 10.1016/S0140-6736(03)12113-7
- Windecker S., Kolh Ph., Alfonso F., Collet J.P., Cremer J., Falk V. et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur. Heart J. 2014;35(37):2541-2619. DOI: 10.1093/eurheartj/ehu278
- Wald D.S., Morris J.K., Wald N.J., Chase A.J., Edwards R.J., Hughes L.O. et al. Randomized trial of preventive angioplasty in myocardial infarction. N. Engl. J. Med. 2013;369(12):1115-1123.
- DOI: 10.1056/NEJMoa1305520
- Cardarelli F., Bellasi A., Ou F.S., Shaw L.J., Veledar E., Roe M.T. et al. Combined impact of age and estimated glomerular filtration rate on in - hospital mortality after percutaneous coronary intervention for acute myocardial infarction (from the American College of Cardiology National Cardiovascular Data Registry). Am. J. Cardiol. 2009;103(6):766-771.
- DOI: 10.1016/j.amjcard.2008.11.033
- Toma M., Вuller C.E., Westerhout C.M., Fu Y., O'Neill W.W., Holmes D.R. Jr. et al. Nonculprit coronary artery percutaneous coronary intervention during acute ST - segment elevation myocardial infarction: insights from the APEX-AMI trial. Eur. Heart J. 2010;31(14):1701-1707.
- DOI: 10.1093/eurheartj/ehq129
- Hannan E.L., Racz M.J., Walford G., Jones R.H., Ryan T.J., Bennett E. et al. Long-term outcomes of coronary - artery bypass grafting versus stent implantation. N. Engl. J. Med. 2005;352:2174-2183.
- DOI: 10.1056/NEJMoa040316
- Thuijs D., Mohr F.W., Serruys P.W., Mack M.J., Holmes D.R., Morice M.C. et al. 10-year survival after bypass surgery versus drug-eluting stents: preliminary results of the randomized SYNTAX extended survival study "SYNTAXES". URL: https://www.acc.org/~/media/Clinical/PDF-Files/Approved-PDFs/2018/09/21/TCT-2018-Slides/Sept24-Mon/3pmET_SYNTAXES-tct-2018.pdf.
- Buchanan G.L., Chieffo A., Bernelli C., Montorfano M., Carlino M., Latib A. et al. Two-year outcomes following unprotected left main stenting with first vs. new - generation drug - eluting stents: the FINE registry. Eurointervention. 2013;9(7):809-816.
- DOI: 10.4244/EIJV917A134
- Kassimis G., Banning A.P. Is it time to take bare metal stents off the catheter laboratory shelf? Eur. Heart J. 2016;37(45):3372-3375.
- DOI: 10.1093/eurheartj/ehw215
- James S.K., Stenestrand U., Lindback J., Carlsson J., Schersten F., Nilsson T. et al. Long-term safety and efficacy of drug-eluting versus bare-metal stents in Sweden. N. Engl. J. Med. 2009;360:1933-1945.
- DOI: 10.1056/NEJMoa0809902
- Burne R.A., Serruys P.W., Baumbach A., Escaned J., Fajadet J., James S. et al. Report of a European Society of Cardiology - European Association of Percutaneous Cardiovascular Interventions task force on the evaluation of coronary stents in Europe: executive summary. Eur. Heart J. 2015;36:2608-2620.
- DOI: 10.1093/eurheartj/ehv203
- Алекян Б.Г., Григорьян А.М., Стаферов А.В., Карапетян Н.Г. Рентгенэндоваскулярная диагностика и лечение заболеваний сердца и сосудов в Российской Федерации - 2017 год. Эндоваскулярная хирургия. 2018;5(2):93-240. 10.24183/2409-4080-2018-5-2-93- 240.
- DOI: 10.24183/2409-4080-2018-5-2-93-240
- Алекян Б.Г., Григорьян А.М., Стаферов А.В. Рентгенэндоваскулярная диагностика и лечение заболеваний сердца и сосудов в Российской Федерации - 2016 год. М.: ЛА Графикс; 2016:220.
- Bonaa K.H., Mannsverk J., Wiseth R., Aaberge L., Myreng Y., Nygård O. et al. Drug-Eluting or bare-metal Stents for cronary artery disease. N. Engl. J. Med. 2016;375:1242-1252.
- DOI: 10.1056/NEJMoa1607991
- Lagerqvist B., James S.K., Stenestrand U., Lindback J., Nilsson T., Wallentin L. Long-term outcomes with drug-eluting stents versus bare-metal stents in Sweden. N. Engl. J. Med. 2007;356:1009-1019.
- DOI: 10.1056/NEJMoa067722
- Kaiser C., Galatius S., Jeger R., Gilgen N., Skov Jensen J., Naber C. et al. Long-term efficacy and safety of biodegradable-polymer biolimuseluting stents: main results of the Basel Stent Kosten - Effectivitats Trial PROspective Validation Examination II (Basket - Prove II), a randomized controlled non inferiority 2 - year outcome trial. Circulation. 2015;131:74-81.
- DOI: 10.1161/CIRCULATIONAHA.114.013520
- Hsieh M.J., Chen C.C., Chang S.H., Wang C.Y., Lee C.H., Lin F.C. et al. Long-term outcomes of drug-eluting stents versus bare-metal stents in large coronary arteries. Int. J. Cardiol. 2013;168(4):3785-3790.
- DOI: 10.1016/j.ijcard.2013.06.005
- Thielmann M., Leyh R., Massoudy P., Neuhäuser M., Aleksic I., Kamler M. et al. Prognostic significance of multiple previous percutaneous interventions in patients undergoing elective coronary artery bypass surgery. Circulation. 2006;114(1):I441-I447.
- DOI: 10.1161/CIRCULATIONAHA.105.001024
- Rao C., Stanbridge R.L., Chikwe J., Pepper J., Skapinakis P., Aziz O. et al. Does previous percutaneous coronary stenting compromise the long-term efficacy of subsequent coronary artery bypass surgery? A microsimulation study. Ann. Thorac. Surg. 2008;85(2):501-507.
- DOI: 10.1016/j.athoracsur.2007.09.036
- Chocron S.C., Baillot R., Rouleau J.L., Warnica W.J., Block P., Johnstone D. et al. Impact of previous percutaneous transluminal coronary angioplasty and/or stenting revascularization on outcomes after surgical revascularization: insights from the imagine study. Eur. Heart J. 2008;29(2):673-679.
- DOI: 10.1093/eurheartj/ehn026
- Weintraub W.S., Grau-Sepulveda M.V., Weiss J.M., O'Brien S.M., Peterson E.D., Kolm P. et al. Comparative effectiveness of revascularization strategies. N. Engl. J. Med. 2012;366:1467-1476.
- DOI: 10.1056/NEJMoa1110717
- Stone G.W., Sabik J.F., Serruys P.W., Simonton C.A., Genereux P., Puskas J. et al. Everolimus-eluting stents or bypass surgery for left main coronary artery disease. N. Engl. J. Med. 2016;375(23):2223-2235.
- DOI: 10.1056/NEJMoa1610227
- Emmert M.Y. CABG in the era of modern PCI. Eur. Heart J. 2017;38(26):2029-2032.
- DOI: 10.1093/eurheartj/ehx328


