Влияние ультразвукового микроструктурирования биологически активных веществ на эффективность процесса их инкапсуляции
Автор: Фаткуллин Ринат Ильгидарович, Калинина Ирина Валерьевна, Васильев Андрей Константинович, Науменко Екатерина Евгеньевна, Ботвинникова Валентина Викторовна
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 4 т.9, 2021 года.
Бесплатный доступ
Целью настоящего исследования стала оценка возможности использования микроструктурирования биологически активных веществ для повышения эффективности их инкапсуляции. Многие биологически активные вещества, особенно полифенольной природы, представляют собой полимерные формы соединений, биологическая активность которых в значительной степени уступает их мономерным формам. Инкапсуляция полимерных форм биоактивных веществ также сопряжена с рядом проблем, среди которых сложность получения препаратов микро- и наноразмерного ряда, низкий уровень загрузки этих веществ в систему доставки, низкая биодоступность этих соединений. В рамках данного исследования предложен и апробирован метод ультразвукового микроструктурирования дигидрокверцетина - растительного антиоксиданта полифенольной природы. Проведена оценка дисперсного состава растворов дигидрокверцетина в исходном и микроструктурированном виде. Показано, что ультразвуковое воздействие в предложенном режиме позволяет изменить размерный ряд частиц биоактивного вещества в растворе и привести их к более выровненному состоянию. Вместе с тем, снятие спектров растворов дигидрокверцетина в исходном и микроструктурированном виде показало, что в обоих случаях биоактивное вещество присутствует в виде смеси полимерной и мономерной форм. Для оценки эффективности инкапсуляции исходной и микроструктурированной форм дигидрокверцетина в качестве системы доставки был выбран β-циклодекстрин, который представляет собой разрешенную к применению пищевую добавку. Методика инкапсуляции дигидрокверцетина в исходном и микроструктурированном виде была идентичной. Полученные результаты определения эффективности инкапсуляции свидетельствуют о целесообразности использования микроструктурирования биологически активного вещества перед его инкапсуляцией. Значение показателя эффективности инкапсуляции дигидрокверцетина в микроструктурированном виде в 1,3 раза превышало значение данного показателя для дигидрокверцетина, инкапсулированного в исходном виде. Предложенный подход может иметь перспективы использования при получении функциональных пищевых ингредиентов и биологически активных добавок с применением технологий инкапсуляции.
Дигидрокверцетин, β-циклодекстрин, инкапсуляция, ультразвуковое микроструктурирование, дисперсный состав, эффективность инкапсуляции
Короткий адрес: https://sciup.org/147236411
IDR: 147236411 | УДК: 664+66.063.62 | DOI: 10.14529/food210411
Текст научной статьи Влияние ультразвукового микроструктурирования биологически активных веществ на эффективность процесса их инкапсуляции
Инкапсуляция на сегодняшний день признана одним из наиболее эффективных подходов к обеспечению защиты лабильных биологически активных веществ от внешних негативных воздействий, таких как свет, кислород колебания температуры, влажности и pH [1-3, 12-16].
На процессах инкапсуляции базируется значительная часть таргетных систем доставки фармацевтических препаратов. В пищевой промышленности инкапсуляция привлекает все большее внимание при разработке функциональных и специализированных пищевых продуктов и пищевых систем с доказанной эффективностью.
Суть процесса инкапсуляции заключается в том, что биологически активное вещество заключается в защитную оболочку предпочтительно микро- или наноразмерного ряда для защиты и последующего высвобождения с контролируемой скоростью и в определенных условиях [16]. Установлено, что размерность системы доставки играет важную роль в формировании ее конечных свойств. Так, микро-и наносистемы характеризуются повышенной биодоступностью и растворимостью биоактивных соединений, предохранением включенных соединений от разложения, замедленным высвобождением и долговременной стабильностью.
Зачастую для формирования системы доставки в технологиях инкапсуляции в качестве защитной оболочки используют биополимеры, такие как углеводы (модифицированный крахмал, мальтодекстрин, циклодекстрины хитозан, пектин и т. д.), белки (казеин, зеин, сывороточный белок, желатин и т. д.), липиды (гидрогенизированные растительные масла , фосфолипиды, моно- и триглицериды) или их сочетание [4, 10, 16, 17].
Для каждого конкретного варианта биологически активного вещества предполагается индивидуальный выбор защитного материала и поиск оптимальных условий и режимов инкапсуляции.
Основное различие между каждой методологией получения системы доставки зависит от метода улавливания биоактивного соединения и особенностей его взаимодействия с материалом оболочки. Это может быть раствор, эмульсия или дисперсия, в зависимости от тех процессов, которые протекают при инкапсуляции. Таким образом, методы инкапсулирования можно разделить на три основные группы (рис. 1).
Вместе с тем, существует и ряд проблем в области разработки систем доставки биологически активных веществ, среди которых ключевая – обеспечение эффективной загрузки биологически активных веществ в защитную оболочку. Эффективность инкапсуляции и загрузочная способность носителей, в конечном счете, определяют эффективность и жизнеспособность разработанной технологии инкапсуляции.
Известно, что получение биологически активных субстанций с микронными и субмикронными размерами является одним из направлений создания высокоэффективных по биодоступности форм веществ. Микроструктурирование позволяет значительно повысить растворимость гидрофобных веществ в водной среде, всасывание в системе организма и биодоступность в целом.
Повышение эффективности инкапсуляции БАВ ассоциируется, в первую очередь, с удельной площадью поверхности инкапсулируемого материала и увеличением эффективной площади, контактирующей с носителем [15]. Поэтому разработка новых технологий микроструктурирования БАВ представляет интерес для повышения эффективности технологии инкапсуляции [15].
Решение проблемы, связанной с низким уровнем загрузки биологически активных веществ в систему доставки определило цель нашего исследования. Для достижения этой цели изучалась возможность использования кавитационных эффектов ультразвукового воздействия для микроструктурирования биологически активных веществ.
Материалы и методы
В данной работе были исследованы процессы инкапсуляции дигидрокверцетина (так-сифолина) в исходном и микроструктуриро-ванном виде в β-циклодекстрин (β-СD).
В качестве исходной субстанции использовалось биологически активное вещество антиоксидантного действия ‒ дигидрокверцетин (экстракт лиственницы Larix gmelinii) , который представлял собой мелкокристаллический порошок светло-кремового цвета , с массовой долей дигидрокверцетина (ДГК) не менее 97,0 % (Свидетельство о государственной регистрации № RU 77.99.11.003.E.018404.05.11 от 06.05.2011 г.).
Физические (механические)
-
• распылительная сушка;
-
• сублимационная сушк;
-
• экструзия;
-
• процессы с использованием сверх критических жидкостей.
Физико-химические
Химические методы
-
• охлаждение распылением;
-
• ионное гелеобразование;
-
• испарение растворителя;
-
• захват липосом;
-
• коацервация.
• межфазная полимеризаци;
• сшивание молекулярных включений.
Рис. 1. Классификация методов инкапсулирования биологически активных веществ [10]
Микроструктурирование ДГК осуществлялось с применением эффектов ультразвукового воздействия (УЗВ). В качестве рабочего инструмента использовали аппарат ультразвуковой «ВОЛНА-Л» УЗТА-0,63/22-ОЛ, г. Бийск с рабочим инструментом грибкового типа. Водный раствор ДГК 0,2 % в объеме 100 мл обрабатывали, используя рабочий режим воздействия: 630 Вт, 10 мин при контроле температуры не более 50 °С.
Для исследования и последующей инкапсуляции использовали растворы ДГК (0,2 % по массе):
Контроль (ДГК) ‒ навеску ДГК массой (0,2 ± 0,001) г растворяют в 100 мл дистиллированной Н2О и вымешивают на магнитной мешалке в течение 2 ч при температуре не более 50 °С;
Микроструктурированный ДГК (ДГКмикр) ‒ навеску ДГК массой (0,2 ± 0,001) г растворяют в 100 мл дистиллированной Н 2 О, подвергают ультразвуковому воздействию в режиме (20 ± 2) кГц 630 Вт, в течение 5 мин при контроле температуры не более 50 °С.
Для установления размера частиц ДГК использовали анализатор Nanotrac Ultra (Microtrac Inc., США). Измерения, проводимые на Nanotrac, соответствуют стандарту ISO 13321. Принцип действия прибора основан на прохождении лазерного луча через жидкость, отражении его от движущихся частиц и возвращении в камеру прибора.
Спектры спиртовых растворов ДГК получали с применением спектрофотометра СФ-56. Спектры снимали для спиртовых (этанольных) растворов ДГК концентрацией 0,001 %, в диапазоне 230-380 нм с использованием кюветы из кварцевого стекла, оптический путь 10 мм.
В качестве таргетной системы (системы доставки) использовали β-CD пищевой (Е459), был приобретен в ООО «Кемикал Лайн».
Условия инкапсуляции
Инкапсуляцию ДГК в β-CD проводили при соотношении компонентов 3:1 по молярной массе. Навески соответствующих количеств ДГК и β-CD растворяли в установленном количестве растворителя (30 % водно-этанольный раствор) и вымешивали при скорости 100 об/мин в течение 1 ч при температуре 40 °С [11].
Эффективность инкапсуляции (ЭИ) определяли, используя методику, описанную Sun, Dai и Gao (2016) с модификацией. Коротко, к 0,2 г полученной суспензии добавляли 1 мл этанола и аккуратно перемешивали, затем определяли содержание БАВ в надосадочной жидкости (Х1 – неинкапсулированный ДГК) [17].
ЭИ рассчитывали по формуле:
ЭИ =Х Х ×100 %, где Х – исходное количество ДГК, используемое для инкапсуляции, мг; Х1 – количество неинкапсулированного ДГК, мг
Экспериментальные исследования проводились в трех-пятикратных повторностях для каждого из вариантов опыта и контроля с доверительной вероятностью 0,95.
Результаты и обсуждение
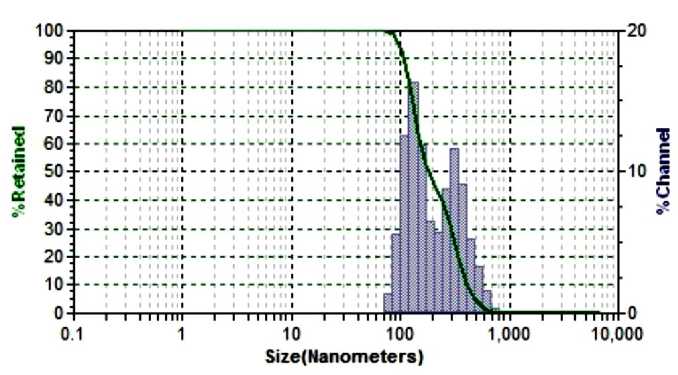
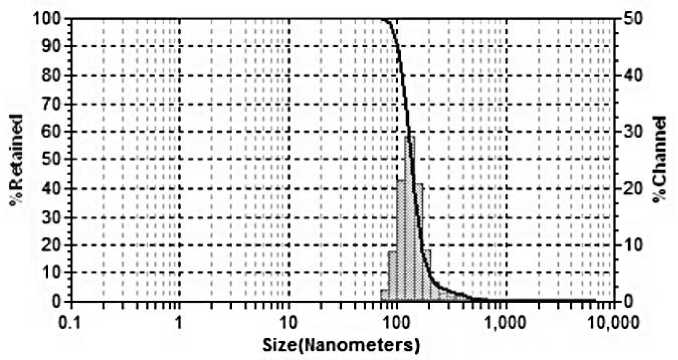
Анализ доступной литературы свидетельствует о том, что УЗВ позволяет провести процесс диспергирования и микроструктурирования гомо- и гетерогенных систем достаточно эффективно [2, 5, 6, 13, 14 17]. На первом этапе наших исследований был проведен анализ дисперсного состава растворов ДГК в исходном и микроструктурированном виде методом лазерного динамического светорассеяния (рис. 2), который показал, что исследуемые образцы весьма разнородны по размерным характеристикам частиц.
В контрольном образце ДГК присутствуют частицы размерного ряда 338,0 нм – 41,8 % и 134,6 нм – 58,2 %. При этом имеется вероятность присутствия частиц более крупного размера, которые находятся за пределами чувствительности прибора. Данное предположение связано с тем, что в процессе исследований в контрольном образце раствора оставались видимые глазом нерастворенные частицы ДГК, которые с течением времени выпадали в осадок.
Представленные на рис. 2 данные показывают, что воздействие ультразвуковой кавитации обусловливает изменение состояния дисперсной системы растворов ДГК, приводит к выравниванию размеров частиц, в мик-роструктурированном образце преобладают частицы размерного ряда – 136,5 нм – 82 % и 18 % составляют частицы размером 58 нм.
Известно, что ДГК способен существовать в трех формах:
-
– полимерной, когда молекулы связаны цепочками гидроксильных групп;
-
– димерной, когда две молекулы связаны между собой;
-
– монокристаллической [7–9].
а)
338,0 нм – 41,8 %
134,6 нм – 58,2 %
б)
136,5 нм – 82,0 %
58 нм – 18,0 %
Рис. 2. Результаты дисперсного анализа растворов дигидрокверцетина: а – контроль; б – УЗВ в режиме 630 Вт 5 мин
Биологическая активность молекулы ДГК обусловлена ее нативной, т. е. природной, формой, благодаря которой молекула выполняет свое биологическое предназначение. В организме растений молекула ДГК представляет собой неферментативную форму антиоксиданта – молекулу мономерной формы.
Ввиду значительной склонности ДГК к образованию полимерных форм, обладающих меньшей биологической активностью, особую важность приобретает необходимость установления соотношения мономерной и полимерной структур ДГК в составе добавки.
Спектры ДГК в мономерной и полимерной формах различны. Полоса поглощения 328-340 нм принадлежит только мономерной форме, тогда как полоса при (290 ± 2) нм принадлежит смеси мономерной и полимерной форм.
Нами были получены спектры ДГК контрольного и микроструктурированного образцов (рис. 3), которые свидетельствуют о том, что ДГК в обоих случаях находится в виде смеси мономерной и полимерной форм, что, в целом, согласуется с результатами оценки дисперсного состава образцов ДГК.
Вместе с тем, в контрольном образце значение оптической плотности плеча 325-340 нм ниже, чем в образце, полученном с применением УЗВ. Это указывает на тот факт, что УЗВ способствует разрыву химических связей и образованию мономерных форм ДГК. Известно, что полимеризация ДГК осуществляется за счет ковалентного связывания через фенольные гидроксильные группы, что снижает проявление активности полимерами ДГК.
На следующем этапе исследований была проведена инкапсуляция исходной и микро-структурированной форм ДГК в β-CD. Для полученных суспензий была проведена оценка эффективности инкапсуляции. Результаты показали, что значения ЭИ при использовании ДГК микр составили 73,8 %, тогда как для ис-
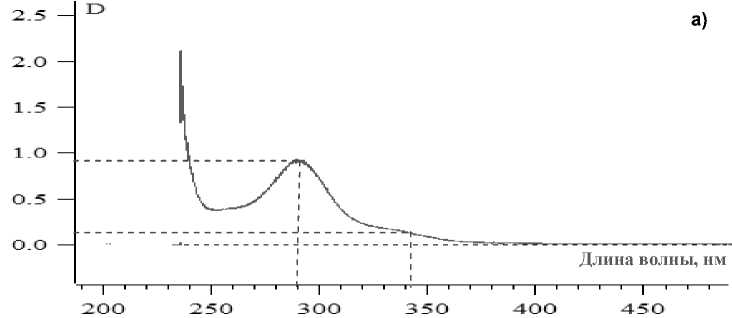
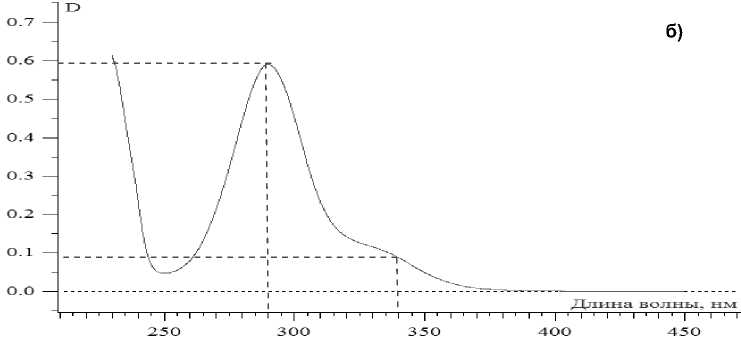
Рис. 3. Спектры спиртовых растворов дигидрокверцетина: а – контроль; б – УЗВ 630 Вт, 5 мин
ходной формы – 56,7 %. Такие значения, вероятно, обусловлены преобладанием ДГК в мономерной форме в составе образца микро-структурированного ДГК. Согласно данным открытых научных источников наиболее вероятным является взаимодействие ДГК и β-CD в стехиометрии 1:1, что обусловлено идеальным совпадением размера внутренней полости β-CD и молекулы ДГК. Эффективность инкапсуляции (ЭИ) также может зависеть от условий проведения процесса. Вместе с тем, полученные результаты убедительно доказывают, что при соблюдении равных условий проведения процесса инкапсуляции предварительное микроструктурирование ДГК позволило увеличить ЭИ в 1,3 раза.
Выводы
Полученные результаты доказывают, что УЗВ оказывает выраженное влияние на дисперсный состав, а также соотношение мономерной и полимерных форм в растворах дигидрокверцетина. Ультразвуковое воздействие в режиме 630 Вт в течение 5 мин позво- лило уменьшить размер частиц ДГК до 58 нм, таким образом доведя раствор до состояния, приближенного к истинному.
Анализ полученных спектров испытуемых растворов ДГК показал, что как в контрольных, так и в опытных образцах присутствует ДГК в виде смеси мономерной и полимерной форм.
Оценка влияния микроструктурирования ДГК на эффективность его инкапсуляции в β-CD показала целесообразность использования такого подхода. Так, значение ЭИ возросло более чем в 1,3 раза относительно исходной формы ДГК, инкапсулированной в β-CD.
Таким образом, проведенные исследования показали перспективность применения ультразвукового микроструктурирования для повышения эффективности технологии инкапсуляции. Это может быть полезно при разработке функциональных пищевых ингредиентов и биологически активных добавок на основе ДГК.
Вместе с тем, необходимы дальнейшие исследования, направленные на математическое моделирование и установление оптимальных режимов ультразвукового микроструктурирование применительно как к ДГК, так и другим биологически активным веществам.
Статья выполнена при финансовой поддержке гранта Президента РФ для молодых ученых для государственной поддержки молодых российских ученых – кандидатов наук МК-3690.2021.5.
Список литературы Влияние ультразвукового микроструктурирования биологически активных веществ на эффективность процесса их инкапсуляции
- Корулькин, Д.Ю. Природные флаво-ноиды / Д.Ю. Корулькин, Ж.А. Абилов, Р.А. Музычкина, Г.А. Толстиков. – Новосибирск: Тео, 2007. – 232 с.
- Калинина, И.В. Результаты влияния ка-витационных эффектов ультразвука на степень экстракции биологически активных веществ из растительного сырья / И.В. Калинина, И.Ю. Потороко, Р.И. Фаткуллин и другие // Аграрный вестник Урала. – 2017. – № 10 (164). – С. 30–35.
- Шатилов, А.В. Роль антиоксидантов в организме в норме и при патологии / А.В. Шатилов, О.Г. Богданова, А.В. Коробов // Ветеринарная патология. – 2007. – № 2. – С. 207–211.
- Antiproliferative and antioxidant activity of new dihydroquercetin derivatives / V.S. Rogovskii, A.I. Matiushin, N.L. Shimanovskii et. al. // Eksp. Klin. Farmakol. – 2010. – Vol. 73. – P. 39–42.
- Application of ultrasonic waves for the improvement of particle dispersion in drinks / R. Fatkullin, N. Popova, I. Kalinina et. al. // Agron-omy Research. – 2017. – Vol. 15. – P. 1295–1303.
- Applications of sonochemistry in Russian food processing industry / O. Krasulya, S. Shes-takov, V. Bogush et. al. // Ultrasonics Sonoche-mistry. – 2014. – Vol. 21. – P. 2112–2116.
- Dihydroquercetin (DHQ) induced HO-1 and NQO1 expression against oxidative stress through the Nrf2-dependent antioxidant pathway / L. Liang, C. Gao, M. Luo et. al. // J. Agric. Food Chem. – 2013. – Vol. 61. – P. 2755–2761.
- Dihydroquercetin as a means of antioxi-dative defence in rats with tetrachloromethane hepatitis / Y.O. Teselkin, I. Babenkova, V. Kolhir et. al. // Phytother. Res. – 2000. – Vol. 14. – P. 160–162.
- Enhancement of solubility, antioxidant ability and bioavailability of taxifolin nanoparti-cles by liquid antisolvent precipitation technique / Y. Zu, W. Wu, X. Zhao et. al. // International Journal of Pharmaceutics. – 2014. – Vol. 471. – P. 366–376.
- Fang, Z., Bhandari, B.. Encapsulation of polyphenols – a review // Trends in Food Science &Technology. – 2010. – Vol. 21 (10). – P. 510–523.
- Li-Juan Yang, Wen Chen, Shui-Xian Ma, Yun-Tao Gao, Rong Huang, Sheng-Jiao Yan, Jun Lin. Host–guest system of taxifolin and native cyclodextrin or its derivative: Preparation, characterization, inclusion mode, and solubilization // Carbohydrate Polymers. – 2011. – Vol. 85(3). – P. 629–637.
- Mittler, R. Oxidative stress, antioxidants and stress tolerance / R. Mittler // Trends in Plant Science. – 2002. – Vol. 7 (9). – P. 405–410. https://doi.org/10.1016/S1360-1385(02)02312-9.
- Potoroko I.Yu., Kalinina I.V., Naumenko N.V., Fatkullin R.I., Nenasheva A.V., Uskova D.G., Sonawane S.H., Ivanova D.G., Velyamov M.T. Sonochemical Micronization of Taxifolin Aimed at Improving Its Bioavailability in Drinks for Athletes // Human. Sport. Medicine. – 2018. – Vol. 18, no. 3. – P. 90–100. DOI: 10.14529/ hsm180309
- Potoroko, I.U., Kalinina, I.V., Naumenko, N.V., Fatkullin, R.I., Shaik S., Sonawane, S.H., Ivanova, D., Kiselova-Kaneva, Y., Tolstykh, O., Paymulina, A.V. Possibilities of Regulating Antioxidant Activity of Medicinal Plant Extracts // Human. Sport. Medicine. – 2017. – Vol. 17, no. 4. – P. 77–90. DOI: 10.14529/hsm170409
- Rasenack, N. Preparation of microcrys-tals by in situ micronization / N.Rasenack, H. Steckel, B.W. Müller // Powder Technology. – 2004. – Vol. 143–144. – P. 291–296.
- Sobel R., Versic R., Gaonkar A.G. Intro-duction to microencapsulation and controlled delivery in foods // Microencapsulation in the food industry. – Elsevier Inc., 2014. – P. 3–12.
- Sun C., Dai L., Gao Y. Binary complex based on zein and propylene glycol alginate for delivery of quercetagetin // Biomacromolecules. – 2016. – Vol. 17 (12). – P. 3973–3985.


