Влияние уровня биомаркеров на течение послеоперационного периода при операциях в условиях искусственного кровообращения
Автор: Петрищев Юрий Иванович, Левит Александр Львович, Лейдерман Илья Наумович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Послеоперационный период и интенсивная терапия
Статья в выпуске: 3 т.18, 2014 года.
Бесплатный доступ
Определение системной воспалительной реакции (СВР) было дано в 1980 г., в кардиохирургии она описана в 1996 г. Объем научных публикаций по данной тематике огромен, но в клинической практике тяжесть состояния пациентов после операции на сердце принято считать обусловленной объемом операции и длительностью искусственного кровообращения (ИК). Мы попытались взглянуть на эту проблему под другим ракурсом и провести параллель между тяжестью состояния кардиохирургического пациента и СВР, развившейся в ответ на операционную травму. В исследование включено 48 пациентов, которым проводились операции на открытом сердце. Исследовался плазменный уровень интерлейкина-6 (IL-6), лактата и прокальцитонина (ПКТ) до начала операции, после окончания ИК и через 24 ч от первого исследования. Удалось обнаружить связь длительности ИК с плазменным уровнем IL-6 (r = 0,66; p = 0,000), лактата (r = 0,46; p = 0,0009) и ПКТ (r = 0,4; p = 0,005). Также выявлена связь между плазменным уровнем IL-6, лактата и ПКТ (r = 0,53; p = 0,000 в обоих случаях). Уровень ПКТ на III этапе оказался связан с продолжительностью ИК (r = 0,4; p = 0,005), ИВЛ (r = 0,44; p = 0,001) и длительностью лечения в ОРИТ (r = 0,53; p = 0,000). Выявить связь длительности нахождения пациентов в ОРИТ и продолжительностью ИК нам не удалось. Корреляция между плазменным уровнем ПКТ и продолжительностью интенсивного этапа лечения указывает на важность динамики этого биомаркера для раннего прогнозирования течения послеоперационного периода при операциях на открытом сердце.
Системная воспалительная реакция, кардиохирургия, биомаркеры
Короткий адрес: https://sciup.org/142140619
IDR: 142140619 | УДК: 616
Текст научной статьи Влияние уровня биомаркеров на течение послеоперационного периода при операциях в условиях искусственного кровообращения
В 1980 J. Kirklin дал определение системной воспалительной реакции (СВР), назвав ее «a whole body inflammatory response». Системная воспалительная реакция, по мнению исследователя, связана с увеличением проницаемости капилляров, развитием отека тканей и проявляется органной дисфункцией, переходящей в полиорганную недостаточность (ПОН) [1]. Согласно современному представлению, сепсис – это документированное или предполагаемое наличие инфекции вместе с ее системным проявлением. Сепсис-индуцированная органная дисфункция или тканевая гипоперфузия характеризуют тяжелый сепсис [2]. В 1987 г. опубликованы данные о наличии эндотоксина в крови при операциях в условиях искусственного кровообращения [3]. Впервые СВР при операциях на сердце описана в 1996 г. [4]. Муль-тицентровое исследование, проведенное в клиниках Австралии и Новой Зеландии, показало связь критериев выраженности ПОН (шкала SOFA) c летальностью после операций на сердце [5]. Большинство исследователей главной причиной развития СВР при операциях на сердце называют искусственное кровообращение [4]. Механизм реализации системной воспалительной реакции хорошо изучен и связан с контактом крови с чужеродной поверхностью контура аппарата искусственного кровообращения и с газовой фракцией, с дезорганизацией системы коагуляции и фибринолиза, с дегрануляцией лейкоцитов, высвобождением цитотоксичных энзимов, медиаторов воспаления (TNF-α, IL-1β, IL-6, IL-8), с активацией эндотелиоци-тов, тромбоцитов, системы комплемента, с выключением легких из кровообращения и реперфузией, а также с постперфузионной сосудистой недостаточностью вследствие нарушения метаболизма эндогенного NO [6]. С учетом трудностей диагностики СВР при операциях в условиях ИК большие надежды возлагались на биомаркеры воспаления. Однако анализ многочисленных исследований и обзоров (всего более 50 000, в том числе более 1 000 при операциях на сердце, по данным Pubmed) свидетельствует об отсутствии единства в отношении клинического значения отдельных биомаркеров. Диа- гностические критерии системной воспалительной реакции при искусственном кровообращении неспецифичны, а возможности ее предотвратить ограничены [7]. В клинической практике длительность интенсивного этапа лечения в ОРИТ связывают с тяжестью состояния пациентов, которую принято считать обусловленной объемом операции и длительностью ИК.
Мы попытались взглянуть на эту проблему под другим ракурсом и провести параллель между тяжестью состояния кардиохирургического пациента после неосложнённой операции и СВР, развившейся в ответ на операционную травму. Наша гипотеза заключалась в следующем. Хирургическое вмешательство в условиях ИК является повреждающим фактором, оказывающим воздействие на организм пациента даже при неосложненном течении операции. В ответ на действие повреждающего фактора развивается СВР, которая, в свою очередь, оказывает повреждающее воздействие на организм. Мы предположили, что, анализируя плазменные уровни маркеров СВР и тканевой гипоксии в периоперационном периоде, мы сможем на ранних этапах обнаружить развитие СВР и связать ее выраженность с длительностью нахождения пациентов в ОРИТ, тем самым выявить пациентов группы риска, которые в дальнейшем длительное время будут нуждаться в проведении интенсивной терапии.
Материал и методы
После разрешения этического комитета больницы в исследование включено 48 пациентов (17 мужчин и 31 женщина), в возрасте 58 лет (22–73 года). Этим пациентам были выполнены операции в условиях искусственного кровообращения: на аортальном клапане – 9, на митральном клапане – 9, на митральном и аортальном клапанах – 1, на митральном, аортальном и трикуспидальном – 13, на аортальном клапане с реваскуляризацией миокарда – 3, на митральном клапане с реваскуляризацией миокарда – 1, на митральном и аортальном с реваскуляризацией – 1, на митральном и трикуспидальном – 6, на митральном и трикуспидальном с реваскуляризацией миокарда – 2, на митральном и трикуспидальном с операцией MAZE-2, на митральном и аортальном с операцией MAZE-1.
Критерием включения в исследование были показания к проведению операции на открытом сердце, вне зависимости от объема оперативного вмешательства. Критерий исключения – наличие классических критериев синдрома системного воспалительного ответа (SIRS) перед операцией [8].
Всем пациентам проводили стандартную комбинированную анестезию: фентанил 10 мкг/кг/ч, мидазолам 100 мкг/кг/ч, рокуроний 100 мкг/кг/ч, изофлюран МАК ситуационно.
Всем пациентам проводили стандартное нормотермическое ИК на аппаратах Stockert 5, с использованием мембранных оксигенаторов: объемная скорость перфузии 2,5 л/мин/м2 площади тела и стандартная холодовая фармако-кровяная кардиоплегия с интервалом 30 мин.
Всем пациентам проводили стандартную послеоперационную интенсивную терапию: ИВЛ в пресоцикличес-ком режиме, коррекцию волемии и адреномиметическую поддержку при необходимости.
Исследовали плазменный уровень прокальцитонина (ПКТ), лактата, интерлейкина 6 (IL-6). Этапы исследования: I – до начала операции, II – плавающая точка окончание ИК, III – через 24 ч от первого этапа.
Полученные данные проверены на соответствие критериям нормального распределения с использованием критерия Колмогорова. Достоверность различия полученных данных внутри группы и между группами проверяли с использованием парного критерия Вилкоксона. Для корреляционного анализа использовали показатель корреляции Спирмена.
Результаты
У всех пациентов вне зависимости от длительности нахождения в ОРИТ послеоперационный период без осложнений. Причиной, обусловившей длительность нахождения пациентов в ОРИТ, была потребность в инфузии адреномиметиков в незначительной дозировке.
Длительность ИК составила 102,85±30,48 мин. Время пережатия аорты 81,96±28,29 мин. Продолжительность ИВЛ 12,7±6,5 ч. Продолжительность послеоперационного лечения в ОРИТ 41,3±32,3 ч. Уровень IL-6 увеличивался к окончанию ИК и оставался без изменений к III этапу. Уровни лактата и ПКТ увеличивались на каждом этапе. Уровень IL-6 на II этапе имел средней силы прямую корреляцию с уровнем лактата на II этапе (r = 0,53; p = 0,000) и с уровнем ПКТ на III этапе (r = 0,53; p = 0,000) (табл. 1, рисунок ).
Длительность лечения пациентов в ОРИТ имела средней силы прямую корреляцию с продолжительностью ИВЛ (r = 0,56; p = 0,000). Корреляция продолжительности нахождения пациентов в ОРИТ с длительностью ИК и временем пережатия аорты отсутствовала.
Уровень IL-6 на II этапе имел средней силы прямую корреляцию с продолжительностью ИК (r = 0,66; p = 0,000) и временем пережатия аорты (r = 0,66; p = 0,000).
Уровень лактата на II этапе имел средней силы прямую корреляцию с продолжительностью ИК (r = 0,46; p = 0,0009) и временем пережатия аорты (r = 0,43; p = 0,002). Уровень лактата на III этапе имел средней силы прямую корреляцию с продолжительностью ИК (r = 0,4; p = 0,0006), временем пережатия аорты (r = 0,41; p = 0,003) и длительностью ИВЛ (r = 0,43; p = 0,002).
Уровень ПКТ на III этапе имел средней силы прямую корреляцию с продолжительностью ИК (r = 0,4; p = 0,005), ИВЛ (r = 0,44; p = 0,001) и длительностью лечения в ОРИТ (r = 0,53; p = 0,000).
Внутригрупповой анализ
В зависимости от времени нахождения в ОРИТ больные разделены на две подгруппы. В подгруппу А включено 40 больных, распределенных на две группы по 20 человек. Больные группы А1 (10 мужчин и 10 женщин) находились в ОРИТ менее 24 ч после операции. Средний возраст 51,6
Корреляция между плазменным уровнем ПКТ, лактата и IL-6.
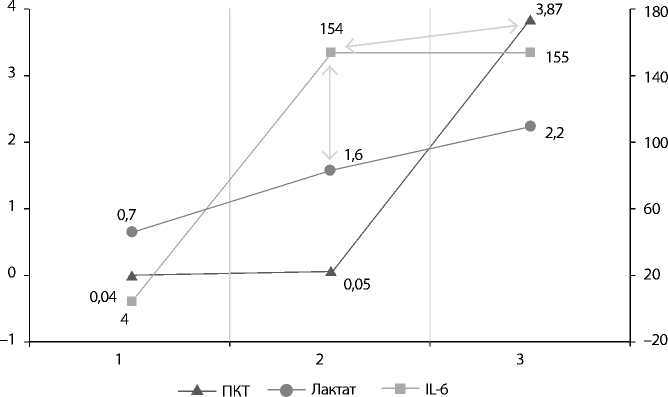
Таблица 1
Динамика уровней IL -6, лактата и ПКТ на этапах исследования,
Таблица 2
Динамика уровней
IL -6, лактата и ПКТ у пациентов подгруппы А на этапах исследования, * достоверность различия между группами
Между группами было достоверное различие по продолжительности искусственного кровообращения (группа А1 87,15±20,5 мин, группа А2 118,35±30,3 мин, р <0,05), времени пережатия аорты (группа А1 66,8±18,3 мин, группа А2 96,2±27,8 мин, р <0,05), длительности послеоперационной ИВЛ (группа А1 7,8±2,0 ч, группа А2 17,35±6,6 ч, р <0,05) и длительности лечения в ОРИТ (группа А1 21,35±0,9 ч, группа А2 69,25±34,3 ч, р <0,05).
Уровень IL-6 на всех этапах достоверно выше в группе А2. Уровень лактата на III этапе достоверно выше в группе А2. Уровень ПКТ на III этапе также достоверно выше в группе А2 (табл. 2).
Подгруппу Б составили 18 человек, распределенных на две группы – по 9 человек в каждой. Больные группы Б1 (4 мужчин и 5 женщин) находились в ОРИТ более 24 ч и менее 48 ч после операции. Средний возраст 58 лет (от 39 до 73 лет). Больные группы Б2 (1 мужчина и 8 женщин)
находились в ОРИТ более 48 ч. Средний возраст 61 год (от 46 до 73 лет).
Между группами не было достоверного различия в возрасте. Продолжительность искусственного кровообращения составила: группа Б1 114,7±27,6 мин, группа Б2 122,7±36,4 мин; время пережатия аорты: группа Б1 97,7±24,3 мин, группа Б2 96,8±32,2 мин; длительность послеоперационной ИВЛ: группа Б1 15,6±6,3 ч, группа Б2 20,2±6,1 ч без достоверного различия между группами. Достоверно различалась лишь длительность лечения в ОРИТ (группа Б1 44,0±1,4 ч, группа Б2 77,2±29,6 ч, р <0,05). Уровень ПКТ в группе Б2 на III этапе был достоверно выше (табл. 3).
Обсуждение
Нам не удалось выявить связь между длительностью ИК и продолжительностью нахождения пациентов в ОРИТ, что, на наш взгляд, подтверждает мнение о том, что длительность нахождения пациентов в ОРИТ не имеет прямой связи с продолжительностью ИК. Нам удалось обнаружить
Таблица 3
Динамика уровней
Il-6, лактата и ПКТ у пациентов подгруппы Б на этапах исследования, * достоверность различия между группами
Корреляция между плазменным уровнем ПКТ на III этапе и продолжительностью интенсивного этапа лечения указывает на важность этого биомаркера для раннего прогнозирования течения послеоперационного периода. Проведенный анализ внутри подгруппы Б, показавший, что пациенты с одинаковой длительностью ИК и одинаковой выраженностью СВР, но с различным уровнем ПКТ к окончанию первых послеоперационных суток имеют различную длительность интенсивного этапа лечения, подтверждает это.
Также мы выявили связь между плазменным уровнем IL-6, лактата и ПКТ, что, по-видимому, подтверждает гипотезу о том, что именно вызванная периоперативной травмой СВР связана с тканевой гипоксией и повышением уровня ПКТ в ближайшем послеоперационном периоде.
Мнения ученых о том, что означает увеличение уровня ПКТ в ближайшем послеоперационном периоде при операциях на сердце, не однозначны. Одни полагают, что это может быть маркером бактериальной инфекции [9], другие в этом вопросе более осторожны [10], третьи не считают его маркером бактериальной инфекции после кардиохирургических операций [11]. Сейчас мы можем утверждать лишь то, что уровень ПКТ в ближайшем послеоперационном периоде является ранним маркером, указывающим на пациентов группы риска с длительным послеоперационным нахождением в ОРИТ. Мы можем согласиться с мнением ученых о том, что только динамика плазменного уровня ПКТ позволяет дифференцировать наличие или отсутствие бактериальной инфекции у конкретного пациента [12]. Это особенно важно у пациентов после длительного ИК при иммунодефицитном состоянии [13]. Выяснению этого вопроса посвящено проводимое нами в данный момент исследование.


