Влияние условий автоселекции на биосинтез экзополисахаридов и адгезиную активность микробного консорциума
Автор: Хамагаева И.С., Занданова Т.Н., Замбалова Н.А.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 2 (41), 2013 года.
Бесплатный доступ
Показано, что при формировании микробного консорциума курунги методом автоселекции кефирной грибковой закваски и термофильных лактобактерий включаются механизмы, активизирующие синтез экзополисахаридов (ЭПС). Синтез ЭПС начинается с первых часов автоселекции и максимально концентрируется в стационарной фазе. Изменения в динамике ЭПС совпадают с динамикой снижения рН и процессами саморегуляции микрофлоры. Повышение температуры до 30 0С ускоряет изменение активной кислотности среды и скорость накопления ЭПС. Условия автоселекции способствуют повышению адгезивных свойств микробного консорциума.
Автоселекция, кефирная грибковая закваска, активная кислотность, синтез экзополисахаридов, микробный консорциум
Короткий адрес: https://sciup.org/142142665
IDR: 142142665 | УДК: 602.3:579.8
Текст научной статьи Влияние условий автоселекции на биосинтез экзополисахаридов и адгезиную активность микробного консорциума
Изучение способности молочнокислых бактерий адаптироваться к изменяющимся условиям окружающей среды имеет большие перспективы в области создания бактериальных препаратов с жизнеспособными клетками, длительное время сохраняющими свою активность.
Метаболическая гетерогенность микробных консорциумов, а также физиологобиохимические особенности клеток способствуют снижению их чувствительности к неблагоприятным внешним факторам. Особое внимание заслуживают не столько метаболические различия культур, входящих в состав этих продуктов, сколько их чувствительность к стрессовым факторам. Одна из точек зрения на причину формирования симбиотических микробных сообществ исходит из того предположения, что эти сообщества являются способом защиты микроорганизмов от неблагоприятных условий [2].
Действительно, микроорганизмы в сообществах более устойчивы к различным воздействиям: изменениям рН, температуры, лимитированию субстратами и др. В таких сообществах между видами конкуренция обнаруживается редко. Даже когда один из видов благода- ря более высокой скорости роста занимает господствующее положение, другие сохраняют жизнеспособность [4].
Одним из механизмов адаптации микроорганизмов является синтез ЭПС. Микроорганизмы в зависимости от конкретных условий существования синтезируют экзополисахариды различного состава и свойств. Экзогенные углеводы выполняют функцию саморегулятора процессов роста и развития, осуществляют важную трофическую функцию в экосистемах, регулируют состав гидроценозов, что обусловлено их большим разнообразием биохимического состава. Характеризуясь анионной природой, ЭПС проявляют сорбирующую способность по отношению к токсичным элементам [5].
До недавнего времени считалось, что бактериальная культура представляет собой сообщество независимых друг от друга клеток, способных к автономному росту. Однако в настоящее время накоплено достаточно фактов, свидетельствующих о сложности процессов, протекающих внутри бактериальной популяции, в которой клетки находятся в постоянном взаимодействии, напоминая при этом многоклеточный механизм. Свойством такой системы является кооперация отдельных клеток, когда их согласованная деятельность направлена на достижение одного и того же результата. Адаптация к факторам внешней среды обеспечивается механизмами, гарантирующими стабильность микробного консорциума. К таким механизмам относятся межклеточная когезия и адгезия бактерий [2, 3].
Цель исследования - изучить влияние стрессорных воздействий селективных условий формирования микробного консорциума курунги на биосинтез ЭПС и адгезивные свойства.
Объекты и методы исследования
В качестве объекта исследования использовали микробный консорциум для производства курунги, полученный путем автоселекции кефирной грибковой закваски и термофильных лактобактерий Lactobacillus acidophilus и Lactobacillus bulgaricus в соотношении 1:0,5:0,5 соответственно.
В исследованиях использовались как стандартные, так и современные физикохимические, биохимические и микробиологические методы исследований.
Величину активной кислотности определяли потенциометрическим методом по ГОСТ 26781.
Количество экзополисахаридов (ЭПС) определяли антроновым методом: к 1 объему микробного консорциума добавляли 4 объема дистиллированной воды и 10 объемов свежеприготовленного антронового реактива. Смесь инкубировали 10 мин при 100 0С на водяной бане. Концентрацию ЭПС устанавливали спектрометрическим методом при длине волны 620 нм. В качестве эталона использовали растворы различной концентрации.
Количественный учет микроорганизмов проводили методом предельных разведений по числу колониеобразующих единиц (КОЕ) при высевах на агаризованных лактознокартофельной и глюкозно-картофельной средах для дрожжей, сбраживаю-щих/несбраживающих лактозу, соответственно молочнокислых бактерий на среде ГМК по ТУ10-02-02-789-192-95.
Адгезивные свойства изучали на формалинизированных эритроцитах по развернутому методу В.И. Брилис [1].
Результаты и их обсуждение
Изучение биосинтеза экзополисахаридов проводили в процессе автоселекции комбинированной закваски, состоящей из кефирной грибковой закваски и термофильных лактобактерий Lactobacillus acidophilus и Lactobacillus bulgaricus; культивирование - при 200 С и 300 С. При достижении рН критического значения 3,5 ед. дальнейшее культивирование исследуемых образцов вели полунепрерывным методом путем их ежедневного раскисления обезжиренным пастеризованным молоком до титруемой кислотности 1700 Т.
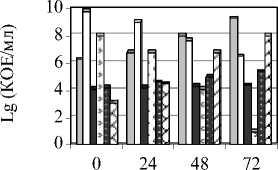
Результаты количественного учета основных групп микроорганизмов формируемого микробного консорциума представлены на рисунке 1.
Исследования влияния температуры на изменение состава микрофлоры комбинирован- ной закваски показали, что повышение температуры культивирования закваски до 30° С интенсифицирует формирование микробного консорциума (рис. 1 а). При этом создаются благоприятные условия для развития молочнокислых палочек и дрожжей, подавляется развитие стрептококков, чувствительных к высокой концентрации кислот.
В результате проведенных нами исследований установлено, что через 72 ч культивирования при 300 С формируется микробный консорциум, содержащий КОЕ/мл: мезофильных лактобактерий 3х109, лактозонесбраживающих дрожжей 8х107, термофильных лактобактерий 7х106, лактозосбраживающих дрожжей – 4х105 и ацетобактерий – 3х104 (см. рис. 1 а).
Совместно с коллективом научной лаборатории сельскохозяйственного университета Внутренней Монголии (КНР) был исследован состав лактобактерий полученного микробного консорциума и установлено присутствие следующих видов: Lactobacillus plantarum, Lactobacillus pentosus, Lactobacillus paraplantarum, Lactobacillus parabrevis, Lactobacillus brevis, Lactobacillus kefiri, Lactobacillus hilgardii, Lactobacillus acidophilus, Lactobacillus rhamnosus, Lactobacillus casei, Lactobacillus pontis, Lactobacillus reuter, Lactobacillus fermentum, Lactoba-cillu samylolyticus, Lactobacillus bulgaricus, Lactobacillus hamsteri, Lactobacillus cripatus, Lactobacillus helveticus, Lactococcus lactis subsp. lactis.
Продолжительность автоселекции, ч
-
□ мезофильные молочнокислые палочки
-
□ термофильные молочнокислые палочки
-
□ ацетобактерии
-
□ молочнокислые стрептококки
-
н дрожжи, сбраживающие лактозу
-
□ дрожжи, не сбраживающие лактозу
а
б
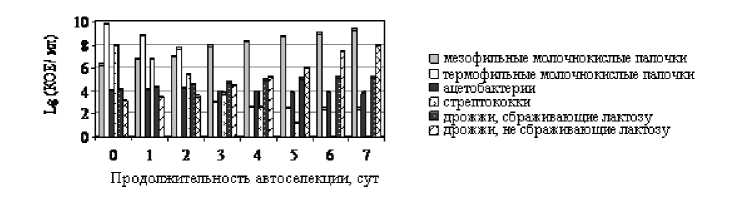
Рис. 1. Динамика количественного соотношения микроорганизмов в процессе автоселекции: а) при 300С; б) при 20°С
Полученные результаты свидетельствуют о соответствии видового состава лактобактерий микробного консорциума микрофлоре естественной курунговой закваски.
Популяционная автоселекция микрофлоры кефирной грибковой закваски и термофильных лактобактерии при 20° С длится (6–7) сут (рис. 1 б).
Снижение температуры культивирования приводит к резкому сокращению термофильных лактобацилл до 6х102 КОЕ/мл. Через (4–5) сут количество неустойчивых к высокой кислотности стрептококков и ароматообразующих бактерий достигает минимального значения.
Полученные данные свидетельствуют о том, что основными регулирующими факторами автоселекционного процесса являются температура и активная кислотность среды.
Результаты исследования динамики биосинтеза ЭПС в процессе автоселекции микробного консорциума представлены на рисунках 2 и 3.
—A— рН —X— ЭПС время, ч
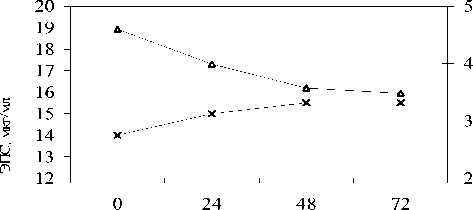
Рис. 2. Динамика экзополисахаридов и рН ферментируемой закваски в процессе автоселекции при 300С
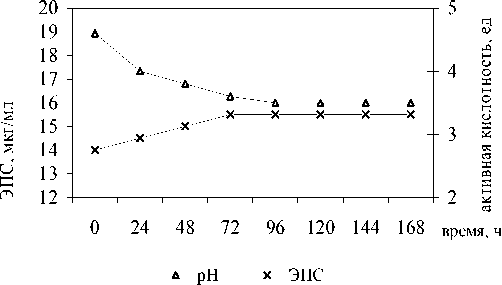
Рис. 3. Динамика экзополисахаридов и рН ферментируемой закваски в процессе автоселекции при 20 0С
Из данных, представленных на рисунке 2, видно, что синтез ЭПС начинается с первых часов автоселекции при 300 С и максимально концентрируется в стационарной фазе. Установленная динамика зеркально отражает динамику рН: прирост ЭПС по времени совпадает с резким снижением рН до 3,5, дальнейшее ведение автоселекционного процесса полунепрерывным культивированием стабилизирует рН среды и синтез ЭПС.
В варианте опыта (рис. 3), когда автоселецию проводили при 200 С, динамика была сходной, но более продолжительной: увеличение количества ЭПС в течение 72 ч сопровождало снижение рН от 4,6 до 3,5, затем, при последующей стабилизации активной кислотности, содержание ЭПС не изменялось.
На основании этих данных можно считать, что изменения в динамике ЭПС связаны с процессами саморегуляции микрофлоры. В начале автоселекционного процесса наблюдается уменьшение количества неустойчивых к низкой кислотности среды стрептококков до 106 КОЕ/мл и термофильных лактобактерий до 107 КОЕ/мл (см. рис. 1). Несмотря на неблагоприятные условия окружающей среды, популяции этих микроорганизмов сохраняются в создаваемом микробном консорциуме. Очевидно, что микроорганизмы в ответ на экстремальные условия культивирования включают эволюционно выработанные механизмы адаптации к изменениям окружающей среды, выходящим за пределы толерантности для данного вида. Прирост ЭПС в исследуемых образцах в течение автоселекции можно рассматривать как стрессовый ответ формируемого микробного консорциума на изменения рН и температуры среды. Протекторные свойства ЭПС играют защитную роль и обеспечивают существование как продуцента, так и других представителей микробного консорциума. О наличии симбиотических взаимоотношений в создаваемом микробном консорциуме свидетельствует активный рост популяции мезофильных палочек, неустойчивых к низким значениям рН среды до 4 ед. В стационарной фазе их количество в процессе автоселекции достигает 109 КОЕ/мл (см. рис.1).
При полунепрерывном культивировании (применяемой после достижения в образцах рН 3,5 ед) обеспечивается регулярный приток питательных веществ. Микробные клетки в благоприятных ростовых условиях синтезируют гидролитический фермент или комплекс ферментов, необходимых для освоения питательных субстратов, в том числе ЭПС. Вероятно, этим объяснятся прекращение увеличения количества ЭПС, при этом следует отметить, что их концентрация превышает исходный уровень на 1,5 мкг/мл.
Стрессовые условия автоселекции микрофлоры кефирной грибковой закваски и термофильных лактобактерий способствуют формированию симбиотических взаимоотношений микробных популяций, обеспечивающих высокую степень их выживаемости.
Как показали наши исследования, нахождение бактерий в составе консорциумов, несомненно, создает им определенные преимущества, например повышение биотехнологических свойств, антибиотической активности, синтез экзополисахаридов и др.
Адгезивные свойства микробного консорциума оценивали по среднему показателю адгезии (СПА), коэффициенту участия эритроцитов (КУЭ); об адгезивности культур и микробного консорциума судили по индексу адгезивности микроорганизмов (ИАМ). Согласно методике микроорганизмы считали неадгезивными при ИАМ менее 1,75, низкоадгезивными – от 1,76 до 2,5; среднеадгезивными – от 2,51 до 4,0; высокоадгезивными – при ИАМ более 4,0. В качестве объектов исследования использовали полученный автоселекцией при 300 С микробный консорциум, кефирную грибковую закваску и чистые культуры L.acidophilus, L.helveticus, L.lactissubsp. lactis, L.casei и L.bulgricus. Результаты исследования представлены в таблице.
Из данных таблицы следует, что лактобациллы по разному адгезируются к эритроцитам человека in vitro – индекс адгезивности был наиболее высоким для штамма L.casei (5,1), кефирной закваски (4,4), микробного консорциума – (4,8), L.lactis subsp. lactis (4.3), средним для L.acidophilus (2,9), умеренным для L.bulgаricus (2,4) и пониженным для L. helveticus (0,85).
Таблица
Адгезивность микробного консорциума и чистых культур лактобактерий
|
Наименование опыта |
СПА |
КУЭ |
ИАМ |
Адгезивные свойства |
|
L.acidophilus |
3,3 |
78 |
2,9 |
Среднеадгезивные |
|
L.helveticus |
0,61 |
71 |
0,85 |
Низкоадгезивные |
|
L.casei |
4,05 |
79 |
5,1 |
Высокоадгезивные |
|
L.lactis subsp. lactis |
2,6 |
60 |
4,3 |
Высокоадгезивные |
|
L.bulgаricus |
1,73 |
72 |
2,4 |
Низкоадгезивные |
|
Кефирная грибковая закваска |
3,3 |
74 |
4,4 |
Высокоадгезивные |
|
Микробный консорциум |
3,8 |
78 |
4,8 |
Высокоадгезивные |
Из полученных данных следует, что микробные сообщества, чистые культуры L.casei и L.lactis subsp. lactis обладают высокоадгезивными свойствами. Полученные результаты подтверждают данные о том, что адгезивные свойства микроорганизмов зависят от физиологического состояния, вызванных адаптацией к внешним факторам. Механизм адаптации посредством адгезии клеток регулируется содержащимися в среде внеклеточными метаболитами (экзополисахаридами, ферментами, аминокислотами и др.). Следовательно, изменения рН и температуры при автоселекции микрофлоры кефирной закваски и термофильных лактобактерий для получения микробного консорциума активизируют синтез ЭПС и повышают как его адгезивные свойства, так и отдельных, выделенных из него чистых культур. Такая способность микробного консорциума делает его и выделенные культуры устойчивыми при хранении, способными к быстрой адаптации в условиях желудочно-кишечного тракта. Это открывает широкие перспективы для применения их в производстве бактериальных препаратов при производстве кисломолочных продуктов.
Работа выполнена при поддержке РФФИ, грант № 11-09-91161/12.


