Влияние условий обработки шкур толстолобика на структуру коллагена
Автор: Антипова Л.В., Сухов И.В., Котов И.И.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (82), 2019 года.
Бесплатный доступ
Инфракрасная (ИК) спектроскопия в настоящее время является одним из основных методов анализа и идентификации органических соединений. Метод основан на пропускании инфракрасного излучения через изучаемый объект, что влечет за собой возбуждение молекул, заставляя их совершать колебательные движения. Во время этого процесса наблюдается ослабление интенсивности света, проходящего через образец. Поглощение происходит на длинных волнах, энергия которых сопоставима с энергией возбуждения колебаний в изучаемых молекулах. Это свидетельствует о наличии в молекулах образцов или функциональных групп. Тем самым можно спрогнозировать и узнать о возможном строении вещества. Авторами исследования предложен способ получения коллагенсодержащей основы. Подбор концентрации органической кислоты дает возможность получения продукта с необходимыми характеристиками. Основной задачей проведения эксперимента является охарактеристика структурных изменений в коллагеновом волокне в процессе получения гидрата коллагена...
Инфракрасная спектроскопия, коллаген, молекулы, пики поглащения
Короткий адрес: https://sciup.org/140248277
IDR: 140248277 | УДК: 639 | DOI: 10.20914/2310-1202-2019-4-53-57
Текст научной статьи Влияние условий обработки шкур толстолобика на структуру коллагена
В настоящее время ощущается нехватка пористых материалов из коллагена, которые активно используются в медицине, косметологии и пищевой промышленности Данные материалы должны обладать высокими показателями влагоемкости и при этом сохранять свойства природных биополимеров. Одним из таких материалов может быть коллаген – уникальный Для цитирования
белок соединительной ткани животных. Он отличается высоким содержанием глицина, гидроксипролина, пролина, которые придают ему жесткость и прочность. Относится к фибриллярным белкам, образуя волокнистый материал. Коллагены способны набухать в водных растворах благодаря наличию функциональных групп [1].
Наибольший интерес в этом отношении представляет рыбный коллаген, в частности
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License коллаген пресноводных рыб, благодаря особым реологическим свойствам, облегчающим его технологическую обработку (он более низкомолекулярный, чем коллаген животных, не требует обязательного гидролиза при переработке сырья, а материалы из него более эластичны). Однако данных о его взаимодействии с водой и водными средами недостаточно, а объект мало изучен. Кроме того, открытым остается вопрос о методах обработки коллагена для повышения его водопоглощающей способности.
В разное время разрабатывались различные способы получения и очистки коллагенсодержащих продуктов [2]. Но зачастую все методы включают в себя обработку сырья с использованием агрессивных сред или же основаны на применении ферментных препаратов, которые дорого стоят, что приводит к увеличению стоимости конечного продукта. В соответствии с поставленной задачей необходимо совершенствовать метод получения гидрата коллагена для достижения требуемых физико-химических показателей готового гидрата надлежащего качества, который сохраняет нативную форму и исключает денатурацию и деструкцию белковых фракций. Гидрат должен удовлетворять технологическим параметрам, необходимым для высушивания и получения губчатых коллагеновых основ с высоким показателем влагоемкости.
С помощью ИК-спектроскопии можно быстро и надежно определить наличие функциональных групп таких, как карбонильная, гидроксильная, карбоксильная, амидная, амино, циано. Есть возможность определить непредельные фрагменты: двойные и тройные углеродуглеродные связи, ароматические или гетеро-ароматические системы [5–6].
Цель исследования – идентификация структуры изменения шкуры толстолобика в процессе обработки. На каждом этапе были изучены морфологические характеристики шкур, их спектры поглощения в инфракрасной области для оценки технологических параметров обработки.
Материалы и методы
В качестве объектов исследования использовались кожи рыб толстолобика. Рыбы вылавливали в осенний период массой 700–1500 г. Шкуры отделяли вручную в лабораторных условиях при предварительном снятии чешуи, отделении хвоста, головы, жабр, плавников, зачистки внутренней поверхности от жировых тканей и прирезей мышечной ткани.
Для дальнейшей обработки использовалась средняя часть шкуры. Сырье промывали водой, выдерживали в мыльном растворе 20–30 мин, затем промывали водой и заливали раствором перекиси водорода 3% и щелочи 2 %, смесь выдерживали в течение 1 ч, затем промывали и заливали раствором органической кислоты 1,5%, после чего выдерживали не менее 3 сут.
Фиксация обеспечивает стабилизацию тканевых структур и их уплотнение, прекращает аутолиз, стабилизирует локализацию структур. Механизм действия фиксаторов основан на коагуляции белков и стабилизации липидов.
Для получения коллагеновой основы использовались следующие реактивы:
─кислота уксусная для пищевой промышленности по ГОСТ Р 55982–2014;
─раствор перекиси водорода по ГОСТ 177–88;
─гидроксид натрия по ГОСТ Р 55064–2012;
─мыло хозяйственное твердое 72% ГОСТ 30266–95;
На каждой стадии обработки шкура подвергалась исследованию ИК-спектроскопией. Структурные особенности по спектру поглощения в инфракрасной области идентифицировали на аппарате ИК-Фурье спектрометр MPA и Vertex 70. Фурье спектрометр MPA разработан для оптимизации работы и решения широкого спектра задач. Позволяет проводить исследования жидких образцов, работает в диапазоне 12 800–3 600 см -1 [5].
Результаты и обсуждения.
Для получения высушенного коллагена с сохранением пространственной структуры фибрилл необходимо получить гидрат коллагена с высокой вязкостью, меньшим гидромодулем и показателем PH, близким к нейтральному. Для решения данной задачи предлагается более глубокая очистка шкур и отделение более уплотненных участков шкур. Из строения плавников рыбы видно (рисунок 1), что в местах крепления и брюшной полости вид шкуры значительно отличается более плотной структурой. Для подтверждения данной гипотезы проведены гистоморфологические исследования.

Рисунок 1. Предпочтительные области шкуры для выделения коллагеновой основы
Figure 1. The preferred areas of the skin to highlight the collagen base
Как видно из рисунка 2, черным цветом даны области с более плотной структурой, которые следует убрать, а для дальнейшего исследования берутся области, выделенные красным цветом. В данной области шкура более однородна, меньше мышечной и соединительной ткани, чешуя отделяется легче. Для оптимизации получения коллегановой основы были проведены исследования шкур толстолобика путем заливка по Ромейсу с модификацией:
-
• вместо бензол-парафина был толуол-парафин. Так быстрее растворяется;
-
• отмывка от парафина после нарезки была толуолом;
-
• толуольное просветление и потом заключение в раствор полистирола в толуоле 0,04% и запайка в полистирол.

Рисунок 2. Срез верхнего участка шкуры приплавниковой зоны
Figure 2. Cut the upper portion of the skin at the fin zone уплотнена, что приведет в процессе выделения к более низкому разволокнению, поскольку требуется увеличение концентрации кислоты, чтобы разорвать межфибриллярные связи.
Рисунок 3. Срез среднего участка шкуры
Figure 3. Cut the middle section of the skin
В средних участках шкур наблюдается менее плотное расположение коллагеновых волокон, нити коллагена менее плотные и более рыхлой структуры. Это позволяет нам сделать вывод, что предпочтительно использовать средние участки шкуры толстолобика в производстве коллагеновой основы (рисунок 3).
Были отобраны образцы исходной шкуры толстолобика в сравнении с каждой стадией обработки шкуры с полученным гидратом коллагена (рисунок 4). Следующей задачей было изучение структурных особенностей на всех этапах технологического процесса производства коллагена.
Как видно на рисунке 2, линии фибрилл коллагена расположены равномерно, структура
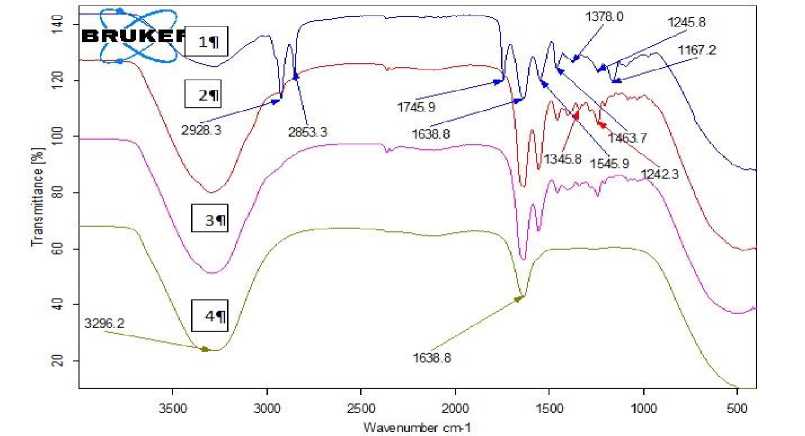
Рисунок 4. ИК-спектроскопия получения гидрата коллагена: 1 – кожа толстолобика; 2 – кожа после обработки
NаОН, перекись водорода; 3 – кожа после обработки уксусной кислотой; 4 – гидрат коллагена
Figure 4. Infrared spectroscopy of collagen producing hydrate: 1 – leather carp; 2 – skin after NаОН treatment, hydrogen peroxide; 3 – skin after acetic acid treatment; 4 – collagen hydrate
Нами были изучены образцы шкуры коллагена на 3 стадиях обработки в сравнении с исходным образцом № 1 шкуры толстолобика.
Отбирались пробы на каждой стадии обработки шкур в размере 10 г, затем образцы помещались в спектометр.
Из первого спектра колебаний исходной шкуры толстолобика наблюдается от 3500 см-1 разноупорядоченных метил и метильных группы – СО-NH-, это свидетельствует об общей структуре белковых молекул. В исходном образце отмечен пик 1570–1515 см-1 NH амид II и колебания С-N, так и в пике 1638 см-1отно-сится к вторичным аминам.
На второй стадии после обработки перекисью и щелочью эти группы исчезли. Это связано, скорей всего, с взаимодействием с перекисью водорода. Амид III наблюдается на пике 1245 см-1, пики 1378,1245 – амид II. Это говорит о том, что на участках амидных связей происходит обрыв цепей, и они могут взаимодействовать с водой. Следующие 5 пиков увеличиваются до 1790 см-1, что соответствует С=O карбоксильным группам, могут взаимодействовать с аминами. По всей видимости, происходит превращение карбоксильных групп. После взаимодействия с NаОН число этих групп увеличивается. Просматриваются валентные колебания С 2 O в области 1250–1230. Это колебания = С- О- и CH- группы. При 1067 = С-О могут проявляться спиртовые группы оксимицелиновые и оксипролиновые. Потом этот пик исчезает и количество групп уменьшается. На третьей стадии обработки при воздействии уксусной кислоты наблюдаются амиды (I, II). Аминные группы накладываются на водородные связи соединенных цепей. Это характерно для коллагеновых фибрилл [10]. На последнем этапе при взаимодействии с водой
Амиды IV-V в конце исчезают, что обуславливается высоким взаимодействием с водой.
Во время оценки структуры белковых молекул наиболее важно участие ОН-групп и образование Н-связей, поскольку гидроксильные группы в структурной связи воды с белковыми молекулами участвуют в стабилизации надмолекулярной и молекулярной организации белка [7–9]. Водородные связи ОН-группы наблюдаются в области 3400–3500 см-1. На последней стадии обработки повсеместно прослеживается связь вода-вода. В результате обработки на всех стадиях получения гидрата сохраняются неизменными полосы амид I, амид II, амид III, амид А, характерно присутствие повсеместно полипептидных связей белковых молекул [5–6]. Таким образом, полученная субстанция содержит исходную структуру, а следовательно, функции коллагена вне живого организма.
Заключение
В результате проведенных экспериментов пришли к выводу о целесообразности применения средних участков шкур пресноводных рыб (толстолобика) в технологическом процессе изготовления коллагена. Результаты говорят о морфологических отличиях на разных участках шкуры и структурных изменениях в различных стадиях обработки этих шкур. Сохранение природных свойств биополимеров открывает перспективы использования его в медицинских целях как объекта, интенсифицирующего регенерацию тканей коллагеновой природы.
Список литературы Влияние условий обработки шкур толстолобика на структуру коллагена
- Антипова Л.В., Сторублевцев С.А. Коллагены: источники, свойства, применение. Воронеж: ВГУИТ, 2014. 512 с.
- Батечко С.А. Коллаген. Новая стратегия сохранения здоровья и продления молодости. Колечково, 2010. 244 с.
- Воробьев В.И. Использование рыбного коллагена и продуктов его гидролиза // Известия Калининградского государственного технического университета. 2008. № 13. С. 55-58.
- Казицына Л.А., Куплетская Н.Б. Применение УФ-, ИК и ЯМР-спектроскопии в органической химии. М.: Высшая школа, 1971. 233 с.
- Гремлих Г.-У. Язык спектров. Введение в интерпретацию спектров органических соединений. ООО "Брукер Оптико", 2002. 94 с.
- Matthews J.A., Wnec G.E. Electrospinning of Collagen Nanofibers // Biomacromolecules. 2002. № 3 (2). P. 232-238.
- Bhattarai N., Edmondson D., Veiseh O., Matsen F.A. et al. Electrospun chitosan-based nanofibers and their cellular compatibility // Biomaterials. 2005. V. 26. № 31. P. 6176-6184.
- Mo X., Chen Z., Weber H.J. Electrospun nanofibres of collagen - chitosan and p(LLA-CL) for tissue engineering // Frontiens of medicines science in China. 2007. № 1 (1). P. 20-23.
- Li G.Y. Physicochemical properties of collagen isolated from calf limed splits // Amer. Leather Chem. Ass. 2003. V. 98. P. 224-229.
- Rennard S.I., Martin G.R., Crystal R.G. Enzyme linked immunoassay (ELISA) for connective tissue proteins: type I collagen // Immunochemistry of the extracellular matrix. 2018. P. 237-252.


