Влияние условий подготовки ооцитов и донорских клеток на эффективность соматического клонирования у домашней овцы (Ovis aries L.)
Автор: Сингина Г.Н., Лопухов А.В., Шедова Е.Н., Жукова А.С.
Журнал: Сельскохозяйственная биология @agrobiology
Статья в выпуске: 4 т.59, 2024 года.
Бесплатный доступ
Технология получения эмбрионов методом клонирования ядер соматических клеток (somatic cell nuclear transfer, SCNT) может быть применена в овцеводстве для решения задач по размножению и сохранению ценных животных, а также созданию новых генотипов методами геномного редактирования. Вместе с тем эффективность SCNT у Ovis aries остается сравнительно низкой и существует необходимость в оптимизации ее отдельных этапов. В представленной работе была поставлена цель оценить результативность технологии SCNT в зависимости от применяемой среды in vitro созревания (in vitro maturation, IVM) ооцитов, их возраста на момент начала процедуры энуклеации и переноса соматической клетки (СК) в перивителлиновое пространство полученных цитопластов (nuclear transfer, NT), а также условий подготовки СК - продолжительности их сывороточного голодания (СГ) в культуре и длительности хранения в суспензии накануне NT. Изучали воздействие перечисленных факторов на образование цитогибридов в процессе слияния энуклеированного ооцита и СК (доля слияния), а также на развитие клонированных эмбрионов (доля дробления цитогибридов). Выделенные post mortem ооцит-кумулюсные комплексы (ОКК) созревали в ТС-199 или в среде BO-IVM от «IVF Bioscience» (Великобритания). Для NT использовали ооциты с первым полярным тельцем (ППТ) в возрасте от 20 до 23 ч (с момента начала IVM), а также фетальные фибробласты (ФФБ) в качестве донорских СК. Последние накануне культивировали до 80-100 % монослоя с последующей инкубацией в условиях СГ (для синхронизации клеточного цикла) в течение 24 или 48 ч. К процедуре переноса в энуклеированный ооцит готовили суспензию ФФБ, которую хранили до NT на протяжении различных периодов времени (£ 30, 31-90, 91-150 и > 151 мин). Полученные в результате NT-реконструирования клеточные комплексы подергали процедуре электрослияния, образовавшиеся цитогибриды активировали, после чего культивировали в течение 2 сут для эмбрионального развития. Доля слияния значимо не различалась между экспериментальными группами и варьировалась от 31 до 42 %. Также не различалась доля дробления цитогибридов, если созревание ооцитов происходило в среде ТС-199 или BO-IVM (соответственно 47,1±2,40 % и 50,9±3,30 %). Когда для процедуры NT использовали ооциты с ППТ в возрасте 22 ч, выход клонированных эмбрионов составил 55,8±3,78 %. Для более ранних ооцитов результат был сопоставимым, а более возрастные (23 ч) показали его существенное ухудшение (до 39,3±6,69 %, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Ovis aries, домашняя овца, клонирование, ооциты, созревание in vitro, соматические клетки, сывороточное голодание, эмбриональное развитие
Короткий адрес: https://sciup.org/142243763
IDR: 142243763 | УДК: 636.32/.38:591.39:576.5 | DOI: 10.15389/agrobiology.2024.4.692rus
Текст научной статьи Влияние условий подготовки ооцитов и донорских клеток на эффективность соматического клонирования у домашней овцы (Ovis aries L.)
Получение эмбрионов методом клонирования ядер соматических клеток (somatic cell nuclear transfer, SCNT) — репродуктивная биотехнология с потенциалом применения в сельском хозяйстве и медицине. У овец это размножение ценных генотипов и сохранение вымирающих видов (1), а также создание методами трансгенеза и геномного редактирования новых геноти-
∗ Исследования выполнены при поддержке Министерства науки и высшего образования РФ по теме FGGN-2024-0014 (номер государственной регистрации 124020200127-7).
пов животных (1-3), в частности продуцентов биологически активных веществ, а также моделей для биомедицинских исследований (4). Кроме того, в силу умеренной стоимости и простоты содержания, а также относительно короткого периода беременности по сравнению с другими видами, представляющими зоотехнический интерес, овца — одно из модельных млекопитающих для исследований в области SCNT (5).
При клонировании из ооцита (цитопласта) удаляется собственный хромосомный материал с последующей заменой его на ядро диплоидной соматической клетки (СК) от животного, генетическую копию которого планируется получить (кариопласт). Содержимое цитопласта и кариопласта объединяется в процессе слияния в цитогибрид, активация которого позволяет запустить перепрограммирование донорского ядра в тотипотентное состояние и получить клонированный эмбрион, пригодный для трансплантации животным-реципиентам и развития до рождения живых клонов (6). Считается, что такие трансформации ядра соматической клетки (кариопла-ста) зависят от условий ее подготовки к SCNT, а также опосредуются факторами цитоплазмы ооцита, начиная с момента объединения (слияния) цитопласта и карипласта (7). При этом изучение характера указанных воздействий остается актуальным, поскольку рассматривается как способ повышения эффективности SCNT, которая у O. aries остается низкой с точки зрения как получения SCNT-эмбрионов, так и клонированного потомства (1, 7, 8).
Показано, что результативность SCNT во многом обусловлена координацией клеточного цикла соматической клетки и ооцита-реципиента, поскольку использование кариопластов в неподходящей фазе может приводить к повреждению хромосом вследствие их преждевременной конденсации и несвоевременного разрушения ядерной оболочки (9). В подавляющем большинстве работ по соматическому клонированию в качестве цитопластов применяют ооциты в метафазе II мейоза (из-за высокой активности MPF) (10) и лучшей для переноса кариопластом является клетка с диплоидным ядром в фазе G 0 /G 1 , ожидающая репликации (4, 11). Сывороточное голодание (культивирование СК в среде, содержащей экстремально низкую концентрацию ФБС) служит одним из способов синхронизации клеточного цикла донорской клетки в указанной фазе клеточного цикла (12, 13). Тем не менее в силу противоречивости данных литературы (14-16) время, в течение которого СК должны голодать, требует уточнения. Кроме того, после сывороточного голодания CК, как правило, снимают с субстрата и готовят их суспензию для использования в процедуре SCNT, но до сих пор не охарактеризовано, как влияет длительность нахождения будущих кариопластов в суспензии на развитие клонированных эмбрионов млекопитающих.
Созревание ооцитов — источников цитопластов в условиях in vitro (in vitro maturation, IVM) представляет собой важный этап получения клонированных эмбрионов. Выделенные из фолликулов яичников половые клетки самок в процессе культивирования развиваются от стадии диплотены до метафазы II мейоза (МII) — стадии, на которой, как отмечалось выше, чаще всего проводят процедуру удаления (энуклеации) собственных хромосом ооцита и их замену на хромосомы соматической клетки (nuclear transfer, NT) (17). Наряду с ядерным созреванием в ооцитах происходят различные трансформации в цитоплазме (цитоплазматическое созревание), необходимые для подготовки ооцитов к активации и последующему эмбриональному развитию (1). У мелких жвачных животных, включая овец, в основном используются протоколы IVM для крупного рогатого скота (КРС), с момента рождения овцы Долли (18) они мало изменились и, как правило предусматривают применение среды TC-199, дополненной сывороткой различного происхождения, гормонами и аминокислотами (19). Однако TC-199 — это среда, которая изначально разработана не для ооцитов млекопитающих, а для культивирования СК, и содержащаяся в ней сыворотка, хотя и служит источником эндотоксинов, аминокислот и факторов роста (20), представляет собой вариабельный компонент и может быть причиной снижения качества эмбрионов, в том числе клонированных (21). Также очевидно, что использование различных модификаций TC-199 для созревания ооцитов овец не отвечает потребностям этих клеток (с годами низкая результативность SCNT у O. aries практически не изменилась) (1, 7, 8, 19). Следовательно, условия IVM с целью получения SCNT-эмбрионов у вида O. aries требуют оптимизации. Кроме того, из-за противоречивости имеющихся данных литературы (отсутствие единых временных параметров созревания) существует необходимость в установлении подходящего возраста созревших яйцеклеток, используемых для клонирования (22-24).
В рамках представленной работы выполнена оценка возможности использования среды BO-IVM для созревания ооцитов, которая впервые показала ее сопоставимую эффективность с традиционными условиями IVM (среда ТС-199, дополненная сывороткой, гонадотропными гормонами) при получении клонированных эмбрионов овец. Кроме того, проводилась оптимизация протокола SCNT у O. aries : определен подходящий возраст (20-22 ч со старта IVM) созревших ооцитов на момент начала процедуры NT, установлена длительность (48 ч) культивирования фетальных фибробластов (ФФБ) в культуре при экстремально низких концентрациях ФБС для их остановки в фазе G 0 /G 1 и допустимое время нахождения ФФБ в суспензии перед процедурой NT, при котором не наблюдается ухудшения развития клонированных эмбрионов овец in vitro.
Цель представленной работы заключалась в оценке влияния среды in vitro созревания, возраста MII ооцитов на начало процедуры NT, а также условий подготовки ФФБ (продолжительность их сывороточного голодания в культуре и длительность хранения в суспензии накануне NT) на эффективность клонирования у O. aries . Изучали воздействие перечисленных факторов на образование цитогибридов в процессе слияния энуклеированного ооцита и соматической клетки, а также на развитие клонированных эмбрионов.
Методика . Во всех экспериментах, кроме отмеченных случаев, были использованы реагенты фирмы «Sigma-Aldrich» (США). Культивирование ооцитов, СК и эмбрионов осуществляли при температуре 38,5 ° С в атмосфере с 5 % СО 2 в воздухе. Вне инкубатора все манипуляции c данными объектами проводились при 37 ° С.
Накануне каждой процедуры SCNT необходимое количество ФФБ размораживали (25), культивировали в DMEM-Р не менее чем до 80 % монослоя, используя чашки Петри диаметром 30 мм («TPP», Швейцария), после чего ростовую среду меняли на DMEM-Р с экстремально низким содержанием ФБС (0,5 %) и инкубировали в условиях сывороточного голодания (с целью синхронизации клеточного цикла) в течение 24 или 48 ч. По окончании указанных периодов ростовую среду заменяли раствором трип-син/EDTA («Gibco», США), чашки инкубировали в термостате при 37 ° С, после чего суспензию клеток переносили в центрифужные пробирки со средой ТС-199, содержащей 0,3 % бычьего сывороточного альбумина (БСА) и 50 мкг/мл гентамицина (ТС-199Б), и осаждали (центрифуга 3-30KS, «Sigma», Германия) при 300 g в течение 7 мин. Супернатант сливали, осадок ресус-пендировали в 500 мкл среды аналогичного состава и хранили до использования при клонировании.
Подготовка ооцитов-реципиентов. Источником ооцитов служили яичники половозрелых овец разной породной принадлежности, отобранные на мясокомбинате и доставленные в лабораторию в течение 45 ч после убоя животных. Препарирование яичников и выделение из них ооцитов в составе ооцит-кумулюсных комплексов (ОКК), а также селекцию пригодных для культивирования ОКК проводили по протоколу, описанному нами ранее (26). ОКК отобранные по качеству, с целью завершения в них процесса созревания культивировали либо в среде BO-IVM («IVF Bioscience», Великобритания), либо в ТС-199, содержащей HEPES (25 мМ), Na-пируват (0,5 мМ), фолликулостимулирующий и лютеоинизирующий гормоны (по 10 мкг/мл) и 10 нг/мл эпидермального фактора роста (ЭФР) («Thermo Fisher Scientific», США), а также ФБС (10 %) и гентамицин (50 мкг/мл). Культивирование проводили в 4-луночных планшетах (ООО «Биомедикал», Россия) группами по 15-25 ОКК в каплях среды объемом 500 мкл. Через 19-23 ч IVM ооциты освобождали от клеток кумулюса (КК), инкубируя ОКК в 0,1 % растворе гиалуронидазы, с последующей дезагрегацией комплексов пипетированием, после чего проводили отбор тех ооцитов, которые достигли метафазы II мейоза (созрели in vitro), то есть имели в перивителлиновом пространстве первое полярное тельце (ППТ). Процедура освобождения ооцитов от КК проводилась в среде TC-199, содержащей ФБС (10 %) и гентамицин (50 мкг/мл) (ТС-199Ф). В этой же среде отобранные яйцеклетки хранились до использования.
Реконструирование созревших ооцитов. Перед SCNT ооциты с ППТ инкубировали в среде TC-199Ф, дополненной 7,5 мкг/мл цитохалазина Б, в течение 20 мин. После этого их вместе с ФФБ помещали в капли среды ТС-199Б объемом 20 мкл, которые были предварительно нанесены на дно чашек Петри и покрыты слоем легкого минерального масла. Микроманипуляции проводили с использованием инвертированного микроскопе Ti-U Eclipse («Nikon», Япония), совмещенного с микроманипуля-ционной техникой («Narishige», Япония). В процессе реконструирования ооциты фокусировали с помощью удерживающей пипетки в поле зрения микроскопа в положении, позволяющем четко визуализировать ППТ в пе-ривителлиновом пространстве. Микропипеткой для биопсии (внутренний диаметр 13-15 мкм) прокалывали зону пеллюцида в месте локализации ППТ, хромосомы яйцеклетки удаляли вслепую аспирацией ППТ и прилежащей к нему цитоплазмы. Соматическую клетку вводили в перивителлиновое пространство зафиксированного ооцита микропипеткой, используемой ранее для биопсии ППТ, через отверстие, сформированное в процессе энуклеации.
Полученные комплексы ооцит-соматическая клетка после кратковременного выдерживания в среде ТС-199Ф (не более 30 мин) переносили в микрокамеру для слияния («Eppendorf», Великобритания), заполненную буфером (270 мМ маннитол, 0,1 мМ MgSO 4 , 0,05 мМ СaCl 2 ) и подвергали воздействию двух импульсов постоянного тока напряжением 40 В с продолжительностью 20 мкс. Процедуру электрослияния проводили с использованием мультипоратора фирмы «Eppendorf» (Великобритания). Обработанные таким образом клеточные комплексы затем переносили в капли среды ТС-199Ф для кратковременного культивирования. Через 1 ч инкубации оценивали образование из комплексов ооцит-соматическая клетка морфологически нормальных клонированных цитогибридов и проводили их отбор.
Активация и постактивационное культивирование клонированных цитогибридов. Через 1,5-2 ч с момента отбора полученные цитогибриды активировали посредством инкубации в растворе Тироде (27), содержащем 5 мМ иономицин, в течение 5 мин c последующим культивированием сначала в течение 4 ч в среде CR1aa (28) с 6-диметиламинопури-ном (2 мМ) и циклогекседином (10 мкг/мл), а затем без указанных добавок. На 2-е сут после активации проводили морфологическую оценку раздробившихся зигот под стереомикроскопом («Nikon», Япония), используя ее как критерий эффективности развития клонированных эмбрионов.
Статистическую обработку данных проводили методом однофакторного дисперсионного анализа при помощи компьютерной программы SigmaStat («Systat Software, Inc.», США). Число независимых опытов (повторов) в каждой экспериментальной группе равнялось не менее 7. Результаты представлены в виде средних значений ( М ) и их стандартных ошибок (±SEM). Для оценки достоверности различий между сравниваемыми средними значениями использовали критерий Тьюки, при этом был принят порог значимости менее 5 %.
Результаты . Для изучения влияния условий созревания ооцитов in vitro на эффективность соматического клонирование незрелые ОКК (рис. 1, а) культивировали в среде ТС-199, содержащей ФБС, гонадотропные гормоны и ЭФР ( n = 424 ОКК) или в среде BO-IVM ( n = 637 ОКК). Доля созревания (число ооцитов с ППТ относительно исходного числа культивируемых ОКК) была сходной в обеих средах и составила соответственно 83,7 и 85,3 % (рис. 2). Дополнительно в этом и последующих исследованиях результативность SCNT оценивали по доле слияния — числу цитогибридов (см. рис. 1, д) относительно числа использованных для слияния комплексов энуклеированный ооцит-СК (см. рис. 1, г), а также по способности полученных цитогибридов после активации образовывать клонированный эмбрион (см. рис. 1, е). Доля слияния не различалась между экспериментальными группами, и составляла 38,5±3,3 и 43,3±2,6 % соответственно для ТС-199 и BO-IVM. Мы не обнаружили влияния среды IVM и на получение клонированных эмбрионов. Выход эмбрионов ранних стадий развития (см. рис. 1, е), определяемый через 2 сут культивирования цитогибридов, для среды ТС-199 составлял 47,1±2,4 %, для BO-IVM — 50,9±3,3 % (см. рис. 2).
Кроме того, мы исследовали, как влияет на результативность SCNT возраст созревших ооцитов, а именно интервала между стартом IVM и началом процедуры реконструирования ооцитов, то есть их энуклеации (см. рис. 1, б) и переноса соматической клетки (кариопласта) в перивителлиновое пространство полученных цитопластов. Сравнивали четыре возрастных интервала: ≥ 20 < 21, ≥ 21 < 22, ≥ 22 < 23, ≥ 23 ч, которые обозначили как 20, 21. 22, 23 ч. Результаты сравнительного анализа представлены в таблице 1. Доля слияния была несколько выше при интервале 20 ч по сравнению с интервалами 21, 22 и 23 ч (соответственно p = 0,077, 0,068 и 0,168), которые, в свою очередь, имели сходные между собой значения этого показателя. Тем не менее мы обнаружили влияние возраста ооцита на развитие клонированных эмбрионов. Для 22 ч доля раздробившихся цитогибридов была максимальной, она не отличалась от таковой для 20 и 21 ч, но была выше (p < 0,05), чем для 23 ч.
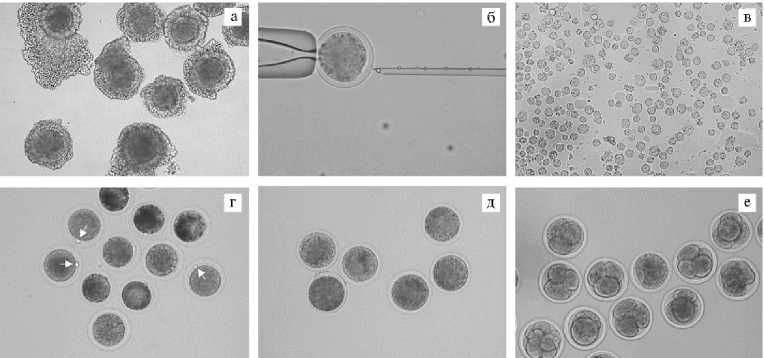
Рис. 1. Микрофотографии соматических клеток, ооцитов и эмбрионов овец ( Ovis aries L.) на этапах клонирования ядер соматических клеток (somatic cell nuclear transfer, SCNT) : а — выделенные из яичников и отобранные для культивирования ооцит-кумулюсные комплексы, б — процедура энуклеации ооцитов с первым полярным тельцем, в — снятые с субстрата фетальные фибробласты в суспензии, г — комплексы энуклеированный ооцит-соматическая клетка (соматические клетки отмечены стрелками), д — цитогибриды, е — клонированные эмбрионы. Микроскоп Eclipse Ti-U («Nikon», Япония): а, г-е — увеличение ½100; б, в — увеличение ½200.
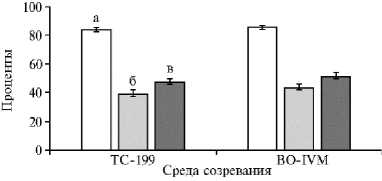
Рис. 2. Результативность клонирования ядер соматических клеток (somatic cell nuclear transfer, SCNT) у овец ( Ovis aries L.) в зависимости от среды созревания ооцитов — источников цитопластов: а — доля созревания, б — доля слияния, в — доля дробления ( M ±SEM). Для среды ТС-199 n = 20, для BO-IVM («IVF Bio-science», Великобритания) n = 32.
1. Результативность клонирования ядер соматических клеток (somatic cell nuclear transfer, SCNT) у овец ( Ovis aries L.) в зависимости от возраста созревших ооцитов на момент начала процедуры NT
|
Возраст ооцита, ч |
Число повторов |
Число комплексов ооцит-СК |
Получено цитогибридов |
Доля раздробившихся цито гибридов, %, M ±SEM |
|
|
n |
%, M ±SEM |
||||
|
20 |
11 |
170 |
68 |
42,2±3,32 |
49,8±5,10аб |
|
21 |
9 |
151 |
47 |
32,2±4,23 |
48,6±6,77аб |
|
22 |
10 |
153 |
47 |
31,0±4,23 |
55,8±3,78а |
|
23 |
9 |
134 |
46 |
33,7±5,07 |
39,3±6,69б |
Примечание. NT — процедура микрохирургической энуклеации ооцита с последующим переносом в его перивителлиновое пространство соматической клетки (СК) и, как следствие, получением комплексов ооцит-СК. а, б Средние значения для одной группы, помеченные разными буквами, статистически достоверно различаются при p < 0,05.
2 . Результативность клонирования ядер соматических клеток (somatic cell nuclear transfer, SCNT) у овец ( Ovis aries L.) в зависимости от длительности сывороточного голодания (СГ) культуры фетальных фибробластов — источников ка-риопластов
|
Длительность СГ |
Число повторов |
Число комплексов ооцит-СК |
Получено цитогибридов |
Доля раздробившихся цитогибридов, %, M ±SEM |
|
|
n |
%, M ±SEM |
||||
|
24 ч |
15 |
228 |
77 |
34,3±3,30 |
45,0±4,21 |
|
48 ч |
19 |
304 |
100 |
33,2±3,53 |
55,4±4,50* |
|
* Различия с группой 24 ч СГ статистически значимы при p < 0,05. |
|||||
3 . Результативность клонирования ядер соматических клеток (somatic cell nuclear transfer, SCNT) у овец ( Ovis aries L.) в зависимости от длительности хранения суспензионной формы фетальных фибробластов (ФФБ) перед процедурой NT
|
Время хранения ФФБ, мин |
Число повторов |
Число комплексов ооцит-СК |
Получено цитогибридов |
Доля раздробившихся цитогибридов, %, M ±SEM |
|
|
n |
%, M ±SEM |
||||
|
≤ 30 |
12 |
182 |
66 |
35,8±3,95 |
47,4±4,21 |
|
31-90 |
12 |
188 |
68 |
36,5±4,16 |
56,6±4,65 |
|
91-150 |
7 |
119 |
37 |
32,2±5,83 |
49,3±6,10 |
|
> 151 |
8 |
115 |
44 |
37,6±4,81 |
40,8±7,63* |
Пр им еч ани е. NT — процедура микрохирургической энуклеации ооцита с последующим переносом в его перивителлиновое пространство соматической клетки (СК) и, как следствие, получением комплексов ооцит-СК. Длительность хранения ФФБ в целом была не менее 15 мин и не превышала 240 мин.
* Различия с группой 31-90 мин статистически значимы при p = 0,081.
Для получения клонированных эмбрионов в качестве кариопластов мы использовали фетальные фибробласты, условия подготовки которых также были предметом исследования в настоящей работе. В частности, мы оценили влияние продолжительности сывороточного голодания ФФБ в культуре, а также длительности их хранения в суспензии накануне NT на результативность SCNT. В первом случае ФФБ культивировали в условиях экстремально низких концентраций ФБС в течение 24 или 48 ч. Доля слияния энуклеированного ооцита и СК не различалась между экспериментальными группами (табл. 2) и имела примерно те же значения, что и при оценке влияния среды созревания ооцитов (см. рис. 2, табл. 2). В то же время доля раздробившихся цитогибридов была ниже при голодании в течение 24 ч, тогда как с удлинением этого периода до 48 ч анализируемый показатель увеличивался на 10,4 % (p < 0,05) (см. табл. 2). Во втором исследовании ФФБ снимали с субстрата и хранили до NT в виде суспензии на протяжении разного времени: < 30, 31-90, 91-150 и > 151 мин. Длительность хранения ФФБ не повлияла на результативность объединения энуклеированного ооцита и СК: доля слияния варьировалась от 32 до 37 % (табл. 3). Не наблюдалось также значимых различий между сравниваемыми вариантами по способности полученных цитогибридов к эмбриональному развитию. Тем не менее доля развития клонированных эмбрионов при использовании ФФБ, хранившихся до NT от 31 до 90 мин, была самой высокой (56,6 %), а более 150 мин — самой низкой (40,8 %). К тому же между указанными вариантами различия были на уровне тенденции (p = 0,076).
Экстракорпоральное созревание — важный этап технологии соматического клонирования, условия которого у O. aries остаются субоптимальными и служат объектом дальнейших исследований (19). В представленной работе мы попытались оптимизировать эти условия, впервые сравнив две среды IVM — наиболее популярную ТС-199 (19, 29), дополненную ФБС, гонадотропными гормонами, ЭФР, и BO-IVM от фирмы «IVF Bioscience». Данные об использовании BO-IVM в литературе лимитированы, но есть сообщения, указывающие на ее высокую эффективность при получении эмбрионов КРС (30, 31), а также на перспективность применения этой среды для созревания ооцитов овец in vitro (32). Сравниваемые среды одинаково обеспечивали созревание овечьих ооцитов: для ТС-199 и BO-IVM доля созревания составила соответственно 83,7 и 85,3 % (см. рис. 2). Об отсутствии различий между исследуемыми вариантами IVM также сообщали I. Bunder-son с соавт. (32). По их данным, в аналогичных условиях культивирования до стадии МII мейоза развивается соответственно 75 и 73 % ооцитов. Результаты SCNT (выход слившихся цитогибридов и клонированных эмбрионов) при использовании ооцитов, созревших в ТС-199 и BO-IVM, также были сходными (см. рис. 2) и, кроме этого, аналогичными таковым, полученным другими авторами в традиционных условиях IVM (12, 23, 33). Таким образом, в сравнении с ТС-199 среда BO-IVM на этапе созревания ооцитов не изменяет эффективность соматического клонирования у овец (по крайней мере по анализируемым параметрам) и может стать ее альтернативной заменой. Кроме того, у среды BO-IVM есть несомненное преимущество — упрощение и стандартизация процедуры подготовки ооцитов к этапу NT.
Соблюдение длительности культивирования ооцитов in vitro — важное условие приобретения ими способности к последующему эмбриональному развитию (29). В выполненном исследовании мы впервые в сравнительном аспекте определили возраст (от старта IVM), который должны иметь зрелые ооциты овец на момент начала процедуры NT. Отметим, что имеющиеся данные литературы (22-24) по этому вопросу довольно противоречивы: сравнительной оценки по исследуемому показателю, насколько нам известно, не проводили, а у разных авторов можно встретить какое-то одно исходное время. Минимальный возраст яйцеклетки составлял 20 ч, как в работе S. Deng с соавт. (23), максимальный — 23,6 ч, как в статье Y.R. Yuan с соавт. (24) с шагом 1 ч, возраст яйцеклетки — 20 ч, как в работе S. Deng с соавт. (23), максимальный — 23,6 ч, как в статье Y.R. Yuan с соавт. (24), с шагом 1 ч. Наибольший выход клонированных эмбрионов ранних стадий развития (55,8 %) наблюдался при использовании MII ооцитов в возрасте 22 ч (см. табл. 1), по более ранним ооцитам результаты были сопоставимы, а более возрастные показали существенное ухудшение (до 39,3 %, p < 0,05). Вероятно, что в MII ооцитах наиболее возрастной категории к моменту их активации инициировались процессы старения, которые, как известно, негативно влияют на качество яйцеклеток (34), что, следовательно, могло стать причиной снижения их компетенции к последующему эмбриональному развитию (25).
Сывороточное голодание (СГ), то есть культивирование СК в среде с экстремально низким содержанием ФБС, считается эффективным методом обратимой остановки развития соматических клеток в фазе G0/G1 перед их использованием в качестве донорских в SCNT у разных видов животных (35, 36), включая овец (12, 13). Тем не менее длительность СГ до сих пор остается предметом дискуссий и требует уточнения (13). В представленной работе CК (ФФБ) накануне NT мы синхронизировали голоданием в течение 24 и 48 ч. В результате более длительное культивирование ФФБ в среде, содержащей 0,5 % ФБС, повышало выход клонированных эмбрионов, но не влияло на долю слияния цитопластов и кариопластов (см. табл. 2). При выборе вариантов мы руководствовались данными литературы, свидетельствующими, что более продолжительное культивирование СК в присутствии экстремально низких концентраций ФБС, с одной стороны, повышает эффективность синхронизации клеток в фазе G0/G1 (36, 37), с другой — в них возрастает уровень апоптотической дегенерации (15, 37), и после использования таких СК в качестве цитопластов наблюдаются низкие показатели развития клонированных эмбрионов (13, 38, 39). Другие данные демонстрируют, что СГ культуры клеток в течение 24 ч достаточно для получения более высоких результатов развития клонированных бластоцист КРС, чем при синхронизации клеточного цикла СК методом контактного ингибирования. Тем не менее в представленной нами работе СГ ФФБ в течение 24 ч оказалось менее результативным с точки зрения получения клонированных эмбрионов овец по сравнению с 48 ч, что, возможно, связано с видовыми особенностями используемых нами СК (13, 39).
Как известно, при подготовке к NT соматические клетки снимают с субстрата и готовят их суспензию. Как долго СК могут хранится в таком состоянии — вопрос, на который мы постарались ответить в своем исследовании в силу практической необходимости и отсутствия такой информации в работах других авторов. СК хранили в среде ТС-199 c БСА на протяжении всего периода NT. При этом ухудшения способности к слиянию с цитопластом мы не выявили (32-37 %), равно как и значимых различий в развитии клонированных эмбрионов (см. табл. 3). Тем не менее более благоприятным для эмбрионального развития оказалось время хранения СК от 31 до 90 мин, менее результативным — период, превышающий 150 мин.
Итак, мы установили, что у овец эффективность получения клонированных эмбрионов ранних стадий развития зависит от возраста ооцитов — времени между стартом IVM (in vitro maturation) и началом процедуры NT (nuclear transfer), а также от продолжительности сывороточного голодания культуры фетальных фибробластов накануне NT. Применительно к описанному нами протоколу оптимальные значения этих параметров — соответственно 20-22 и 48 ч. Также показано, что на этапе созревания ооцитов овец среда BO-IVM («IVF Bioscience», Великобритания) обеспечивает сопоставимые с традиционной средой TC-199 результаты SCNT (somatic cell nuclear transfer) — долю слияния цитопластов и кариопластов, а также долю дробления полученных цитогибридов. Следовательно, BO-IVM может служить альтернативой среде TC-199 при получении клонированных эмбрионов овец. Для достижения более стабильных показателей эмбрионального развития время хранения соматических клеток в суспензии перед процедурой NT не должно превышать 150 мин, для более высоких показателей — находиться в диапазоне от 31 до 90 мин. В целом выявленные закономерности можно считать предварительными, так как тестируемые факторы могут оказывать долгосрочные эффекты (в частности, на развитие клонированных эмбрионов до стадии бластоцисты и их качество), при изучении которых между исследованными вариантами могут проявиться более значимые различия.
Список литературы Влияние условий подготовки ооцитов и донорских клеток на эффективность соматического клонирования у домашней овцы (Ovis aries L.)
- Vazquez-Avendaño J.R., Ambríz-García D.A., Cortez-Romero C., Trejo-Córdova A., Navarro-Maldonado M.D.C. Current state of the efficiency of sheep embryo production through somatic cell nuclear transfer. Small Ruminant Research, 2022, 212: 106702 (doi: 10.1016/j.smallrumres.2022.106702).
- Perisse I.V., Fan Z., Singina G.N., White K.L., Polejaeva I.A. Improvements in gene editing technology boost its application in livestock. Frontiers in Genetics, 2021, 11: 614688 (doi: 10.3389/fgene.2020.614688).
- Shakweer W.M.E., Krivoruchko A.Y., Dessouki S.M., Khattab A.A. A review of transgenic animal techniques and their applications. Journal of Genetic Engineering and Biotechnology, 2023, 21(1): 55 (doi: 10.1186/s43141-023-00502-z).
- Polejaeva I.A. 25th Anniversary of cloning by somatic cell nuclear transfer: Generation of genetically engineered livestock using somatic cell nuclear transfer. Reproduction, 2021, 162(1): F11-F22 (doi: 10.1530/REP-21-0072).
- Loi P., Czernik M., Zacchini F., Iuso D., Scapolo P.A., Ptak G. Sheep: the first large animal model in nuclear transfer research. Cellular Reprogramming, 2013, 15(5): 367-373 (doi: 10.1089/cell.2013.0032).
- Gurdon J.B. The egg and the nucleus: a battle for supremacy. Development, 2013, 140(12): 2449-2456 (doi: 10.1242/dev.097170).
- Latham K.E. Early and delayed aspects of nuclear reprogramming during cloning. Biol. Cell., 2005, 97: 119-132. (doi: 10.1042/BC20040068).
- Srirattana K., Kaneda M., Parnpai R. Strategies to improve the efficiency of somatic cell nuclear transfer. International Journal of Molecular Sciences, 2022, 23(4): 1969 (doi: 10.3390/ijms23041969).
- Wang X., Qu J., Li J., He H., Liu Z., Huan Y. Epigenetic reprogramming during somatic cell nuclear transfer: recent progress and future directions. Frontiers in Genetics, 2020, 11: 205 (doi: 10.3389/fgene.2020.00205).
- Wu B., Ignotz G., Currie W.B., Yang X. Dynamics of maturation-promoting factor and its constituent proteins during in vitro maturation of bovine oocytes. Biology of Reproduction, 1997, 56(1): 253-259 (doi: 10.1095/biolreprod56.1.253).
- Campbell K.H.S., Choi I., Zhu J., Fulka J. Cell cycle regulation in cloning. In: Principles of cloning: Second Edition, Academic Press, 2013: 149-160 (doi: 10.1016/B978-0-12-386541-0.00012-6).
- Yagcioglu S., Ersoy N., Demir K., Birler S., Pabuccuoglu S. Can roscovitine and trichostatin A be alternatives to standard protocols for cell cycle synchronization of ovine adult and foetal fibroblast cells? Reproduction in Domestic Animals, 2023, 58(9): 1251 (doi: 10.1111/rda.14425).
- Ma L., Liu X., Wang F., He X., Chen S., Li W. Different donor cell culture methods can influence the developmental ability of cloned sheep embryos. PLoS ONE, 2015, 10(8): e0135344 (doi: 10.1371/journal.pone.0135344).
- Miranda Mdos S., Bressan F.F., Zecchin K.G., Vercesi A.E., Mesquita L.G., Merighe G.K., King W.A., Ohashi O.M., Pimentel J.R., Perecin F., Meirelles F.V. Serum-starved apoptotic fibroblasts reduce blastocyst production but enable development to term after SCNT in cattle. Cloning Stem Cells, 2009, 11(4): 565-73 (doi: 10.1089/clo.2009.0028).
- Park H.J., Koo O.J., Kwon D.K., Kang J.T., Jang G., Lee B.C. Effect of roscovitine-treated donor cells on development of porcine cloned embryos. Reproduction in Domestic Animals, 2010, 45(6): 1082-1088 (doi: 10.1111/j.1439-0531.2009.01499.x).
- Rodrigues L.L.V., Moura Y.B.F., Viana J.V.D.S., de Oliveira L.R.M, Praxedes É.A., Vieira J.B., Sales S.L.A., Silva H.V.R., Luciano M.C.D.S., Pessoa C., Pereira A.F. Full confluency, serum starvation, and roscovitine for inducing arrest in the G0/G1 phase of the cell cycle in puma skin-derived fibroblast lines. Animal Reproduction, 2023, 20(1): e20230017 (doi: 10.1590/1984-3143-AR2023-0017).
- German S.D., Campbell K.H.S. Livestock somatic cell nuclear transfer. In: Sustainable food production /P. Christou, R. Savin, B.A. Costa-Pierce, I. Misztal, C.B.A. Whitelaw (eds.). Springer, New York, 2013: 1067-1095 (doi: 10.1007/978-1-4614-5797-8_2).
- Wilmut I., Schnieke A.E., McWhir J., Kind A.J., Campbell K.H. Viable offspring derived from fetal and adult mammalian cells. Nature, 1997, 385(6619): 810-3 (doi: 10.1038/385810a0).
- Falchi L., Ledda S., Zedda M.T. Embryo biotechnologies in sheep: achievements and new improvements. Reproduction in Domestic Animals, 2022, 57(Suppl 5): 22-33 (doi: 10.1111/rda.14127).
- McKiernan S.H., Bavister B.D. Different lots of bovine serum albumin inhibit or stimulate in vitro development of hamster embryos. In vitro Cellular and Developmental Biology, 1992, 28A: 154-156 (doi: 10.1007/bf02631084).
- Sagirkaya H., Misirlioglu M., Kaya A., First N.L., Parrish J.J., Memili E. Developmental potential of bovine oocytes cultured in different maturation and culture conditions. Animal Reproduction Science, 2007, 101: 225-240 (doi: 10.1016/j.anireprosci.2006.09.016).
- Hosseini S.M., Moulavi F., Foruzanfar M., Hajian M., Abedi P., Rezazade-Valojerdi M., Parivar K., Shahverdi A.H., Nasr-Esfahani M.H. Effect of donor cell type and gender on the efficiency of in vitro sheep somatic cell cloning. Small Ruminant Research, 2008, 78: 162-168 (doi: 10.1016/j.smallrumres.2008.06.004).
- Deng S., Li G., Zhang J., Zhang X., Cui M., Guo Y., Liu G., Li G., Feng J., Lian Z. Transgenic cloned sheep overexpressing ovine toll-like receptor 4. Theriogenology, 2013, 80(1): 50-57 (doi: 10.1016/j.theriogenology.2013.03.008 ).
- Yuan Y., Liu R., Zhang X., Zhang J., Zheng Z., Huang C., Cao G., Liu H., Zhang X. Effects of recipient oocyte source, number of transferred embryos and season on somatic cell nuclear transfer efficiency in sheep. Reproduction in Domestic Animals, 2019, 54(11): 1443-1448 (doi: 10.1111/rda.13546).
- Singina G.N., Lopukhov A.V., Shedova E.N. In vitro development of cloned embryo in cattle in relation with fusion and activation parameters. Sel'skokhozyaistvennaya Biologiya [Agricultural Biology], 2020, 55(2): 295-305 (doi: 10.15389/agrobiology.2020.2.295eng).
- Singina G.N., Lukanina V.A., Shedova E.N., Chinarov R.Yu., Gladyr E.A., Tsyndrina E.V. The results of production and transplantation of IVEP embryos in sheep (Ovis aries). Sel'skokhozyaistvennaya Biologiya [Agricultural Biology], 2023, 58(6): 1088-1099 (doi: 10.15389/agrobiology.2023.6.1088rus).
- Bavister B.D., Liebfried M.L., Lieberman G. Development of preimplantation embryos of the golden hamster in a defined culture medium. Biology of Reproduction, 1993, 28: 235-247 (doi: 10.1095/biolreprod28.1.235).
- Rosenkrans C.F.Jr., First N.L. Effect of free amino acids and vitamins on cleavage and develop-mental rate of bovine zygotes in vitro. Journal of Animal Science, 1994, 72(2): 434-437 (doi: 10.2527/1994.722434x).
- Zhu J., Moawad A.R., Wang C.Y., Li H.F., Ren J.Y., Dai Y.F. Advances in in vitro production of sheep embryos. International Journal of Veterinary Science and Medicine, 2018, 27(6 Suppl): S15-S26 (doi: 10.1016/j.ijvsm.2018.02.003).
- Nielsen J.M.K., Wrenzycki C., Hyttel P., Poppicht F., Strøbech L. New culture media affects blastocyst development and gene expression levels in in vitro-produced bovine embryos. Reproduction, Fertility, and Development, 2014, 27(1): 206-207 (doi: 10.1071/RDv27n1Ab234).
- Gutierrez-Castillo E., Ming H., Foster B., Gatenby L., Mak C.K., Pinto C., Bondioli K., Jiang Z. Effect of vitrification on global gene expression dynamics of bovine elongating embryos. Reproduction Fertility and Development, 2021, 33(5): 338-348 (doi: 10.1071/RD20285).
- Bunderson I., Liu Y., Polejaeva I. Effects of serum-free maturation medium and resveratrol supplementation on ovine oocyte maturation and quality. Reproduction, Fertility and Development, 2024, 36(2): 263 (doi: 10.1071/RDv36n2Ab207).
- Demir K., Pabuccuoğlu S., Cirit Ü., Evecen M., Karaman E., Özdaş Ö.B., Alkan S., Attala H., Birler S. Effects of serum starvation and ionomycin activation on the development of somatic cell nuclear transfer embryos in sheep. Ankara Üniversitesi Veteriner Fakültesi Dergisi, 2019, 66: 37-42 (doi: 10.1501/Vetfak_0000002885).
- Shirazi A., Bahiraee A., Ahmadi E., Nazari H., Heidari B., Borjian S. The effect of the duration of in vitro maturation (IVM) on parthenogenetic development of ovine oocytes. Avicenna J. Med. Biotechnol., 2009, 1(3): 181-191.
- Cho J.K., Lee B.C., Park J.I., Lim J.M., Shin S.J., Kim K.Y., Lee B.D., Hwang W.S. Development of bovine oocytes reconstructed with different donor somatic cells with or without serum starvation. Theriogenology, 2002, 57(7): 1819-1828 (doi: 10.1016/s0093-691x(01)00699-9).
- Nguyen V.K., Somfai T., Salamone D., Thu Huong V.T., Le Thi Nguyen H., Huu Q.X., Hoang A.T., Phan H.T., Thi Pham Y.K., Pham L.D. Optimization of donor cell cycle synchrony, maturation media and embryo culture system for somatic cell nuclear transfer in the critically endangered Vietnamese Ỉ pig. Theriogenology, 2021, 166: 21-28 (doi: 10.1016/j.theriogenology.2021.02.008).
- Sadeghian-Nodoushan F., Eftekhari-Yazdi P., Dalman A., Eimani H., Sepehri H. Mimosine as well as serum starvation can be used for cell cycle synchronization of sheep granulosa cells. Chinese Journal of Biology, 2014, 2014: 851736 (doi: 10.1155/2014/851736).
- Gómez N.A., Ramírez M.M., Ruiz-Cortés Z.T. Primary fibroblast cell cycle synchronization and effects on handmade cloned (HMC) bovine embryos. Ciencia Animal Brasileira, 2018, 2018: e48555 (doi: 10.1590/1809-6891v19e-48555).
- Жукова А.С. Способы синхронизации клеточного цикла кариопластов для повышения результативности соматического клонирования сельскохозяйственных животных. Гены и клетки, 2024, 19(3): 630218 (doi: 10.17816/gc630218).


