Влияние внутривенного введения стволовых клеток на показатели антиоксидантной системы почек крыс после нанесения дефекта кости
Автор: Серкина А.Н.
Журнал: Juvenis scientia @jscientia
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.7, 2021 года.
Бесплатный доступ
Введение. Нарушение функциональной активности почек после перелома кости значительно увеличивает сроки восстановления больных, риск развития осложнений и инвалидизации. В последнее время для восстановления как костной, так и почечной ткани стали использовать мезенхимальные стволовые клетки. Наше исследование было посвящено изучению влияния стволовых клеток на процессы перекисного окисления липидов (ПОЛ) и работу антиоксидантной системы после нанесения костной травмы.
Крысы, перелом, мезенхимальные стволовые клетки, почки, перекисное окисление липидов, антиоксидантная система
Короткий адрес: https://sciup.org/14121389
IDR: 14121389
Текст научной статьи Влияние внутривенного введения стволовых клеток на показатели антиоксидантной системы почек крыс после нанесения дефекта кости
Original article
THE EFFECT OF INTRAVENOUS STEM CELLS INJECTION ON THE INDICATORS OF THE ANTIOXIDANT SYSTEM OF KIDNEYS OF RATS AFTER APPLICATION OF A BONE DEFECT
A. N. Serkina
Saint Luka Lugansk State Medical University
1G quarter of the 50th anniversary of Defense of Lugansk, 91045 Lugansk, Ukraine
Introduction. Dysfunction of the kidneys after a bone fracture significantly increases the recovery time of patients, the risk of complications and disability. Recently, mesenchymal stem cells have been used to restore both bone and kidney tissue. Our study was devoted to the study of the effect of stem cells on the processes of lipid peroxidation (LPO) and the work of the antioxidant system after bone injury.
Materials and methods. The study was carried out on 120 male white rats weighing from 190 to 225 grams, which were divided into 3 groups: K – control animals, D – animals that were inflicted with a defect in both tibia (TBC), DM – animals that received corrections were injected intravenously allogeneic mesenchymal stem cells. The study was carried out on the 7th, 15th, 30th, 60th and 90th days after the operation. The activity of lipid peroxidation (LPO) was determined by the level of malondialdehyde (MDA), the activity of the non-enzymatic link of the antioxidant defense was determined by the level of reduced glutathione (GSH).
Results. After the application of the bone defect, there was a significant increase in the level of MDA, as well as a decrease in the level of reduced glutathione. More pronounced changes were observed on the 7th day after the operation. After intravenous injection of stem cells, a faster recovery (from day 7) of the studied parameters took place.
Conclusion. The use of cell therapy after the application of the LBC defect leads to a more rapid restoration of the work of the non-enzymatic link of the antioxidant system and a pronounced decrease in lipid peroxidation.
Введение. Почки и костная ткань достаточно тесно связаны еще с периода эмбриогенеза. Почки играют важную роль в формировании и развитии костей благодаря регуляции гомеостаза кальция и фосфатов, необходимых для минерализации костного матрикса. Большое количество веществ, синтезируемых почками – кальцитриол, костный морфогенетический белок-7, эритропоэтин – принимают участие в различных стадиях формирования, ремоделирования и восстановления кости. Также почки влияют на некоторые биологически активные молекулы (остеопротегерин, скле-ростин, фактор роста фибробластов, паратгормон), которые играют важную роль в метаболизме костей [1]. Поэтому не удивительно, что от сроков восстановления функциональной активности почек будет зависеть и сроки восстановления костной ткани после перелома. В результате травмы происходит централизация кровообращения, в кровь поступают продукты воспаления, гибели клеток, активные формы кислорода, продукты перекисного окисления липидов и др., происходит увеличение образования оксида азота (II), разрушающего клетки и приводящего к запуску апоптоза [2, 3, 4]. Эти неблагоприятные факторы приводят к гипоксии почек, нарушению их структуры и функций. В последнее время использование стволовых клеток во многих областях медицины, в том числе и регенеративной, показывает хорошие результаты не только благодаря их способности к самообновлению и дифференцировке, но и проявлению системных эффектов, ускоряющих процессы восстановления [5, 6]. Мезенхимальные стволовые клетки (МСК) обладают иммуномодулирующими и антиапоптотическими свойствами, за счет секреции биологически активных пептидов, тканевых гормонов, переноса митохондрий и микровезикул с РНК. Они усиливают антимикробную активность моноцитов и нейтрофилов, подавляют синтез воспалительных молекул, NO, угнетают перекисное окисление липидов, апоптоз и гипоксию [7, 8, 9]. В связи с этим большое значение имеет изучение изме- нения показателей антиоксидантной защиты клеток почек, в частности, уровней каталазы и СОД, после нанесения костного дефекта и внутривенного введения мезенхимальных стволовых клеток.
Цель исследования. Установить изменение показателей перекисного окисления липидов в почечной ткани по уровню малонового диальдегида, неферментативного звена антиоксидантной системы по уровню восстановленного глутатиона после нанесения дефекта ББК и внутривенного введения МСК.
Материалы и методы. Материалом служили почки 120 самцов белых беспородных крыс с массой тела 190-225 г. Животные распределялись на группы следующим образом: К – контрольная группа, Д – животным наносили сквозной дефект (d=2,00 мм) на границе проксимального метафиза и диафиза ББК, СД – животным наряду с нанесением дефекта вводили в хвостовую вену 5 млн МСК на 3-и (СД3), 10-е (СД10), 15-е (СД15) сутки после операции. Для получения МСК питательной средой из ББК вымывали костный мозг, помещали его в среду Игла-МЕМ с L-глютамином, 10% телячьей эмбриональной сывороткой и антибиотиком и выращивали 2 недели в СО 2 -инкубаторе HF151UV при 37 ° С. Для оценки жизнеспособности клеток использовали тест с трипановым синим. Фенотипирование проводили методом непрямой флюоресценции с помощью маркеров к МСК – моноклональных антител CD-73, CD-105, CD-44, CD-90 и CD-54. Во время проведения эксперимента крысы содержались в стандартных условиях вивария в соответствии с нормами, указанными в Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и научных целей [10]. На 7-е, 15-е, 30-е, 60-е и 90-е сутки крыс выводили из эксперимента путем декапитации под эфирным наркозом и выделяли почки. После выделения, почки помещали в раствор сахарозы и измельчали в гомогенизаторе. Уровень МДА (как маркера активности процессов липопероксидации) определяли реакцией
|
Группа |
Срок наблюдения (сут.) |
МДА (мкмоль/л) |
|
К |
7 |
0,72±0,02 |
|
15 |
0,73±0,01 |
|
|
30 |
0,76±0,002 |
|
|
60 |
0,78±0,01 |
|
|
90 |
0,79±0,002 |
|
|
Д |
7 |
1,65±0,02* |
|
15 |
1,36±0,002* |
|
|
30 |
0,79±0,004* |
|
|
60 |
0,77±0,01 |
|
|
90 |
0,80±0,01 |
|
|
СД3 |
7 |
1,53±0,02*^ |
|
15 |
0,82±0,01*^ |
|
|
30 |
0,74±0,01^ |
|
|
60 |
0,76±0,01 |
|
|
90 |
0,78±0,01 |
|
|
СД10 |
15 |
0,82±0,01*^ |
|
30 |
0,73±0,002*^ |
|
|
60 |
0,75±0,01 |
|
|
90 |
0,79±0,01 |
|
|
СД15 |
30 |
0,72±0,002*^ |
|
60 |
0,75±0,01 |
|
|
90 |
0,79±0,01 |
|
Группа |
Срок наблюдения (сут.) |
GSH (мМ) |
|
К |
7 |
0,166±0,003 |
|
15 |
0,164±0,001 |
|
|
30 |
0,163±0,002 |
|
|
60 |
0,159±0,001 |
|
|
90 |
0,157±0,002 |
|
|
Д |
7 |
0,09±0,01* |
|
15 |
0,12±0,003* |
|
|
30 |
0,14±0,001* |
|
|
60 |
0,158±0,001 |
|
|
90 |
0,156±0,002 |
|
|
СД3 |
7 |
0,12±0,003*^ |
|
15 |
0,14±0,002*^ |
|
|
30 |
0,162±0,0004^ |
|
|
60 |
0,16±0,001 |
|
|
90 |
0,157±0,001 |
|
|
СД10 |
15 |
0,13±0,002*^ |
|
30 |
0,162±0,0002^ |
|
|
60 |
0,159±0,001 |
|
|
90 |
0,157±0,001 |
|
|
СД15 |
30 |
0,161±0,0002^ |
|
60 |
0,159±0,001 |
|
|
90 |
0,156±0,002 |
Таблица 1
Значения МДА в почечной ткани крыс после нанесения дефекта ББК и внутривенного введения МСК
Таблица 2
Значения GSH в почечной ткани крыс после нанесения дефекта ББК и внутривенного введения МСК
Примечание:
* – значимые различия по сравнению с контрольной группой (р≤0,05);
^ – значимые различия по сравнению с животными группы Д.
с 2-тиобарбитуровой кислотой (в присутствии Н+) и спектрофотометра СФ-46 с λ=532 нм, уровень GSH-реакцией с 5,5-дитио-бис-(2-ни-тробензойной) кислотой (реактив Эллмана). Далее проводили спектрофотометрию на приборе СФ-46 (λ=400 нм). Данные обрабатывали методами вариационной статистики
(лицензионная версия Microsoft Office Excel), приводили в соответствие с Международной системой единиц, анализировали на нормальность распределения с использованием критерия Колмогорова-Смирнова. Статистическую значимость отклонений оценивали с использованием критерия Стьюдента (в слу- чае нормального распределения) либо Манна-Уитни (в случае ненормального распределения). Различия считали значимыми при значениях р<0,05.
Результаты. Нами было установлено, что уровень продуктов липопероксидации и показателей антиоксидантной системы напрямую зависит от сроков наблюдения и достоверно изменяется после внутривенного введения МСК.
Уровни малонового диальдегида у животных групп Д и СД резко увеличивались по сравнению с контрольными животными (таблица 1).
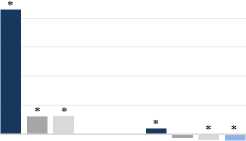
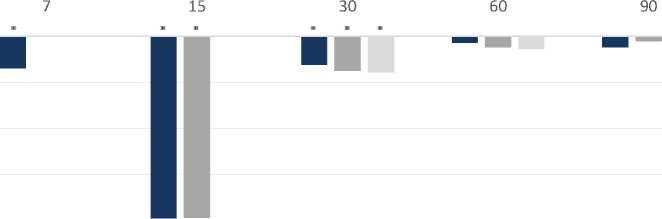
По сравнению с контрольными крысами значения МДА у животных группы Д достоверно возрастали на 7-е, 15-е и 30-е сутки на 128,93%, 85,99% и 3,82%. В группе СД3 данный показатель был выше на 7-е и 15-е сутки на 112,76% и 12,37%. По отношению к показателям оперированных животных значения МДА в группе СД3 уменьшались с 7-е по 30-е сутки на 7,06%, 39,58% и 6,24% (рисунок 1).
После введения стволовых клеток на 10-е сутки показатели малонового диальдегида возрастали на 15-е сутки на 12,70% и снижа-лисьна 30-е сутки на 4,08% в сравнении с животными группы К. Если сравнивать данный показатель с крысами группы Д, то происходило достоверное снижение на 15-е и 30-е сутки на 39,40% и 7,61% соответственно.
У животных группы СД15 уровень МДА достоверно уменьшался только на 30-е сутки: по сравнению с контролем на 4,36%, по сравнению с крысами группы Д – на 7,88% (рисунок 2).
Показатели работы неферментативного звена антиоксидантной системы в почках крыс контрольной группы на протяжении всего срока исследования постепенно снижались (таблица 2).
Уровни GSH после нанесения костного дефекта резко снижались с 7-х по 30-е сутки наблюдения на 45,58%, 29,25% и 11,31% с постепенным восстановлением к 90-м суткам по сравнению с животными группы К (рисунок 3).
После применения клеточной терапии на
3-и сутки после операции показатели восстановленного глутатиона снижались на 7-е и 15-е сутки на 28,21% и 16,81% в сравнении с группой К и увеличивались с 7-х по 30-е сутки на 31,90%, 17,58% и 12,05% в сравнении с группой Д. При введении МСК на 10-е сутки после нанесения дефекта показатели восстановленного глутатиона снизились по сравнению с группой К на 15-е сутки на 19,52% и выросли по отношению к животным группы Д на 15-е и 30-е сутки на 13,75% и 11,73%. У животных группы СД15 уровень GSH значимо изменялся только в сравнении с группой оперированных животных – увеличивался на 30-е сутки на 11,03% (рисунок 4).
На 60-е и 90-е сутки исследования значимых отличий уровня МДА и GSH от показателей контрольных животных и крыс группы Д выявлено не было.
Обсуждение. Данные нашего исследования свидетельствуют о резком снижении уровня восстановленного глутатиона в почечных гомогенатах и значительном повышении уровня МДА (как маркера процессов ПОЛ) после нанесения дефекта ББК. Причем степень выраженности отклонений зависит от сроков исследования и максимальна на 7-е сутки после операции. Данная динамика свидетельствует об истощении запасов антиоксидантной системы и активации процессов ПОЛ, а также повреждении клеток почек, являющихся очень чувствительными к действию стрессовых факторов [6, 7]. Нами установлено, что внутривенное введение МСК после костной травмы приводит к значимому увеличению показателей неферментативного звена антиоксидантной системы, а значит, снижению ПОЛ и повреждения почечной паренхимы. При этом функциональная активность почек восстанавливается быстрее. Эти эффекты стволовых клеток проявляются за счет снижения продукции конечных метаболитов оксида азота, активных форм кислорода, уменьшения фрагментации ДНК и апоптоза, увеличения продукции факторов роста и противовоспалительных цитокинов, иммуносупрессии, усиления анти-
140,00
120,00
100,00
80,00
60,00
40,00
20,00
0,00
‐20,00

15 30 60
Д СД3 СД10 СД15
‐10
‐20
‐30
‐40
Рисунок 1. Изменения значений малонового диальдегида в гомогенатах почек после нанесения дефекта и введения МСК (в % по отношению к группе К). Примечание: на этом и последующих рисунках: * – обозначает значимые различия по сравнению с соответствующей группой сравнения (р≤0,05).
‐50
СД3 СД10 СД15
Рисунок 2. Изменения значений малонового диальдегида в гомогенатах почек после нанесения дефекта и введения МСК (в % по отношению к группе Д).
10,00
0,00
‐10,00
‐20,00
‐30,00
‐40,00
‐50,00


30 60 90

Д СД3 СД10 СД15
Рисунок 3. Изменения значений восстановленного глутатиона в гомогенатах почек после нанесения дефекта и введения МСК (в % по отношению к группе К).
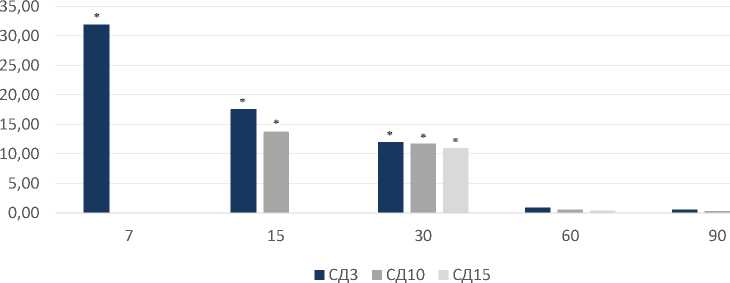
Рисунок 4. Изменения значений восстановленного глутатиона в гомогенатах почек после нанесения дефекта и введения МСК (в % по отношению к группе Д).
бактериальной активности моноцитов и нейтрофилов, уменьшения гипоксии [11, 12, 13]. Оптимальными сроками введения МСК, по нашим данным, являются 3-и сутки после нанесения дефекта. При этом восстановление показателей наблюдается уже с 7-х суток по сравнению с оперированными животными.
Заключение. Нанесение костного дефекта сопровождается значительным увеличением уровня МДА – основного маркера процессов перекисного окисления липидов – и снижением активности восстановленного глутатиона – неферментативного звена антиокислительной системы почечной ткани – из-за увеличения образования активных форм кислорода. Такая динамика демонстрирует высокую чувствительность ткани почек к окислительному стрессу. Использование МСК в качестве корректора в ранние сроки после нанесения дефекта приводит к скорейшему восстановлению уровня исследуемых показателей, а значит, и функции почек. Наш эксперимент подтверждает целесообразность дальнейшего исследования влияния МСК на восстановление функций других органов и тканей после нанесения дефекта кости.
Список литературы Влияние внутривенного введения стволовых клеток на показатели антиоксидантной системы почек крыс после нанесения дефекта кости
- Wei K, Yin Z, Xie Y. Roles of the kidney in the formation, remodeling and repair of bone. J Nephrol. 2016;29(3):349-357. DOI: 10.1007/s40620-016-0284-7.
- Васильев А.В. Ниши стволовых клеток и регенеративная медицина // Российский физиологический журнал им. И.М. Сеченова. 2016. Т. 102. № 3. С.241-261. [Vasiliev AV. Niches of stem cells and regenerative medicine. Russian Journal of Physiology. 2016;102(3):241-261. (in Russ)].
- Демьяненко Е.В. Влияние мезенхимальных стволовых клеток на показатели перекисного окисления липидов и антиоксидантной защиты сыворотки крови и почечной ткани крыс при остром иммобилизационном стрессе // Современные проблемы науки и образования. 2018. № 6. С. 78-88. [Demyanenko EV. Influence of mesenchymal stem cells on the parameters of lipid peroxidation and antioxidant protection of blood serum and renal tissue of rats in acute immobilization stress. Modern problems of science and education. 2018;(6):78-88. (in Russ)].
- Кирпатовский В.И. Возможности клеточной терапии в восстановлении нарушенной функции органов мочеполовой системы // Вопросы реконструктивной и пластической хирургии. 2016. № 1(56). С. 60-67. [Kirpatovsky VI. Possibilities of cell therapy in restoring the impaired function of the organs of the genitourinary system. Issues of reconstructive and plastic surgery. 2016;1(56):60-67. (in Russ)].
- Лузин В.И. Способ получения культуры аллогенных мезенхимальных стволовых клеток лабораторных крыс для оптимизации репаративной остеорегенерации // Материалы научно-практической конференции с международным участием «Актуальные вопросы травматологии и ортопедии мирного и военного времени». 2019. № 2. С. 93-94 [Luzin VI. Method of obtaining culture of allogeneic mesenchymal stem cells of laboratory rats for optimization of reparative osteoregeneration. Materials ofthe scientific-practical conference with international participation "Topical issues of traumatology and orthopedics in peacetime and wartime". 2019;(2):93-94. (in Russ)].
- Демьяненко Е.В. Влияние мезенхимальных стволовых клеток на показатели перекисного окисления липидов и антиоксидантной защиты сыворотки крови и почечной ткани крыс при остром иммобилизационном стрессе // Современные проблемы науки и образования. 2018. № 6. С. 78-
- [Demyanenko EV. Influence of mesenchymal stem cells on the parameters of lipid peroxidation and antioxidant protection of blood serum and renal tissue of rats in acute immobilization stress. Modern problems of science and education. 2018;(6):78-88. (in Russ)].
- Rajasekar S, Anjum M, Prashant K, et al. An Overview on Stem Cells in Tissue Regeneration. Current Pharmaceutical Design. 2019;25(18). DOI: 10.2174/1381612825666190705211705.
- Arvidson K, Abdallah BM, Applegate LA, et al. Bone regeneration and stem cells. J Cell Mol Med. 2011;15(4):718-746. DOI: 10.1111/j.1582-4934.2010.01224.x.
- Einhorn TA, Gerstenfeld LC. Fracture healing: mechanisms and interventions. Nat Rev Rheumatol. 2015;11(1):45-54. DOI:10.1038/nrrheum.2014.164.
- Figliomeni A, Signorini V, Mazzantini M. One year in review 2018: progress in osteoporosis treatment. Clin Exp Rheumatol. 2018;36(6):948-958. PMID: 30526765
- Андреева Е.Р. Мультипотентные мезенхимальные стромальные клетки и внеклеточный матрикс: особенности регуляции при гипоксии // Физиология человека. 2018. Т. 44. № 6. С. 104-114 [Andreeva ER. Multipotent mesenchymal stromal cells and extracellular matrix: regulation features in hypoxia. Human Physiology. 2018;6(44):104-114. (in Russ)].
- Abdel Meguid E, Ke Y, Ji J, El-Hashash AHK. Stem cells applications in bone and tooth repair and regeneration: New insights, tools, and hopes. J Cell Physiol. 2018;233(3):1825-1835. DOI: 10.1002/jcp.25940.
- Spees JL, Lee RH, Gregory CA. Mechanisms of mesenchymal stem/stromal cell function. Stem Cell Res Ther. 2016;7(1):125. DOI: 10.1186/s13287-016-0363-7.


