Влияние высокоуглеводной высокожировой диеты на возрастные изменения миокарда у крыс
Автор: С.В. Логвинов, Л.Р. Мустафина, Б.К. Курбатов, М.А. Сиротина, С.А. Горбунов, Н.В. Нарыжная
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.38, 2023 года.
Бесплатный доступ
Связанный с долголетием рост сердечно-сосудистых заболеваний и метаболических нарушений актуализирует исследование влияния высококалорийных диет на старение сердца. Цель исследования: экспериментальное изучение влияния высокоуглеводной высокожировой диеты (ВУВЖД) на миокард в молодом и старческом возрасте. Материал и методы. Проведено морфологическое исследование миокарда в четырех группах крыс-самцов линии Вистар: группа 1 – 150-дневные животные, содержавшиеся на стандартном рационе; группа 2 – 150-дневные крысы, содержавшиеся на ВУВЖД в течение 90 сут (с 60-дневного возраста); группа 3 – 540-дневные животные, содержавшиеся на стандартном рационе; группа 4 – 540-дневные крысы, содержавшиеся на ВУВЖД в течение 90 сут (с 450-дневного возраста). Иммуноферментным методом в сыворотке крови определяли концентрацию фибронектина, трансформирующего фактора роста (ТФР) бета-1, фактора роста соединительной ткани (ФРСТ). Результаты. В группах 2–4 выявлены лейкостазы, очаговая лимфо-моноцитарная инфильтрация стромы миокарда, увеличение количества кардиомиоцитов с кариопикнозом и отеком перинуклеарной зоны саркоплазмы, контрактурными нарушениями, увеличение удельного объема соединительной ткани стромы. Поражение кардиомиоцитов и фиброз были наиболее выражены в группе 4. ВУВЖД повышала концентрацию фибронектина как у молодых, так и у старых животных с преобладанием в группе 4, вызывала тенденцию к повышению содержания ТФРбета-1, ФРСТ в сыворотке крови. Таким образом, ВУВЖД ускоряет и усиливает возрастные изменения миокарда белых крыс.
Возрастные изменения миокарда, высокоуглеводная высокожировая диета, контрактурные изменения кардиомиоцитов, фибронектин, трансформирующий фактор роста бета-1, фактор роста соединительной ткани
Короткий адрес: https://sciup.org/149141585
IDR: 149141585 | УДК: 611.127:616.127-092.9]-06:613.25.038 | DOI: 10.29001/2073-8552-2023-38-1-90-98
Текст научной статьи Влияние высокоуглеводной высокожировой диеты на возрастные изменения миокарда у крыс
the authors do not declare a conflict of interest the study of myocardial changes in young rats with induced metabolic syndrome was supported by the Russian Science Foundation Grant /22-25-20001/ and funds from the Administration of the Tomsk Region. Studies of myocardial changes in old rats with induced metabolic syndrome were carried out within the framework of the state task 122020300042-4. The work was performed using the Center for Collective Use “Medical Genomics”.
Logvinov S.V., Mustafina L.R., Kurbatov B.K., Sirotina M.A., Gorbunov A.S., Naryzhnaya N.V. Influence of a high-carbohydrate high-fat diet on age-related changes in the myocardium in rats. The Siberian Journal of Clinical and Experimental Medicine. 2023;38(1):90–98. https://doi. org/10.29001/2073-8552-2023-38-1-90-98.
Увеличение продолжительности жизни людей приводит к росту сердечно-сосудистых заболеваний и метаболических нарушений, связанных со старением [1]. Повышение во всем мире числа больных с метаболическим синдромом, являющимся предиктором болезней сердца, стимулировало проведение экспериментального исследования данной патологии и разработку ее диетических моделей, максимально приближенных к пищевым погрешностям у человека [2, 3]. Однако влияние высококалорийных диет на развитие возрастных нарушений сердца, структурные основы сердечной патологии, вызванной высокоуглеводной высокожировой диетой (ВУВЖД), в различных возрастных группах еще далеки от исчерпывающего понимания. Знания о взаимодействии двух патогенетических факторов – старения и ВУВЖД – необходимы для разработки профилактики и лечения возрастных диабетических кардиомиопатий.
Цель настоящей работы: экспериментальное изучение влияния ВУВЖД на миокард в молодом и старческом возрасте.
Материал и методы
Исследование проведено на крысах-самцах линии Вистар в возрасте 60 и 450 дней. Все процедуры соответствовали Директиве Европейского парламента 2010/63/ EU и заявлению FASEB о принципах использования животных в исследованиях и образовании. Экспериментальные группы формировали следующим образом: группа 1 ( n = 14) – интактные 150-дневные (5-месячные) крысы, содержавшиеся на стандартном рационе в течение 90 сут (с 60-дневного возраста); группа 2 ( n = 14) –
150-дневные крысы, содержавшиеся на ВУВЖД в течение 90 сут (с 60-дневного возраста); группа 3 (n = 14) – интактные 540-дневные (18-месячные) крысы, содержавшиеся на стандартном рационе в течение 90 сут (с 450-дневного возраста); группа 4 (n = 14) – 540-дневные крысы, содержавшиеся на ВУВЖД в течение 90 сут (с 450-дневного возраста). ВУВЖД включала 16% белков, 21% жиров, 46% углеводов, в том числе 17% фруктозы, 0,125% холестерина. Вода была заменена 20%-м раствором фруктозы. Крысам групп 1 и 3 (интактным животным) давали стандартный корм для грызунов (белки – 24%, жиры 6%, углеводы – 44%) и чистую воду ad libitum. Из эксперимента животных выводили путем декапитации с предварительной анестезией хлоралозой (100 мг/кг внутрибрюшинно). Перед декапитацией забирали образцы крови, которые центрифугировали (15 мин 3000 об/мин), образцы сыворотки хранили в морозильной камере при –70 °C. Иммуноферментным методом в сыворотке крови определяли концентрацию фибронектина (rat ab108850, Abcam), трансформирующего фактора роста (ТФР) бета-1 (transforming growth factor beta-1, TGFβ-1) (rat ab119558, Abcam), фактора роста соединительной ткани (ФРСТ) (connective tissue growth factor, CTGF) (rat SEA010Ra Cloud-Clone). Образцы измеряли с помощью микроплан-шетного ридера Infinite 200 PRO (Tecan GmbH, Австрия). Для гистологического исследования стенку сердца разрезали на кусочки толщиной 2–3 мм, фиксировали в 10%-м растворе забуференного формалина в течение 24 ч, промывали в проточной воде и обезвоживали в растворе для гистологической обработки на основе абсолютизированного изопропилового спирта Изопреп (ООО «БиоВитрум», Санкт-Петербург). После обезвоживания образцы миокарда заливали в гомогенизированную парафиновую среду для заливки BioPlast («BioOptica», Италия). Гистологические срезы толщиной 5–7 мкм, полученные при помощи ротационного механического микротома HM 325 (Thermo Scientific, США), окрашивали гематоксилином и эозином, а также по Ван Гизону, используя красители ООО «БиоВитрум» (Санкт-Петербург). Окрашенные препараты заключали в синтетическую монтирующую среду BioMount («BioOptica», Италия) и изучали под световым микроскопом Axio Lab.A1 («Carl Zeiss», Германия). Микрофотографии гистологических препаратов получали с помощью фотокамеры Axiocam 105 color («Carl Zeiss», Германия). В миокарде левого желудочка подсчитывали среднее содержание в поле зрения микроскопа кардиомиоцитов с кариопикнозом, перинуклеарным отеком саркоплазмы, контрактурными изменениями, а также содержание неизмененных кардиомиоцитов. Подсчет кардиомиоцитов производили в 10 независимых полях зрения срезов миокарда левого желудочка каждого сердца при увеличении 400 крат, площадь поля зрения составила 0,785 мм2. С помощью окулярной сетки Автандилова определяли удельные объемы (%) соединительной ткани стромы миокарда, окрашенной по Ван Гизону.
Статистическую обработку данных проводили с использованием программы STATISTICA 13.0 (StatSoft Inc., США). Полученные данные прошли проверку на согласие распределения с нормальным законом с помощью критерия Шапиро – Уилка. Данные, не соответствовавшие нормальному распределению, представляли в виде медианы и квартилей ( Ме ( Q 1– Q 3)). Проверку на гомогенность дисперсий производили с использованием критерия Левене. Статистическую значимость различий показателей в группах при апостериорных сравнениях оценивали по критерию Манна – Уитни с поправками Бонферрони. Исходное пороговое значение значимости p было принято равным 0,05; с учетом поправки Бонфер-рони пороговый уровень значимости различий показателей в каждом из 6 апостериорных парных сравнений групп составил 0,0127.
Результаты
В сердцах крыс группы 1 (рис. 1А) зарегистрировано обычное строение подавляющего большинства кардиомиоцитов, соединительнотканной стромы, сосудов миокарда, а также эпикарда и эндокарда. У крыс группы 2 миокард характеризовался лейкостазами в просвете части венул (рис. 1Б), очагами инфильтрации стромы клетками преимущественно лимфоцитарно-моноцитарного ряда (рис. 1В). Имели место очаги пролиферации соединительной ткани между мышечными волокнами различной величины, иногда довольно обширные. Небольшая доля кардиомиоцитов была подвержена деструктивным изменениям в виде гомогенизации саркоплазмы, кариопикно-за и дистопии ядер (рис. 1Г).
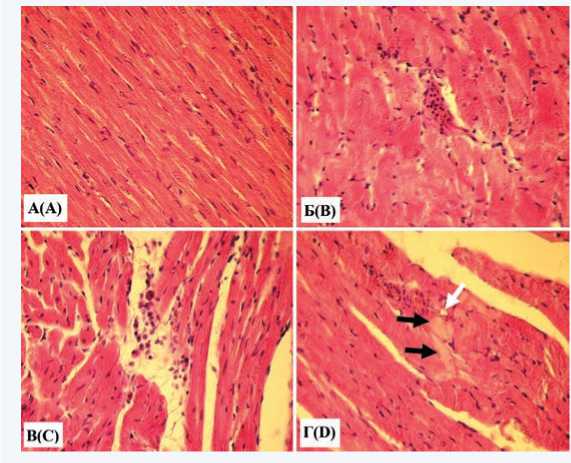
Рис. 1. Гистологические изменения сердца, связанные с высоко-углеводной высокожировой диетой, у 5-месячных крыс: А – обычное строение миокарда, группа 1; Б – лейкостаз в венуле миокарда (стрелка), группа 2; В – инфильтрация стромы миокарда клетками лимфо-моноцитарного ряда (стрелка), группа 2;
Г – гомогенное гипохромное окрашивание саркоплазмы кардиомиоцитов (черная стрелка), кариопикноз (белая стрелка), группа 2. Окраска гематоксилином и эозином. Увеличение х 400
Fig. 1. Histological changes in the heart associated with HСHFD in 5-month-old rats: A – normal structure of the myocardium, group 1;
B – leukostasis in myocardial venule (arrow), group 2; C – infiltration of the myocardial stroma by cells of the lympho-monocytic series (arrow), group 2; D – homogeneous hypochromic staining of myocardial cells sarcoplasm (black arrow), karyopyknosis (white arrow), group 2. Staining with hematoxylin and eosin. Magnification x 400
В миокарде животных группы 3 обнаруживалось разрастание коллагеновых волокон между кардиомиоцитами и в периваскулярных областях, но указанные изменения носили очаговый характер (рис. 2А).
Особенно заметна пролиферация соединительнотканных клеток, среди которых весьма часто выявлялись моноциты, макрофаги, фибробласты и лимфоциты (рис. 2Б). Стенка артерий и вен была утолщена в основном за счет адвентиции, часть гладких миоцитов средней оболочки вакуолизирована. Нередкой находкой являлись стаз и сладж эритроцитов в сосудах микроциркулятор- ного русла. Перикард имел очаговые утолщения за счет пролиферации соединительной ткани, что сопровождалось инфильтрацией его лимфоцитами и клетками моноцитарно-макрофагального ряда (рис. 2В). Значительная доля кардиомиоцитов была подвержена деструктивным нарушениям в виде кариопикноза, гомогенизации саркоплазмы. Отмечены контрактурные изменения, проявлявшиеся эозинофильными полосами в саркоплазме, извитостью мышечных волокон (рис. 2Г). Наряду с этим верифицировались гипертрофические изменения некоторых ядер кардиомиоцитов.
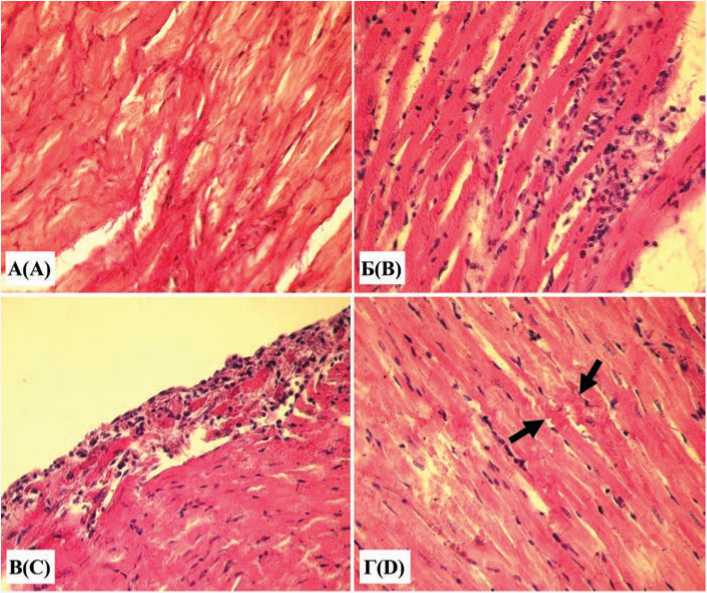
Рис. 2. Гистологические изменения сердца 18-месячных белых крыс, содержавшихся на обычной диете (группа 3): А – разрастание коллагеновых волокон, обладающих фуксинофилией (красный цвет), между кардиомиоцитами; Б – выраженная пролиферация клеток стромы миокарда; В – клеточная инфильтрация перикарда; Г – контрактурные изменения кардиомиоцитов (стрелки). Окраска: А – по Ван Гизону; Б, В, Г – гематоксилином и эозином. Увеличение х 400
Fig. 2. Histological changes in the heart of 18-month-old white rats kept on a normal diet (group 3): A – proliferation of collagen fibers with fuchsinophilia (red color) between cardiomyocytes; B – pronounced proliferation of myocardial stroma cells; С – cellular infiltration of the pericardium; D – contracture changes in cardiomyocytes (arrows). Staining: A according to Van Gieson; B, C, D – with hematoxylin and eosin. Magnification x 40
В группе 4 наблюдались выраженные деструктивные изменения значительного количества кардиомиоцитов, проявлявшиеся потерей поперечной исчерченности и гомогенным прокрашиванием саркоплазмы, утратой сродства к эозину либо очаговой повышенной эозинофилией, кариопикнозом и дистопией ядер к периферии мышечного волокна (рис. 3А). В некоторых кардиомиоцитах возникал отек, опустошение перинуклеарной зоны цитоплазмы, проявлявшееся резким снижением ее сродства к красителям (рис. 3Б).
Отмечалась фрагментация части сердечных мышечных волокон (рис. 3В). Обнаруживались лейкостазы в венулах, прикраевое стояние лимфоцитов и миграция их в соединительную ткань стромы. Имела место очаговая выраженная лимфо-моноцитарная инфильтрация перикарда, разрастание в нем соединительнотканных волокон. Сформированы обширные очаги фиброза в миокарде (рис. 3Г). Для количественной оценки степени поражения миокарда левого желудочка подсчитывали среднее содержание в поле зрения микроскопа неизмененных и измененных кардиомиоцитов. В качестве критериев повреждения кардиомиоцитов использовали такие отчетливо выявляемые морфологические изменения, как кариопикноз кардиомиоцитов, проявляющийся гиперконденсацией хроматина, гиперхромией кариоплазмы, сморщиванием ядра (см. рис. 3А, В); отек перинуклеарной зоны саркоплазмы, выявляемый в виде просветленного широкого ободка вокруг ядра (см. рис. 3Б); онтрактурные изменения, проявлявшиеся эозинофильными полосами в саркоплазме, извитостью мышечных волокон (см. рис. 2Г). Следует отметить, что указанные признаки нередко сочетались в одном и том же кардиомиоците.
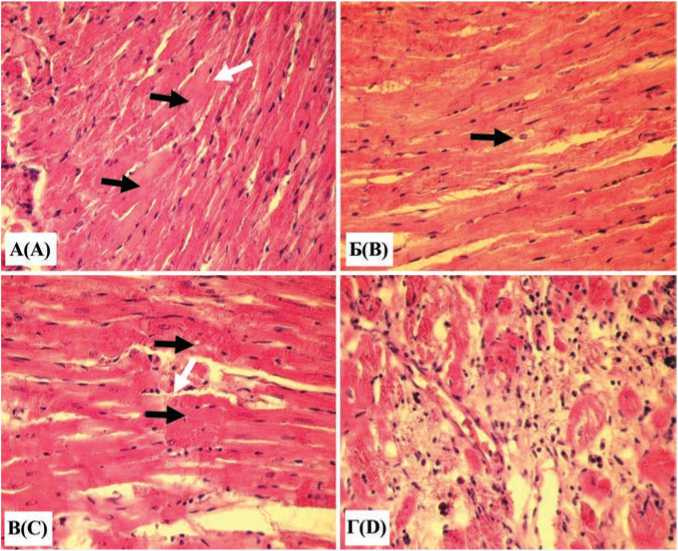
Б(В)
P(D)
В(С)
Рис. 3. Гистологические изменения сердца 18-месячных белых крыс, содержавшихся на высокоуглеводной высокожировой диете (группа 4): А – деструктивные нарушения кардиомиоцитов, проявляющиеся утратой поперечной исчерченности, гомогенным окрашиванием саркоплазмы (черные стрелки), кариопикнозом и дистопией ядер (белые стрелки); Б – отек перинуклеарной зоны саркоплазмы кардиомиоцита (стрелки); В – фрагментация, глыбчатый распад кардиомиоцитов (черные стрелки), кариопикноз (белая стрелка); Г – очаг фиброза в миокарде. Окраска гематоксилином и эозином. Увеличение х 400
Fig. 3. Histological changes in the heart of 18-month-old albino rats kept on HСHFD (group 4): A – destructive disorders of myocardial cells, manifested by the loss of striation, homogeneous staining of the sarcoplasm (black arrows), karyopyknosis and nuclear dystopia (white arrows); B – edema of the perinuclear zone of the sarcoplasm of the myocardial cell (arrows); C – fragmentation, clumpy disintegration of myocardial cells (black arrows), karyopyknosis (white arrow); D – focus of fibrosis in the cardiac muscle. Staining with hematoxylin and eosin. Magnification x 400
Проведенный количественный анализ показал (табл. 1), что в группе 2 значимо снижалось содержание неизмененных (нормальных) кардиомиоцитов, возраста- ло количество кардиомиоцитов с кариопикнозом и отеком перинуклеарной зоны саркоплазмы по сравнению с таковым в группе 1.
Таблица 1. Морфологические изменения кардиомиоцитов и стромы левого желудочка сердца под влиянием высокоуглеводной высокожировой диеты, Me ( Q 1 – Q 3 )
Table 1. Morphological changes in myocardial cells and stroma of the left ventricle of the heart under the influence of HFHCD, Me ( Q 1 – Q 3 )
|
Группы Groups Показатели Indicators |
Крысы 5 мес. без ВУВЖД 5-month-old rats without HCHFD |
Крысы 5 мес. на ВУВЖД 5-month-old rats at HCHFD |
Крысы 18 мес. без ВУВЖД 18-month-old rats without HCHFD |
Крысы 18 мес. на ВУВЖД 18-month-old rats at HCHFD |
Уровень значимости Significance level |
|
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
Группа 4 Group 4 |
||
|
Неизмененные кардиомиоциты Normal myocardial cells |
31,2 (30,6–31,5) |
29,9 (29,3–30,2) |
26,0 (25,6–26,4) |
23,8 (21,3–24,7) |
р 1–2 = 0,000340 р 1–3 = 0,000003 р 2–3 = 0,000037 р 1–4 = 0,000001 р 2–4 = 0,000030 р 3–4 = 0,007950 |
|
Кариопикноз каридомиоцитов Karyopyknosis of myocardial cells |
0,4 (0,3–0,4) |
1,3 (1,2–1,5) |
2,5 (2,2–2,7) |
3,1 (1,9–6,0) |
р 1–2 = 0,000004 р 1–3 = 0,000003 р 2–3 = 0,000003 р 1–4 = 0,000001 р 2–4 = 0,000001 р 3–4 = 0,251210 |
|
Перинуклеарный отек в кардиомиоцитах Perinuclear edema in myocardial cells |
0,5 (0,3–0,6) |
1,2 (0,9–1,3) |
1,5 (1,4–1,5) |
1,4 (1,2–2,1) |
р 1–2 = 0,00004 р 1–3 = 0,000003 р 2–3 = 0,000037 р 1–4 = 0,00001 р 2–4 = 0,01561 р 3–4 = 0,60473 |
Окончание табл. 1
End of table 1
|
Группы Groups Показатели Indicators |
Крысы 5 мес. без ВУВЖД 5-month-old rats without HCHFD |
Крысы 5 мес. на ВУВЖД 5-month-old rats at HCHFD |
Крысы 18 мес. без ВУВЖД 18-month-old rats without HCHFD |
Крысы 18 мес. на ВУВЖД 18-month-old rats at HCHFD |
Уровень значимости Significance leve |
|
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
Группа 4 Group 4 |
||
|
Контрактурные изменения кардиомиоцитов Contracture changes in myocardial cells |
0,1 (0–0,2) |
0,1 (0,1–0,1) |
1,1 (1,0–1,5) |
1,1 (0,9–2,5) |
р 1–2 = 0,79501 р 1–3 = 0,000003 р 2–3 = 0,000003 р 1–4 = 0,00001 р 2–4 = 0,00001 р 3–4 = 0,34937 |
|
Всего кардиомиоцитов в поле зрения Total myocardial cells in view |
32,0 (31,0–32,2) |
32,4 (31,8–32,8) |
31,4 (30,8–32,0) |
29,5 (29,1–30,9) |
р 1–2 = 0,165860 р 1–3 = 0,122911 р 2–3 = 0,503240 р 1–4 = 0,00449 р 2–4 = 0,010573 р 3–4 = 0,072001 |
|
Удельные объемы соединительной ткани, % Specific volumes of co -nective tissue, % |
6,8 (6,4–7,2) |
8,8 (8,6–9,2) |
9,2 (8,4–9,2) |
11,2 (10,8–11,2) |
р 1–2 = 0,000001 р 1–3 = 0,000022 р 2–3 = 0,494507 р 1–4 = 0,000001 р 2–4 = 0,000001 р 3–4 = 0,000006 |
Примечание: р 1-2 – уровень статистической значимости различий между группамии 1 и 2, р 1-3 – уровень статистической значимости различий между группами 1 и 3, р 2-4 – уровень статистической значимости различий между группами 2 и 4, р 3-4 – уровень статистической значимости различий между группами 3 и 4.
Note: р 1-2 – statistical significance of differences between groups 1 and 2, р 1-3 – statistical significance of differences between groups 1 and 3, р 2-4 – statistical significance of differences between groups 2 and 4 р 3-4 – statistical significance of ifferences between groups 3 and 4
Между группами 1 и 2 не выявлено значимых различий по критерию контрактурных нарушений кардиомиоцитов. В группе 3 зарегистрированы весьма выраженные возрастные изменения миокарда, проявившиеся значимым увеличением количества кардиомиоцитов с кари-опикнозм, отеком перинуклеарной зоны саркоплазмы и контрактурными нарушениями по сравнению с аналогичными показателями в группах 1 и 2. В группе 4 значимо уменьшалось количество неизмененных кардиомиоцитов по сравнению с таковым в группах 1–3, а также снижалось содержание кардиомиоцитов в поле зрения микроскопа, что могло быть связано с их гибелью. По критериям ка-риопикноза, отека перинуклеарной зоны саркоплазмы и контрактурным нарушениям в группе 4 изменения кардиомиоцитов были более выраженными, чем в группах 1 и 2, но значимо не отличались от наблюдавшихся в группе 3. Содержание кардиомиоцитов с кариопикнозом в группе 4 было наибольшим, значимо превышало таковое в группах 1 и 2 и имело тенденцию к увеличению по сравнению с зарегистрированным в группе 3.
Морфометрия удельных объемов соединительной ткани в миокарде левого желудочка (см. табл. 1) показала увеличение данного показателя у молодых крыс, содержавшихся на ВУВЖД (группа 2), при сравнении с таковым у животных без диеты (группа 1). У старых крыс без диеты (группа 3) удельный объем соединительной ткани был выше, чем у молодых (группа 1). Но наибольших значений удельный объем соединительной ткани достигал у старых животных на ВУВЖД (группа 4), значимо превышая аналогичные показатели в остальных группах.
Биохимические исследования выявили возрастные различия (группы 1 и 3) в содержании фибронектина, ТФРбета-1 и ФРСТ у крыс на стандартной диете (табл. 2). Назначение ВУВЖД способствовало повышению уровней фибронектина у животных в обеих возрастных группах с преобладанием в группе 4. Концентрация ТФРбета-1 и ФРСТ у крыс на ВУВЖД имела выраженную тенденцию к увеличению при сравнении с таковой в соответствующих возрастных группах животных, содержавшихся на стандартной диете.
Таблица 2. Влияние высокоуглеводной высокожировой диеты на содержание фибронектина, трансформирующего фактора роста бета 1 и фактора роста соединительной ткани в сыворотке крови белых крыс, Me ( Q 1 – Q 3 )
Table 2. Influence of HCHCD on the content of fibronectin TGFβ-1, and CTGF in the blood serum of white rats, Me ( Q 1 – Q 3 )
|
Группы Groups Показатели Indicators |
Крысы 5 мес. без ВУВЖД 5-month-old rats without HCHCD |
Крысы 5 мес. на ВУВЖД 5-month-old rats at HCHCD |
Крысы 18 мес. без ВУВЖД 18-month-old rats without HCHCD |
Крысы 18 мес. на ВУВЖД 18-month-old rats at HCHCD |
Уровень значимости Significance leve |
|
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
Группа 4 Group 4 |
||
|
ТФРбета-1, пг/мл TGFβ-1, pg/ml |
14262 (8039–23429) |
20435 (14072– 22713) |
33765,81 (24232– 45736) |
36252 (19477– 41313) |
р 1–2 = 0,288488 р 1–3 = 0,004072 р 2–4 = 0,030369 р 3–4 = 0,778196 |
Окончание табл. 2
End of table 2
|
Группы Groups Показатели Indicators |
Крысы 5 мес. без ВУВЖД 5-month-old rats without HCHCD |
Крысы 5 мес. на ВУВЖД 5-month-old rats at HCHCD |
Крысы 18 мес. без ВУВЖД 18-month-old rats without HCHCD |
Крысы 18 мес. на ВУВЖД 18-month-old rats at HCHCD |
Уровень значимости Significance level |
|
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
Группа 4 Group 4 |
||
|
Фибронектин, мг/дл Fibronectin, mg/dl |
21,7 (19,2–23,5) |
25,7 (23,3–31,1) |
31,2 (23,3–37,4) |
41,7 (37,4–49,2) |
р 1–2 = 0,014179 р 1–3 = 0,012346 р 2–4 = 0,001437 р 3–4 = 0,006362 |
|
ФРСТ, пг/мл CTGF, pg/ml |
99,8 (61,6–155,5) |
130,0 (91,9–168,7) |
275,7 (207,3–330,8) |
337,9 (277,2–474,6) |
р 1–2 = 0,452913 р 1–3 = 0,005411 р 2–4 = 0,003095 р 3–4 = 0,309880 |
Примечание: р 1-2 – уровень статистической значимости различий между группами 1 и 2, р 1-3 – уровень статистической значимости различий между группами 1 и 3, р 2-4 – уровень статистической значимости различий между группами 2 и 4, р 3-4 – уровень статистической значимости различий между группами 3 и 4.
Note: р 1-2 – statistical significance of differences between groups 1 and 2, р 1-3 – statistical significance of differences between groups 1 and 3, р 2-4 – statistical significance of differences between groups 2 and 4, р 3-4 – statistical significance of differences between groups 3 and 4.
Биохимические исследования выявили возрастные различия (группы 1 и 3) в содержании фибронектина, ТФР бета1 и ФРСТ у крыс на стандартной диете (см. табл. 2). Назначение ВУВЖД способствовало повышению уровней фибронектина у животных в обеих возрастных группах с преобладанием в группе 4. Концентрация ТФРбета-1 и ФРСТ у крыс на ВУВЖД имела выраженную тенденцию к увеличению при сравнении с таковой в соответствующих возрастных группах животных, содержавшихся на стандартной диете.
Обсуждение
Проведенные нами исследования позволили обнаружить отчетливые возрастные изменения миокарда, проявившиеся у 18-месячных крыс на стандартной диете увеличением удельного объема соединительной ткани стромы, количества кардиомиоцитов с деструктивными нарушениями в виде кариопикноза, отека перинуклеарной зоны цитоплазмы, с контрактурными повреждениями, уменьшением количества неизмененных кардиомиоцитов по сравнению с данными показателями у молодых 5-месячных животных. Зарегистрировано возрастное увеличение фибронектина и ФРСТ в сыворотке крови, сопровождавшиеся морфологическими признаками разрастания стромы миокарда.
Потеря кардиомиоцитов и фиброз являются типичными признаками старения сердца. Нагрузка на кардиомиоциты в фиброзном сердце увеличивается, что вызывает дополнительную гибель кардиомиоцитов и замену их фиброзным материалом, создавая порочный круг дальнейшего снижения функции сердца [4, 5].
Однако есть точка зрения, что возрастные нарушения в сердце обусловлены патологическими процессами, связанными со старением, а не самими процессами старения [6]. «Нормальные» возрастные изменения служат основой, которая поддерживает снижение пластичности и ограниченную способность к ремоделированию тканей при патологическом состоянии миокарда [7]. Процесс старения генетически запрограммирован, но изменяется под влиянием факторов окружающей среды, поэтому скорость старения миокарда у разных людей может сильно различаться [8]. В этой связи в на- стоящем исследовании была предпринята попытка оценить влияние ВУВЖД на миокард в возрастном аспекте. В нашей предыдущей публикации [9] было показано, что ВУВЖД вызывала у белых крыс повышение массы тела, концентрации глюкозы в сыворотке крови, интеграционного индекса инсулинорезистентности, артериального давления, накопление триглицеридов в печени, которые являются характерными чертами метаболического синдрома. В аорте было выявлено увеличение коллагена и замещение им эластических мембран, приводящие к потере эластичности, увеличению жесткости и утолщению сосудистой стенки, что играет существенную роль в механизмах повышения артериального давления. Все перечисленные изменения чаще появлялись или преобладали у старых животных на ВУВЖД по сравнению с таковыми у молодых. Изменения метаболизма липидов в сыворотке крови, печени и почек также были более выражены у старых животных, чем у молодых на ВУВЖД [2].
Указанные метаболические нарушения, повышенное артериальное давление, очевидно, играют важную роль в механизмах сердечных нарушений. В сердце молодых крыс (5-месячных), содержавшихся на ВУВЖД, нами было зарегистрировано значимое увеличение числа кардиомиоцитов с альтеративными нарушениями в отличие от аорт, в которых у молодых животных признаки повреждения были невыраженными. Критериями поражения кардиомиоцитов был кариопикноз, свидетельствующий о гибели клеток, а также отек перинуклеарной зоны саркоплазмы, указывающий на глубокие нарушения ядерно-цитоплазматических взаимоотношений. Отек или «просветление» околоядерной зоны цитоплазмы весьма характерны для кардиомиоцитов при различных патологических состояниях, например, при антрациклиновой кардиомиопатии, выраженной гиперхолестеринемии [10], иммобилизационном стрессе [11], при которых происходят литические изменения миофибрилл, митохондрий, накопление лизосом, липофусцина именно в обширной перинуклеарной части саркоплазмы. У старых животных, содержавшихся на ВУВЖД, доля кардиомиоцитов с кариопикнозом была значимо выше, чем у молодых, достигая порядка 10%. Возрастало количество сердечных мышечных клеток с контрактурными изменениями, в то время как содержание неизмененных кардиомиоцитов у старых животных на ВУВЖД было значимо меньше, чем у старых крыс на стандартной диете. Кроме того, значимо уменьшалось количество кардиомиоцитов в поле зрения, что можно расценивать как их гибель и замещение соединительной тканью, удельные объемы которой у старых крыс на ВУВЖД были больше, чем в остальных экспериментальных группах. Выявленное нами повышение концентрации фибронектина, ТФРбета-1, ФРСТ в сыворотке крови соответствовало росту соединительнотканного компонента миокарда. Следует также иметь в виду и реактивный фиброз, возникающий для замещения некротизированных и апоптозных кардиомиоцитов при старении [7].
Обращает на себя внимание очаговая клеточная инфильтрация стромы миокарда и эпикарда, появляющаяся у молодых и значительно усиливающаяся у старых животных на ВУВЖД. Инфильтраты локализовались в основном периваскулярно и содержали преимущественно лимфоциты и макрофаги, в меньшей степени нейтрофильные лейкоциты. Подобные инфильтраты были обнаружены у старых крыс на стандартной диете, что подчеркивало сходство морфологических процессов, связанных с возрастом и ВУВЖД. Отмечается связь лимфоцитарной инфильтрации периваскулярных областей стареющего сердца с профилем воспалительного гена и возрастным фиброзом миокарда, что нуждается в дальнейшем детальном исследовании [4].
Список литературы Влияние высокоуглеводной высокожировой диеты на возрастные изменения миокарда у крыс
- Sun M., Tan Y., Rexiati M., Dong M., Guo W. Obesity is a common soil for premature cardiac aging and heart diseases – Role of autophagy. Biochim. Biophys. Acta-Mol. Basis Dis. 2019;1865(7):1898–1904. DOI: 10.1016/j.bbadis.2018.09.004.
- De Castro U.G.M., dos Santos R.A.S.A.S., Silva M.E., de Lima W.G., Campagnole-Santos M.J., Alzamora A.C. Age-dependent effect of high-fructose and high-fat diets on lipid metabolism and lipid accumulation in liver and kidney of rats. Lipids Health Dis. 2013;(12–136). DOI: 10.1186/1476-511X-12-136.
- Martinelli I., Tomassoni D., Moruzzi M., Roy P., Cifani C., Amenta F. et al. Cardiovascular Changes Related to Metabolic Syndrome: Evidence in Obese Zucker Rats. Int. J. Mol. Sci. 2020;21(6):2035. DOI: 10.3390/ijms21062035.
- Boyle A.J., Shih H., Hwang J., Ye J., Lee B., Zhang Y. et al. Cardiomyopathy of aging in the mammalian heart is characterized by myocardial hypertrophy, fibrosis and a predisposition towards cardiomyocyte apoptosis and autophagy. Exp. Gerontol. 2011;46(7):549–559. DOI: 10.1016/j.exger.2011.02.010.
- Piek A., de Boer R.A., Silljé H.H.W. The fibrosis-cell death axis in heart failure. Heart Fail. Rev. 2016;21(2):199-211. DOI: 10.1007/s10741-016-9536-9.
- Klausner S.C., Schwartz A.B. The aging heart. Clin. Geriatr. Med. 1985;1(1):119-141. URL: https://pubmed.ncbi.nlm.nih.gov/3913496/
- Tracy E., Rowe G., LeBlanc A.J. Cardiac tissue remodeling in healthy aging: the road to pathology. Am. J. Physiol. Cell Physiol. 2020;319(1):C166–C182. DOI: 10.1152/ajpcell.00021.2020.
- Nakou E.S., Parthenakis F.I., Kallergis E.M., Marketou M.E., Nakos K.S., Vardas P.E. Healthy aging and myocardium: A complicated process with various effects in cardiac structure and physiology. Int. J. Cardiol. 2016;209:167–175. DOI: 10.1016/j.ijcard.2016.02.039.
- Logvinov S.V., Naryzhnaya N.V., Kurbatov B.K., Gorbunov A.S., Birulina Y.G., Maslov L.L. et al. High carbohydrate high fat diet causes arterial hypertension and histological changes in the aortic wall in aged rats: The involvement of connective tissue growth factors and fibronectin. Exp. Gerontol. 2021;154:111543. DOI: 10.1016/j.exger.2021.111543.
- Непомнящих Л.М., Лушникова Е.Л., Семенов Д.Е. Регенераторно-1пластическая недостаточность сердца: Морфологические основы и молекулярные механизмы. М.: Изд-во РАМН; 2003:255. [Nepomnyashchih L.M., Lushnikova E.L., Semenov D.E. Regenerative plastic insufficienc of the heart: Morphological bases and molecular mechanisms. Мoscow: Publishing House RAMS; 2003:255].
- Kurbatov B.K., Prokudina E.S., Maslov L.N., Naryzhnaya N.V., Logvinov S.V., Gorbunov A.S. et al. The role of adrenergic and muscarinic receptors in stress-induced cardiac injury. Pflugers Arch. 2021; 473(10):1641–1655. DOI: 10.1007/s00424-021-02602-6.
- Sahraoui A., Dewachter C., de Medina G., Naeije R., Bouguerra S.A., Dewachter L. Myocardial Structural and Biological Anomalies Induced by High Fat Diet in Psammomys obesus Gerbils. PLoS One. 2016;11(2):e0148117. DOI: 10.1371/journal.pone.0148117.
- Poudyal H., Panchal S.K., Ward L.C., Waanders J., Brown L. Chronic high-carbohydrate, high-fat feeding in rats induces reversible metabolic, cardiovascular, and liver changes. Am. J. Physiol. Endocrinol. Metab. 2012;302(12): E1472–1482. DOI: 10.1152/ajpendo.00102.2012.
- Bhandarkar N.S., Brown L., Panchal S.K. Chlorogenic acid attenuates high-carbohydrate, high-fat diet-induced cardiovascular, liver, and metabolic changes in rats. Nutr. Res. 2019;62:78–88. DOI: 10.1016/j.nutres.2018.11.002.
- Elrashidy R. Dysregulation of nuclear factor erythroid 2-related factor 2 signaling and activation of fibrogenic pathways in hearts of high fat diet-fed rats. Mol. Biol. Rep. 2020;47(4):2821–2834. DOI: 10.1007/s11033-020-05360-3.
- Comunoglu C., Comunoglu N., Eren B., Tanrlöver O., Türkmen N., Gündogmuş U.N. et al. Age-related histopathological changes in the cardiac conducting system in the Turkish population: an evaluation of 202 autopsy cases. Folia Morphol. 2012;71(3):178–182. URL: https://journals.viamedica.pl/folia_morphologica/article/view/18756.
- Pudil R. Age-related myocardial remodeling: myth or reality? Vnitr. Lek. 2020;66(8):507–511. URL: https://pubmed.ncbi.nlm.nih.gov/33740851/


