Внутрикаллусная изменчивость удвоенных гаплоидов риса, полученных в андрогенезе in vitro
Автор: Илюшко М.В., Ромашова М.В., Zhang J.-M., Deng L.-W., Liu D.-J., Zhang R., Гученко С.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Культуры in vitro
Статья в выпуске: 3 т.55, 2020 года.
Бесплатный доступ
Андрогенез in vitro - один из ведущих методов при создании исходного материала для селекции сельскохозяйственных культур. Многие селекционеры считают семенное потомство любого удвоенного гаплоида новой линией вне зависимости от того, с какого каллуса она получена. Однако в полевых условиях линии с одного каллуса часто выглядят одинаково и выбраковываются. Известно около 100 генов устойчивости к грибному возбудителю пирикуляриоза риса Pyricularia oryzae Cav. [ Magnaporthe grisea (Hebert Barr.)]. В число наиболее актуальных генов для российского Дальнего Востока входят Pi-ta и Pi-ta2 . В настоящей работе впервые выявлен внутрикаллусный морфологический полиморфизм и генетическая вариабельность удвоенных гаплоидов риса Oryza sativa L., полученных в андрогенезе in vitro гибридного растения, по генам устойчивости к пирикуляриозу Pi-ta и Pi-ta2 вследствие гаметоклональной и сомаклональной изменчивости. Впервые среди удвоенных гаплоидов одной каллусной линии продемонстрирована мономорфность (отсутствие генетической вариабельности), обусловленная клональным размножением (митотическим делением) клеток каллуса. Целью нашей работы было изучение внутрикаллусной морфологической и генетической изменчивости удвоенных гаплоидов риса Oryza sativa L., полученных в андрогенезе in vitro гибридного растения. Опыты проводили в ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки (Россия) и Институте селекции зерновых культур Хейлунцзянской академии сельскохозяйственных наук (Китай) в 2017-2018 годах. В качестве исходного растения для получения удвоенных гаплоидов риса использовали гибрид F1 сортов Дон 4237 ½ Долинный. Сорт Долинный служит носителем аллелей генов Pi-ta и Pi - ta2 , определяющих устойчивость к пирикуляриозу. В культуру in vitro было введено 386 гибридных пыльников. Каллусообразование составило 17,1 %. Сформировалось 18 каллусных линий с зелеными регенерантами, из которых для эксперимента отобрали шесть. По два семени каждой линии удвоенных гаплоидов высевали в почвогрунт в пластиковых стаканчиках и выращивали в условиях культуральной комнаты при 24 °С, 5000 лк и режиме 16 ч (день)/8 ч (ночь). Через 90 сут после посева одно растение срезали и определяли окраску среза (наличие/отсутствие антоцианового пигмента). Отмечали следующие фазы роста и развития растений: поздняя стадия кущения, выход в трубку, выметывание, цветение. Удвоенные гаплоиды, находящиеся на первых двух указанных стадиях, были объединены в группу поздних. Ранними считали растения, достигшие фазы выметывания и цветения. После созревания отмечали дискретные признаки: наличие или отсутствие остей, их длину и окраску. ДНК выделяли из свежих листьев СТАВ-методом. Качество и количество ДНК определяли методом электрофореза в 1,0 % агарозном геле. Аллели генов Pi-ta и Pi - ta2 , определяющие устойчивость к пирикуляриозу, выявляли методом полимеразной цепной реакции. В качестве позитивного контроля для гена Pi-ta использовали растения китайского моногенного сорта K12, для гена Pi - ta2 - сорта K27. Установлено, что удвоенные гаплоиды двух каллусных линий 7.2.2 и 21.2.1 были мономорфными, без генетической изменчивости по обоим генами устойчивости Pi - ta и Pi-ta2 . Семена растений каждой каллусной линии 7.2.2 и 21.2.1 в дальнейшем будут объединены в две отдельные селекционные линии, а большее число семян позволит интенсифицировать селекционный процесс. Среди удвоенных гаплоидов четырех других изученных каллусных линий (1.2.1, 4.1.2, 8.2.1 и 36.2.3) нами выявлен полиморфизм по остистости, скорости развития растений и антоциановой окраске среза. У каллусной линии 8.2.1 обнаружена генетическая изменчивость: 10 растений несли аллели устойчивости по обоим генам ( Pi-ta и Pi-ta2 ), 8 растений не имели ни одного аллеля, у 26 растений был детектирован только определяющий устойчивость аллель гена Pi-ta2 . Таким образом, при каллусообразовании в андрогенезе in vitro происходят два разнонапра
Андрогенез in vitro, внутрикаллусная изменчивость, пирикуляриоз, устойчивость
Короткий адрес: https://sciup.org/142226315
IDR: 142226315 | УДК: 633.18:575:57.085.23 | DOI: 10.15389/agrobiology.2020.3.533rus
Текст научной статьи Внутрикаллусная изменчивость удвоенных гаплоидов риса, полученных в андрогенезе in vitro
Андрогенез in vitro — один из ведущих методов при создании исходного материала для селекции многих сельскохозяйственных культур (1-3), включая рис Oryza sativa L. (4, 5). В подходящих условиях можно относительно легко получить значительное количество удвоенных гаплоидов, константных по морфологическим и генетическим признакам (расщепление отсутствует вследствие их гомозиготности), что позволяет сократить селекционный процесс на несколько лет (1, 4, 6). При характеристике удвоенных гаплоидов исследователи, как правило, выявляют их изменчивость между сортами и гибридами (5, 7). Вопросы внутрисортовой/внутригибридной и внутрикаллусной изменчивости остаются малоизученными. По комплексу количественных признаков на сорте риса Каскад показаны достоверные различия между удвоенными гаплоидами двух каллусных линий, полученных из двух пыльников (9).
Теоретически считается, что один культивируемый in vitro пыльник может давать более 1000 гаплоидных растений (10), которые представляют собой клоны (11, 12). На одной каллусной линии риса формируются десятки (13), а иногда более сотни удвоенных гаплоидов. В этом случае все удвоенные гаплоиды одной каллусной линии можно было бы объединить в одну селекционную линию, что позволило бы ускорить селекционный процесс за счет увеличения массы семян одного образца. На примере пшеницы убедительно доказано происхождение андрогенных эмбриоидов из одной клетки (14). Известно, что существует геномная изменчивость регенерантов (гаплоиды—удвоенные гаплоиды—тетраплоиды) внутри одной каллусной линии риса, полученной от одного пыльника (13), поэтому вероятна и генетическая изменчивость среди удвоенных гаплоидов. Многие селекционеры априори считают семенное потомство любого удвоенного гаплоида новой линией (8, 15) вне зависимости от того, с какого каллуса она получена. Однако в полевых условиях линии с одного каллуса часто выглядят одинаково и выбраковываются, для дальнейшей работы остаются две или три. Обоснованность такого противоречивого подхода требует экспериментального подтверждения или опровержения полиморфизма и генетической изменчивости удвоенных гаплоидов одной каллусной линии.
Известно около 100 генов устойчивости к грибному возбудителю заболевания риса Pyricularia oryzae Cav. [ Magnaporthe grisea (Hebert Barr.)] семейства Pi (16), большая часть из которых используется в селекции в разных регионах мира в зависимости от расоспецифичности патогена. В число наиболее актуальных генов для российского Дальнего Востока входят Pi-ta и Pi-ta2 (17). Возможна их идентификация в растениях риса с помощью молекулярных маркеров (18-20).
В настоящей работе впервые выявлен внутрикаллусный морфологический полиморфизм и генетическая вариабельность удвоенных гаплоидов риса Oryza sativa L., полученных в андрогенезе in vitro гибридного растения, по генам Pi-ta и Pi-ta2 вследствие гаметоклональной и сомаклональной изменчивости. Впервые среди удвоенных гаплоидов одной каллусной линии продемонстрирована мономорфность в отсутствие генетической вариабельности, обусловленная клональным размножением (митотическим делением) клеток каллуса.
Нашей целью было изучение внутрикаллусной морфологической и генетической изменчивости удвоенных гаплоидов риса Oryza sativa L., полученных в андрогенезе in vitro гибридного растения.
Методика . Опыты проводили в ФНЦ агробиотехнологий Дальнего
Востока им. А.К. Чайки (Россия) и Институте селекции зерновых культур Хейлунцзянской академии сельскохозяйственных наук (Китай) в 2017-2018 годах. В качестве исходного растения для получения удвоенных гаплоидов риса использовали гибрид F 1 сортов Дон 4237 ½ Долинный, у которого при предварительной оценке регенерантов R 1 была выявлена значительная внутрикаллусная изменчивость удвоенных гаплоидов по остистости. Сорт риса Долинный служит носителем аллелей генов Pi-ta и Pi - ta2 , определяющих устойчивость к перикуляриозу (21, 22). Методика создания удвоенных гаплоидов описана ранее (23). В каждой каллусной линии (всего 6 линий) брали семена (от 9 до 44 шт.) удвоенных гаплоидов первого поколения (всего 106 линий удвоенных гаплоидов), высевали по 2 шт. в почвогрунт в пластиковых стаканчиках и выращивали в условиях культуральной комнаты при 24 °С, 5000 лк и режиме 16 ч (день)/8 ч (ночь). Из этих семян взошли регенеранты второго поколения R 2 , у которых изучали изменчивость морфологических признаков и фазы роста.
Через 90 сут после посева одно растение из каждой линии удвоенных гаплоидов R 2 (всего 106 растений) срезали и определяли окраску среза (наличие/отсутствие антоцианового пигмента). С того же растения брали листья для выделения ДНК. На другом растении отмечали следующие фазы роста и развития: поздняя стадия кущения (наличие соломины без флагового листа, метелка не просматривается внутри соломины), выход в трубку (наличие соломины с флаговым листом, внутри которой просматривается метелка), выметывание (видны 5-6 верхних цветков метелки), цветение (метелка полностью видна). Удвоенные гаплоиды, находящиеся на первых двух указанных стадиях, были объединены в группу поздних. Ранними считали растения, находящиеся в фазах выметывания и цветения. После созревания отмечали дискретные признаки: наличие или отсутствие остей, их длину (короткие — менее 1 см или в виде шипиков на некоторых зерновках метелки, длинные — более 2 см) и окраску (белые, черные).
ДНК выделяли из свежих листьев СТАВ-методом (24). Качество и количество ДНК определяли методом электрофореза в 1,0 % агарозном геле с использованием в качестве стандарта ДНК известной концентрации. Аллели генов Pi-ta и Pi - ta2 , детерминирующие устойчивость, выявляли методом полимеразной цепной реакции (ПЦР). Для Pi-ta использовали пару праймеров 5´-AGCAGGTTATAAGCTAGGCC-3´ и 5´-CTACCAACAAGTT-CATCAAA-3´ (18), для Pi-ta2 — пару 5´-CAGCGAACTCCTTCGCATAC-GCA-3´ и 5´-CGAAAGGTGTATGCACTATAGTATCC-3´ (20).
Реакцию проводили в 20 мкл реакционной смеси, содержащей 2½ ПЦР буфер, 2,5 мМ MgCl 2 , 0,2 мМ dNTP, по 0,25 мкл прямого и обратного праймеров, 1 ед. Taq ДНК-полимеразы («Takara», Япония) и по 70-120 нг ДНК исследуемых образцов. Амплификацию осуществляли в 3-кратной повторности в термоциклере Veriti 96-Well Thermal Cycler («Applied Biosys-tems», США). Для гена Pi-ta использовали следующий температурный профиль реакции: 5 мин при 94 °С (начальная денатурация); 1 мин при 94 °С (денатурация), 1 мин при 56 °С (отжиг праймеров), 1 мин при 72 °С (элонгация) (35 циклов); 10 мин при 72 °С (заключительная элонгация). Для гена Pi - ta2 режим был следующим: 5 мин при 95 °С (начальная денатурация); 1 мин при 95 °С (денатурация), 1 мин при 60 °С (отжиг праймеров), 1 мин при 72 °С (элонгация) (35 циклов); 10 мин при 72 °С (заключительная элонгация).
Продукты амплификации разделяли электрофоретически в 1,0 % агарозном геле на основе 0,5½ ТВЕ буфера в камере Sub Cell Model 192 («Bio-Rad», США) с источником питания PowerPac Basic («Bio-Rad», США)
и визуализировали в ультрафиолетовом свете c использованием системы гель-документирования Gel Doc XR+ («Bio-Rad», США), предварительно окрашивая 1,0 % раствором бромистого этидия. Наличие аллеля устойчивости признавали только в случае яркого окрашивания образцов ДНК.
В качестве позитивного контроля для гена Pi-ta использовали растения китайского моногенного сорта K12, для гена Pi - ta2 — сорта K27.
Результаты . В культуру in vitro было введено 386 гибридных пыльников. Каллусообразование составило 17,1 % от их общего числа. Сформировалось 18 каллусных линий с зелеными регенерантами, что составило 27,3 % от общего числа каллусов. Для эксперимента отобрали шесть каллу-сных линий с многочисленными удвоенными гаплоидами (табл. 1).
1. Регенерационная характеристика каллусных линий риса Oryza sativa L., полученных в андрогенезе in vitro у гибрида F 1 сортов Дон 4237 ½ Долинный
|
Каллусная линия |
Число зеленых регенерантов, шт. |
Число удвоенных гаплоидов |
Объем выборки в эксперименте (R 2 ), шт. |
|
|
шт. |
% |
|||
|
1.2.1 |
138 |
24 |
17 |
12 |
|
4.1.2 |
34 |
28 |
82 |
9 |
|
7.2.2 |
16 |
15 |
94 |
11 |
|
8.2.1 |
69 |
57 |
83 |
44 |
|
21.2.1 |
24 |
19 |
79 |
15 |
|
36.2.3 |
76 |
71 |
93 |
15 |
Результаты молекулярного маркирования показали, что отцовская форма (сорт Долинный) и исходный гибрид риса при электрофорезе продуктов амплификации имели характерную для аллеля устойчивости гена Pita зону в области 1042 п.н., а у материнской формы (сорт Дон 4237) этот ДНК-фрагмент отсутствовал (рис. 1).
w Wl —' *• *• * - • ' ■ --*■ ■ -
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 M
Рис. 1. Электрофоретическое разделение ПЦР-продуктов, полученных при выявлении гена устойчивости к пирикуляриозу Pi-ta у родительских растений, гибрида F 1 сортов Дон 4237 ½ Долинный и удвоенных гаплоидов R 2 шести каллусных линий риса Oryza sativa L.: 1, 2 — 1.2.1; 3, 4 — 4.1.2; 5, 6 — 7.2.2; 7-16 — 8.2.1, 17, 18 — 21.2.1; 19, 20 — 36.2.3; 21 — сорт Долинный, 22 — сорт Дон 4237, 23 — гибрид F 1 Дон 4237 ½ Долинный, 24 — позитивный контроль, 1042 п.н. (мо-ногенная линия К12), 25 — маркер молекулярной массы D2000 («TIANGEN», КНР).
Аллель гена Pi - ta2 , определяющий устойчивость, был обнаружен у обеих родительских форм и гибрида. Удвоенные гаплоиды пяти каллусных линий (1.2.1, 4.1.2, 7.2.2, 21.2.1 и 36.2.3) обладали аллелями устойчивости по обоим генам Pi-ta и Pi - ta2 (табл. 2). Наблюдалась генетическая изменчивость среди удвоенных гаплоидов каллусной линии 8.2.1: 10 растений несли аллели устойчивости по обоим генам, у 8 растений оба аллеля отсутствовали, у остальных 26 растений выявили только аллель устойчивости Pi-ta2 . Порядок дифференциации удвоенных гаплоидов на каллусной линии 8.2.1 слабо влиял на наличие детектируемых продуктов амплификации. Так, из 69 зеленых регенерантов, образовавшихся на каллусной линии 8.2.1 (см. табл. 1), удвоенные гаплоиды с аллелями устойчивости по обоим генам встречались среди порядковых номеров 1-44, с аллелями устойчивости только по гену Pi - ta2 — среди номеров 22-68. Аллели устойчивости обоих генов отсутствовали у части удвоенных гаплоидов с номерами от 2 до 69, то есть определенной очередности не наблюдалось.
Анализ фенотипической изменчивости показал, что удвоенные гаплоиды каллусных линий 7.2.2 и 21.2.1 мономорфны. Полиморфизм наблюдался среди удвоенных гаплоидов четырех каллусных линий. Наибольшую морфологическую изменчивость отмечали у каллусной линии 8.2.1, и эта вариабельность не была связана с генетической изменчивостью удвоенных гаплоидов (см. табл. 2).
2. Генотипы и фенотипы удвоенных гаплоидов R2 каллусных линий риса Oryza sativa L., полученных у гибрида F1 сортов Дон 4237 ½ Долинный в андрогенезе in vitro
|
Каллусная линия |
Удвоенные гаплоиды, шт. |
Окраска среза стебля |
Наличие и длина остей |
Тип развития |
Наличие генов |
|
|
Pi-ta |
Pi-ta2 |
|||||
|
1.2.1 |
2 |
Антоциановая |
Короткие |
Ранний |
+ |
+ |
|
1 |
Антоциановая |
Отсутствуют |
Ранний |
+ |
+ |
|
|
6 |
Антоциановая |
Короткие |
Поздний |
+ |
+ |
|
|
3 |
Антоциановая |
Длинные |
Поздний |
+ |
+ |
|
|
4.1.2 |
2 |
Антоциановая |
Короткие |
Ранний |
+ |
+ |
|
4 |
Антоциановая |
Короткие |
Поздний |
+ |
+ |
|
|
1 |
Антоциановая |
Отсутствуют |
Ранний |
+ |
+ |
|
|
2 |
Антоциановая |
Отсутствуют |
Поздний |
+ |
+ |
|
|
7.2.2 |
11 |
Без антоциана |
Длинные |
Поздний |
+ |
+ |
|
8.2.1 |
3 |
Антоциановая |
Короткие |
Ранний |
+ |
+ |
|
2 |
Антоциановая |
Длинные |
Поздний |
+ |
+ |
|
|
1 |
Без антоцитана |
Длинные |
Поздний |
+ |
+ |
|
|
3 |
антоциановая |
Отсутствуют |
Ранний |
+ |
+ |
|
|
1 |
Без антоциана |
Отсутствуют |
Ранний |
+ |
+ |
|
|
1 |
антоциановая |
Короткие |
Ранний |
+ |
||
|
1 |
антоциановая |
Длинные |
Ранний |
+ |
||
|
18 |
антоциановая |
Короткие |
Поздний |
+ |
||
|
1 |
антоциановая |
Длинные |
Поздний |
+ |
||
|
5 |
Без антоциана |
Короткие |
Поздний |
+ |
||
|
1 |
антоциановая |
Короткие |
Ранний |
|||
|
5 |
антоциановая |
Короткие |
Поздний |
|||
|
1 |
Без антоциана |
Короткие |
Ранний |
|||
|
1 |
Без антоциана |
Короткие |
Поздний |
|||
|
21.2.1 |
15 |
Антоциановая |
Отсутствуют |
Ранний |
+ |
+ |
|
36.2.3 |
2 |
Антоциановая |
Отсутствуют |
Ранний |
+ |
+ |
|
13 |
Антоциановая |
Отсутствуют |
Поздний |
+ |
+ |
|
|
П р и м е ч а н и е. «+» — наличие аллеля устойчивости; «–» — отсутствие аллеля устойчивости. |
||||||
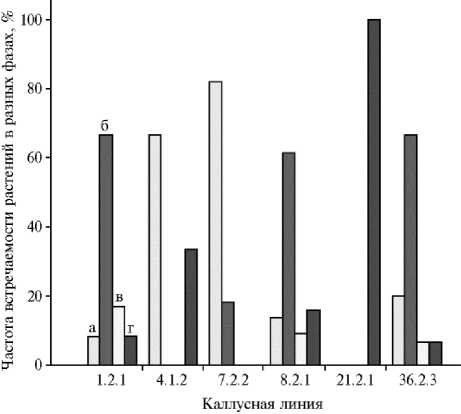
Рис. 2. Распределение удвоенных гаплоидов R 2 риса Oryza sativa L. шести каллусных линий, полученных в андрогенезе in vitro гибрида F 1 сортов Дон 4237 ½ Долинный, по фазам роста и развития через 90 сут после посева: а — кущение, б — выход в трубку, в — выметывание, г — цветение.
Детальное распределение удвоенных гаплоидов по фазам роста и развития представлено на рисунке 2. Все растения кал-лусной линии 21.2.1 цвели, изменчивость по другим признакам также не наблюдали. Растения линии 4.1.2 четко разделились на две группы: три ранних (в фазе цветения) и пять поздних (в фазе кущения), среди тех и других были остистые и безостые (см. табл. 2). Растения линии 7.2.2 по срокам прохождения как фазы кущения, так и фазы выхода в трубку были поздними и мономорфными по другим признакам. В трех из шести каллусных линий
(1.2.1, 8.2.1 и 36.2.3) у удвоенных гаплоидов отмечали все четыре стадии роста и развития. ИЗ них линия 36.2.3 полностью безостая с антоциановой окраской среза соломины, то есть изменчивая только по скороспелости, линия 1.2.1 полиморфна по остистости и фазам роста и развития. В линии 8.2.1 удвоенные гаплоиды проявляли как генетическую, так и фенотипическую изменчивость, причем среди удвоенных гаплоидов было выявлено различное сочетание морфологических и генетических признаков (см. табл. 2). Изменчивость по окраске остей среди удвоенных гаплоидов одной каллу-сной линии мы не наблюдали: в линии 7.2.2 зерновки были с белыми остями, в линиях 1.2.1, 4.1.2 и 8.2.1 — с темными.
В пыльнике риса содержится около 1 тыс. пыльцевых зерен (25), которые могут быть индуцированы в каллус. Каллусная линия от одного пыльника формируется из каллусных агрегатов, которые могут быть образованы несколькими недозрелыми микроспорами. Это приводит как к полиморфизму и генетической изменчивости среди удвоенных гаплоидов, так и к геномной изменчивости регенератов одной каллусной линии (гаплоиды, удвоенные гаплоиды, тетраплоиды) (13). Однако не исключается и клональное размножение регенерантов в культуре in vitro. Так, для некоторых мор-фотипов и генотипов насчитывается от небольшого числа до нескольких десятков удвоенных гаплоидов, например 18 растений у каллусной линии 8.2.1 (см. табл. 2). Ранее мы выявили образование до 7-18 растений-тетра-плоидов одной каллусной линии. Хотя полиморфизм тетраплоидов одной каллусной линии не изучался, столь массовое их формирование на одном каллусе скорее всего происходит за счет тиражирования 4 n каллусных клеток митозом (26). Удвоенные гаплоиды каллусных линий 7.2.2 и 21.2.1, которые мономорфны, можно рассматривать как идентичные растения и объединить при селекции в два отдельных образца. Аналогичный вариант использования очевиден и для групп одинаковых растений внутри других кал-лусных линий.
Особый интерес представляла каллусная линия 8.2.1, в которой встречались растения-регенеранты с аллелями одновременно двух генов устойчивости — Pi-ta и Pi-ta2, только Pi-ta2 и не несущих аллелей ни одного из этих генов. Существует несколько возможных объяснений подобного расщепления по генам Pi-ta и Pi-ta2 в линии 8.2.1. Один из родителей (сорт Долинный) был носителем аллеля гена Pi-ta, определяющего устойчивость, и его гибрид унаследовал в гетерозиготе этот ген. Как следствие, часть удвоенных гаплоидов имели аллель гена устойчивости Pi-ta, а часть нет (см. рис. 1). Оба родителя и гибрид обладали аллелем гена устойчивости Pi-ta2, однако у 8 удвоенных гаплоидов (см. табл. 2) он отсутствовал. Праймеры, использованные в работе, были способны детектировать наличие или отсутствие аллеля гена, определяющего устойчивость, но не выявляли аллельного состояния гена. Можно предположить, что один из родителей (сорт Дон 4234) был гетерозиготен, а второй (сорт Долинный) — гомозиготен по гену Pi-ta2, тогда как гибрид оказался гетерозиготен по этому гену. Возможная схема дигибридного скрещивания, приведшая к генетической изменчивости среди удвоенных гаплоидов каллусной линии 8.2.1, представлена на рисунке 3. Получить три типа сочетания аллелей устойчивости в растениях-регенерантах возможно только во втором варианте скрещивания. Микроспоры типа АВ, аВ и аb индуцировали каллусо-образование, далее произошло спонтанное удвоение хромосом и регенерация. Микроспоры четвертого типа Ab либо не образовали каллуса, либо сформировали только гаплоиды.
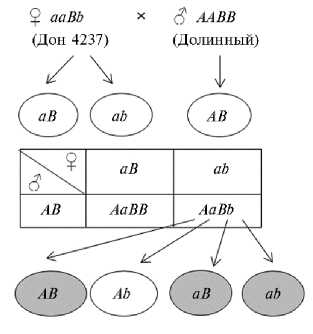
Рис. 3. Возможная схема дигибридного скрещивания родительских сортов риса Oryza sativa L. с получением каллуса из микроспор, приводящая к появлению удвоенных гаплоидов с двумя аллелями генов устойчивости к пирикуляриозу Pi-ta и Pi-ta2 , с одним аллелем (только по гену Pi-ta2 ) и без аллелей обоих генов устойчивости: А — аллель гена Pi-ta , определяющий устойчивость, a — аллель гена Pi-ta , определяющий восприимчивость, B — аллель гена Pi-ta2 , определяющий устойчивость, b — аллель гена Pi-ta2 , определяющий восприимчивость.
Z. Wang с соавт. (27) считают гены Pi-ta и Pi-ta2 аллельными либо тесно сцепленными друг с другом. По данным Ory-zabase (28), это один и тот же ген (7281 нуклеотид), выявляемый разными праймерами, амплифицирующими разные участки гена. Изучен полиморфизм аллелей гена Pi-ta у нескольких видов и сортов риса. Обнаружено, что только 99 % аллелей схожи по нуклеотидной последовательности и имеют неоина-ковую степень дивергенции (29). Правда, фенотипическое проявление, иcследованное с помощью сортов-дифференциаторов, у генов Pi-ta и Pi-ta2 значительно различается (17, 20, 30). У изученных растений можно было ожидать либо наличие, либо полное отсутствие аллелей устойчивости для обоих генов. Однако у 26 растений присутствовал только определяющий устойчивость аллель ген Pi-ta2 .
Явление сомаклональной изменчивости широко распространено в культуре клеток и тканей in vitro, обусловливает повышение генетической вариабельности и часто не затрагивает жизнеспособности регенерантов, полученных из каллуса (31-33). В нашем эксперименте не исключены генетические мутации, вызванные культивированием в условиях in vitro. Эти изменения могли произойти на участке ДНК гена Pi - ta , который не идентичен гену Pi-ta2 , в каллусных клетках еще до спонтанного удвоения наборов хромосом с последующим образованием из них удвоенных гаплоидов. Нельзя исключить мутаций на участках ДНК, приведших к отсутствию устойчивых аллелей обоих генов у восьми растений удвоенных гаплоидов. В пользу этого говорит наличие устойчивых аллелей генов Pi-ta и Pi-ta2 среди удвоенных гаплоидов пяти других каллусных линий. Возможно, вследствие сомаклональной изменчивости, произошедшей уже после спонтанного удвоения, мы имеем в нескольких образцах риса любой из генов в гетерозиготном состоянии, что невозможно детектировать с помощью использованных праймеров.
Выявленный полиморфизм может свидетельствовать о том, что в пыльнике, который был использован при получении линии 8.2.1, индукция каллусообразования произошла минимум на 14 недозрелых микроспорах с последующим удвоением хромосом и регенерацией. Однако ранее отмечалась высокая частота изменений среди сомаклонов по физиологическим и количественным признакам, таким как время зацветания (выметывания метелки), сроки созревания, наличие или отсутствие остей, высота растений (32, 34). Посредством морфологического, биохимического и молекулярногенетического анализа выявлено, что в процессе сомаклональной изменчивости уже на ранних этапах культивирования происходят сходные генети- ческие преобразования, приводящие к появлению общих признаков в разных группах сомаклонов одного культурного вида (35). Такая совпадающая изменчивость может быть объяснена транспозиционными взрывами (34). Среди дигаплоидов табака и рапса встречаются выщепляющиеся морфологические мутанты, которые должны быть полностью гомозиготными (34). В случае сходной изменчивости у полученных нами удвоенных гаплоидов четырех каллусных линий (1.2.1, 4.1.2, 8.2.1, 36.2.3) возможны генетические изменения еще на стадии гаплоидных клеток с последующим спонтанным удвоением. Две другие каллусные линии, не затронутые этой изменчивостью, вероятно, более стабильны (7.2.2, 21.2.1). Следовательно, можно предположить, что на способность накопления мутационных изменений в культуре клеток in vitro значительное влияние оказывает не только сорт исходного растения, что установлено О.И. Кузнецовой с соавт. (33), но и генотип пыльцевого зерна, использованного для андрогенеза in vitro.
Андрогенез in vitro позволяет создавать огромное разнообразие линий удвоенных гаплоидов для селекционных программ. В частности, объединение мономорфных удвоенных гаплоидов одной каллусной линии в единую селекционную линию ускоряет селекционный процесс за счет увеличения количества семян одного образца. Также можно использовать наблюдаемое в некоторых каллусных линиях риса O. sativa разнообразие удвоенных гаплоидов, рассматривая каждый из них в качестве отдельной селекционной линии. Это особенно актуально для генотипов с затрудненным процессом андрогенеза in vitro: даже если каллусооразование удалось индуцировать только у одного из множества недозрелых пыльников, сформировавшаяся каллусная линия позволяет получить несколько полиморфных линий удвоенных гаплоидов.
На следующем этапе селекционной работы мы планируем изучить устойчивость полученных раннеспелых безостых линий удвоенных гаплоидов риса, несущих аллели обоих генов ( Pi-ta и Pi-ta2 ), при искусственном заражении штаммами P. oryzae , циркулирующими в Дальневосточной зоне рисосеяния.
Таким образом, нами впервые выявлен внутрикаллусный морфологический полиморфизм и генетическая вариабельность удвоенных гаплоидов риса Oryza sativa L., полученных в андрогенезе in vitro от гибридного растения, по генам устойчивости к пирикуляриозу Pi-ta и Pi-ta2 . В результате выполненных исследований выделены удвоенные гаплоиды каллусных линий 7.2.2 и 21.2.1, которые мономорфны и не проявляют генетической изменчивости по обоим генами устойчивости ( Pi - ta и Pi-ta2 ). Среди удвоенных гаплоидов четырех других изученных каллусных линий (1.2.1, 4.1.2, 8.2.1 и 36.2.3) обнаружен полиморфизм по остистости, скорости развития растений и антоциановой окраске среза. У каллусной линии 8.2.1 показана генетическая изменчивость, что проявляется в наличии у растений аллелей обоих генов Pi-ta и Pi-ta2 , только одного гена Pi-ta2 или отсутствие аллелей обоих генов. При каллусообразовании в андрогенезе in vitro происходят два разнонаправленных процесса. Первый и хорошо изученный — это сомакло-нальная изменчивость, ведущая к полиморфизму клеток и растений-регенерантов. Второй — клонирование клеток с возникающим вследствие этого внутрикаллусным единообразием, единообразием части регенерантов, а во многих случаях всех регенерантов, полученных от одного пыльника. Мономорфные удвоенные гаплоиды после предварительной оценки по морфологическим и молекулярно-генетическим признакам составляют единый
селекционный образец.
Список литературы Внутрикаллусная изменчивость удвоенных гаплоидов риса, полученных в андрогенезе in vitro
- Germanà M.A. Anther culture for haploid and doubled haploid production. Plant Cell Tiss. Organ. Cult., 2011, 104(3): 283-300 ( ). DOI: 10.1007/s11240-010-9852-z
- Ferrie A.M.R., Caswell K.L. Isolated microspore culture techniques and recent progress for haploid and doubled haploid plant production. Plant Cell Tiss. Organ. Cult., 2011, 104(3): 301-309 ( ). DOI: 10.1007/s11240-010-9800-y
- Dunwell J.M. Haploids in flowering plants: origins and exploitation. Plant Biotechnology Journal, 2010, 8(4): 377-424 ( ). DOI: 10.1111/j.1467-7652.2009.00498.x
- Mishra R., Rao G.J.N. In-vitro androgenesis in rice: advantages, constraints and future prospects. Rice Science, 2016, 23(2): 57-68 ( ). DOI: 10.1016/j.rsci.2016.02.001
- Sarao N.K., Gosal S.S. In vitro androgenesis for accelerated breeding in rice. In: Biotechnologies of crop improvement. Vol. 1 /S.S. Gosal, S.H. Wani (eds.). Springer, Cham, 2018: 407-435 ( ). DOI: 10.1007/978-3-319-78283-6_12
- Datta S.K. Androgenic haploids: factors controlling development and its application in crop improvement. Current Sci., 2005, 89(11): 1870-1878.
- Mishra R., Rao G.J.N., Rao R.N., Kaushal P. Development and characterization of elite doubled haploid lines from two indica rice hybrids. Rice Science, 2015, 22(6): 290-299 ( ).
- DOI: 10.1016/j.rsci.2015.07.002
- Lapitan V.C., Redoña E.D., Abe T., Brar D. Molecular characterization and agronomic performance of DH lines from the F1 of indica and japonica cultivars of rice (Oryza sativa L.). Field Crops Research, 2009, 112(2-3): 222-228 ( ).
- DOI: 10.1016/j.fcr.2009.03.008
- Ilyushko M.V., Romashova M.V. Variability of rice haploids obtained from in vitro anther culture. Russian Agricultural Sciences, 2019, 45(3): 243-246 ( ).
- DOI: 10.3103/S1068367419030108
- Сибикеева Ю.Е., Сибикеев С.Н. Влияние комбинаций чужеродных транслокаций на андрогенез in vitro у почти изогенных линий яровой мягкой пшеницы. Генетика, 2014, 50(7): 831-839 ( ).
- DOI: 10.7868/S0016675814070169
- Круглова Н.Н. Инновационная биотехнология андроклинной гаплоидии яровой мягкой пшеницы: эмбриологический подход. Аграрная Россия, 2009, 1: 34-38.
- Heberle-Bors E. In vitro haploid formation from pollen: a critical review. Theoret. Appl. Genetics, 1985, 71: 361-374 ( ).
- DOI: 10.1007/BF00251175
- Илюшко М.В., Ромашова М.В. Регенерационная способность каллусных трансплантантов риса в культуре пыльников in vitro. Аргарный вестник Приморья, 2018, 1(9): 5-8.
- Сельдимирова О.А., Круглова Н.Н. Андроклинный эмбриоидогенез in vitro злаков. Успехи современной биологии, 2014, 134(5): 476-487.
- Mishra R., Rao G.J.N., Rao R.N., Kaushal P. Development and characterization of elite doubled haploid lines from two indica rice hybrids. Rice Science, 2015, 22(6): 290-299 ( ).
- DOI: 10.1016/j.rsci.2015.07.002
- Wu Y., Xiao N., Chen Y., Yu L., Pan C., Li Y., Zhang X., Huang N., Ji H., Dai Z., Chen X., Li A. Comprehensive evaluation of resistance effects of pyramiding lines with different broad-spectrum resistance genes against Magnaporthe oryzae in rice (Oryza sativa L.). rice, 2019, 12: 11 ( ).
- DOI: 10.1186/s12284-019-0264-3
- Санкин А.Ю., Лелявская В.Н., Сун И.Т. Актуальные в селекционном процессе гены устойчивости к пирикуляриозу риса в условиях Приморского края. Успехи современной науки, 2017, 2(10): С. 26-28.
- Dai X.-J., Yan Y.-Z., Zhou L., Liang M.-Z., Fu X.-C., Chen L.-B. Distribution research of blast resistance genes Pita, Pib, Pi9 and Pikm in blast-resistant rice resources. Life Sci. research, 2012, 16(4): 340-356 ( ).
- DOI: 10.16605/j.cnki.1007-7847.2012.04.009
- Orasen G., Greco R., Puja E., Pozzi C., Stile M.R. Blast resistance R genes pyramiding in temperate japonica rice. Euphytica, 2020, 216: 40 ( ).
- DOI: 10.1007/s10681-020-2575-2
- Wang J.C., Correll J.C., Jia Y. Characterization of rice blast resistance genes in rice germplasm with monogenic lines and pathogenicity assays. Crop Protection, 2015, 72: 132-138 ( ).
- DOI: 10.1016/j.cropro.2015.03.014
- Илюшко М.В., Фисенко П.В., Суницкая Т.В., Гученко С.С., Чжан Ц., Дэн Л.-В., Костылев П.И. Идентификация генов устойчивости к пирикуляриозу в сортах риса дальневосточной селекции с использованием ДНК-маркеров. Зерновое хозяйство России, 2017, 4: 41-45.
- Илюшко М.В., Ромашова М.В., Фисенко П.В., Суницкая Т.В., Гученко С.С., Лелявская В.Н. Идентификация гена устойчивости риса к пирикуляриозу Pi-ta2 в коллекционных образцах и дальневосточных сортах риса методом молекулярного маркирования. Вестник защиты растений, 2019, 1(99): 36-39 (
- DOI: 10.31993/2308-6459-2019-1(99)-36-39)
- Илюшко М.В., Ромашова М.В. Создание регенерантных линий методом культуры пыльников in vitro для селекции риса на российском Дальнем Востоке. Дальневосточный аграрный вестник, 2017, 4(44): 37-45.
- Генная инженерия растений. Лабораторное руководство /Под ред. Дж. Дрейпера, Р. Скотта, Ф. Армитиджа, Р. Уолдена. М., 1991.
- Farrell T.C., Fox K.M., Williams R.L., Fukai S. Genotypic variation for cold tolerance during reproductive development in rice: screening with cold air and cold water. Field Crops Research, 2006, 98(2-3): 178-194 ( ).
- DOI: 10.1016/j.fcr.2006.01.003
- Илюшко М.В., Ромашова М.В. Формирование тетраплоидов риса в андрогенезе in vitro. Российская сельскохозяйственная наука, 2020, 3: 14-17 ( ).
- DOI: 10.31857/S2500262720030047
- Wang Z., Jia Y., Fjellstrom R.G. The relationship between the rice blast resistance genes Pi-ta and Pi-ta2. Journal of Zhejiang wanly university, 2004, 17(2): 91-92.
- Integrated Rice Science Database. Режим доступа: http://shigen.nig.ac.jp/rice/oryzabase/gene/detail/947. Дата обращения: 30.08.2018.
- Ramkumar G., Madhav M.S., Rama Devi S.J.S., Manimaran P., Mohan K.M., Prasad M.S., Balachandran S.M., Neeraja C.N., Sundaram R.M., Viraktamath B.C. Nucleotide diversity of Pita, a major blast redistance gene and identification of its minimal promoter. gene, 2014, 546(2): 250-256 ( ).
- DOI: 10.1016/j.gene.2014.06.001
- Ma J.-T., Zhang G.-M., Xin A.-H., Zhang L.-Y., Deng L.-W., Wang Y.-L., Wang Y., Ran Y., Gong X.-J., Ge X.-L., Yang X.-F. Comparison of pathogenicity of Pyricularia oryzae under different genetic backgrounds. Acta Agronomica Sinica, 2015, 41(12): 1791-1801 ( ).
- DOI: 10.3724/SP.J.1006.2015.01791
- Yamamoto T., Soeda Y., Nishikawa A., Hirohara H. A study of somaclonal variation for rice improvement induced by three kinds of anther-derived cell culture techniques. Plant Tissue Culture Letters, 1994, 11(2): 116-121 ( ).
- DOI: 10.5511/plantbiotechnology1984.11.116
- Ежова Т.А., Багрова А.М., Хартина Г.А., Гостимский С.А. Изучение наследуемости сомаклональных изменений у регенерантов посевного гороха (Pisum sativum L.). Генетика, 1989, XXV(5): 878-885.
- Kuznetsova O.I., Ash O.A., Gostimskij S.A. The effect of duration of callus culture on the accumulation of genetic alteration in pea Pisum sativum L. Russian Journal of Genetics, 2006, 42(5): 555-562 ( ).
- DOI: 10.1134/s1022795406050139
- Scowcroff W.R. Somaclonal variation: the myth of clonal uniformit. In: Genetic flux in plant /B. Hohn, E.S. Dennis (eds.). Wien, New York: Springer-Verlas, 1985: 217-245 ( ).
- DOI: 10.1007/978-3-7091-8765-4
- Osipova E.S., Koveza O.V., Gostimskij S.A., Troitskij A.V., Dolgikh Yu.L., Shamina Z.B. Analysis of specific RAPD and ISSR fragments in maize (Zea mays L.) somaclones and development of SCAR markers on their basis. Russian Journal of Genetics, 2003, 39(12): 1412-1419 (doi: 10.1023/B:RUGE.0000009156.74246.bc).


