Воспаление, гипоксия и склероз как основные модуляторы эволюции эндометриоидной кисты яичника
Автор: Украинец P.B., Корнева Ю.С., Абросимов С.Ю.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая анатомия
Статья в выпуске: 1 т.19, 2023 года.
Бесплатный доступ
Цель: оценить особенности клеточного инфильтрата эндометриоидных кист (ЭК) яичника на различных морфологических стадиях их формирования (эволюции). Материал и методы. Изучены 57 пациенток с гистологически верифицированным диагнозом «ЭК яичника»; морфологически ЭК поделены на «молодые», «зрелые» и «старые». Результаты. В тканях «молодой» ЭК подлежащая фиброзная прослойка (ФП) представлена рыхлой соединительной тканью, с небольшим количеством гранулоцитов, сидерофаги единичные. Увеличение количества гранулоцитов в области ФП по границе ткани ЭК (/-/=17,10; р
Воспаление, нарушение кровообращения, склерозирование, эндометриоидные кисты яичников
Короткий адрес: https://sciup.org/149143250
IDR: 149143250 | УДК: 618.11-006.2:616-002.2 | DOI: 10.15275/ssmj1901083
Текст научной статьи Воспаление, гипоксия и склероз как основные модуляторы эволюции эндометриоидной кисты яичника
EDN: ILSBAS
-
1 Введение. Эндометриоз является распространенным гинекологическим заболеванием, поражающим примерно 5-10% женщин репродуктивного возраста и характеризующимся наличием ткани эндометрия вне полости матки. Наиболее часто мишенью данной патологии становятся яичники. Верификация ЭК яичника занимает в среднем 7–8 лет с момента появления симптомов, что может привести к необратимому повреждению функциональных тканей. Помимо того, длительный период течения данной патологии оставляет отпечаток и на морфологии самой ЭК, которая в результате может превратиться в так называемую склерозированную ЭК яичника, что затрудняет морфологическую верификацию по операционному материалу [1]. По мнению ряда исследователей, в патогенезе эндометриоза важная роль отводится воспалению [2]. Однако, согласно некоторым литературным данным, оно влечет за собой и неблагоприятные последствия [3]. Данное исследование направлено на уточнение роли острой воспалительной реакции в патогенезе эндометриоза на примере ЭК яичника путем морфологического и статистического анализа их клеточного микроокружения.
Цель — оценить особенности клеточного инфильтрата эндометриоидных кист яичника на различных морфологических стадиях их формирования (эволюции).
Материал и методы. В исследование включены 57 пациенток с гистологически верифицированным диагнозом «ЭК яичника» (средний возраст — 33,5 года в возрастном интервале от 19 до 47 лет), находившиеся на лечении в гинекологическом отделении ОГБУЗ «Клиническая больница скорой медицинской помощи» г. Смоленска в 2018 г. Гистологическое исследование операционного материала с окраской гематоксилином и эозином проводилось на базе отделения клинической патологии № 2 имени профессора В. Г. Молоткова ОГБУЗ «Смоленский областной институт патологии». Предварительно на основании ряда морфологических признаков все ЭК были поделены на «молодые», «зрелые» и «старые» (рис. 1) [4]. «Молодая» ЭК: поверхностный отдел эндометриоидной выстилки имеет множество сосочкообразных выростов; покровный маточный эпителий высокий с вытянутыми гиперхромными ядрами; внутриэпителиально располагается множество макрофагов и лимфоцитов; строма эндометриоидной выстилки также преимущественно инфильтрирована макрофагами и лимфоцитами с примесью небольшого количества нейтрофилов и единичных эозинофилов; сидерофаги чаще отсутствуют или единичные; в строме эндометриоидной выстилки можно встретить маточные железы; подлежащая ФП, отделяющая эндометриоидную гетеротопию (ЭГ) от теки — стромы яичника представленная рыхлой соединительной тканью с неравномерно выраженными очагами уплотнения. «Зрелая» ЭК: поверхностный отдел эндометриоидной выстилки ровный, не имеет сосочкообразных выростов; покровный маточный эпителий уплощен; внутриэпителиально располагается множество макрофагов, лимфоцитов и нейтрофилов; строма эндометриоидной выстилки имеет полиморфноклеточную инфильтрацию; имеются группы сидеро-фагов; маточные железы отсутствуют; подлежащая ФП, отделяющая ЭГ от теки — стромы яичника, представлена плотной соединительной тканью. «Старая» ЭК: поверхностный отдел эндометриоидной выстилки ровный, не имеет сосочкообразных выростов; покровный маточный эпителий уплощен, в части полей зрения отсутствует; внутриэпители-ально располагается множество макрофагов, лимфоцитов и нейтрофилов; строма эндометриоидной выстилки истончена, имеет полиморфноклеточную инфильтрацию; определяются группы сидерофагов; маточные железы отсутствуют; подлежащая ФП, отделяющая ЭГ от теки — стромы яичника, представлена плотной соединительной тканью.
В стенке ЭК после окраски гематоксилином и эозином на увеличении ×400 подсчитывали количество лимфоцитов, нейтрофилов, эозинофилов, макрофагов и сидерофагов в 10 полях зрения для каждой гистологической области, обозначенные как зона 1 — маточный эпителий; зона 2 — строма эндометриоидной выстилки; зона 3 — подлежащая ФП.
На рис. 2 представлены пояснения к встречающимся по тексту схематичным изображениям структуры корреляций.
Статистическая обработка данных выполнена с использованием программы Statistica 10.0. Корреляционный анализ проведен с использованием критерия ранговой корреляции Спирмена с оценкой результатов по шкале Чеддока. Сравнение количественных показателей в группах проведено с помощью критерия
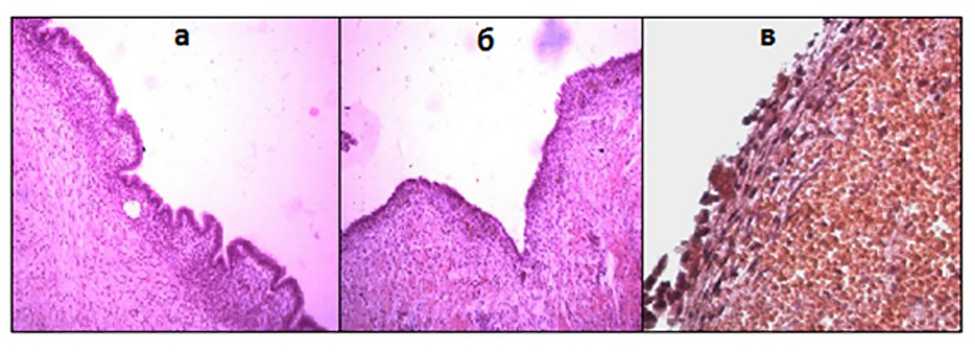
Рис. 1. Типы эндометриоидных кист яичника: а — «молодая» эндометриоидная киста; б — «зрелая» эндометриоидная киста; в — «старая» эндометриоидная киста
Corresponding author — Roman V. Ukrainets
Тел.: +7 (919) 2930849

сила корреляции положительная корреляция отрицательная корреляция

Рис. 2. Условные обозначения для встречающихся далее по тексту схематических изображений структур корреляций в тканях эндометриоидных кист
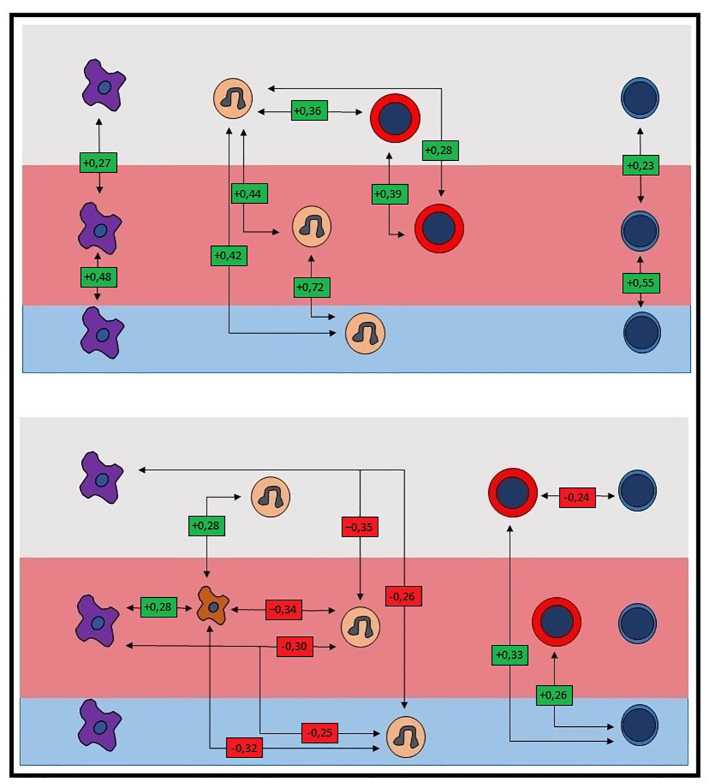
Рис. 3. Корреляции между клеточными популяциями в тканях «молодой» эндометриоидной кисты
Краскела — Уоллиса ( Н ). Результаты считались статистически значимыми при р ≤0,05.
Результаты.
Структура корреляций клеточного микроокружения «молодой» эндометриоидной кисты.
Статистический анализ выявил большое количество корреляций между клеточными популяциями в тканях «молодой» ЭК (рис. 3). Гранулоциты 1–3 зон формируют между собой исключительно положительные корреляции различной силы в количестве шести,
Сравнение количественных показателей клеточных популяций в исследуемых типах эндометриоидных кист с учетом гистологических зон (только статиcтически значимо различающиеся параметры)
Таким образом, гранулоцитарная инфильтрация подлежащей ФП в тканях «молодой» ЭК достаточно скудная (таблица), при этом сама подлежащая ФП преимущественно представлена рыхлой соединительной тканью, а сидерофаги в строме эндометриоидной выстилки единичные. В совокупности эти факты указывают на стабильность гомеостаза ткани ЭГ в условиях отграничения острой воспалительной реакции со стороны прилежащих тканей.
Структура корреляций клеточного микроокружения «зрелой» эндометриоидной кисты. В строении стенки «зрелой» ЭК наблюдается ряд изменений, что отражается на результатах статистического анализа. В сравнении с «молодой» ЭК в зоне 1 количество лимфоцитов и макрофагов значимо снижается, в то время как количество нейтрофилов возрастает; в зоне 2 в «зрелой» ЭК значимо больше лимфоцитов, макрофагов, нейтрофилов и эозинофилов; в зоне 3 количество нейтрофилов и эозинофилов также значимо больше (см. таблицу). По мере «созревания» ЭК наблюдаются изменения корреляций между клеточными популяциями (рис. 4). Гранулоциты 1– 3 зон так же, как и в ткани «молодой» ЭК, образуют между собой исключительно положительные корреляции, однако их количество увеличивается до девяти. Наибольшее количество связей формируют нейтрофилы зоны 1 и эозинофилы зоны 3. Корреляции между гранулоцитами и макрофагами остаются отрицательными. Сидерофаги теряют положительную корреляцию с гранулоцитами и теперь формируют только отрицательные корреляции. При всем том при увеличении количества сидерофагов в строме эндометриоидной выстилки значительно увеличилось и количество корреляций с другими клеточными популяциями. Так, помимо положительной корреляции с макрофагами зоны 2, сидерофаги образуют еще одну положительную корреляцию с макрофагами зоны 3. Обратим внимание на то, что сидерофаги имеют положительные корреляции с лимфоцитами зоны 2 и 3, а также отрицательную корреляцию с лимфоцитами зоны 1; лимфоциты и нейтрофилы зоны 2 формируют между собой отрицательную корреляцию. Изменения наблюдаются и для корреляций между лимфоцитами 1– 3 зон. Лимфоциты зоны 1 ранее в ткани «молодой» ЭК имели одну положительную корреляцию с лимфоцитами зоны 2, тогда как при «созревании» ЭК лимфоциты зоны 1 образуют две отрицательные корреляции с лимфоцитами 2–3 зон.
Структура корреляций клеточного микроокружения «старой» эндометриоидной кисты. В ходе эволюции «старая» ЭК также приобретает ряд морфологических особенностей. Количество нейтрофилов и лимфоцитов в зоне 1 в «старой» ЭК значимо меньше, чем в «молодой» и «зрелой», а макрофагов значимо больше, чем в «зрелой», но меньше, чем в «молодой». В зоне 2 количество лимфоцитов, макрофагов, нейтрофилов и эозинофилов значимо меньше, чем в «зрелой» ЭК, но макрофагов тоже больше, чем в «молодой». Обнаруженные для зоны 3 значимые различия в количестве эозинофилов и нейтрофилов также были меньше в группе «старых» ЭК (см. таблицу).
По мере «старения» ЭК яичника наблюдается прогрессирующая дезорганизация межклеточных взаимоотношений (рис. 5). Между макрофагами 1– 3 зон полностью отсутствуют положительные корреляции, которые определялись в «молодых» и «зрелых» ЭК, но все еще сохраняются исключительно отрицательные корреляции между макрофагами и гранулоцитами. Сидерофаги образуют единственную положительную корреляцию с макрофагами зоны 3, где, вероятнее всего, сохраняются остатки макрофагального пула, трансформирующегося в си-дерофаги за счет поляризации. Лимфоциты 1 и 2 зон имеют одну положительную корреляцию. Между гранулоцитами 1–3 зон также остаются исключительно отрицательные корреляции, изменяется незначительно только их количество (7 вместо 9).
Обсуждение. Увеличения количества сидерофа-гов в строме эндометриоидной выстилки «молодой» ЭК по мере увеличения количества нейтрофилов подлежащей ФП косвенно подтверждает неблагоприятное влияние острого воспаления на микроциркуляцию и трофику эндометриоидной выстилки кисты. Отрицательные корреляции между гранулоцитами и макрофагами указывают на их противоположную
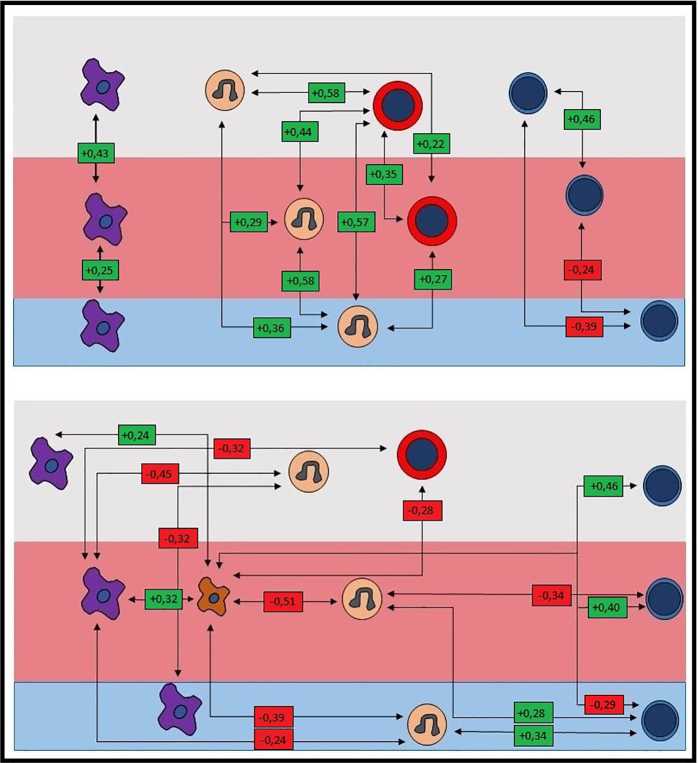
Рис. 4. Корреляции между клеточными популяциями в тканях «зрелой» эндометриоидной кисты
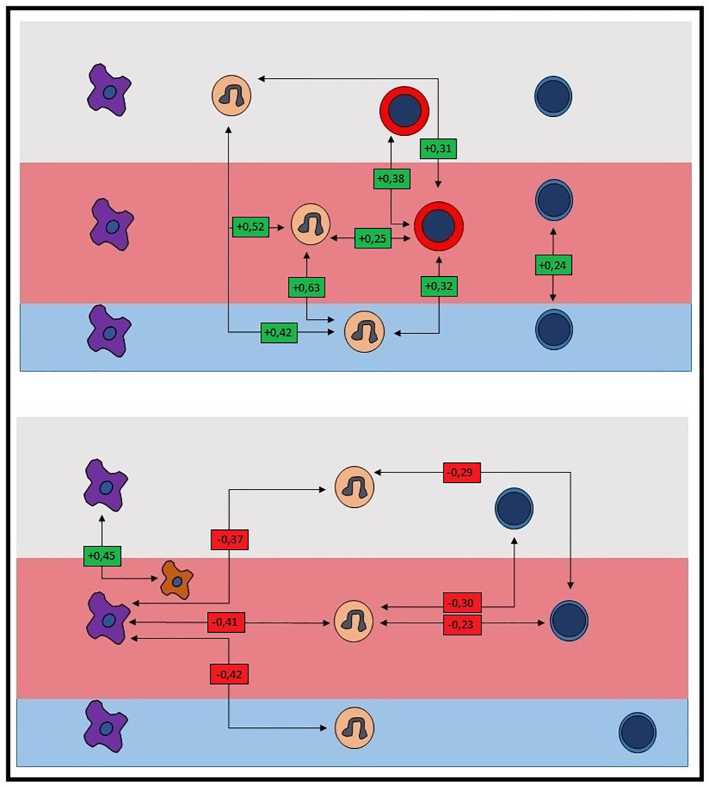
Рис. 5. Корреляции между клеточными популяциями в тканях «старой» эндометриоидной кисты функциональную направленность, в таком случае макрофаги должны быть представлены противовоспалительной субпопуляцией (М2). Интересно, что, по данным исследователей, именно эта субпопуляция преимущественно инфильтрирует ЭГ [5], способствуя сохранению их гомеостаза за счет регуляции процессов регенерации и ангиогенеза [6, 7]. Заметим, что настоящий макрофагальный фенотип имеет слабовыраженную способность к фагоцитозу, что особенно заметно в условиях нарушения кровообращения. Однако положительная корреляция между макрофагами и сидерофагами в пределах зоны 2 свидетельствует о поляризации макрофагального фенотипа с образованием группы провос-палительных макрофагов (М1), обладающих более выраженной способностью к фагоцитозу, поскольку они необходимы для ликвидации последствий усугубляющихся нарушений кровоснабжения в пределах стромы эндометриоидной выстилки. Следовательно, смена макрофагального фенотипа дает возможность восстановления гомеостаза за счет появления сиде-рофагов в условиях нарушенной трофики.
В стенке «зрелой» ЭК наибольшее количество связей формируют нейтрофилы зоны 1 и эозинофилы зоны 3. Это может быть связано с тем, что нейтрофилы преодолели подлежащую ФП и накапливаются в ней, что приводит к ее отеку и постепенному уплотнению; кроме этого, проникновение нейтрофилов в маточный эпителий способствует постепенной атрофии эндометриоидной выстилки. Так, помимо положительной корреляции с макрофагами зоны 2, сидерофаги образуют еще одну положительную корреляцию с макрофагами зоны 3, что может указывать на продолжающуюся поляризацию макрофагов вследствие нарастающих нарушений кровоснабжения. Заметим, что коммуникации ткани ЭГ несостоятельны и не могут обеспечить восполнения макрофагального пула из периферической крови так же эффективно, как в нормальном эндометрии. Следовательно, со временем происходит истощение клеточной субпопуляции противовоспалительных макрофагов (М2), что в конечном итоге еще больше способствует расстройству гомеостаза ЭГ. Перечисленные особенности положения и направления корреляций указывают на постепенную хронизацию воспалительной реакции с одновременным усугублением расстройств кровоснабжения в тканях «зрелой» ЭГ.
В «старой» ЭК уменьшается количество корреляций, сформированных лимфоцитами, вероятная функция которых на данном этапе — это регуляция апоптоза эндометриоидной выстилки по мере усугубления гипоксии и реперфузионных повреждений, обусловленных нарушением кровоснабжения данной области [8]: имеется одна положительная корреляция между лимфоцитами 1 и 2 зон. Вполне очевидно, что гранулоцитарная инфильтрация как морфологический субстрат острого воспаления неблагоприятно влияет на гомеостаз ЭГ, что подтверждается относительной сохранностью количества корреляций между гранулоцитами 1-3 зон на всех этапах существования ЭК при разрушении связей между другими клетками в стенке. Ранее N. M. Nowak с соавт. показали то, что экспериментально воспроизведенный перитонит у мышей негативно влияет на имплантацию взвеси ткани эндометрия и последующее формирование ЭГ, из чего следует, что острое воспаление в брюшной полости блокирует возникновение эндометриоза [3]. Таким образом, происходит дальнейшая хрони-зация воспалительной реакции, что в итоге приведет к полной атрофии эндометриоидной выстилки кисты яичника и формированию так называемой склерозированной ЭК яичника [1].
Заключение. Нарастание плотности гранулоцитарного инфильтрата в области ФП на границе теки — стромы ЭГ способствует ее постепенному уплотнению за счет отека и склероза с последующим нарушением кровоснабжения ткани и истощением макрофагального пула за счет поляризации противовоспалительной субпопуляции макрофагов (М2) с увеличением количества сидерофагов, что неблагоприятно отражается на поддержании гомеостаза ЭГ. Таким образом, острая воспалительная реакция, последующая ее хронизация с исходом в склероз приводят к нарастанию гипоксии, являясь основными модуляторами эволюции ЭК яичника с формированием в конечном итоге так называемой склерозированной ЭК яичника.
Список литературы Воспаление, гипоксия и склероз как основные модуляторы эволюции эндометриоидной кисты яичника
- Нейштадт Э.Л., Ожиганова И.Н. Опухоли яичника. СПб.: Фолиант, 2017; 352 с.
- Jiang L, Yan Y, Liu Z, Wang Y. Inflammation and endo-metriosis. Front Biosci (Landmark Ed). 2016; (21): 941-8. DOI: 10.2741/4431. PMID: 27100482.
- PMID: 27100482
- Nowak NM, Fischer OM, Gust TC, et al. Intraperitoneal inflammation decreases endometriosis in a mouse model. Human Reproduction. 2008; 23 (11): 2466-74.
- Украинец P.В., Корнева Ю.С. Поляризация макрофагального клеточного центра в процессе эволюции эндометриоидной кисты яичника. Сибирский журнал клинической и экспериментальной медицины. 2021; 36 (2): 84-91.
- Smith КА, Pearson СВ, Hachey AM, et al. Alternative activation of macrophages in rhesus macaques (Macaca mulatta) with endometriosis. Comp Med. 2012; 62 (4): 303-10.
- Mantovani A, Sica A, Sozzani S, et al. The chemokine system in diverse forms of macrophage activation and polarization. Trends Immunol. 2004; 25 (12): 677-86. 10.1016/j.it. 2004.09.015.
- Mantovani A. Macrophage diversity and polarization: in vivo veritas. Blood. 2006; 108 (2): 408-9.
- Kim JS, Choi YS, Park JH, et al. Role of B-cell translocation gene 1 in the pathogenesis of endometriosis. Int J Mol Sci. 2019; 20 (13): 3372.


