Воспалительная кардиомиопатия у больного с острой декомпенсацией сердечной недостаточности
Автор: Кручинкина Екатерина Владимировна, Рябова Тамара Ростиславовна, Роговская Юлия Викторовна, Рябов Вячеслав Валерьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 4 т.32, 2017 года.
Бесплатный доступ
Представлен клинический случай воспалительной вирусной кардиомиопатии, протекающей по типу острой декомпенсации хронической сердечной недостаточности. Проводилась дифференциальная диагностика с ишемической кардиомиопатией. Диагноз установлен с помощью эндомиокардиальной биопсии и иммуногистохимическим исследованием ткани сердца.
Острая декомпенсация хронической сердечной недостаточности, ишемическая болезнь сердца, воспалительная кардиомиопатия, 2d-speckle tracking эхокардиография, биопсия миокарда, иммуногистохимический анализ
Короткий адрес: https://sciup.org/149126050
IDR: 149126050 | УДК: 616.12-005.4-008.46: | DOI: 10.29001/2073-8552-2017-32-4-65-69
Текст научной статьи Воспалительная кардиомиопатия у больного с острой декомпенсацией сердечной недостаточности
В настоящее время распространенность случаев хронической сердечной недостаточности (ХСН) в РФ составляет 7,9 млн [1], в США — 5,7 млн [2]. Большая часть случаев (60%) повторных госпитализаций по поводу декомпенсации ХСН приходится на ХСН со сниженной фракцией выброса [3]. В 59% случаев ишемическая болезнь сердца (ИБС) [1] и в 10–15% ишемическая кардиомиопатия вследствие ремоделирования левого желудочка (ЛЖ) после перенесенного инфаркта миокарда выступают этиологическими факторами декомпенсации ХСН [4]. Несмотря на то, что в последнее время разработана оптимальная медикаментозная и инвазивная тактика лечения ИБС и ХСН, которая позволила снизить общую смертность [5], частота повторных госпитализаций по поводу острой декомпенсации ХСН составляет 35% в течение первых 60 дней [6], что свидетельствует о недостаточности современной вторичной профилактики острой декомпенсации ХСН.
Существует необходимость в продолжении научного поиска для понимания патогенеза ХСН, получения новых данных, которые, возможно, лежат в основе сложившейся ситуации, а именно недостаточной эффективности рекомендованной терапии [1]. Одними из вероятных причин высокой частоты острой декомпенсации и повторных госпитализаций являются продолжающееся не диагностированное с помощью неинвазивных методов субклиническое воспаление в ткани миокарда, отсутствие доказательной базы, имеющихся способов диагностики и назначения эффективной противовоспалительной терапии. «Золотым стандартом» диагностики воспаления в миокарде и определения его типа является эндомиокардиальная биопсия (ЭМБ) с иммуногистохимическим анализом.
Клинический случай демонстрирует возможности современных методов диагностики и лечения больного с острой декомпенсацией ХСН, устойчивой к медикаментозному лечению.
Пациент 34 лет, поступил в отделение неотложной кардиологии НИИ кардиологии г. Томска в октябре 2016 г. с жалобами на одышку, возникающую в покое, сухой ка- шель, колющие боли в области сердца, не связанные с физической нагрузкой, отеки на ногах.
В октябре 2015 г. пациент перенес передний STEMI, выполнена экстренная инвазивная коронарная ангиография (КАГ) со стентированием единственной атеросклеротически измененной передней нисходящей коронарной артерии. После перенесенного инфаркта миокарда у пациента развилась ХСН с систолической дисфункцией — фракция выброса (ФВ) ЛЖ 40%. Пациент был бессимптомен в течение двух месяцев, после чего возникла декомпенсация ХСН. На фоне приема ингибиторов ангиотензинпревращающего фермента, антагонистов минералокортикоидных рецепторов, диуретиков, подтверждая комплаентность к медикаментозному лечению и отрицая употребление алкоголя, пациент трижды госпитализировался по поводу острой декомпенсации ХСН. Во время последней госпитализации, в сентябре 2016 г., была выявлена рефрактерность к проводимому лечению, сохранялся двусторонний гидроторакс, асцит.
В описываемую госпитализацию у пациента наблюдались цианоз губ, набухание шейных вен, отеки голеней, учащенное сердцебиение (частота сердечных сокращений (ЧСС) 82 уд./мин), тахипноэ (частота дыхания 22 д./ мин), артериальная гипотония (артериальное давление 87/60 мм рт. ст.), выслушивались влажные хрипы в нижних отделах легких. Лабораторные данные представлены в таблице, признаков воспалительной реакции (лейкоцитоза, увеличения концентрации С-реактивного белка, скорости оседания эритроцитов (СОЭ), диагностически значимого повышения маркеров некроза миокарда) не наблюдалось.
На момент поступления по электрокардиографии (ЭКГ) — ритм синусовый, правильный, ЧСС 84 уд./мин, положение электрической оси сердца резко вправо, Р-mitrale в II, III, aVF и двухфазность зубца P в V1–V2, QS в V4–V6, депрессия сегмента SТ в III, aVF, V1 и V2. Значимых изменений по данным ЭКГ за время госпитализации не наблюдалось, нарушений ритма сердца не зарегистрировано (рис. 1).
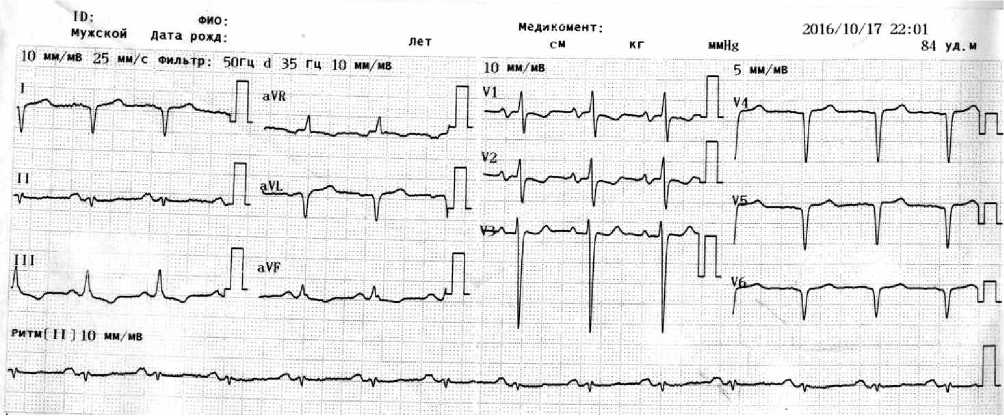
Рис. 1. ЭКГ при поступлении
Лабораторные показатели в динамике
|
Общий анализ крови |
||||
|
17.10.2016 |
18.10.2016 |
1.11.2016 |
норма |
|
|
Лейкоциты, 109/л |
6,3 |
5,6 |
4,0–9,0 |
|
|
Эритроциты, 1012/л |
4,77 |
4,69 |
4,0–5,0 |
|
|
Гемоглобин, г/л |
132 |
131 |
130–160 |
|
|
Гематокрит, % |
41,9 |
41,6 |
40–48 |
|
|
Лимфоциты, % |
32.6 |
34 |
19-40 |
|
|
Нейтрофилы, % |
54 |
53 |
47-72 |
|
|
Моноциты, % |
11,5 |
10,7 |
3–11 |
|
|
Базофилы, % |
0,4 |
0,2 |
0–1 |
|
|
СОЭ, мм/ч |
8 |
6 |
2–12 |
|
|
Биохимический анализ крови |
||||
|
Глюкоза, ммоль/л |
4.2 |
3,8–6,1 |
||
|
АЛТ, Ед/л |
20 |
0–42 |
||
|
АСТ, Ед/л |
23 |
0–37 |
||
|
КФК, Ед/л |
73 |
67 |
57 |
24–171 |
|
КФК-МВ, Ед/л |
18 |
15 |
16 |
До 25 |
|
Тропонин I, нг/мл |
0,032 |
0,044 |
0–0,04 Пороговое для ОКС 0,5 |
|
|
Холестерин, ммоль/л |
2,2 |
3,5–5,2 |
||
|
Альбумин, г/л |
40,8 |
40,5 |
35–52 |
|
|
Общий белок, г/л |
72 |
74 |
64–83 |
|
|
Натрий, ммоль/л |
139 |
136 |
136–145 |
|
|
Калий, ммоль/л |
4,6 |
4,6 |
3,5–5,1 |
|
|
СРБ, мг/л |
9,0 |
4,0 |
0–10 |
|
|
Фибриноген, г/л |
2,49 |
1,64 |
2–4,8 |
|
По эхокардиографии выявлена дилатация всех камер сердца (конечный диастолический объем ЛЖ 180 мл, конечный систолический объем ЛЖ 115 мл), эксцентричная гипертрофия ЛЖ (индекс массы миокарда 160 г/м2), ФВ ЛЖ 32%, акинез передних и перегородочных сегментов, аневризма верхушки 30 мл с пристеночным тромбозом, односторонний гидроторакс (справа до 700 мл). По результатам ультразвукового исследования органов брюшной полости обнаружены признаки застоя в печени, гепатомегалия, асцит до 500 мл.
Результаты 2D Speckle Tracking эхокардиографии показали выраженное диффузное нарушение продольной деформации ЛЖ (Global Longitudinal Strain (GLS) –1,1%). Наиболее выраженная деформация в верхушечных и передне-перегородочных сегментах ЛЖ. Установлено нарушение скручивания ЛЖ за счет снижения скручивания основания (–6,19°) и отсутствия скручивания верхушки (0,34°), torsion 2,41 (рис. 2).
Отсутствие рестеноза стента и de novo атеросклеротического поражения коронарных артерий по результатам инвазивной КАГ явилось основанием для исключения ишемической этиологии неблагоприятного ремоделирования сердца и декомпенсации ХСН. Назначенное оптимальное медикаментозное лечение не давало позитивного ответа, что позволило рассмотреть данную ситуацию как резистентную ХСН.
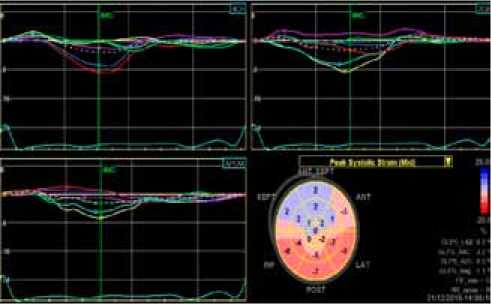
Рис. 2. Показатели продольной деформации ЛЖ
Для уточнения этиологии вторичной дилатационной кардиомиопатии была выполнена ЭМБ, позволившая определить подострый вирусный миокардит с выраженной активностью (CD45+, CD68+>50 в 1 мм2), со слабо выраженным интерстициальным фиброзом, субэндокардиальным фиброзом, фиброзом эндокарда; со слабо выраженной экспрессией антигенов вируса герпеса 6-го типа, выраженной экспрессией энтеровирусного антигена VP-1 (рис. 3). Диагноз был сформулирован на основании Далласских критериев миокардита и классификации С. Basso и F. Calabrese.
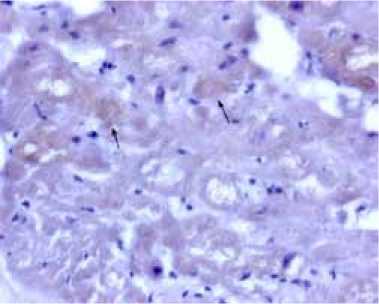
Рис. 3. ЭМБ, иммуногистохимическое исследование (окраска гематоксилин-эозином; х 400). Выраженная экспрессия энтеро-вирусного антигена VP-1 в цитоплазме кардиомиоцитов
Следует отметить, что на данный момент нет единого мнения среди экспертов по ведению больных с миокардитом, однако некоторые завершенные клинические исследования показали, что использование внутривенного введения иммуноглобулинов, интерферона альфа-2b, валацикловира и иммуносупрессоров оказывает положительное влияние на сократительную функцию ЛЖ с последующим уменьшением симптоматических проявлений сердечной недостаточности [7].
Пациенту было назначено:
-
1) внутривенное введение иммуноглобулина G — 50 мл в сутки в течение 3 дней;
-
2) метипред 40 мг в сутки с постепенным снижением дозы до 4 мг в сутки;
-
3) суппозитории интерферона альфа-2b по 1 млн МЕ 2 раза в день в течение 10 дней, затем через 1 день до 6 мес.;
-
4) валацикловир 500 мг по 1 таб. 2 раза в день до 6 мес.
Через трое суток отмечалась положительная динамика в виде уменьшения одышки, отсутствия гидроторакса, асцита, прошла сердечная астма.
При выписке рекомендовано: повторная ЭМБ через 6 мес.; контроль эхокардиографии; при сохраняющейся систолической дисфункции и отсутствии признаков воспаления в ткани миокарда — имплантация кардиовертера-дефибриллятора с целью первичной профилактики внезапной сердечной смерти [8].
В настоящий момент уже ведутся исследования по изучению воспалительной кардиомиопатии (ВКМП) [7, 9], но при этом не существует единой концепции развития, диагностики ВКМП [10] и, как следствие, разработанных рекомендаций по лечению этого тяжелого заболевания.
Список литературы Воспалительная кардиомиопатия у больного с острой декомпенсацией сердечной недостаточности
- Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и др. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр)/Сердечная недостаточность. 2013; 14(7): 379-472
- MiroO., Peacock F.W., McMurray J.J., Bueno H., Christ M., Maisel A.S., Cullen L., Cowie M.R., Di Somma S., Martin Sanchez F.J., Platz E., Masip J., Zeymer U., Vrints C., Price S., Mebazaa A., Mueller C. European Society of Cardiology -Acute Cardiovascular Care Association position paper on safe discharge of acute heart failure patients from the emergency department/European Heart Journal: Acute Cardiovascular Care. 2016; 6(4): 311-320. DOI: 10.1177/2048872616633853
- Farmakis D., Parissis J., Lekakis J., Philippathos G. Acute Heart Failure: Epidemiology, Risk Factors, and Prevention/Rev. Esp. Cardiol. 2015; 68(3): 245-248. DOI: 10.1016/j.rec.2014.11.004
- Энглевский Н.А., Гутор C.С., Шилов Б.В., Казаков В.А., Андреев С.Л., Суходоло И.В. Создание программного комплекса для автоматизации морфометрии миокарда при выборе метода оперативного лечения больных ишемической кардиомиопатией/Медицинские информационные системы. 2014; 2: 33-39
- Оганов Р.Г. Новые возможности улучшения качества и продолжительности жизни больных стабильной ишемической болезнью сердца/Атмосфера. Новости кардиологии. 2015; 1: 11-13
- Mozaffarian D., Benjamin E.J., Go A.S., Arnett D.K., Blaha M.J., Cushman M., Das S.R., Ferranti S., Despres J., Fullerton H.J., Howard V.J., Huffman M.D., Isasi C.R., Jimenez M.C., Judd S.E., Kissela B.M., Lichtman J.H., Lisabeth L.D., Liu S., Mackey R.H., Magid D.J., McGuire D.K., Mohler E.R., Moy C.S., Muntner P., Mussolino M.E., Nasir K., Neumar R.W., Nichol G., Palaniappan L., Pandey D.K., Reeves M.J., Rodriguez C.J., Rosamond W., Sorlie P.D., Stein J., Towfighi A., Turan T.N., Virani S.S., Woo D., Yeh R.W., Turner M.B. Heart Disease and Stroke Statistics-2016 Update. A Report from the American Heart Association/Circulation. 2016; 135(20): e38-e360. DOI: 10.1161/CIR.0000000000000350
- Dominguez F., Kuhl U., Pieske B., Garcia-Pavia P., Tschope C. Update on Myocarditis and Inflammatory Cardiomyopathy: Reemergence of Endomyocardial Biopsy/Rev Esp Cardiol. 2016; 69(2): 178-187. DOI: 10.1016/j.rec.2015.10.015
- Priori S.G., Blomstrom-Lundqvist C., Mazzanti A., Blom N., Borggrefe M., Camm J., Elliott P.M., Fitzsimons D., Hatala R., Hindricks G., Kirchhof P., Kjeldsen K., Kuck K., Hernandez-Madrid A., Nikolaou N., Norekval T.M., Spaulding Ch., Veldhuisen D.J. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC)/European Heart Journal. 2015; (36)41: 2793-2867. DOI: 10.1093/eurheartj/ehv316
- Ryabov V.V., Kruchinkina E.V., Rogovskaya Yu.V., Ryabova T.R., Batalov R.E., Rebenkova M.S., Popov S.V., Karpov R.S. Clinical and morphological characteristics of chronic inflammation in the myocardium in patients with decompensated chronic heart failure accompanied by ischemic systolic dysfunction: study protocol for an open-label nonrandomized trial/Clinical Trials in Degenerative Diseases. 2016; 4: 160-165. DOI: 10.4103/24685658.196980
- Гомбожапова А.Э., Роговская Ю.В., Рябова Т.Р., Кручинкина Е.В., Гундерина К.И., Баталов Р.Е., Рябов В.В. Случай псевдокоронарного варианта клинического течения воспалительной вирусной кардиомиопатии/Сибирский медицинский журнал. 2015;(30)4: 60-65


