Восстановление нарушенного сперматогенеза после интратестикулярной трансплантации ткани неонатального яичка
Автор: Кирпатовский В.И., Кудрявцев Г.Ю., Кудрявцева Л.В., Фролова Е.В.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 4, 2018 года.
Бесплатный доступ
В экспериментах на 20 белых беспородных крысах-самцах моделировали нарушение сперматогенеза путем перемещения обоих яичек в брюшную полость на 2 недели. После этого яички низводили в мошонку, причем в опытной серии при этом производили трансплантацию ткани яичка, полученной от новорожденных крысят (1-2 дня после рождения), под белочную оболочку. В контрольных опытах трансплантации не проводили. При обследовании животных через 1 и 3 месяца в контрольных опытах выявили выраженную гипотрофию яичек (до 51% от нормы), резкое нарушение сперматогенеза, проявляющееся в блоке созревания клеток сперматогенного эпителия на уровне сперматогоний или сперматоцитов 1-го порядка, 3-4 кратное уменьшение количества клеток Сертоли и более чем 10-кратное уменьшение клеток Лейдига, а также почти двукратное снижение концентрации тестостерона в крови. В опытах с трансплантацией неонатальной тестикулярной ткани во всех экспериментах обнаружены прижившие трансплантаты, увеличивающие в размерах к 3 месяцам...
Сперматогенез, трансплантация, гематотестикулярный барьер, тестикулярная ткань
Короткий адрес: https://sciup.org/142216902
IDR: 142216902
Текст научной статьи Восстановление нарушенного сперматогенеза после интратестикулярной трансплантации ткани неонатального яичка
экспериментальная и клиническая урология № 4 2 0 1 8
Метод трансплантации под белочную оболочку яичка был выбран в связи с иммунопривилегированностью этой зоны вследствие наличия гематотестикулярного барьера, что позволяет приживать генетически чужеродным тканям и клеткам. Методика трансплантации заключалась в надсечении белочной оболочки яичка в бессосудистой зоне, формировании с помощью микрохирургического зонда под белочной оболочкой тоннеля и помещении в него фрагмента неонатальной тестикулярной ткани с последующим ушиванием разреза оболочки яичка.
Животных обследовали через 1 и 3 месяца после низведения яичка. В эти сроки брали пробы крови для определения уровня тестостерона в крови, удаляли яички, определяли их массу взвешиванием и брали пробы ткани из области трансплантации для гистологического и морфометрического исследования. Концентрацию тестостерона в сыворотке крови определяли иммунохемилюминес-центным методом на иммунохимиче-ском анализаторе Access 2 (Beckman Coulter, США). Гистологическое исследование проводили по стандартной методике с окрашиванием парафиновых срезов гематоксилином и эозином.
Статистическую обработку цифровых данным проводили по методу Стьюдента с использованием критерия достоверности t. Статистически значимыми считали различия при p <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Во всех экспериментах через 2 недели после перемещения яичек в брюшную полость развивалась их выраженная гипотрофия. Масса органа уменьшалась с 1,87±0,03 г до 0,79±0,02 г (p<0,001). В контрольной серии (без трансплантации) через 1 и 3 месяца после низведения яичек в мошонку их масса возрастала незначительно, но статистически достоверно – до 0,92±0,03 и 0,96±0,03 г соответственно (p<0,05). В опытной серии (с трансплантацией неонатальной тестикулярной ткани) через 1 и 3 месяца после низведения яичек во всех опытах выявили приживший трансплантат, размеры которого возрастали с увеличением сроков наблюдения (рис. 1).
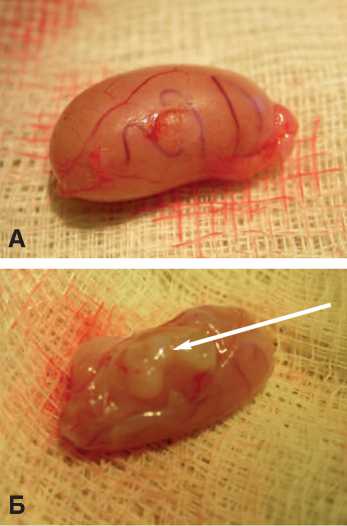
Рис. 1. Внешний вид яичка крысы через 1 месяц (А) и через 3 месяца (Б) после трансплантации ткани неонатального тестикула под белочную оболочку. Стрелкой указан приживший трансплантат
При этом масса органа в опытной серии возрастала в большей степени, чем в контрольных опытах, приближаясь к нормальным значениям – до 1,26±0,02 и 1,59±0,03 г через 1 и 3 месяца, соответственно. Различия между контрольной и опытной группами оказались статистически значимыми с достоверностью p<0,001 (рис. 2).
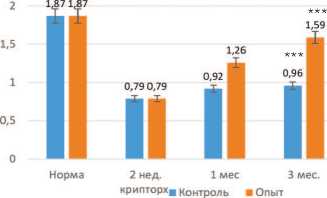
Рис. 2. Влияние трансплантации неонатальной тестикулярной ткани на восстановление массы крипторхированного яичка крысы (в граммах). *** достоверность различий между группами p <0,001
Гистологическое исследование крипторхированных яичек выявило значительное нарушение сперматогенеза с появлением множества пол- ностью запустевших или склерозированных канальцев, а также канальцев с резко дистрофированным эпителием. После низведения яичек в мошонку в контрольной серии картина менялась незначительно. Даже через 3 месяца по-прежнему сохранялось большое количество канальцев, скле- розированных или полностью ли- шенных сперматогенного эпителия, а в канальцах с сохраненным эпителием выявляли только незрелые формы клеток (рис. 3).
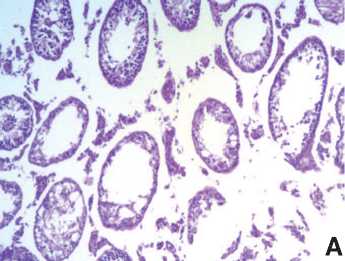
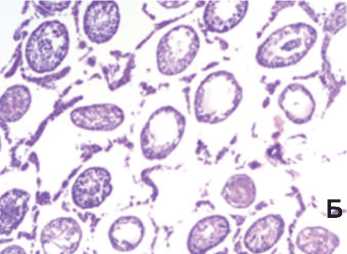
Рис. 3. Гистологическая картина крипторхиро-ванных яичек перед низведением в мошонку (А) и через 3 месяца после низведения (Б). Окраска гематоксилином и эозином. Ув. 100х
При исследовании яичек опытной серии выявили, что в прижившем трансплантате уже через один месяц сформировались зрелые семенные канальцы, выстланные спер-матогенным эпителием разной степени зрелости. Дифференцировка клеток в канальцах доходила до стадии сперматоцитов 1-го порядка. В интерстициальной ткани трансплантата обнаружены кровеносные сосуды и скопления клеток Лейдига. Трансплантат окружен соединительнотканной капсулой, отграничивающий его от ткани яичка экспериментальная и клиническая реципиента (рис. 4). Через 3 месяца сохранялась такая же картина. Таким образом, пересаженная незрелая тестикулярная ткань подвергалась нормальному развитию с формированием типичных структур зрелого органа, но с незавершенным сперматогенезом.
Таблица 1. Морфометрические показатели крипторхированных яичек через 1 и 3 месяца после их низведения
|
Показатели |
1 месяц |
3 месяца |
||
|
Контроль |
Опыт |
Контроль |
Опыт |
|
|
Доля запустевших канальцев (%) |
75,1±6,3 |
6,2±0,3*** |
69,8±5,1 |
3,2±0,2*** |
|
Кол-во клеток Сертоли на 1 каналец |
3,3±0,7 |
34,6±2,2*** |
10,2±0,9 |
41,3±1,8 |
|
Кол-во клеток Лейдига на ед. площади препарата |
1,6±0,6 |
41,1±3,6*** |
3,2±0,6 |
44,8±3,9*** |
Примечание: *** - различие по сравнению с контролем достоверно при p <0,001
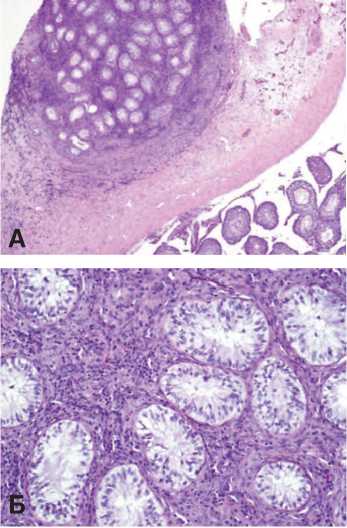
Рис. 4. Трансплантат неонатальной тестикулярной ткани через 1 месяц после пересадки под белочную оболочку крипторхированного яичка.
А – общий вид трансплантата. Окраска гематоксилином и эозином. Ув. 50х
Б – семенные канальцы трансплантата, выстланные сперматогенным эпителием разной степени зрелости. Окраска гематоксилином и эозином. Ув.200х
При этом обнаружили значительное улучшение состояния спер-
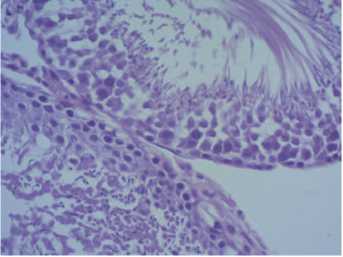
Рис. 5. Гистологическая картина крипторхиро-ванного яичка через 3 месяца после низведения в мошонку с одновременной трансплантацией неонатальной тестикулярной ткани. Окраска гематоксилином и эозином. Ув. 400х матогенного эпителия в семенных канальцах собственного яичка реципиента. Значительно уменьшалось число запустевших канальцев по сравнению с контрольной серией. Большинство канальцев были выстланы сперматогенным эпителием, причем во многих канальцах выявлялся полностью завершенный сперматогенез (выявляли сперматозоиды в просвете канальцев) (рис. 5).
С целью большей объективизации изменений, вызванных трансплантацией неонатальной тестикулярной ткани, провели количественный анализ ряда существенных показателей, характеризующих состояние крипторхированных яичек в опытной и контрольной сериях, а именно, количество запустевших канальцев на единицу площади препарата, число клеток Сертоли на 1 каналец, число клеток Лейдига на единицу площади препарата, а также наличие клеток сперматогенеза разной степени дифференцировки (табл. 1).
В контрольной серии доля полностью запустевших канальцев составила через 1 месяц после низведения 75,1±6,3%, а через 3 месяца -69,8±5,1%, тогда как в опытной серии (с трансплантацией неонатальной тестикулярной ткани) их доля значительно уменьшилась, составив всего 6,2±0,3% и 3,2±0,2% соответственно ( p <0,001 по сравнению с контрольной серией).
Число клеток Сертоли на 1 каналец в контрольной серии составило в среднем 3,3±0,7 клеток через 1 месяц и 10,2±0,9 клеток через 3 месяца после низведения яичек, а в опытной серии этот показатель возрос до 34,6±2,2 и 41,3±1,8 клеток соответственно ( p <0,001 по сравнению с контрольной серией).
Число интерстициальных клеток Лейдига на единицу условной площади в контрольной серии составило 1,6±0,6 и 3,2±0,6 через 1 и 3 месяца после низведения яичек, тогда как в опытной серии этот показатель составил 41,1±3,6 и 44,8±3,9 клеток через 1 и 3 месяца соответственно ( p <0,001 по сравнению с контрольной серией).
Важным показателем состояния сперматогенеза является его завершенность, определяемая гистологически по выявлению клеток
Таблица 2. Влияние трансплантации неонатальной тестикулярной ткани на восстановление нарушенного сперматогенеза в крипторхированных яичках
|
Серии |
Сперматогонии А светлые |
Сперматогонии А темные |
Сперматогонии Б |
Сперматоциты 1 порядка |
Сперматоциты 2 порядка |
Сперматозоиды |
|
Через 1 месяц |
||||||
|
Контроль (1-я серия) |
100% |
60% |
12,5% |
12,5% |
0 |
0 |
|
Опыт (2-я серия) |
100% |
100% |
100%*** |
100%*** |
88%*** |
38%*** |
|
Через 3 месяца |
||||||
|
Контроль (1-я серия) |
100% |
100% |
63% |
38% |
13% |
0 |
|
Опыт (2-я серия) |
100% |
100% |
100% |
100%*** |
100%*** |
75%*** |
Примечание: *** - различие по сравнению с контролем достоверно при p<0,001
экспериментальная и клиническая урология № 4 2 0 1 8 сперматогенного эпителия разной степени зрелости вплоть до сперматозоидов. Проведенный анализ показал, что в контрольной серии в подавляющем большинстве опытов в канальцах с сохраненным сперма-тогенным эпителием выявляли блок сперматогенеза на уровне спермато-гоний или сперматоцитов 1-го порядка (табл. 2). Через 1 месяц после низведения яичек лишь в 60% опытов в семенных канальцах выявляли темные сперматогонии А, а более зрелые формы (сперматогонии Б и сперматоциты 1-го порядка) были обнаружена в канальцах лишь в 1 из 8 опытов. Более зрелые формы не выявлялись ни в одном из опытов этой серии. Через 3 месяца картина несколько улучшилась (сперматого-нии А темные выявлены в канальцах в 100% случаев, сперматогонии Б – в 63% (5 из 8 опытов), сперматоциты 1-го порядка – в 38% (3 из 8 опытов), а сперматоциты 2-го порядка – в 13% (1 из 8 опытов). Сперматозоиды в просвете канальцев не выявлены ни в одном из экспериментов.
В то же время в опытной серии через 1 месяц после низведения яичек во всех опытах сперматогенез доходил до стадии сперматоцитов 1-го порядка, а в 38% (3 из 8 опытов) в просвете канальцев выявляли зрелые сперматозоиды. Через 3 месяца во всех опытах сперматогенез доходил до стадии сперматоцитов 2-го порядка, а в 75% (6 из 8 опытов) был полностью завершенным (в просвете канальцев выявляли сперматозоиды).
Поскольку мы выявили значительное восстановление популяции клеток Лейдига в крипторхирован-ном яичке после трансплантации неонатальной тестикулярной ткани, было важно определить их функциональную активность, а именно способность к синтезу тестостерона. Определение его концентрации в крови показало, что после 2 недель пребывания яичек в брюшной полости уровень тестостерона снижается почти в 2 раза (с 2,51±0,3
нг/мл до 1,32±0,3 нг/мл). В контрольной серии опытов через 1 и 3 месяца после низведения яичек в мошонку он достоверно не менялся, составив 1,44±0,4 и 1,48±0,3 нг/мл соответственно. В то же время в опытной серии уже через 1 месяц уровень тестостерона возрастал до 2,13±0,4 нг/мл, а через 3 месяца достигал нормальных значений (2,87±0,5 нг/мл).
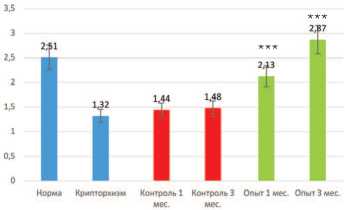
Рис. 6. Влияние трансплантации неонатальной тестикулярной ткани на уровень тестостерона плазмы крови крыс с 2-недельным эксперимен- тально вызванным крипторхизмом.
*** различия достоверны при p <0,001 по сравнению с контрольной серией
Таким образом, полученные нами результаты свидетельствуют, что трансплантация неонатальной тестикулярной ткани, полученной от новорожденных крысят (1-2 суток после рождения), взрослым крысам с нарушением сперматогенеза путем моделирования абдоминальной формы крипторхизма приводит к стимуляции регенерации поврежденных структур органа, включая клетки Сертоли, клетки Лейдига и сперматогенный эпителий. При этом происходит полное восстановление сперматогенеза до стадии сперматозоидов, чего не происходит в контрольных опытах, где трансплантация ткани не выполнялась.
В публикациях последних лет имеется много доказательств, что пересадка низкодифференцированных стволовых клеток внетестику-лярного происхождения, обладающих высокой пластичностью, в частности мезенхимных стволовых клеток костного мозга, жировой ткани или пупочного канатика, приводит к восстановлению сперматогенеза, нарушенного различными методами [4,13-16]. При этом име- ются данные, что эти клетки способны трансформироваться в клетки Лейдига, продуцирующие тестостерон, с чем и связан их лечебный эффект [4,14]. Также описано положительное влияние трансплантации культивированных предшественников клеток Лейдига или стволовых клеток сперматогенного эпителия [2,3,5,17,18]. При этом также выявлено, что пересаженные в яичко сперматогонии могут трансформироваться в клетки Лейдига, секретирующие тестостерон [8], однако для этого необходима кооперация этих клеток с другими клетками их микроокружения. Если при трансплантации суспензии интерстициальной ткани, заключенной в альгинатные капсулы, в подкожную клетчатку кастрированных самцов крыс не выявляли достоверного возрастания уровня тестостерона в крови животных, то при совместной трансплантации интерстициальных клеток и семенных канальцев обнаружили формирование гормонально активных клеток Лейдига с нормализацией уровня тестостерона в крови. Авторы заключают, что интерстициальные клетки-предшественники нуждаются для дифференцировки в гормонально активные клетки в паракринных факторах, которые могут продуцироваться клетками семенных канальцев.
Именно такая ситуация имеет место в незрелых яичках плодов и новорожденных, где имеется полный набор клеток-предшественников всех структур развивающегося органа, что обеспечивает их кооперацию в условиях оптимального микроокружения («ниши»). Это предполагает, что трансплантация ткани плодных или неонатальных яичек может оказать не менее выраженный, а возможно, и более выраженные терапевтический эффект, чем при пересадке культивированных стволовых клеток какого-либо вида.
Наши эксперименты подтверждают это предположение. Транс- плантация ткани неонатального яичка под белочную оболочку поврежденного тестикула (2 недели абдоминального крипторхизма) практически полностью восстанавливала способность к секреции тестостерона и нормализовала сперматогенез вплоть до стадии сперматозоидов. Такой выраженный эффект обеспечивался также длительным сохранением жизнеспособности пересаженной ткани, несмотря на анти- генные различия трансплантата и реципиента (использовали аллогенный вариант трансплантации), что обеспечивалось, с одной стороны, наличием гематотестикулярного барьера, уменьшающего вероятность иммунного отторжения, а с другой стороны более низкой иммуногенностью незрелой тестикулярной ткани за счет низкой экспрессии антигенов гистосовместимости локуса МНС-1 и отсутствие антигенов локуса МНС-2 [19].
ЗАКЛЮЧЕНИЕ
Резюме:
В экспериментах на 20 белых беспородных крысах-самцах моделировали нарушение сперматогенеза путем перемещения обоих яичек в брюшную полость на 2 недели. После этого яички низводили в мошонку, причем в опытной серии при этом производили трансплантацию ткани яичка, полученной от новорожденных крысят (1-2 дня после рождения), под белочную оболочку. В контрольных опытах трансплантации не проводили.
При обследовании животных через 1 и 3 месяца в контрольных опытах выявили выраженную гипотрофию яичек (до 51% от нормы), резкое нарушение сперматогенеза, проявляющееся в блоке созревания клеток сперматогенного эпителия на уровне сперматогоний или сперматоцитов 1-го порядка, 3-4 кратное уменьшение количества клеток Сертоли и более чем 10-кратное уменьшение клеток Лейдига, а также почти двукратное снижение концентрации тестостерона в крови. В опытах с трансплантацией неонатальной тестикулярной ткани во всех экспериментах обнаружены прижившие трансплантаты, увеличивающие в размерах к 3 месяцам. При этом отмечали постепенное увеличение массы криптор-хированных яичек до 84% от нормы, полное восстановление сперматогенеза в большинстве канальцев (наличие сперматозоидов в просвете канальцев) и нормализацию уровня тестостерона в крови.
Считают, что выраженный терапевтический эффект трансплантации фрагментов неонатальной тестикулярной ткани связан с сохранением кооперации стволовых клеток, относящихся к различным органным структурам, в условиях оптимального микроокружения (ниши). Важным условием является длительное сохранение жизнеспособности и пролиферативной активности клеток пересаженной ткани, обусловленное иммунопривилегированностью области пересадки (наличие гематотестикулярного барьера) и низкой иммуногенностью стволовых клеток.
Список литературы Восстановление нарушенного сперматогенеза после интратестикулярной трансплантации ткани неонатального яичка
- Дендеберов Е.С., Кирпатовский И.Д., Михалева Л.М. Новые подходы к лечению крипторхизма, сочетающегося с вторичным гипогонадизмом. Проблемы репродукции 2001;(2):68.
- Deng B, Bondarenko T, Pakhomov O. Changes in sexual behavior of orchidectomized rats under influence of allotransplantation of testicular interstitial cell suspension. Cell Transplant 2017;26(5):795-803 DOI: 10.3727/096368916X693301
- Goodyear S, Brinster R. Spermatogonial stem cell transplantation to the testis. Cold Spring Harb Protoc. 2017;2017(4):pdb.prot094235 DOI: 10.1101/pdb.prot094235
- Ghasemzadeh-Hasankolaei M, Eslaminejad MB, Ghasemzadeh-Hasankolaei M. Functional germ cells from non-testicular adult stem cells: a dream or reality? Curr Stem Cell Res Ther 2018;13(1):60-79 DOI: 10.2174/1574888X12666171107105136
- Zang ZJ, Wang J, Chen Z, Zhang Y, Gao Y, Su Z, et al. Transplantation of CD51+ Stem Leydig cells: a new strategy for the treatment of testosterone deficiency. Stem Cells 2017;35(5): 1222-1232 DOI: 10.1002/stem.2569
- Камалов А.А., Кирпатовский В.И., Охоботов Д.А., Ефименко А.Ю. и др. Использование нового биоматериала на основе продуктов секреции мезенхимных стволовых клеток человека и коллагена для восстановления сперматогенеза на модели экспериментального крипторхизма. Технологии живых систем 2017;14(1):4-17.
- Alves-Lopes JP, Stukenborg JB. Testicular organoids: a new model to study the testicular microenvironment in vitro? Hum Reprod Update 2017;24(2): 176-191 DOI: 10.1093/humupd/dmx036
- Chen H, Jin S, Huang S, Folmer J, Liu J, Ge R, Zirkin BR. Transplantation of alginate-encapsulated seminiferous tubules and interstitial tissue into adult rats: Leydig stem cell differentiation in vivo? Mol Cell Endocrinol 2016;436:250-8 DOI: 10.1016/j.mce.2016.08.046
- Del Vento F, Vermeulen M, de Michele F, Giudice MG, Poels J, des Rieux A, et al. Tissue engineering to improve immature testicular tissue and cell transplantation outcomes: one step closer to fertility restoration for prepubertal boys exposed to gonadotoxic treatments. Int J Mol Sci 2018;19(1). pii: E286 DOI: 10.3390/ijms19010286
- Hotary K, Edward A, Punturieri A, Yana I, Weiss S J. Regulation of cell invasion and morphogenesis in a three-dimensional type I collagen matrix by membrane-type matrix metalloproteinases 1, 2, and 3. J Cell Biol 2000;149(6):1309-1323 DOI: 10.1083/jcb.149.6.1309
- Akhmanova M, Osidak E, Domogatsky S, Rodin S, Domogatskaya A. Physical, spatial, and molecular aspects of extracellular matrix of in vivo niches and artificial scaffolds relevant to stem cells research. Stem Cells Int 2015;2015:167025 DOI: 10.1155/2015/167025
- Кирпатовский В.И, Ефремов Г.Д., Фролова Е.В. Эктопический органогенез при аллотрансплантации ткани свежеудаленного или криоконсервированного неонатального яичка под капсулу почки крыс. Бюллетень экспериментальной биологии и медицины 2018;166(8):230-236.
- Abd Allah SH, Pasha HF, Abdelrahman AA, Mazen NF. Molecular effect of human umbilical cord blood CD34-positive and CD34-negative stem cells and their conjugate in azoospermic mice. Mol Cell Biochem. 2017;428(1-2):179-191 DOI: 10.1007/s11010-016-2928-2
- Peak TC, Haney NM, Wang W, DeLay KJ, Hellstrom WJ. Stem cell therapy for the treatment of Leydig cell dysfunction in primary hypogonadism. World J Stem Cells 2016 Oct 26;8(10):306-315.
- Wang YJ, Yan J, Zou XL, Zhao Y, Meng CY, Yin F, Guo L. Bone marrow mesenchymal stem cells repair cadmium-induced rat testis injury by inhibiting mitochondrial apoptosis. Chem Biol Interact 2017;271:39-47 DOI: 10.1016/j.cbi.2017.04.024
- Jia F, Yudong W, Xin T, Shanling Z, Jinlian H. Immortalization of canine adipose-derived mesenchymal stem cells and their seminiferous tubules transplantation. J Cell Biochem 2018; 119(4):3663-3670.
- Ganguli N, Wadhwa N, Usmani A, Kunj N, Ganguli N, Sarkar RK, et al. An efficient method for generating a germ cell depleted animal model for studies related to spermatogonial stem cell transplantation. Stem Cell Res Ther 2016;7(1):142.
- Mulder CL, Catsburg LAE, Zheng Y, de Winter-Korver CM, van Daalen SKM, van Wely M, et al. Long-term health in recipients of transplanted in vitro propagated spermatogonial stem cells. Hum Reprod 2018;33(1):81-90 DOI: 10.1093/humrep/dex348
- Majumbdar A, Ferber I, Lebkowsky J, Chadwick K, Rouleau A, Gallacher L, et al. Human embryonic Stem Cells possess immune-priveleged properties. Stem Cells 2004;22(4):448-456.


