Воздействие бактериального лектина и повышенной температуры на адипоциты
Автор: Пономарева Е.Г., Черкасова О.А., Симоненко Г.В., Тучин В.В., Никитина В.Е.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Вопросы общей биологии
Статья в выпуске: 1-1 т.14, 2012 года.
Бесплатный доступ
Изучено действие фукозоспецифичного лектина бактерий рода Azospirillum на клетки жировой ткани человека. Исследования проводились при температуре (43,5±0,5)0С. В процессе исследования показана способность лектина ускорять процесс гибели клеток жировой ткани, как здоровых, так и больных сахарным диабетом пациентов, склонных к ожирению. Приведены результаты воздействия двух концентраций лектина на клетки жировой ткани (адипоциты) на структурные изменения клеток в процессе нагрева. Показано, что такое действие приводит к уменьшению размера адипоцитов и их последующей гибели по механизму апоптоза. Особое внимание уделено исследованию скорости гибели клеток. Обнаружены различия в характере гибели клеток при воздействии повышенной температуры, а также лектина и температуры.
Температурный нагрев, лектин, жировая ткань, апоптоз
Короткий адрес: https://sciup.org/148200569
IDR: 148200569 | УДК: 576.385.:
Текст научной статьи Воздействие бактериального лектина и повышенной температуры на адипоциты
Чрезмерное накопление жировых отложений в теле, которое можно определить как ожирение [1-4], было и остается достаточно серьезной проблемой для здоровья человека. При таких заболеваниях, как диабет, гипертония, коронарная патология, гиперлипидемия и подагра, ожирение связано как с перераспределением жировой ткани, так и с увеличением её абсолютного количества [5, 6]. Объем жировой ткани зависит от числа и размера адипоцитов. Причем риск нарушения обмена веществ возрастает с увеличением размера адипоцитов. В организме повышается уровень свободных жирных кислот, что приводит к нарушению структуры мембраны адипоцитов, в результате происходит не только увеличение размера клеток, но и активный рост ткани. При заполнении жиром всех существующих адипоцитов до критической отметки клетки-предшественники начинают делиться и далее заполняться вновь образующимся жиром.
Одним из самых простых способов влияния на жировую ткань является ее нагрев. Известно, что нагрев жировой ткани выше нормального физиологического значения (43°-44 О С) способствует деградации жировых клеток [7]. Однако механизмы деградации и эффективность процесса изучены недостаточно.
Хорошо известно, что гибель части клеток в организме является закономерным и необходимым явлением, и само существование многоклеточного организма подразумевает баланс жизни и смерти на уровне составляющих его клеточных популяций. Программированная гибель или апоптоз – это активная форма гибели клетки, являющаяся результатом реализации ее генетической программы или
ответом на внешние воздействия и проявляющаяся в уменьшении размера клетки, конденсации и фрагментации хроматина, уплотнении клеточной стенки и цитоплазматической мембраны без выхода содержимого клетки в окружающую среду [8]. Апоптоз универсально распространен в мире многоклеточных организмов: аналогичные ему проявления описаны у дрожжей, трипаносом и некоторых других одноклеточных. Ему подвержены все виды тканей. Однако в подавляющем большинстве работ, посвященном апоптозу, объектом изучения являются лимфоциты млекопитающих, прежде всего тимоциты: они легко подвергаются апоптозу, их удобно культивировать, и они хорошо изучены. Именно поэтому классическая схема апоптоза соответствует апоптозу, наблюдаемому в лимфоцитах. Однако процесс апоптоза в других тканях не всегда протекает по классической схеме и имеет свои особенности. Апоптоз, наблюдаемый в кардиомиоцитах [9] или клетках нервной ткани [10], отличается от классической картины апоптоза.
Ранее, основываясь на гипотезе, высказанной в работе [7], при исследовании влияния температуры на жировые клетки человека нами показано, что процесс, подобный апоптозу происходит в жировой ткани под воздействием температуры [11]. Возможно, что эффект температуры можно усилить или, наоборот, ослабить, используя лектин, как биологически активное вещество, способное определенным образом влиять на мембрану клетки и ее метаболизм.
В литературе встречается достаточно большое количество примеров влияния лектинов на клетки животных. Так, лектин бактерий Pseudomonas aeruginosa дестабилизирует мембрану, снижает осмотическую стойкость эритроцитов [12]. Показано, что лектин зародышей пшеницы (АЗП) связывается с инсулиновыми рецепторами на поверхности жировых клеток и оказывает такое же воздействие на ее метаболизм как инсулин: увеличивает скорость окисления глюкозы, ингибирует липолиз, стимулируемый адреналином [13-16]. Таким же действием обладают лектин чечевицы и конканавалин А (Кон А). Оказалось, что Кон А, лектин с другой углево-дсвязывающей специфичностью, имитирует действие инсулина, причем это свойство проявляется не только по отношению к жировым клеткам, но и в случае с клетками печени [17], и мышечных волокон [18]. Кон А к тому же обусловливает увеличение проницаемости мембраны для ионов натрия; лектин фасоли, наоборот, вызывает увеличение поглощения ионов калия клеткой [19]. Обнаружено изменение фагоцитарной активности макрофагов при действии лектина ЛII Paenibacillus polymyxa 1460 на клетки иммунной системы [20]. Лектин Azospirillum brasilense Sp7, выделенный из непатогенных бактерий, обладает митогенными свойствами [21], оказывает влияние на синтез лимфоцитами провосполи-тельных цитокинов [22].
Целью нашего исследования явилось изучение влияния бактериального лектина (биологически активного вещества) и температуры на состояние клеток жировой ткани человека в норме и при патологии.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использовали подкожный жир человека из области брюшной полости и ягодиц. Образцы отбирались у практически здорового человека, с нормальной массой тела, здорового человека склонного к ожирению (СКО) (по определению ИМТ – индекс массы тела) [23] и человека больного диабетом СКО в возрасте 32-35 лет. Всего в эксперименте использовали биологический материал, полученный от 28 человек: – от 12 здоровых; – 7 больных сахарным диабетом и 9 – склонных к ожирению. Изучение изменений структуры жировых клеток под действием температуры проводили в экспериментах in vitro .
Эксперименты проводились на гистологических препаратах клеток подкожной жировой ткани поверхностного слоя, который состоит из плотных пакетов жира, заключенных в хорошо организованную фиброзную оболочку.
Экспериментальная установка состояла из микроскопа (МФН-11 NXA1951), цифрового фотоаппарата (Nikon coolpix 995), подключенного к персональному компьютеру и термостолика, на который помещались образцы [24].
Исследования выполнялись на жировых клетках человека, полученных в процессе хирургического вмешательства. После извлечения методом аутопсии жировая ткань помещалась в физиологический раствор (0,9% водный раствор NaCl с pH 6,8) и промывалась, а затем замораживалась при температуре минус 10ºС. С помощью микротома делали тонкие срезы толщиной 100-200 мкм и размером 1 х 1 см, которые затем нагревались до комнатной температуры 20-25ºС. Жировая ткань использовалась в течение первых 5 суток после изъятия. В результате экспериментального исследования и в соответствии с литературными данными было подобрано время хранения ткани [25]. Жизнеспособность изучаемых клеток фиксировали с помощью окраски 0,2%-ным раствором метиленового синего по методу [26, 27].
В растворе краски тонкий срез ткани выдерживался при комнатной температуре в течение 1-1½ часов. Следует подчеркнуть, что в тучных клетках соединительной ткани (адипоцитах), в спинном и головном мозге при прижизненной окраске не удается получить гранулярного отложения красителя [25]. Адипоциты окрашиваются диффузно, и обратимость паранекротических изменений проявляется при тщательном и длительном отмывании образца, благодаря его диффузии в окружающий раствор. При повторном окрашивании краситель также сначала окрашивает мембрану и только потом проникает в клетку. Повторяемость процесса свидетельствует о жизнеспособности клетки.
В работе был использован лектин бактерий штамма – Azospirillum brasilense Sp7. Штамм бактерий получен из Института микробиологии РАН (г. Москва). Культуры азоспирилл выращивали на жидкой синтетической среде для флоккуляции, предложенной Sadasivan и Neyra при 370С в течение 18 ч [28]. Выделение лектина с поверхности клеток проводили методом Eshdat [29]. Очистку лектина осуществляли с помощью гель-фильтрации на колонке с Sephadex G-75. В качестве элюентов использовали 0,1М СН3СООН (рН 4,8) и 0.05М фосфатный буфер (рН 7,0) с 0,85М NaCl. Гомогенность очищенных лектинов определяли с помощью электрофореза в 10% полиакриламидном геле с SDS. Белок определяли по методу Бредфорд [30]. Концентрация лектина составляла 10 и 35 мкг/мл.
Тонкие образцы ткани обрабатывали лектином и помещали во влажную воздушную среду на 30 мин. Затем образцы промывали фосфатно-солевым буфером (PBS).
Полученные образцы ткани с жизнеспособными клетками помещали на термостолик, который фиксировался с помощью зажимов, на предметном столике микроскопа, и микроскопировали. В ходе наблюдений температура в образце поддерживалась постоянной в пределах физиологической гипертермии (43,5 ± 0,5)°C [31]. Микроскопическое исследование проводилось на 100 клетках в 15 экспериментах.
Основными параметрами, по которым судили о состоянии жировых клеток, были выбраны линейные размеры клеток (большой и малый) и площадь. Данный выбор обусловлен наглядностью и простотой способа наблюдения за изменениями, происходящими с клетками во время воздействия на них внешних факторов. Изображения, полученные с помощью цифровой камеры, переносились на персональный компьютер. Программное обеспечение для поддержки работы фотокамеры включало программу Capture Fly Video’98 для управления камерой в среде Windows 98 или Windows 2000. Запись файлов изображений на диск осуществлялась в формате AVI (Windows Media). Затем полученные файлы переводились в один из следующих форматов: BMP, JPEG.
Во время нагрева образца, фотографии делались через определённые промежутки времени – 2-4 минуты. Наблюдения велись непрерывно за одними и теми же клетками. С помощью программ для обра- ботки растровых изображений Microsoft Photo Editor, Adobe Photoshop из пакета Microsoft Office 2000 и Origin из пакета Origin Lab вычислялись значения размеров выбранной клетки в пикселях по всем элементам изображения. Необходимо отметить, что измерения размеров клетки проводились с погрешностью разрешения монитора (3,7 точек/мм). Калибровка результатов измерений геометрических характеристик образцов осуществлялась по стандартной методике с использованием объект – микрометра проходящего света (ОМ-П).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При сравнении воздействия температуры на динамику гибели адипоцитов практически здоровых людей и людей склонных к ожирению, было установлено, что время гибели клеток жировой ткани людей склонных к ожирению увеличивается вдвое по сравнению с клетками практически здоровых людей, погибающих в течение 60-70 мин [11, 32]. Воздействие лектина на жировую ткань предполагало его влияние на время разрушения адипоцитов. Сравнение результатов действия температуры, а также температуры и лектина на клетки жировой ткани здорового человека склонного к ожирению и человека, больного диабетом и склонного к ожирению, выявило, различия во времени гибели клеток.
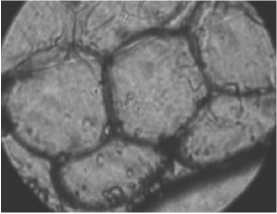
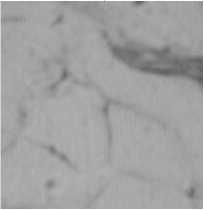
Гибель клеток, наблюдаемая при микроскопическом исследовании (рис. 1), определялась по отсутствию светящегося ободка клеточной стенки. Это связано с дифракцией и многократным внутренним отражением между границами двух прилегающих и отличающихся по преломлению сред жировой капли и межклеточной жидкости. При нарушении равенства показателей преломления клетки и среды видимость клеточной стенки ухудшается и полностью исчезает, когда показатели преломления среды и клеточной стенки становятся равными. Из этого можно предположить, что клетка распалась (погибла) и ее содержание перемешалось с межклеточной жидкостью, уравнивая тем самым показатели пре- ломления. Окрашивание образца по окончанию эксперимента витальным красителем не выявило никаких клеточных структур. Все вышеперечисленные эффекты наблюдались в последние 10-20 минут эксперимента.
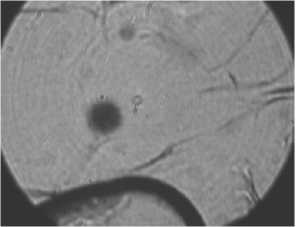
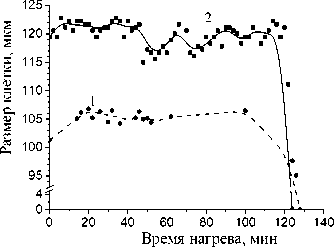
На рис . 2 и 3 представлены измеренные и рассчитанные геометрические характеристики адипоцитов людей больных диабетом и склонных к ожирению и людей здоровых, склонных к ожирению, обработанные лектином различной концентрации и подвергнутые нагреву. Время инкубации в растворе лектина составляло 30 мин. В эксперименте использовали две концентрации лектина – 10 и 35 мкг/мл. Контролем служили клетки жировой ткани, подвергнутые действию температуры и клетки, подвергнутые только действию лектина. Гистологические срезы жировой ткани при воздействии температуры и лектина представлены на фотографиях (рис. 1). Исследования показали, что под действием температуры гибель жировых клеток здоровых людей склонных к ожирению происходила за 120-130 мин (рис. 2а). Время гибели жировых клеток предварительно обработанных лектином и затем подвергнутых действию температуры составляло 45-60 мин (рис. 2б).
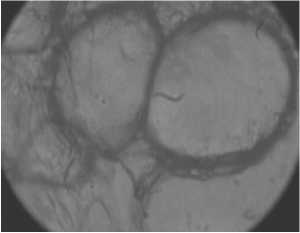
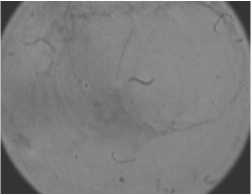
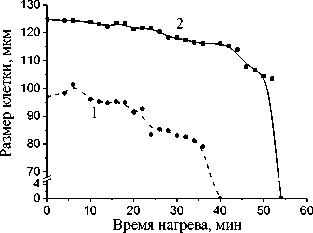
Клетки жировой ткани человека больного диабетом склонного к ожирению под действием температуры гибли в течение 200-240 мин. (рис. 3). Однако совместное воздействие лектина и температуры на адипоциты уменьшало срок существования клеток до 140 мин. и 155 мин. при концентрации лектина 35 мкг/мл и 10 мкг/мл, соответственно (рис. 3).
Связывание лектинов с мембраной вызывает целый ряд изменений в молекулярной организации мембраны и ее функции. Воздействие лектина может вызвать повышение проницаемости мембраны для ионов К+ и Са2+; увеличение текучести мембраны и усиление фосфорилирования мембранных белков [12]. Возможно, изменение данных физических характеристик клеточной мембраны и обуславливает различие действия лектина и температуры, и только температуры на адипоциты.
а
б)
122 минуты нагрева
в)
г) 50 минут нагрева
е) 145 минут нагрева
д)
Рис. 1. Гистологические срезы жировой ткани людей СКО при воздействии температуры и лектина: а, в, д – до нагрева; б, г, е – после нагрева в течение 122, 50 и 145 мин., соответственно; а, б – здорового человека СКО под воздействием температуры; в, г – здорового человека СКО под воздействием температуры и лектина; д, е – больного диабетом СКО под воздействием температуры и лектина
а)
б)
Рис. 2.
Временная зависимость размера жировых клеток здоровых людей СКО в возрасте 32 и 34 лет при температурном воздействии без лектина (а) и с лектином, в концентрациях 10 и 35 мкг/мл (б). Биопсия бралась у двух пациентов СКО из брюшной области: а) кривая 1 – M±m = 101,27±0,98; кривая 2 – M±m = 119,44±1,11; б) кривая 1 – усреднение по 32 клеткам, конц. лектина 35 мкг/мл; кривая 2 – усреднение по 47 клеткам, конц. лектина 10 мкг/мл (0,02 Сравнение результатов совместного воздействия лектина (10 мкг/мл) и температуры на жировую ткань здорового человека, склонного к ожирению и человека, больного сахарным диабетом склонного к ожирению, показало различие во времени гибели клеток в 100 мин. (Рис. 2б, 3). При увеличении концентрации лектина с 10 до 35 мкг/мл разрушение жировых клеток происходило быстрее на 15-20 минут. Необходимо отметить, что разница во времени гибели клеток разных размеров, но при воздействии одной и той же концентрации лектина, составляет, примерно, 2-4 мин. В условиях комнатной температуры 20-25°С лектин не оказывал влияния на морфологию контрольного образца жировой ткани. Воздействие лектина и температуры на жировые клетки сравнивали с действием на них только температуры. Одновременно было изучено действие на адипоциты нейтрального белка – бычьего сывороточного альбумина (BSA) в концентрации 10, 35 и 70 мкг/мл. Как показали исследования, BSA в данных концентрациях не оказывал никакого влияния на процесс гибели клеток, как при комнатной, так и при повышенной температуре. Предварительная обработка жировой ткани бактериальным лектином усиливала действие темпера- туры на клетки жировой ткани как здорового человека склонного к ожирению, так и человека больного сахарным диабетом склонного к ожирению. Обнаружены различия во времени гибели адипоцитов при воздействии температуры и в присутствии лектина в зависимости от физиологического состояния ткани. Установлено, что клетки жировой ткани, подвергнутые нагреву и предварительной обработке лектином, по сравнению с контрольными образцами ткани, не подвергавшимися нагреву, обработанными только лектином или BSA заметно уменьшаются в размере, а затем и погибают. Таким образом, показано, что воздействие лектина на мембрану клетки в совокупности с повышенной температурой активирует механизм клеточной гибели. Величина скорости развития наблюдаемого процесса в клетке, уменьшение размеров клетки, отсутствие нарушения целостности мембраны (до определенного момента) дают основание предположить, что мы наблюдали в жировой ткани процесс подобный процессу апоптоза. Проведенные исследования позволяют оптимизировать термохимические методы редукции подкожной жировой клетчатки, а также, возможно, могут быть использованы, в диагностике заболевания инсулинозависимым сахарным диабетом и выявлении предрасположенности к нему Время нагрева, мин Рис. 3. Временная зависимость размера жировых клеток человека СКО больного сахарным диабетом в возрасте 35 лет при температурном воздействии с лектином, в концентрации 10 и 35 мкг/мл, и без него. Биопсия бралась у пациента СКО больного сахарным диабетом из области ягодиц: кривая 1 – усреднение по 40 клеткам, конц. лектина 35 мкг/мл (0,02 < р <0,05); кривая 2 – усреднение по 58 клеткам, конц. лектина 10 мкг/мл (0,02<р<0,05); кривая 3 – без воздействия лектина, только нагрев, M±m = 116,67±1,12 (0,02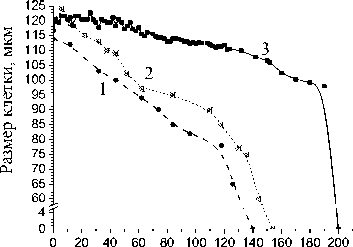
Список литературы Воздействие бактериального лектина и повышенной температуры на адипоциты
- Шурыгин Д.Я., Вядицкий П.О., Сидоров К.А. Ожирение. Л.: Медицина, 1975. 263 c.
- Yanovsky S., Yanovsky J. Obesity//N. Engl. Med. 2002. Vol. 346. № 8. P. 59-602.
- Татонь Ян. Ожирение: патофизиология, диагностика, лечение. Варшава: Польское Мед. Изд., 1981. 363 c.
- Leiter L.A. Obesity: overview of pathogenesis and treatment//Can. J. Physiol. Pharmacol. 1985. Vol. 64. № 6. P. 814-817.
- Matarasso A., Kim R.W., Kral J.G. The impact of liposuction on body fat//Plast. Reconstr. Surg. 1998. Vol. 102. № 5. P. 1686-1689.
- Гнедов Д.А. Жировой компонент массы тела у мужчин, больных ишемической болезнью сердца, и его клиническое значение//Кардиология. 1999. № 1. С. 60-64.
- Prins J.B., Walker N.I., Winterford C.M. and Cameron D.P. Apoptosis of human adipocytes in vitro//Biochem. Boiphys Res. Commun. 1994. Vol. 201. № 2. P. 500-507.
- Фильченко А.А., Стойка Р.С. Апоптоз и рак. К.: Морион. 1999. 184 c.
- Рыбакова М.Г., Гудкова А.Я. Апоптоз и заболевания сердца//Цитология. 2004. Т. 46. № 5. С. 389-394.
- Leist M. & Jäättelä Four deaths and a funeral: from caspases no alternative mechanisms//Nature. 2001. Vol. 2. P.2-10.
- Черкасова О.А. Исследование in vitro жировой ткани при внешних воздействиях//Весник РГМУ. 2004. № 3 (34). С. 192.
- Луцик М.Д., Панасюк Е.Н., Луцик А.Д. Лектины. Львов: Виша школа. 1981. 152 с.
- Cuatrecasas P. and Tell G.P.E. Insulin-like activity of Concanavalin A and wheat germ agglutinin -direct interactions with insulin receptors//Proc. Nat. Acad. Sci. USA. 1973. Vol. 70. № 2. P. 485-489.
- Czech M.P., Lynn W.S. Stimulation of glucose metabolism by lectins in isolated white fat cells//Biochem. Biophys. Acta. 1973. Vol. 297. P. 368-377.
- Hedo J.A., Harrison L.C., Roth J. Binding of insulin receptors to lectin: evidens for common carbohydrate determinants on several membrane receptors//Biochemistry. 1981. Vol. 20. P. 3385-3393.
- Katzen H.M., Vicario P.P., Mumford R.A., Green B.G. Evidence that the insulin-like activities of conconavalin A and insulin are mediated by a common insulin receptor linked effector system//Biochemistry. 1981. Vol. 20. P. 5800-5809.
- Ng T.B., Li W.W., Yeung H.W. Effect of lectins with various carbohydrate binding specificities on lipid metabolism in isolated rat and hamster adipocytes//Int. J. Biochem. 1989. Vol. 21. № 2. P. 149-155.
- Васянин C.И., Гамалей И.А., Трошин А.С. Взаимодействие с поверхностью мышечного волокна и стимуляция транспорта D-ксилозы//Доклады Академии наук СССР. 1982. Т. 262. №2. С. 466-468.
- Хомутовский О.А., Луцик М.Д., Передерей О.Ф. Электронная гистохимия рецепторов клеточных мембран. Киев: Наукова думка. 1986. 166 с.
- Горельникова Е.А., Тихомирова Е.И., Кочергина О.В., Рудик Д.В., Мухачева Е.В. Синтез провоспалительных цитокинов макрофагами мышей при действии лектина ЛII Paenibacillus polymyxa//Сб. науч. работ «Актуальные проблемы медицины и биологии». Выпуск № 2. Томск: СГМУ. 2003. С. 106 -107.
- Никитина В.Е., Богомолова Н.В., Пономарева Е.Г., Соколов О.И. Влияние лектина азоспирилл на способность семян к прорастанию//Известия АН. Серия биологическая. 2004. № 3. С. 1-5.
- Никитина В.Е., Бугаева И.О., Пономарева Е.Г., Тихомирова Е.И., Богомолова Н.В. Влияние лектина Azospirillum brasilense на кинетику клеточных популяций мезентариальных лимфатических узлов и динамику цитокинового статуса экспериментальных животных//ЖМЭИ. 2002. № 1. С. 37-42.
- Шевченко О.П., Праскурничий Е.А., Шевченко А.О. Метаболический синдром. М.: Реафарм, 2004. 141с.
- Черкасова О.А., Симоненко Г.В., Тучин В.В. Исследование жировой ткани при температурном воздействии//Проблемы оптической физики. Саратов: СГУ, 2003. С. 32-38.
- Граменицкий Е.М. Прижизненная окраска клеток и тканей в норме и патологии. Л.: Изд-во мед. лит. 1963. С. 112-115.
- Александров В.Я. Методика прижизненной окраски основными красителями тканей и органов млекопитающих//Тр. АМН СССР. 1949. № 3. С. 10-15.
- Фихман Б.А. Микробиологическая рефрактометрия. М.: Медицина, 1967. 280 с.
- Sadasivan L., Neyra C.A. Flocculation in Azospirillum brasilense and Azospirillum lipoferum: exopolysaccharides and cyst formation//J. Bacteriol. 1985. Vol. 163. P.716-723.
- Eshdat Y, Ofek I, Yachow-Yan Y, Sharon N, Mirelman D. Isolation of a mannose-specific lectin from Escheriahia coli and its role in the adherence of the bacteria to epithelial cells//Biochem. Biophys. Res. Commun. 1978. Vol. 85. P. 1551-1559.
- Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding//Anal. Biochem. 1976. Vol. 72. № 1. P. 248-254.
- Баллюзек Ф.В., Баллюзек М. Ф., Виленский В.И., Горелов С.И., Жигалов С.А., Иванов А. А., Кузьмин С.Н., Определяков Г. А. Управляемая гипертермия. С-Пб.: Невский Диалект, 2001. 124 с.
- Simonenko G.V., Cherkasova O.A., Denisova T.O., Tuchin V.V. Thermal action on the lipocells//Proc. SPIE. 2003. Vol. 5068. P. 458-461.


