Возможность использования показателей клинического анализа крови в оценке воспалительного статуса пациентов с COVID-19
Автор: Некрасова Людмила Андреевна, Джайн Марк, Губенко Никита Сергеевич, Будко Антон Александрович, Самоходская Лариса Михайловна, Орлова Яна Артуровна, Камалов Армаис Альбретович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.13, 2022 года.
Бесплатный доступ
Обоснование. С-реактивный белок (СРБ) является ключевым лабораторным биомаркером системного воспаления и индикатором необходимости противовоспалительной терапии у пациентов с COVID-19. Однако доступность биохимических анализаторов для определения уровня СРБ ограничена в удаленных от региональных центров медицинских учреждениях. Цель исследования - разработка подхода к прогнозированию воспалительного статуса пациентов с COVID-19 на основании показателей общего анализа крови. Методы. В ретроспективное исследование включены 423 пациента (мужчин 54,6%; женщин 45,4%; средний возраст 59,1 года), проходивших стационарное лечение на базе МНОЦ МГУ имени М.В. Ломоносова в период с 21 апреля по 13 июня 2020 г. с диагнозом COVID-19. Всем пациентам были выполнены общий и биохимический анализы крови, компьютерная томография (КТ) легких. Результаты. На основе данных общего анализа крови была разработана модель качественной оценки системного воспаления, соответствующего уровню СРБ >60 мг/л. В нее вошли скорость оседания эритроцитов и отношение нейтрофилов к лимфоцитам. В соответствии с результатами ROC-анализа (Receiver Operating Characteristic) разработанная модель характеризовалась чувствительностью 70,2%, специфичностью 74,6%, а площадь под ROC-кривой составила 0,781. В ходе сравнения ключевых клинических показателей тяжести течения COVID-19, таких как срок госпитализации и степень поражения легких по данным КТ при поступлении и выписке, были обнаружены статистически значимые отличия между группами с уровнями СРБ ≤60 мг/л и >60 мг/л, определенными при рутинном лабораторном анализе, по всем названным параметрам (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Covid-19, с-реактивный белок, общий анализ крови, отношение нейтрофилов к лимфоцитам, скорость оседания эритроцитов
Короткий адрес: https://sciup.org/143178540
IDR: 143178540
Текст научной статьи Возможность использования показателей клинического анализа крови в оценке воспалительного статуса пациентов с COVID-19
Submitted 15.09.2021 Revised 13.12.2021 Published 10.02.2022
Еще в первые месяцы пандемии было продемонстрировано, что у пациентов с наиболее тяжелым течением заболевания наблюдаются нарушения в регуляции иммунного ответа [3]. Вскоре было установлено, что смертность при COVID-19 ассоциирована с индуцируемой вирусом повышенной экспрессией провоспалительных цитокинов (так называемый цитокиновый шторм), что приводит к острому респираторному дистресс-синдрому и распространенному поражению тканей организма с последующим развитием полиорганной недостаточности [4]. Следовательно, лабораторный анализ биомаркеров воспаления занимает важнейшее место в ведении пациентов с COVID-19.
Наиболее изученными показателями воспалительной реакции являются параметры общего анализа крови и уровень С-реактивного белка (СРБ) [5, 6]. Но именно уровень СРБ, согласно Временным российским рекомендациям по лечению новой коронавирусной инфекции [7], выбран ключевым лабораторным биомаркером-индикатором начала противовоспалительной терапии. При этом доступность биохимических анализаторов для определения уровня СРБ, в отличие от оборудования для проведения общего анализа крови, ограничена в удаленных от региональных центров медицинских учреждениях.
Цель исследования — разработка подхода к прогнозированию воспалительного статуса паци-

кт ГА
ентов с COVID-19 на основании показателей общего анализа крови.
МЕТОДЫ
Дизайн исследования
Ретроспективное.
Условия проведения
В исследование включены пациенты, проходившие стационарное лечение на базе МНОЦ МГУ имени М.В. Ломоносова в период с 21 апреля по 13 июня 2020 г. с диагнозом COVID-19.
Диагноз COVID-19 подтверждали путем взятия мазка из ротоглотки с последующим анализом методом полимеразной цепной реакции (ПЦР) на SARS-CoV-2.
Описание медицинского вмешательства
Анализ уровня биохимических показателей крови проводился с использованием автоматического биохимического анализатора AU480 (Beckman Coulter, Германия). Общий анализ крови выполнялся при помощи гематологического анализатора XN 2000 (Sysmex Corporation, Япония).
Компьютерная томография (КТ) легких и органов грудной клетки проводилась на 32-разряд-ном компьютерном томографе Somatom Scope (Siemens, Германия) при толщине среза 1 мм в соответствии с описанной ранее методикой [8]. КТ выполнялась при поступлении и выписке пациента. Для обработки данных КТ использовалась платформа Syngo.via (Siemens, Германия). Анализ инфильтративных изменений в легких проводился при помощи программного обеспечения Муль-тивокс (Гаммамед, Россия) и Botkin.AI (Интерлод-жик, Россия).
Этическая экспертиза
Протокол исследования одобрен локальным этическим комитетом МНОЦ МГУ имени М.В. Ломоносова (протокол № 1/21 от 25.01.2021).
Статистический анализ
Статистический анализ проводили с использованием пакета программ GraphPad Prism (GraphPad Software, США). Для оценки нормальности распределения данных использовали тест Колмогорова–Смирнова. Так как распределение данных, вошедших в анализ, было отличным от нормального, то их представляли в виде медианы (Q2) и интерквартильного размаха (Q1; Q3). Для сравнения двух несвязанных выборок применяли тест Манна–Уитни, для сравнения связанных — тест Вил-коксона. Корреляционный анализ выполняли с использованием метода Спирмена. Для построения предсказательных моделей применяли линейный регрессионный анализ. Определение порогового значения расчетного коэффициента предсказательной модели проводили при помощи ROC-анализа (Receiver Operating Characteristic). Результаты статистической обработки признавали значимыми при p <0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование включены 423 пациента с подтверждённым с помощью ПЦР на РНК SARS-CoV-2 диагнозом COVID-19.
Возраст пациентов колебался от 24 до 98 лет и в среднем составил 59,1 года. Индекс массы тела пациентов колебался от 20,3 до 42,2 кг/м2 и в среднем составил 29,0 кг/м2. Распределение пациентов по полу было следующим: мужчин — 231 (54,6%), женщин — 192 (45,4%). Средняя длительность госпитализации составила 11,9±6,6 дней.
Основные результаты исследования
Для того чтобы определить показатели общего анализа крови, которые могли бы стать кандидатами для построения модели прогнозирования уровня СРБ, был применен корреляционный анализ. Параметры, статистически значимо связанные с уровнем СРБ, представлены в табл. 1.
Многие показатели общего анализа крови продемонстрировали статистически значимую корреляцию, однако в большинстве случаев ее сила была довольно низкой (коэффициент корреляции не превышал ±0,2). Лишь уровень нейтрофилов, соотношение уровней нейтрофилов и лимфоцитов (Н/Л) и скорость оседания эритроцитов (СОЭ) оказались связаны с уровнем СРБ умеренной силой (коэффициенты корреляции 0,375; 0,454 и 0,434 соответственно).
В связи с тем, что пороговым значением для начала противовоспалительной терапии при COVID-19 является уровень СРБ >60 мг/л [7], разрабатываемая предсказательная модель будет предназначена для того, чтобы отнести пациента к группе «СРБ ≤60 мг/л» или «СРБ >60 мг/л», нежели чем для предсказания абсолютного уровня СРБ. В соответствии с результатами ROC-анализа параметры общего анализа крови, количество
Том 13 № 1
Таблица 1 / Table 1
Связь параметров общего анализа крови с уровнем С-реактивного белка у пациентов с COVID-19 / Correlation of hematologic blood test parameters with C-reactive protein levels in patients with COVID-19
|
Показатели общего анализа крови |
Связь с CРБ |
|
|
r* |
p |
|
|
Лейкоциты (WBC) |
0,165 |
<0,001 |
|
Эритроциты (RBC) |
-0,128 |
0,009 |
|
Гемоглобин (HGB) |
-0,167 |
<0,001 |
|
Гематокрит (HCT) |
-0,155 |
0,001 |
|
Ширина распределения эритроцитов (RDW-CV) |
0,113 |
0,021 |
|
Ширина распределения эритроцитов (RDW-SD) |
0,131 |
0,007 |
|
Нейтрофилы (NEUT)** |
0,375 |
<0,001 |
|
Соотношение уровней нейтрофилов и лимфоцитов (N/L)** |
0,454 |
<0,001 |
|
Моноциты (MON) |
-0,130 |
0,008 |
|
Эозинофилы (EO) |
-0,161 |
<0,001 |
|
Скорость оседания эритроцитов (СОЭ)** |
0,434 |
<0,001 |
Примечание. * Коэффициент корреляции Спирмена; ** показатели общего анализа крови, продемонстрировавшие умеренную корреляционную связь с уровнем СРБ. СРБ — С-реактивный белок.
Note: * Spearmen correlation coefficient; ** hematologic blood test parameters demonstrated moderate power of correlation with C-reactive protein levels. СРБ — C-reactive protein.
нейтрофилов, Н/Л и СОЭ по отдельности характеризовались низкой дискриминативной способностью в отношении порогового уровня СРБ 60 мг/л: площади под ROC-кривой — 0,718; 0,746 и 0,700 соответственно (рис. 1). Было принято решение об использовании линейного регрессионного анализа для расчета коэффициента превышения уровня СРБ 60 мг/л (КСРБ60). В результате была получена следующая расчетная формула (параметр «количество нейтрофилов» был исключен, так как он не вносит вклада в повышение точности модели):
КСРБ60 = 0,007 х СОЭ + 0,046 х Н/Л.
ROC-анализ продемонстрировал, что при пороговом значении КСРБ60 0,369 чувствительность модели составляет 70,2%, специфичность — 74,6%, а площадь под ROC-кривой — 0,781. Таким образом, разработанная комбинированная предсказательная модель существенно превосходила использование параметров общего анализа крови поодиночке.
Для подтверждения клинической пригодности разработанной предсказательной модели было проведено сравнение ряда показателей тяжести
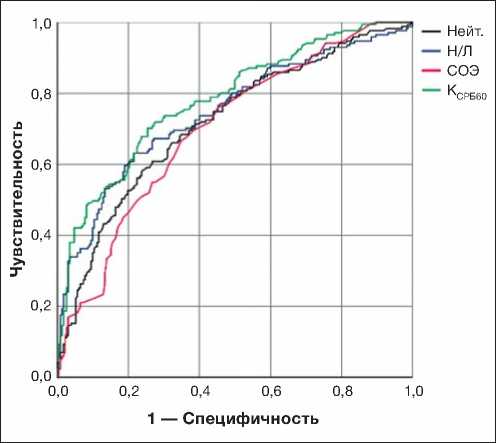
Рис. 1. ROC-кривая для предсказания уровня С-реак-тивного белка более 60 мг/л.
Примечание. Нейт. — нейтрофилы; Н/Л — соотношение уровней нейтрофилов и лимфоцитов; СОЭ — скорость оседания эритроцитов; КСРБ60 — коэффициент превышения уровня С-реактивного белка 60 мг/л.
Fig. 1. ROC-curve for the prediction of C-reactive protein levels more than 60 mg/L.
Note: Нейт. — neutrophils; Н/Л — ratio of neutrophil and lymphocyte levels; СОЭ — erythrocyte sedimentation rate; КСРБ60 — coefficient of excess of C-reactive protein level 60 mg/l.
▼ж^жтжтж «АТАТАТ ГАТАТ
КТ

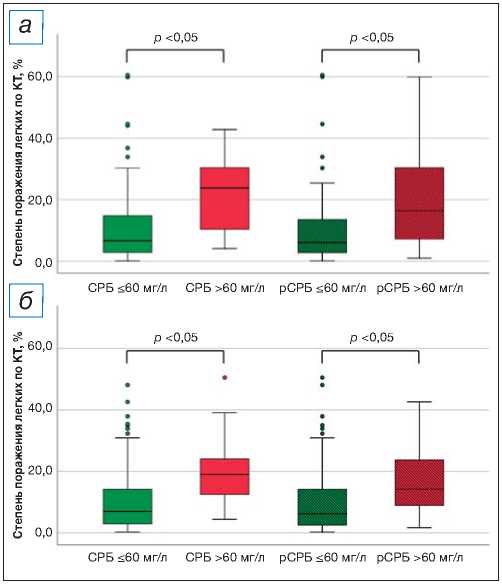
Рис. 2. Степень поражения легких по данным компьютерной томографии в зависимости от уровня С-реак-тивного белка: а — данные, полученные при госпитализации; б — данные, полученные при выписке.
Примечание. КТ — компьютерная томография; СРБ — С-реактивный белок (лабораторный анализ); рСРБ — С-реактивный белок (расчет по разработанной модели).
Fig. 2. Lung damage according to the results of computer tomography depending on C-reactive protein levels: a — data acquired at hospital admission; б — data acquired at hospital discharge.
Note: КТ — computed tomography; СРБ — C-reactive protein (laboratory analysis); рСРБ — C-reactive protein (calculation according to the developed model).
заболевания с использованием данных лабораторного анализа уровня СРБ и расчетных (рСРБ). Так, степень поражения легких (%) по данным КТ при поступлении в стационар статистически значимо не различалась между группами «СРБ >60 мг/л» и «рСРБ >60 мг/л» [23,8 (9,6; 31,6) против 22,6 (7,4; 32,8); p >0,05], как и между группами «СРБ ≤60 мг/л» и «рСРБ ≤60 мг/л» [7,7 (3,2; 17,6) против 7,6 (2,8; 14,3), p >0,05] (рис. 2, а). Это справедливо и для степени поражения легких (%) по данным КТ при выписке из стационара [19,0 (10,8; 24,1) против 14,2 (8,8; 24,1); p >0,05] и [7,0 (2,5; 14,6) против 6,6 (3,3; 17,5), p >0,05] соответственно (рис. 2, б). Стоит отметить, что в обоих случаях в группах с существенно повышенным значением СРБ (>60 мг/л) наблюдалась статистически значимо более вы- сокая степень поражения легких, чем в группах с менее повышенным уровнем СРБ (≤60 мг/л) (p <0,05).
Длительность госпитализации также значимо не отличалась при использовании разработанной модели предсказания уровня СРБ. Так, в группе «СРБ >60 мг/л» срок госпитализации составил 13 (11; 15) дней против 12 (10; 14) в группе «рСРБ >60 мг/л» ( р >0,05), а в группе «СРБ ≤60 мг/л» — 9 (7; 12) дней против 10 (7; 12) в группе «рСРБ ≤60 мг/л» ( р >0,05). Вновь при существенном повышении уровня СРБ, определенного обоими методами, наблюдалось статистически значимое удлинение срока госпитализации ( p <0,05).
Среди пациентов, которым потребовалась искусственная вентиляция легких, были лишь лица, принадлежащие одновременно к группам «СРБ >60 мг/л» и «рСРБ >60 мг/л». Таким образом, данный параметр не отличался при использовании расчетного уровня.
На основании данных, полученных в ходе ROC-анализа и регрессионного анализа, был разработан последовательный алгоритм качественной оценки уровня СРБ по параметрам Н/Л и СОЭ, вошедшим в обсужденную ранее предсказательную модель (рис. 3). Данный упрощенный алгоритм наиболее пригоден для выделения группы с высоким уровнем СРБ. Однако при определенных условиях (низкое значение Н/Л и высокое значение СОЭ) он не позволяет верно судить об уровне
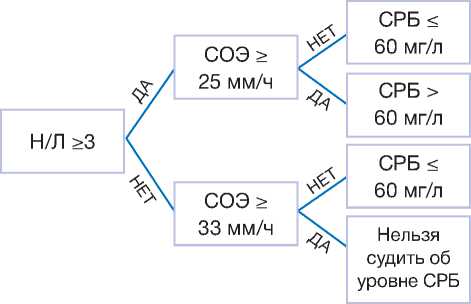
Рис. 3. Последовательный алгоритм качественной оценки уровня С-реактивного белка.
Примечание. СРБ — С-реактивный белок; Н/Л — соотношение уровней нейтрофилов и лимфоцитов; СОЭ — скорость оседания эритроцитов.
Fig. 3. Step-by-step algorithm for C-reactive protein level estimation.
Note: СРБ — C-reactive protein; Н/Л — ratio of neutrophil and lymphocyte levels; СОЭ — erythrocyte sedimentation rate.
СРБ. В нашей выборке таких случаев оказалось около 12%.
ОБСУЖДЕНИЕ
Как было сказано ранее, воспалительный ответ организма является определяющим фактором течения COVID-19 [9, 10]. S. Wan и соавт. [11] продемонстрировали, что цитокиновый шторм ответственен за наиболее тяжелые осложнения и смертность от данного заболевания. Так, благодаря подобным ранним работам, изучающим роль избыточного воспалительного ответа, контроль воспалительных факторов был включен еще в 5-е издание государственных рекомендаций по профилактике и контролю COVID-19 Китайской Народной Республики [12].
За полтора года всестороннего изучения связанных с воспалением биомаркеров крови при COVID-19 был определен ряд наиболее информативных показателей: количество лимфоцитов и нейтрофилов, нейтрофилов и лимфоцитов, СОЭ, СРБ, прокальцитонин, интерлейкин-6, D-димер, тропонин, креатинкиназа, аспартатаминотрансфераза [3, 11, 13–17]. В настоящее время ведется также активный поиск новых перспективных биомаркеров течения COVID-19. Так, было продемонстрировано, что высокий уровень гомоцистеина связан с большей степенью поражения легких по данным КТ [18]. Особое внимание стоит уделить биомаркерам, связанным с активностью ангио-тензинпревращающего фермента 2 (АПФ2), ведь известно, что именно АПФ2 является мишенью на поверхности клеток человека для связывания S-белка SARS-CoV-2 [19, 20]. Многообещающими молекулами являются ангиотензин II, ангиотензин (1-7), ангиотензин (1-9) и аламандин, однако на данный момент данных об их клинической значимости недостаточно [17].
К сожалению, далеко не все из вышеперечисленных биомаркеров являются широкодоступными для рутинного лабораторного определения. В данной работе представлена модель, позволяющая на основе результатов общего анализа крови качественно оценить уровень СРБ — одного из наиболее ценных, с клинической точки зрения, биомаркеров, крайне необходимого для выбора оптимальной тактики терапии при COVID-19. Было продемонстрировано, что оценка воспалительного статуса с применением расчетного показателя СРБ для предсказания клинического течения новой коронавирусной инфекции у госпитализиро- ванных больных значимо не отличается от данных, полученных с использованием лабораторно измеренного показателя. В нашей когорте у пациентов с уровнем СРБ >60 мг/л (определенным как в ходе лабораторного анализа, так и при помощи разработанной модели) наблюдалось статистически значимое повышение степени поражения легких по данным КТ и увеличение срока госпитализации, что согласуется с данными ряда аналогичных исследований [5, 21–23].
Помимо модели для качественного определения уровня СРБ на основе показателей общего анализа крови, в данной работе представлен альтернативный последовательный алгоритм, применение которого не требует проведения каких-либо математических манипуляций. Данный алгоритм может оказаться более привлекательным для рутинного использования медицинским персоналом ввиду простоты его применения. Однако тот факт, что его применение невозможно у 12% пациентов, указывает на то, что использование нашей расчетной модели с порогом КСРБ60 0,369 является более предпочтительным.
Ограничения исследования
Представленная модель предсказания уровня СРБ требует валидации для непосредственного выбора тактики терапии пациентов с COVID-19. Параметры общего анализа крови, вошедшие в представленную модель, могут варьировать в зависимости от ряда факторов, таких как пол, возраст, нарушения метаболизма и др. Вклад данных факторов не был изучен в представленной работе. Кроме того, в будущих исследованиях стоит провести сравнение с приборными и/или бесприборны-ми методами лабораторной диагностики известных маркеров начала цитокинового шторма.
ЗАКЛЮЧЕНИЕ
Расчетный и измеренный показатели СРБ являются в значительной степени взаимозаменяемыми при решении определенных клинических задач. Разработанная нами модель качественной оценки воспалительного статуса на основе результатов общего анализа крови может помочь врачу выбрать оптимальную тактику ведения пациента с COVID-19 в условиях ограниченного лабораторного потенциала.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. А.А. Камалов, Я.А. Орлова — концепция и дизайн исследования; Л.А. Некрасова,
кт ГА
Список литературы Возможность использования показателей клинического анализа крови в оценке воспалительного статуса пациентов с COVID-19
- Who.int [Internet]. World Health Organization. WHO Director-General's opening remarks at the media briefing on COVID-19 [updated 2021, August 14; cited 2021, August 14]. Available from: https://www.who.int/director-general/speeches/ detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020.
- Worldometers.info [Internet]. American Library Association. COVID-19 Coronavirus Pandemic [updated 2021, August 14; cited 2021, August 14]. Available from: https://www.worldometers.info/ coronavirus/.
- Qin C, Zhou L, Hu Z, et al. Dysregulation of immune response in patients with COVID-19 in Wuhan, China. Clin Infect Dis. 2020;71(15):762-768. doi: 10.1093/cid/ciaa248
- Ragab D, Eldin HS, Taeimah M, et al. The COVID-19 cytokine storm; what we know so far. Front Immunol. 2020;11:1446. doi: 10.3389/fimmu.2020.01446
- Sahu BR, Kampa RK, Padhi A, Panda AK. C-reactive protein: a promising biomarker for poor prognosis in COVID-19 infection. Clin Chim Acta. 2020;509:91-94. doi: 10.1016/j.cca.2020.06.013
- Yang AP, Liu JP, Tao WQ, Li HM. The diagnostic and predictive role of NLR, d-NLR and PLR in COVID-19 patients. Int Immuno-pharmacol. 2020;84:106504. doi: 10.1016/j.intimp.2020.106504
- Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 6 (28.04.2020). Минздрав России; 2020.
- Mareev VY, Orlova YA, Pavlikova EP, et al. Steroid pulse-therapy in patients with coronAvirus Pneumonia (COVID-19), sYstemic inFlammation and Risk of vEnous thRombosis and thromboembolism (WAYFARER Study) [In English, Russian]. Kardiologiia. 2020;60(6):15-29. doi: 10.18087/cardio.2020.6.N1226
- Yang P, Ding Y, Xu Z, et al. Epidemiological and clinical features of COVID-19 patients with and without pneumonia in Beijing, China. MedRxiv. 2020. doi: 10.1101/2020.02.28.20028068
- Zumla A, Hui DS, Azhar EI, et al. Reducing mortality from 2019-nCoV: host-directed therapies should be an option. Lancet. 2020;395:e35. doi: 10.1016/S0140-6736(20)30305-6
- Wan S, Yi Q, Fan S, et al. Characteristics of lymphocyte subsets and cytokines in peripheral blood of 123 hospitalized patients with 2019 novel coronavirus pneumonia (NCP). MedRxiv. 2020. doi: 10.1101/2020.02.10.20021832
- Nhc.gov.cn [Internet]. Disease Control and Prevention Bureau of China. Interpretation of New Coronavirus Pneumonia Prevention and Control Plan (Fifth Edition) [updated 2021, August 14; cited 2021, August 14]. Available from: http://www.nhc.gov.cn/jkj/ s3578/202002/dc7f3a7326e249c0bad0155960094b0b.shtml.
- Henry BM, de Oliveira MH, Benoit S, et al. Hematologic, biochemical and immune biomarker abnormalities associated with severe illness and mortality in coronavirus disease 2019 (COVID-19): a meta-analysis. Clin Chem Lab Med. 2020;58(7):1021-1028. doi: 10.1515/cclm-2020-0369
- Xia W, Shao J, Guo Y, et al. Clinical and CT features in pediatric patients with COVID-19 infection: different points from adults. Pediatric Pulmonology. 2020;55:1169-1174. doi: 10.1002/ppul.24718
- Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395(10223): 507-513. doi: 10.1016/S0140-6736(20)30211-7
- Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020;8(5):475-481. doi: 10.1016/S2213-2600(20)30079-5
- Ponti G, Maccaferri M, Ruini C, et al. Biomarkers associated with COVID-19 disease progression. Crit Rev Clin Lab Sci. 2020;57(6):389-399. doi: 10.1080/10408363.2020.1770685
- Yang Z, Shi J, He Z, et al. Predictors for imaging progression on chest CT from coronavirus disease 2019 (COVID-19) patients. Aging. 2020;12(7):6037-6048. doi: 10.18632/aging.102999
- Lu J, Sun PD. High affinity binding of SARS-CoV-2 spike protein enhances ACE2 carboxypeptidase activity. J Biol Chem. 2020;295(52):18579. doi: 10.1074/jbc.ra120.015303
- Khanna K, Raymond W, Charbit AR, et al. Binding of SARS-CoV-2 spike protein to ACE2 is disabled by thiol-based drugs; evidence from in vitro SARS-CoV-2 infection studies. BioRxiv. 2020. doi: 10.1101/2020.12.08.415505
- Smilowitz NR, Kunichoff D, Farshick M, et al. C-reactive protein and clinical outcomes in patients with COVID-19. Eur Heart J. 2021;42(23):2270-2279. doi: 10.1093/eurheartj/ehaa1103
- Wang L. C-reactive protein levels in the early stage of COVID-19. Med Mal Infect. 2020;50(4):332-334. doi: 10.1016/j.medmal.2020.03.007
- Tan C, Huang Y, Shi F, et al. C-reactive protein correlates with computed tomographic findings and predicts severe COVID-19 early. J Med Virology. 2020;92(7):856-862. doi: 10.1002/jmv.25871


