Возможности гибридной хирургии в гемодинамической коррекции ребенка с синдромом гипоплазии левых отделов сердца (клиническое наблюдение)
Автор: Неверова Юлия Николаевна, Тарасов Р.С., Халивопуло И.К.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 2 т.24, 2020 года.
Бесплатный доступ
Благодаря развитию пренатальной диагностики и интервенционной кардиологии новорожденные могут пережить сложные паллиативные хирургические процедуры. Современные методы позволяют изменить принципы лечения детей, которым планируется гемодинамическая коррекция с операцией Фонтена, а также стимулируют развитие гибридных вмешательств (катетерная процедура и хирургическая операция в период новорожденности). В статье представлено динамическое наблюдение за ребенком с синдромом гипоплазии левого сердца, которому в возрасте 2 нед. сделана операция Норвуда с последующим рестенозом дистального анастомоза и выполнением баллонной дилатации рестеноза неоаорты с установкой кобальт-хромового баллонорасширяемого стента Andrastent XL параректальным левосторонним доступом к инфраренальному отделу аорты в 11 мес. для снижения хирургического риска и подготовки ребенка к следующему этапу коррекции - операции Гленна и Фонтена.
Клинический случай, новорожденный, операция норвуда, рестеноз дистального анастомоза, синдром гипоплазии левого сердца, стентирование дистального анастомоза гибридным методом
Короткий адрес: https://sciup.org/142230738
IDR: 142230738 | DOI: 10.21688/1681-3472-2020-2-95-101
Текст научной статьи Возможности гибридной хирургии в гемодинамической коррекции ребенка с синдромом гипоплазии левых отделов сердца (клиническое наблюдение)
Возможности гибридной хирургии в гемодинамической коррекции ребенка с синдромом гипоплазии левых отделов сердца (клиническое наблюдение). Патология кровообращения и кардиохирургия. 2020;24(2):95-101. http:// org/10.21688/1681-3472-2020-2-95-101
Ю.Н. Неверова,
Р.С. Тарасов,
И.К. Халивопуло,
Синдром гипоплазии левого сердца (СГЛС) — наиболее распространенная аномалия единственного желудочка, при которой структуры левых отделов сердца недостаточно развиты, чтобы обеспечить системный кровоток. Благодаря достижениям пренатальной диагностики и интервенционной кардиологии новорожденные могут пережить сложную паллиативную хирургическую процедуру. Несмотря на улучшение хирургических результатов операции Норвуда, существуют проблемы, которые необходимо решить. Развитие обструкции дуги аорты после операции Норвуда является одной из важных и распространенных проблем, с которой связано нарушение сердечной функции в виде увеличения пост- нагрузки, что обязательно приведет к снижению сердечного выброса и клапанной недостаточности, дисбалансу системного и легочного кровотока. T. Sakurai с соавт. писали, что данная проблема ассоциирована с летальным исходом у 22–37 % детей. Причиной, по мнению авторов, является использование модифицированного шунта Блэлок – Тауссиг, остаточная дуктальная ткань, тип заплаты [1], поэтому определение оптимальной реконструктивной техники дуги неоаорты является столь актуальным. W. Whiteside с соавт. отмечали, что баллонная дилатация у таких детей достаточно успешна, а повторный рестеноз наступает в 9,7 % случаев в течение 1,5 лет наблюдения [2]. Современные методы стиму- лируют развитие гибридных вмешательств (катетерная процедура и хирургическая операция в период новорожденности) и позволяют изменить принципы лечения детей с унивентрикулярной гемодинамикой [3]. Можно предположить, что применение менее инвазивного, но при этом эффективного технического решения необходимо. Цель описания клинического случая — демонстрация применения баллонной дилатации обструкции дуги неоаорты стента с возможностью роста для снижения хирургического риска перед следующими этапами коррекции синдрома гипоплазии левого сердца.
В Кузбасский кардиологический центр поступил ребенок (возраст 2 нед.) с диагнозом: СГЛС, гипоплазия аортального клапана, стеноз выходного отдела левого желудочка, гипоплазия восходящего отдела аорты, дуги аорты, коарктация аорты, дефект межпредсердной перегородки. Диагноз установлен пренатально. Из анамнеза: родоразрешение путем срочных родов на 39-й нед. По шкале Апгар: 8 баллов. Ребенок доставлен в тяжелом состоянии по причине сердечной недостаточности, при осмотре отмечен акроцианоз, дыхание самостоятельное, сатурация на руках 70 %. При поступлении проведена инфузия вазапростана в дозе 50 нг/кг/мин. Вес ребенка на момент поступления составлял 3,6 кг, рост — 54 см. С учетом достаточного веса ребенка при поступлении, отсутствия консервативных методов лечения указанной патологии и гипоксемического синдрома решено выполнить операцию Норвуда: дистальный анастомоз сформирован интраоперационно между брахиоцефальным стволом и протезом Gore-Tex (диаметр протеза 3,5 мм) для начала искусственного кровообращения. В условиях гипотермии 25 °С наложен анастомоз Дамус – Кей – Стенсел. Реконструкция неоаорты осуществлена путем формирования аутоперикардиальной заплаты от нисходящего отдела аорты до анастомоза Дамус – Кей – Стенсел. Продолжительность искусственного кровообращения — 191 мин, время пережатия аорты — 79 мин. С учетом миокардиального отека в послеоперационном периоде сведение грудной клетки выполнено отсрочено (через 2 дня), проведена инотропная терапия в терапевтических дозировках. На 6-е сут. ребенок экстубирован, отменена инотропная поддержка. На 7-е сут. ребенок переведен в кардиохирургическое отделение. В дальнейшем отмечены эпизоды сину- совой брадикардии, по поводу которой проведено суточное мониторирование электрокардиографии (нарушения проводимости не отмечено). Ребенок в удовлетворительном состоянии на 14-е сут. выписан домой (в возрасте 28 дней), сатурация на руках — 73 %, сатурация на ногах — 77. Даны рекомендации по приему амбулаторно аспирина 5 мг/кг/сут., дигоксина 10 мкг/кг/сут., эналаприла 0,5 мг, спиронолактон 6,25 мг, под контролем гидробаланса: фуросемид 3 мг (0,3 мл) 3 раза в день. Вес при выписке 3,85 кг.
В возрасте 3 мес. у ребенка отмечено нарастание отдышки при приеме пищи, акроцианоз. По данным мультиспиральной компьютерной томографии (МСКТ) выявлен значимый стеноз дистального отдела дуги аорты. С учетом критического стеноза в области перешейка аорты (место формирования заплатой дистального анастомоза) выбрана щадящая тактика лечения в пользу рентгенэндоваскулярной баллонной ангиопластики аорты. Интраоперационно: систолическое артериальное давление (АД) до стеноза — 148 мм рт. ст, систолический градиент — 90 мм рт. ст., после вмешательства систолический градиент — 15 мм рт. ст. Проведенная процедура позволила экстубировать ребенка в 1-е сут. после операции. Отмечена положительная динамика по эхокардиографии (ЭхоКГ): увеличение фракции выброса до 62 % (на момент поступления — 55), улучшение контрактильности миокарда, градиент на неоаорте — 48 мм рт. ст. Ребенок переведен в кардиохирургическое отделение на следующие сутки. Сатурация на руках — 73, сатурация на ногах — 77. Частота дыхания — 42. Пациент выписан на 7-е сут., вес при выписке — 4 650 г. Рекомендовано на амбулаторном этапе продолжить ранее назначенную терапию.
В возрасте 5 мес. отмечены жалобы на плохую прибавку массы тела, одышку при умеренной физической нагрузке. При осмотре: акроцианоз, кожные покровы чистые, нормальной влажности; грудная клетка правильной формы, равномерно участвовала в акте дыхания; в легких дыхание везикулярное над всеми легочными полями; хрипы — проводные над всеми легочными полями; частота сердечных сокращений — 134 уд./мин; артериальное давление — 94/60 мм рт. ст.; сердечные тоны ясные, ритмичные; шум систоло-диастолический во всех точках; сатурация на руках — 73 %; частота дыхания — 29; пульс на бедренной артерии проводился; живот мягкий;
отеки отсутствовали. Вес при поступлении — 5 100 г, отмечалось нарастание градиента давления в зоне анастомоза до 97 мм рт. ст., что подтверждено данными МСКТ. В условиях нормотермии из левосторонней торакотомии в 4-м межреберье выполнено расширение дистального анастомоза дуги аорты заплатой из ксеноперикарда. Очевидной причиной развития рестеноза дистального анастомоза, с одной стороны, являлось неполное устранение дуктальной ткани во время предыдущего вмешательства, с другой — рост ребенка. В этом возрасте эндоваскулярное вмешательство не представлялось возможным из-за малого диаметра бедренных сосудов для системы доставки стентов, отсутствия технической оснащенности для выполнения процедуры, а также предпочтений оперирующего хирурга. Продолжительность пережатия аорты — 35 мин. Послеоперационный период протекал без особенностей. Экстубация проведена через 24 ч. Осуществлена кратковременная кардиотоническая поддержка адреналином. На момент выписки градиент давления на неоаорте — 48–50 мм рт. ст.
В возрасте 11 мес. у ребенка при амбулаторном наблюдении родителями отмечены жалобы на одышку в покое и при умеренной физической нагрузке, частые острые респираторные вирусные инфекции. Сатурация в пределах 85 %. Вес — 7,6 кг; рост — 72 см. Ребенок госпитализирован для выполнения аортографии с целью визуализации аорты и подготовки к следующему этапу коррекции — операции Гленна. По данным аортографии, выявлен стеноз устья брахиоцефального ствола и левой общей сонной артерии до 70 %, рекоарктация с сужением просвета до 70; модифицированный шунт Блэлок – Тауссиг функционирует. При тензиометрии: давление в дуге аорты — 133/32 мм рт. ст., среднее — 71 мм рт. ст., градиент между подключичной артерий и дугой аорты — 61 мм рт. ст. Давление ниже коарктации — 50/32 мм рт. ст., среднее — 43 мм рт. ст., систолический градиент — 83 мм рт. ст. в зоне коарктации. С учетом значимого рестеноза в области перешейка аорты (место формирования заплатой дистального анастомоза) выбрана двухэтапная коррекция: первый этап заключался в параректальном левостороннем доступе к инфраренальному отделу аорты для установки системы доставки; второй этап заключался в баллонной дилатации и стентировании кобальт-хромовым баллонорасширяемым стентом
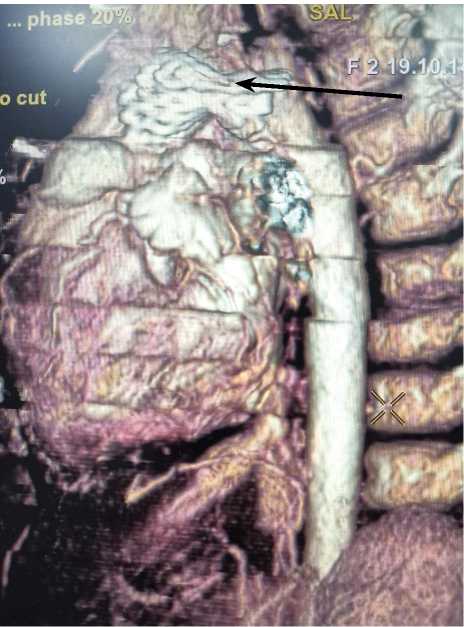
Рис. 1. Рестеноз неоаорты в зоне установки стента (указано стрелкой)
Andrastent XL (длина — 30 мм, кремпированный на баллонном катетере длиной 40 мм и диаметром 15 мм) путем пункции выделенного сегмента аорты и инфлации давлением 3–4 атм. с достижением остаточного систолического градиента 10 мм рт. ст. Данная тактика выбрана с учетом крайне высокого риска повторной хирургической операции, а также невозможности имплантации стента с потенциалом увеличения диаметра доступом через бедренную артерию (масса тела ребенка — 7,6 кг). По результатам контрольной ЭхоКГ, систолический градиент давления в зоне имплантации стента 22 мм рт. ст., что позволило через 5 дней выполнить операцию Гленна (двунаправленный кавопульмональный анастомоз). Продолжительность искусственного кровообращения составила 48 мин. В послеоперационном периоде отмечена преходящая синоатриальная блокада 2 ст. Мобиц I, при выполнении суточного мониторирования электрокардиограммы пауз не зарегистрировано, осмотрен аритмологом, данных за дисфункцию синусового узла нет. Экстубация проведена
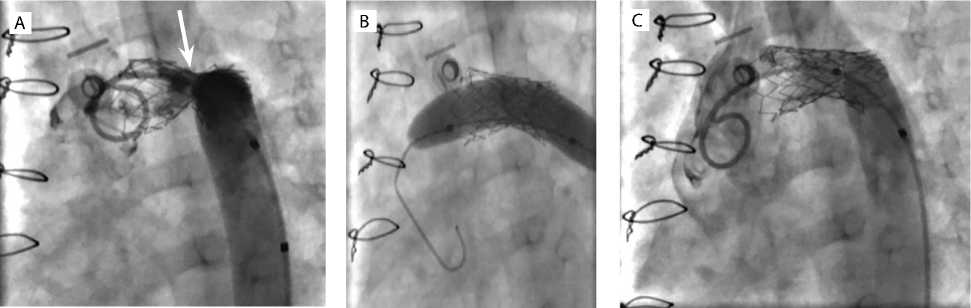
Рис. 2. Основные этапы рентгенэндоваскулярного вмешательства: ре-рестеноз неоаорты с признаками неполного расправления стента (указано стрелкой) (А); раздувание баллона в области ранее имплантированного стента (В); результат (С)
в 1-е сут., на 3-и сут. ребенок переведен в кардиохирургическое отделение, на 14-е сут. — выписан на амбулаторный этап с ежемесячным осмотром кардиолога.
Спустя полтора года после имплантации стента — ухудшение состояния в течение месяца: быстрая утомляемость, одышка в покое, усиливающаяся при умеренной физической нагрузке, цианоз пальцев рук и ног, эпизоды цианоза носогубного треугольника при сильном плаче. При обследовании в поликлинике выявлен ре-рестеноз неоаорты в области имплантированного стента с градиентом давления 59 мм рт. ст., обусловленный ростом ребенка и необходимостью дополнительной дилатации стента (стент с потенциалом роста), в нисходящем отделе аорты кровоток измененный магистральный, близкий к коллатеральному. Общее состояние средней степени тяжести обусловлено сердечной недостаточностью, гипоксемическим синдромом, высокой легочной гипертензией, сопутствующей патологией. Оценка физического развития: рост — 89 см (рост долженствующий 90,3–95,5 см, перцентиль роста — 15); вес — 11,5 кг (вес долженствующий 11,7–13,0 кг, перцентиль веса — 23), соответственно физическое развитие ниже среднего, гармоничное. Сатурация кислорода: на руках — 80 %, на ногах — 83. Кожные покровы и видимые слизистые цианотичные, влажные, чистые. Подкожно жировой слой развит достаточно, распределен равномерно. Пульс на лучевых артериях несимметричный, ритмичный. Пульс на бедренных артериях не проводился. Границы относительной сердечной тупости расширены. Сердечные тоны ясные, ритмичные. Шум систолический во всех точках. Физиологические отправления не нарушены.
По результатам ЭхоКГ и МСКТ, анатомия порока прежняя, сохраняется выраженный ре-рестеноз неоаорты в зоне установки стента с признаками неполного расправления стента и градиентом давления 66 мм рт. ст., что подтверждено данными МСКТ (диаметр сужения до 2,2 мм на протяжении 4,7 мм) (рис. 1).
Сократительная способность сердца удовлетворительная (фракция выброса — 67 %). Клинически проявления симптоматической артериальной гипертензии (артериальное давление на правой верхней конечности — 110–130/40–50 мм рт. ст.), гипоксемического синдрома (сатурация 78–85 %) — явления хронической сердечной недостаточности в покое, усиливающиеся при умеренной физической нагрузке. С учетом клинических и инструментальных данных принято решение о проведении ангиографии аорты и баллонной дилатация аорты в зоне имплантированного стента (рис. 2).
В условиях рентгенооперационной с использованием седации, местной анестезии и спонтанного дыхания выполнена катетеризация посредством пункции общей бедренной артерии справа. При аортографии подтвержден ре-рестеноз неоаорты с признаками неполного раскрытия ранее имплантированного стента в средней части (рис. 2, А). Проведена прямая тензиометрия: измерено систолическое артериальное давление до стеноза — 85 мм рт. ст., после — 55 мм рт. ст. (систолический градиент на стенте в неоаорте — 30 мм рт. ст.).
Далее баллоном высокого давления диметром 10 мм под давлением 16 атм. выполнена дилатация стента (рис. 2, В). Проведена контрольная тензиоме- трия проксимальнее и дистальнее стента, отмечено снижение систолического градиента давления в зоне имплантации стента с 30 до 16 мм рт. ст., что подтверждено данными ЭхоКГ интраоперационно и спустя 24 ч после вмешательства, что свидетельствует об удовлетворительном результате (рис. 2, С).
Послеоперационный период протекал без осложнений. Нахождение ребенка в отделении реанимации — 3 ч, в детском кардиологическом отделении — 10 сут. Проведена дезагрегантная терапия (аспирин в дозе 50 мг/сут.), терапия ингибиторами ангиотензин-превращающего фермента (эналаприл в дозе 1,25 мг 2 раза в сут.), диуретическая терапия (спиронолактон 1,25 мг/сут.). Ребенок выписан на амбулаторный этап под динамическое наблюдение для подготовки к следующему этапу коррекции — операции Фонтена (экс-тракардиальный кондуит 16 мм протезом Gore-Tex).
Через 6 мес. ребенок (в возрасте трех лет) поступил для проведения операции Фонтена. Операция прошла успешно. Экстубация проведена в 1-е сут. после операции. Наблюдалась стабильная гемодинамика без инотропной поддержки. На 6-е сут. пациент переведен в отделение кардиохирургии. В динамике выполнено ЭхоКГ, по данным которого отмечено, что фракция выброса — 75 %, на экстракардиальном кондуите кровоток фазный, максимальный градиент на неоаорте — 8 мм рт. ст. Реабилитация проходила закономерно, с постепенным расширением физической активности, высокобелковой диетой, массажем. Ребенок выписан из отделения кардиохирургии на 20-е сут. после этапа реабилитации на амбулаторный этап.
Обсуждение
Распространенность СГЛС составляет 4–9 % среди всех врожденных пороков сердца. Как известно, послеоперационная (30-дневная) летальность и однолетняя выживаемость у таких детей составляет около 63 и 51 % соответственно [4].
Основные факторы риска, ответственные за развитие рестеноза дистального анастомоза после операции Норвуда: диаметр нативного восходящего отдела аорты ≤ 3 мм, атрезия митрального, аортального клапанов. Частота развития рестеноза дистального анастомоза аорты у детей достигает, по некоторым исследованиям, 23 % и возникает в среднем через 4,3 мес. (разброс от 1 до 28 мес.), при этом имеется взаимосвязь между стенозом и материалом заплаты; 86 ± 7 % детей не имеют стеноза анастомоза в течение
2 лет наблюдения [4–6]. Авторы выделяют следующие причины рестеноза, кроме типа заплат: неполное иссечение дуктальной ткани, аномальная анатомия дуги (в основном аберрантная правая подключичная артерия), технические ошибки, недостаточность атриовентрикулярного клапана. Известно, что пиковый градиент 26 мм рт. ст. или выше по данным эхокардиографии после операции Норвуда, но до операции Гленна является прогностическим фактором необходимости повторного вмешательства во время госпитализации для проведения Гленна [6]. В представленном случае основной причиной являлось неполное иссечение дуктальной ткани во время первого вмешательства. Среди стратегий лечения пациентов с рестенозами неоаорты рассматриваются следующие: повторное хирургическое вмешательство, которое влечет за собой все риски, связанные с реоперацией, необходимостью циркуляторного ареста и ассоциированными с ним осложнениями, но при этом устраняются все анатомические и технические проблемы. Второй путь решения заключается в выполнении эндоваскулярных методов коррекции, которые существенно снижают риски неблагоприятных исходов, но требуют выбора места сосудистого доступа у детей из-за систем доставки стентов [7–9]. Баллонная ангиопластика, по мнению D. Porras и соавт., является стандартной терапией первой линии для развившегося рестеноза и в целом эффективной, при этом показатели составляют 89–100 %; несмотря на многообещающие результаты, мало данных об отдаленных исходах после баллонной ангиопластики [10]. Оценивая все возможные осложнения, мы считаем, что перспективным методом может выступать общий консенсус между хирургическим вмешательством (для возможности установки системы доставки стента) и эндоваскулярным подходом (имплантация стента с потенциалом последующей дилатации по мере роста ребенка).
Гибридные операции по коррекции стеноза дуги аорты при помощи стентирования успешно используются у детей со СГЛС после операции Норвуда. Как правило, сроки выполнения таких операций весьма лимитированы с учетом гемодинамической значимости данной патологии [10]. Первостепенной задачей такого вида коррекции является устранение обструкции дуги неоаорты с имплантацией стента большого диаметра. У маленьких детей выполнять эндоваскулярные вмешательства по имплантации стентов в крупные сосуды технически невозможно ввиду не- обходимости использования систем доставок стентов больших размеров. В таких случаях необходи- 4.
мо имплантировать такие стенты, которые по мере роста ребенка можно будет расширить до нужного размера. Баллонорасширяемые стенты большого размера, обладающие способностью к дальнейшей дилатации: GenezisXD (Cordis, США), CP (NuMed, Канада), Andrastents (Andramed, Германия), Intrastent (Ev 3, США). С появлением низкопрофильных стентов Valeo, 5. которые уже монтированы на баллонный катетер и требуют доставляющую систему 6–7 Fr, возможности эндоваскулярной хирургии увеличились, так как эти 6. стенты в последующем также можно расширить [12].
Описанный нами случай демонстрирует перспективность данного способа коррекции и возможности моделирования стента с потенциалом для дальнейше- 7.
го расширения по мере роста ребенка, что позволяет избежать осложнений, связанных с реоперациями. Это особенно важно с такой сложной категорией пациентов, требующих многоэтапных хирургических вмешательств (двунаправленный анастомоз Гленна, операция Фонтена). 8.
Заключение
Использование гибридного подхода в поэтапном лечении детей со СГЛС позволяет снизить риски хи- 9.
рургического вмешательства и может рассматриваться как вариант выбора при условии использования стентов с потенциалом моделирования для 10. стадийного лечения пациентов со СГЛС в условиях центров с высоким уровнем хирургии врожденных пороков сердца.
Список литературы Возможности гибридной хирургии в гемодинамической коррекции ребенка с синдромом гипоплазии левых отделов сердца (клиническое наблюдение)
- Sakurai T., Rogers V., Stickley J., Khan N., Jones T.J., Barron D.J., Brawn W.J. Single-center experience of arch reconstruction in the setting of Norwood operation. Ann Thorac Surg. 2012;94(5):1534-1539. https://doi. org/ DOI: 10.1016/j.athoracsur.2012.05.097 PMID: 22841016
- Whiteside W., Hirsch-Romano J.,Yu S., Pasquali S.K., Armstrong A. Outcomes associated with balloon angioplasty for recurrent coarctation in neonatal univentricular and biventricular norwood-type aortic arch reconstructions. Catheter Cardiovasc Interv. 2014;83(7):1124-1130. https://doi. org/ DOI: 10.1002/ccd.25318 PMID: 24323365
- Sinha L., OzturkM., Zurakowski D.,Yerebakan C., Ramakrishnan K., Matisoff A., Ruth J., Jonas R.A., Sinha P. Intra-extracardiac versus extracardiac Fontan modifications: comparison of early outcomes. Ann Thorac Surg. 2019;107(2):560-566. DOI: 10.1016/j.athoracsur.2018.07.080 PMID: 30273570
- Тарасов Р.С., Нохрин А.В., Ануфриев А.И., Шушпанников П.А., Кузьмин И.В., Кузьмин А.В., Глебов К.К. Гибридная имплантация стента при рестенозе дистального анастомоза аорты после операции Норвуда (клиническое наблюдение). Диагностическая и интервенционная радиология. 2018;12(3);53-60.
- Jonas R.A., Jacobs J.P., Jacobs M.L., Mavroudis C. Reporting of mortality associated with pediatric and congenital cardiac surgery. J Thorac Cardiovasc Surg. 2010;140(3):726;author reply 726-727. DOI: 10.1016/j.jtcvs.2010.04.034 PMID: 20723742


