Возможности эллипсометрии, раман-спектроскопии, КНИ-нанопроволочного биосенсора в диагностике колоректального рака
Автор: Кручинина Маргарита Витальевна, Прудникова Яна Игоревна, Курилович Светлана Арсентьевна, Громов Андрей Александрович, Кручинин Владимир Николаевич, Атучин Виктор Валерьевич, Наумова Ольга Викторовна, Спесивцев Евгений Васильевич, Володин Владимир Алексеевич, Пельтек Сергей Евгеньевич, Шувалов Геннадий Владимирович, Генералов Владимир Михайлович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.16, 2017 года.
Бесплатный доступ
С помощью спектральной эллипсометрии вблизи условий наблюдения поверхностного плазмонного резонанса (ППР) экспериментально установлены различия констант скоростей специфических взаимодействий опухолевой М2-пируваткиназы (Tumor M2-PK) сыворотки крови (СК) пациентов с колоректальным раком (КРР) разных стадий и с различной локализацией метастазов с высоко специфичными моноклональными антителами, нанесенными слоями на поверхности биочипов (AUC 0,89). Методом сканирующей эллипсометрии обнаружено значимое увеличение эффективной толщины покрытия биомолекул в результате специфического взаимодействия «антиген-антитело» в группе пациентов с вне- и печеночными метастазами по сравнению с группой здоровых лиц (p
Диагностика, колоректальный рак, эллипсометрия, флуоресцентная оптическаяспектрометрия, поверхностный плазмонный резонанс, raman-спектроскопия, кни-нанопроволочный биосенсор, опухолевая м2 пируваткиназа
Короткий адрес: https://sciup.org/140254129
IDR: 140254129 | УДК: 616.34-006.6-073 | DOI: 10.21294/1814-4861-2017-16-4-32-41
Текст научной статьи Возможности эллипсометрии, раман-спектроскопии, КНИ-нанопроволочного биосенсора в диагностике колоректального рака
Глиобластома (ГБМ) является высокозлокачественной первичной глиальной опухолью головного мозга, которая характеризуется устойчивостью к современным хирургическим, химио- и радио-терапевтическим методам лечения [1–3]. Медиана выживаемости пациентов с ГБМ после выполнения максимально возможной микронейрохирургиче- ской резекции, проведения курсов адъювантной химиотерапии темозоломидом и радиотерапии составляет не более 12–14 мес [4]. Степень резекции опухолевой ткани является важнейшим прогностическим фактором для пациентов с ГБМ [5]. Учитывая тот факт, что ГБМ характеризуется инфильтративным ростом без четкого отграничения
от окружающей мозговой ткани, тотальная резекция опухоли представляет собой сложную задачу для нейрохирурга [5, 6]. К настоящему времени для достижения максимальной степени резекции ГБМ разработаны многочисленные техники и методики: интраоперационная МРТ и МСКТ, ультрасонография, а также флуоресцентная навигация с 5-аминолевулиновой кислотой (5-АЛА-ФН).
Использование 5-АЛА-ФН является современным методом интраоперационной навигации в хирургии ГБМ. При метаболизировании 5-АЛА в клетках ГБМ накапливается протопорфирин-IX, который и вызывает эффект флуоресценции при освещении опухолевой ткани в специальном синефиолетовом световом спектре. Флуоресцирующая ткань ГБМ позволяет нейрохирургу четко визуализировать опухолевую ткань, её наиболее вероятные границы со здоровой тканью головного мозга и выполнить максимально радикальную резекцию [7]. Рандомизированные контролируемые исследования наглядно продемонстрировали достоверное увеличение медианы выживаемости у пациентов с ГБМ после микронейрохирургической резекции с применением 5-АЛА-ФН [8–10]. В настоящее время использование 5-АЛА-ФН в хирургии глиом высокой степени злокачественности одобрено во всем мире. Однако широкое применение флуоресцентной навигации приводит к развитию нежелательных явлений, что требует уточнения показаний к её использованию и строгого отбора пациентов.
Цель данного метаанализа – определить клиническую эффективность 5-АЛА-ФН в хирургии ГБМ, а также оценить чувствительность и специфичность данной методики.
Материал и методы
Проанализированы опубликованные с 2000 по 2017 г. результаты хирургического лечения ГБМ с использованием 5-АЛА-ФН. Для оценки клинической эффективности применения 5-АЛА-ФН определены следующие критерии включения литературных источников в метаанализ:
-
1) опубликованные с 2000 по 2017 г. результаты зарубежных и отечественных исследований, в которых использовалась 5-АЛА-ФН при хирургическом лечении ГБМ;
-
2) в исследовании отмечена чувствительность и специфичность применения 5-АЛА-ФН в хирургии ГБМ;
-
3) в исследовании сообщается о тотальной резекции ГБМ при использовании 5-АЛА-ФН;
-
4) в исследовании указывается длительность безрецидивного периода (ДБП) и общая выживаемость пациентов с ГБМ.
Критериями исключения являлись:
-
1) исследования, посвященные применению 5-АЛА-ФН в хирургии других типов опухолей;
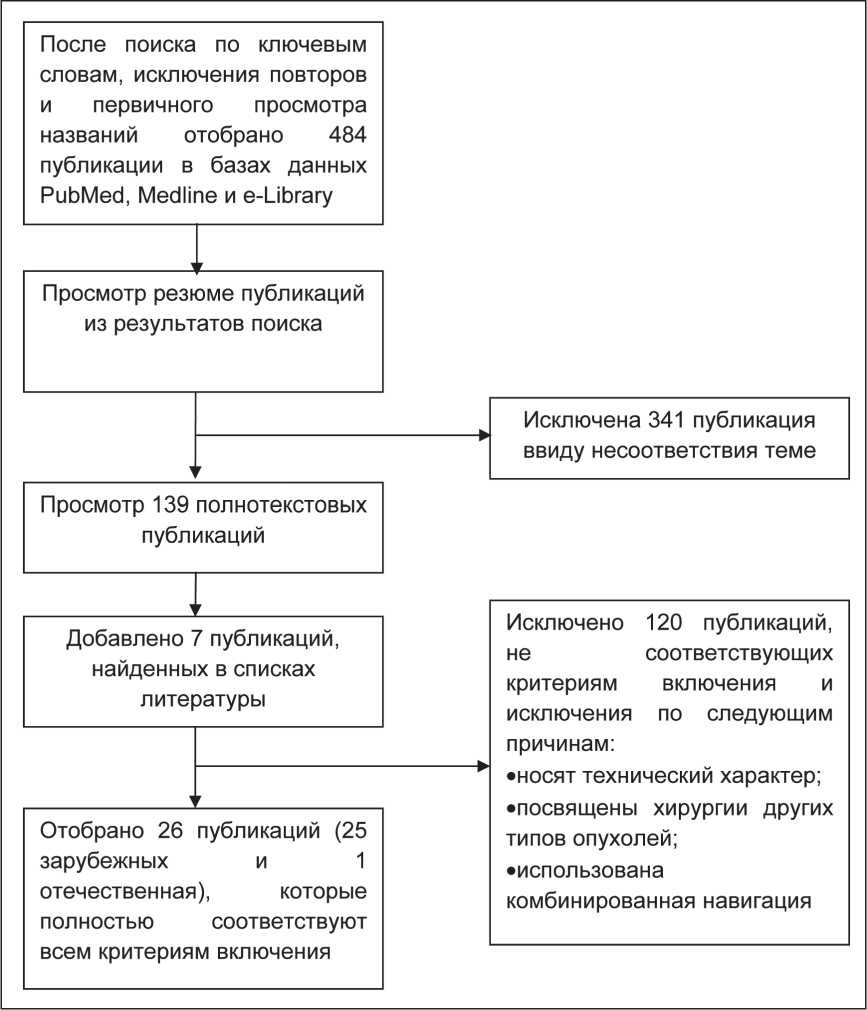
Рис. 1. Стратегия поиска и отбора данных для включения в метаанализ
-
2) исследования типа случай-контроль;
-
3) исследования, касающиеся технической составляющей 5-АЛА-ФН в хирургии ГБМ;
-
4) исследования, посвященные комбинированным методам навигации в хирургии ГБМ.
Этапы систематического поиска и отбора-фильтрации данных для метаанализа представлены на рис. 1. На первом этапе в базах данных Medline, Pubmed и e-Library проводился поиск литературных источников с использованием ключевых слов «fluorescence», «glioblastoma», «glioma», «5-aminolevulinic acid (5-ALA)», «neurosurgery» для англоязычных систем, «флуоресцентная навигация», «5-аминолевулиновая кислота» «глиобластома», «хирургия» – для системы e-Library и ручной отбор статей по названиям на соответствие критериям исследования. На втором этапе просматривали абстракты статей и исключали публикации, не соответствующие критериям исследования. На третьем этапе просматривали полный текст отобранных статей на соответствие критериям включения и список литературы на наличие релевантных исследований. Информацию, полученную из статей для метаанализа заносили в таблицы и выполняли анализ. Таким образом, систематизирована информация об 1 отечественном и 25 зарубежных исследованиях. Для вычисления статистических показателей метаанализа и построения метаграф использовано программное обеспечение Microsoft Excel 2010. Полученные данные представлены в виде долей, их стандартных ошибок и 95 % доверительных интервалов (ДИ). Результаты взвешены с использованием модели случайных эффектов на основании расчета коэффициентов гетерогенности I2 и Q. Порог значимости р был выбран равным 0,05.
Результаты
Значение 5-АЛА-ФН в достижении максимальной степени резекции ГБМ
В современной нейроонкологии под термином максимальная степень резекции опухоли принято понимать отсутствие контрастирования в ложе удаленной опухолевой ткани на Т1-взвешенных изображениях, полученных с помощью МРТ в первые 72 ч после оперативного вмешательства [11]. С другой стороны, некоторые авторы утверждают, что удаление 98 % и более от исходного объема опухоли представляет собой максимальную степень резекции [12, 13]. В настоящем метаанализе результаты включенных исследований согласуются с данным определением. У 74,8 % пациентов (95 % ДИ: 67,4–83,5 %) удалось достичь максимальной степени резекции опухоли (рис. 2).
Влияние 5-АЛА-ФН на ДБП
В любом клиническом исследовании ДБП принято рассматривать в качестве первичной конечной точки. В настоящем метаанализе приведены 3 исследования, сообщающих о ДБП у пациентов после микронейрохирургического удаления ГБМ с применением 5-АЛА-ФН. Несмотря на наличие достоверной неоднородности, анализ указанных наблюдений показал, что 5-АЛА-ФН увеличивает ДБП у пациентов с ГБМ в среднем на 8,14 мес (95 % ДИ: 4,36–12,02) (рис. 3).
Влияние 5-АЛА-ФН на общую выживаемость пациентов с ГБМ
Общая выживаемость пациентов с ГБМ не является корректной первичной конечной точкой в рандомизированных исследованиях, поскольку не позволяет контролировать эффективность различных методов лечения после рецидива ГБМ. В настоящем метаанализе представлены результаты
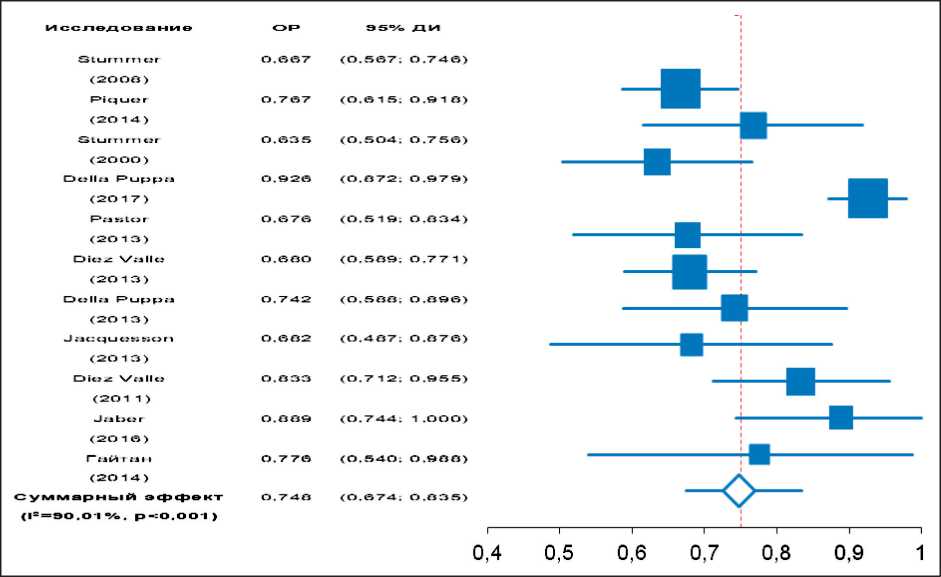
Рис. 2. Метаанализ применения 5-АЛА-ФН с целью достижения максимальной степени резекции ГБМ (I2=90,01, Q=50,86)
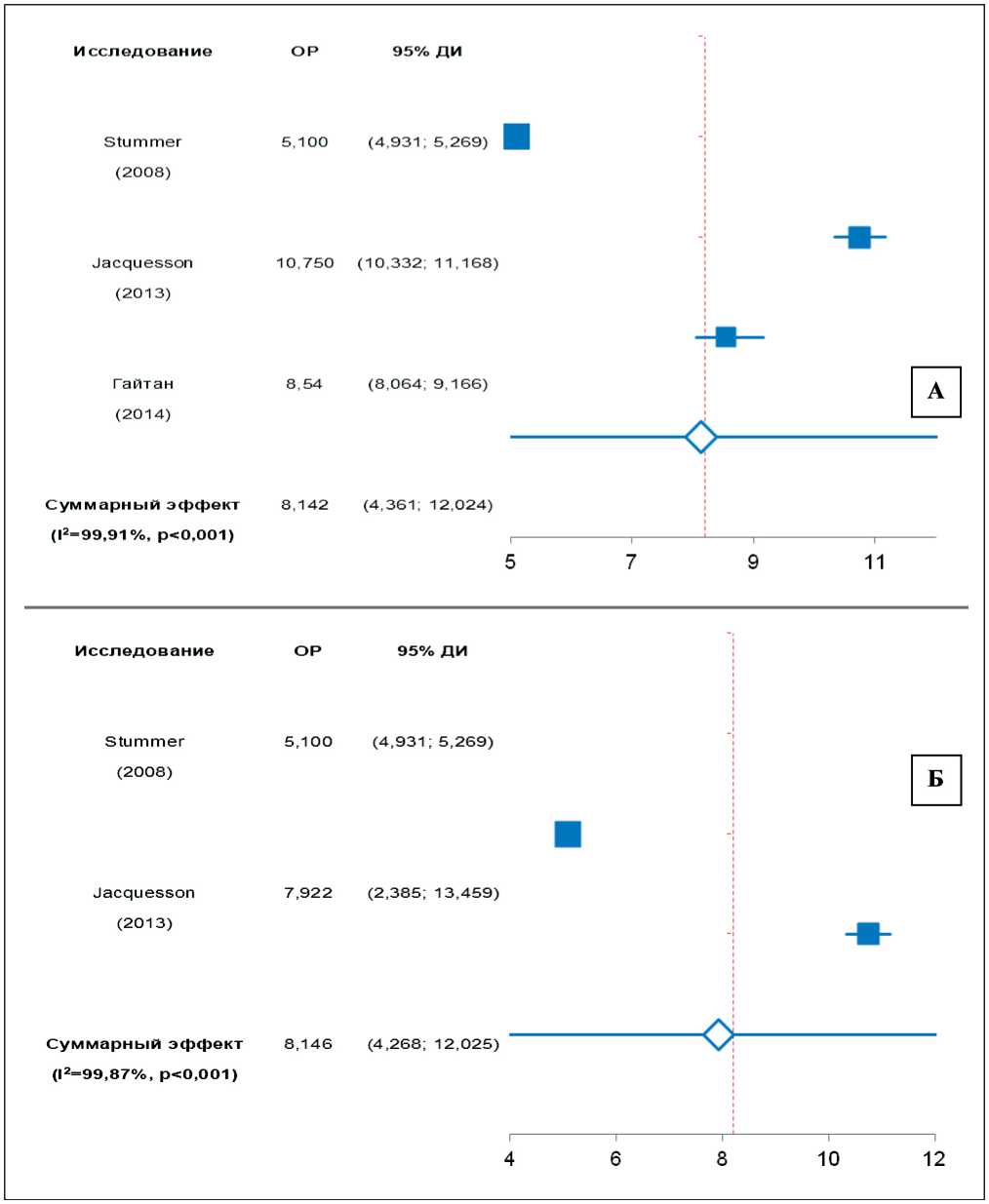
Рис. 3. Метаанализ влияния 5-АЛА-ФН на ДБП у пациентов с ГБМ: А – с включением исследования Гайтан и соавт. [27] (I2=99,91, Q=24,47); Б – без включения данного исследования ввиду использования комбинированной ФН (с нейронавигацией) (I2=99,87, Q=20,83)
трех исследований, в которых указывалась информация об общей выживаемости пациентов. При этом в исследовании Eljamel [13] при резекции ГБМ с использованием 5-АЛА-ФН также применялись методы фотодинамической терапии. По этой причине метаанализ влияния 5-АЛА-ФН на общую выживаемость пациентов с ГБМ выполнен с включением данного исследования и без него. В среднем разница в общей выживаемости пациентов с ГБМ при использовании 5-АЛА-ФН и без применения таковой составила 4,35–6,17 мес (95 % ДИ: 0,9–13,23) (рис. 4).
Специфичность методики 5-АЛА-ФН в хирургии ГБМ
Специфичность – это способность диагностического метода не давать ложноположительный результат при отсутствии заболевания и определяется как доля истинно отрицательных результатов среди здоровых лиц в группе исследуемых [15]. В данном метаанализе приведены результаты нескольких исследований, посвященных изучению специфичности и чувствительности 5-АЛА-ФН в хирургии ГБМ с патоморфологическим подтверждением диагноза. В двух клинических сериях представлены данные для других типов опухолей головного мозга, а потому метаанализ проведен как с включением данных исследований, так и без них. Специфичность методики 5-АЛА-ФН составила 86,6–87,5 % (95 % ДИ: 81,6–91,7) (рис. 5).
Чувствительность методики 5-АЛА-ФН в хирургии ГБМ
Чувствительность – это способность диагностического метода давать правильный результат и определяется как доля истинно положительных результатов среди всех проведенных тестов [14]. Чувствительность методики 5-АЛА-ФН составила 79,8–82,2 % (95 % ДИ: 73,5–91,07) (рис. 6).
Обсуждение
Степень резекции ГБМ является независимым прогностическим фактором для ДБП и, как следствие, общей выживаемости пациентов [15]. Принято считать, что резекция 98 % и более от общего объема ГБМ достоверно увеличивает ДБП у данной группы пациентов [16]. При выполнении микронейрохирургического удаления ГБМ без использования 5-АЛА-ФН максимально возможный объём резекции достигается в 25–36 % случаев [17]. Использование 5-АЛА-ФН позволяет достоверно достичь максимально возможной степени резекции у 64 % пациентов [18]. В настоящем метаанализе приведены результаты нескольких исследований, которые полностью согласуются с указанными данными. По результатам указанных клинических серий у 74,8 % пациентов (95 % ДИ: 67,4–83,5 %) достигнута максимальная степень резекции ГБМ [16–27]. Стоит отметить, что послеоперационное МРТ-исследование головного мозга

Рис. 4. Метаанализ влияния 5-АЛА-ФН на общую выживаемость пациентов с ГБМ: А – с включением исследования Гайтан и соавт. [27] (I2=99,78, Q=28,41); Б – без включения данного исследования ввиду использования комбинированной ФН (с нейронавигацией) (I2=98,81, Q=28,34)
в первые 72 ч после оперативного вмешательства, является малоинформативным методом в истинной оценке степени резекции ГБМ. Это связано с тем, что границы ГБМ, выявленные на МРТ-граммах головного мозга и интраоперационно при использовании 5-АЛА-ФН, не совпадают. Как правило, границы ГБМ при 5-АЛА-ФН распространяются на здоровую мозговую ткань в среднем на 10 мм. Тем не менее МРТ является стандартным методом исследования в послеоперационном периоде у пациентов с ГБМ.
Как известно, ДБП у пациентов с ГБМ представляет собой первичную конечную точку в рандомизированном клиническом исследовании, посвященном эффективности того или иного метода лечения. В настоящем метаанализе приведены результаты нескольких наблюдений, в которых сообщалось о ДБП у пациентов с ГБМ [19, 24, 27].
Несмотря на неоднородность данных наблюдений, среднее значение ДБП у пациентов после резекции ГБМ с использованием 5-АЛА-ФН составило 8,14 мес (95 % ДИ: 4,36–12,02). В двух исследованиях наглядно продемонстрировано значимое увеличение ДБП у пациентов с использованием 5-АЛА-ФН, по сравнению с обычным микронейрохирургическим удалением ГБМ [19, 24].
Как уже было отмечено ранее, в отличие от ДБП общая выживаемость пациентов не является корректной первичной конечной точкой в рандомизированных исследованиях, поскольку не позволяет контролировать эффективность различных методов лечения после рецидива ГБМ. Однако в настоящий метаанализ включены два исследования, в которых представлена информация об общей выживаемости в группе пациентов после резекции ГБМ с применением 5-АЛА-ФН и
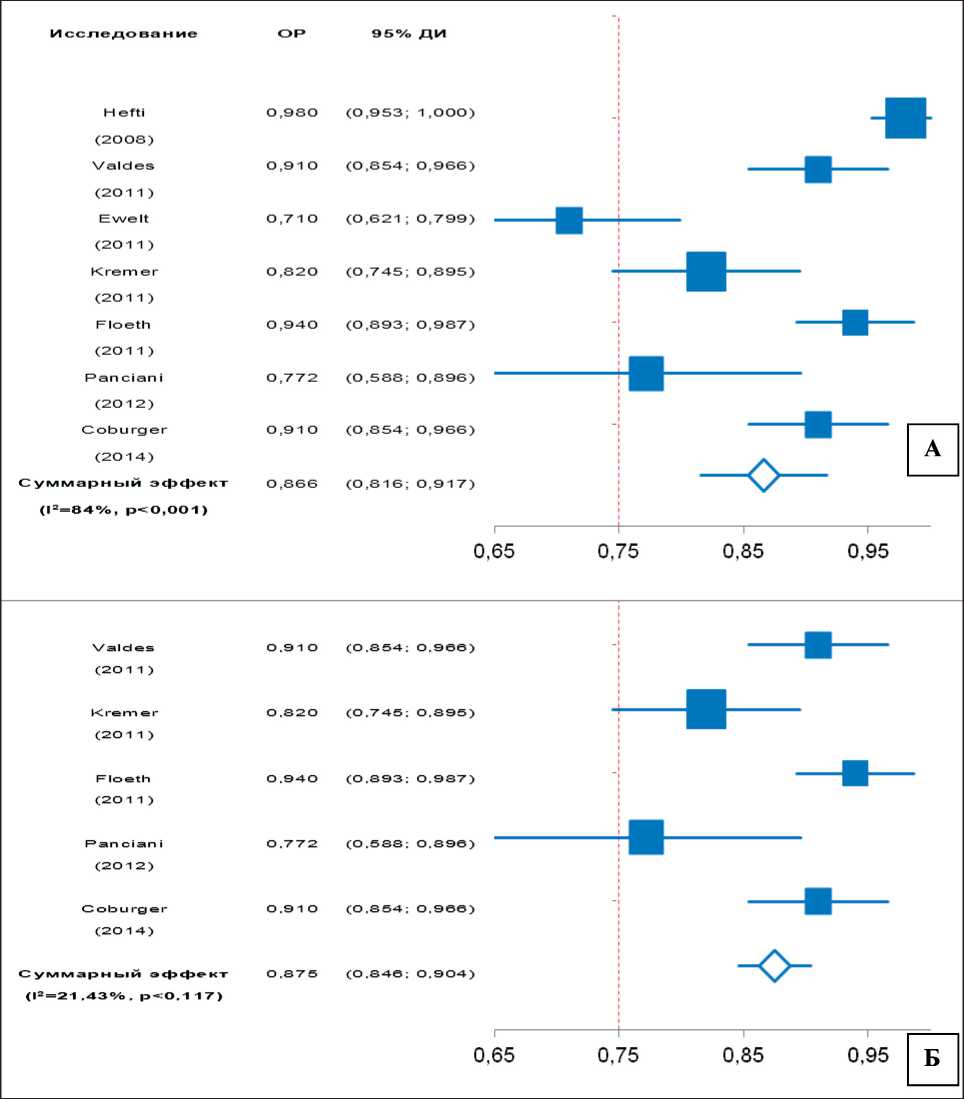
Рис. 5. Метаанализ специфичности методики 5-АЛА ФН в хирургии ГБМ: А – с включением исследований, в которых 5-АЛА-ФН применялась при резекции других типов опухолей головного мозга (I2=84, Q=47,76); Б – без включения данных исследований (I2=21,43, Q=7,16)
в группе без нее [19, 24]. При этом разница в общей выживаемости между указанными группами пациентов с ГБМ составила 4,35–6,17 мес (95 % ДИ: 0,9–13,23). Необходимо отметить тот факт, что при анализе указанных данных отмечаются широкий 95 % ДИ и высокая степень гетерогенности. Это обусловлено тем, что часть пациентов с ГБМ из указанных клинических серий подвергалась повторному оперативному лечению с применением 5-АЛА-ФН. Учитывая результаты данных иссле- дований, а также отсутствие регистрации других методов лечения, не представляется возможным утверждать, что применение 5-АЛА-ФН в хирургии ГБМ дает значительное преимущество в общей выживаемости пациентов.
Данный метаанализ наглядно доказал, что использование 5-АЛА-ФН обладает высокой специфичностью 86,6–87,5 % (95 % ДИ: 81,6–91,7) и чувствительностью 79,8–82,2 % (95 % ДИ: 73,5–91,07) в отношении ГБМ [28–34]. Несмотря
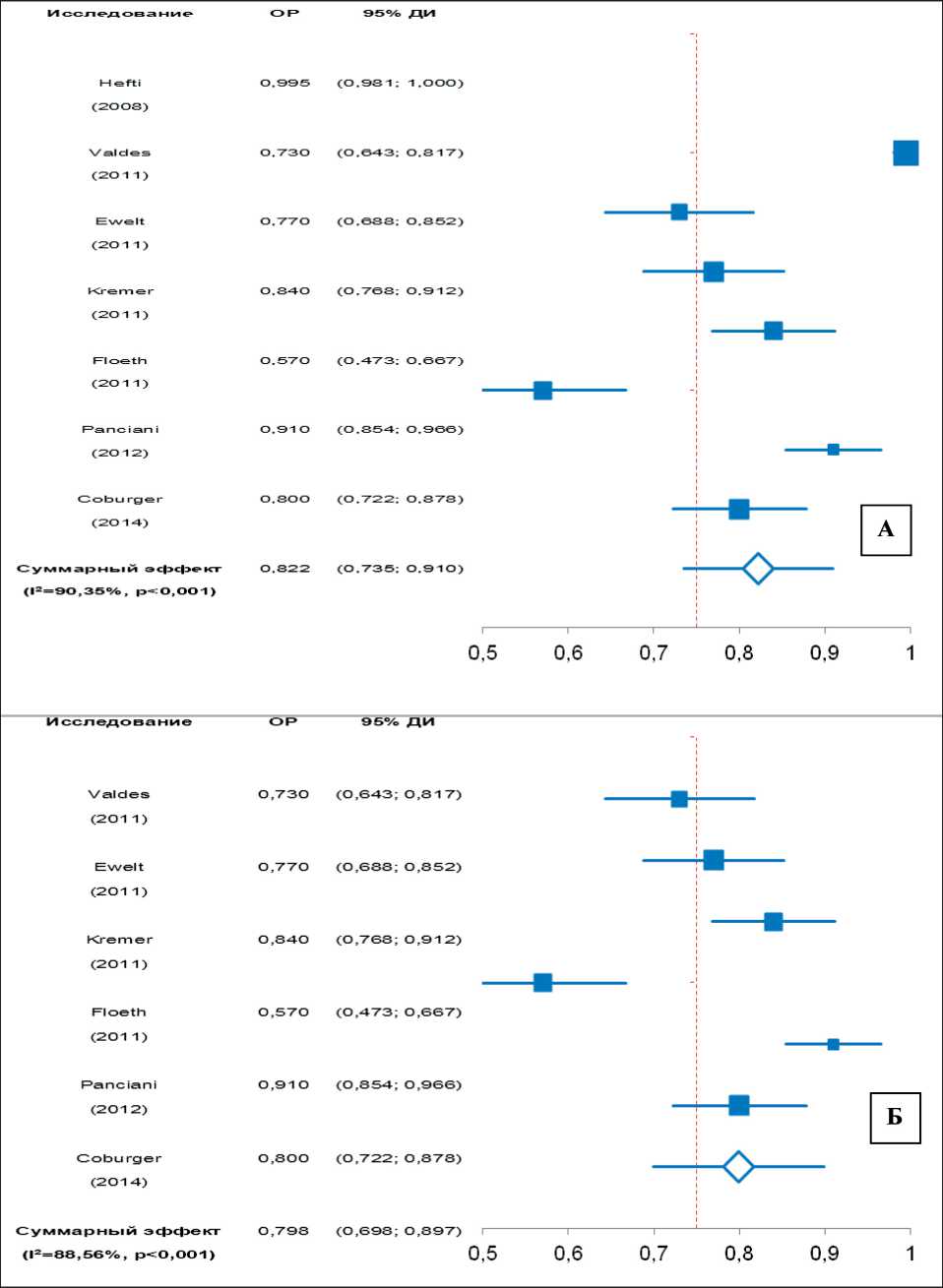
Рис. 6. Метаанализ чувствительности методики 5-АЛА ФН в хирургии ГБМ: А – с включением исследований, в которых 5-АЛА-ФН применялась при резекции других типов опухолей головного мозга (I2=90,35, Q=63,25); Б – без включения данных исследований (I2=88,56, Q=64,16)
на включение в метаанализ двух клинических серий с применением 5-АЛА-ФН в хирургии не только ГБМ, но и других опухолей, показатели чувствительности и специфичности данного метода навигации остались по-прежнему высокими [29, 31]. Другие методы интраоперационной навигации (МРТ, МСКТ, ультрасонография, нейронавигация) существенно уступают по чувствительности и специфичности 5-АЛА-ФН.
По данным метаанализа Su et al. [35], чувствительность и специфичность 5-АЛА-ФН в хирургии ГБМ составляют соответственно 84 % и 91 %. Стоит отметить, что в указанный метаанализ включены исследования, где при резекции ГБМ применялась навигация с флуоресцеином. В нашем метаанализе указанные исследования исключены, так как механизмы флуоресценции клеток ГБМ при использовании 5-АЛА и флуоресцеина различны. В своем метаанализе Zhao et al. [36] показали, что чувствительность 5-АЛА-ФН составляет 87 %, специфичность – 89 %. Наиболее близким по критериям включения к нашему исследованию, является метаанализ Eljamel [37]. Автор пришел к заключению, что специфичность и чувствительность методики 5-АЛА-ФН в хирургии ГБМ составляют 88 % и 82,6 % соответственно. В целом, несмотря на различные подходы к выбору критериев включения в исследования, полученные нами результаты полностью согласуются с данными указанных метаанализов.
Безусловно, степень хирургической резекции представляет собой важнейший прогностический фактор в ДБП и общей выживаемости пациентов с глиомами высокой степени злокачественности. На данный момент 5-АЛА-ФН является доступным и безопасным методом, позволяющим достигнуть
Список литературы Возможности эллипсометрии, раман-спектроскопии, КНИ-нанопроволочного биосенсора в диагностике колоректального рака
- Jemal A., Siegel R., Ward E., Hao Y., Xu J., Thun M.J. Cancer statistics, 2009. CA Cancer J Clin. 2009 Jul-Aug; 59 (4): 225-49. DOI: 10.3322/caac.20006
- Cai S.R., Zhang S.Z., Zhu H.H., Huang Y.Q., Li Q.R., Ma X.Y., Yao K.Y., Zheng S. Performance of a colorectal cancer screening protocol in an economically and medically underserved population. Cancer Prev Res (Phila). 2011 Oct; 4 (10): 1572-9. DOI: 10.1158/1940-6207.CAPR-10-0377
- Pawlik T.M., Scoggins C.R., Zorzi D., Abdalla E.K., Andres A., Eng C., Curley S.A., Loyer E.M., Muratore A., Mentha G., Capussotti L., Vauthey J.N. Effect of surgical margin status on survival and site of recurrence after hepatic resection for colorectal metastases. Ann Surg. 2005; 241: 715-22. DOI: 10.1097/01.sla.0000160703.75808.7d
- Meyerhardt J.A., Mangu P.B., Flynn P.J., Corde L., Loprinzi C.L., Minsky B.D., Petrelli N.J., Ryan K., Schrag D.H., Wong S.L., Benson A.B. Follow-Up Care, Surveillance Protocol, and Secondary Prevention Measures for Survivors of Colorectal Cancer: American Society of Clinical Oncology Clinical Practice Guideline Endorsement. J Clin Oncol. 2013 Dec 10; 31 (35): 4465-70. DOI: 10.1200/JCO.2013.50.7442
- Bathe O.F., Ernst S., Sutherland F.R., Dixon E., Butts C., Bigam D., Holland D., Porter G.A., Koppel J., Dowden S. A phase II experience with neoadjuvant irinotecan (CPT-11), 5-fluorouracil (5-FU) and leucovorin (LV) for colorectal liver metastases. BMC Cancer. 2009; 9: 156-67. DOI: 10.1186/1471-2407-9-156


