Возможности эндоваскулярного лечения пациентов с окклюзией инфраренального отдела аорты
Автор: Жолковский Александр Владимирович, Ермоленко Вячеслав Владимирович, Боронджиян Тигран Сергеевич, Тимофеева Лариса Леонидовна, Чубаров Виталий Ервантович, Урусов Идар Анатольевич
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 (29), 2017 года.
Бесплатный доступ
Окклюзия терминального отдела аорты чаще всего обусловлена атеросклерозом и при развитии ишемии нижних конечностей требует оперативного лечения. Помимо открытой хирургии аорты могут также быть использованы реканализация и стентирование. В статье представлен первый опыт эндоваскулярного лечения больных с хорошими непосредственными и среднеотдаленными результатами. Данная методика целесообразна в использовании пациентам с противопоказаниями к общей анестезии.
Хроническая окклюзия брюшной аорты, эндоваскулярное лечение, реканализация, стентирование
Короткий адрес: https://sciup.org/143164623
IDR: 143164623
Текст научной статьи Возможности эндоваскулярного лечения пациентов с окклюзией инфраренального отдела аорты
Введение. Окклюзия инфраренального отдела аорты сопровождается типичным симп-томокомплексом, впервые описанным в 1923 г. R.Leriche [1]. При этом основной (88-94 %) причиной развития синдрома Лериша является атеросклероз [2, 3]. При развитии у больных с поражением терминального отдела аорты и подвздошных артерий ишемии нижних конечностей IIБ, III и IV степени по Фонтейну– Покровскому показано оперативное лечение в объеме резекции аорты с протезированием, аортобедренного шунтирования или экстраанатомических операций. При высокой окклюзии аорты часто необходимо выполнять тромбэктомию из интерренального сегмента аорты, что может потребовать более травматичного тора-кофреноперитонеального доступа [4]. По данным Покровского А.В. и соавт. 10-летняя выживаемость после реконструкции терминального отдела аорты составляет 61 % , что связывается с превалированием пациентов с мультифокальным атеросклерозом [5]. Несмотря на то, что традиционно данной категорией больных занимаются в отделениях сосудистой хирургии, развитие эндоваскулярных технологий в последние годы значительно меняет структуру вмеша- тельств, показаны хорошие непосредственные и отдаленные результаты стентирования подвздошных артерий [6]. Также появились отдельные публикации, посвященные эндоваскулярному лечению окклюзий аорты и подвздошных артерий [7].
Материал и методы. В 2008-2016 гг. 13 пациентов были прооперированы по поводу хронической окклюзии инфраренального отдела аорты и подвздошных артерий. Пациенты разделены на 3 группы: 1-я группа: 4 пациента в возрасте 47-70 лет (среднее – 59,3), которым было выполнено аортобедренное шунтирование/протезирование из срединной лапаротомии; 2-я группа: 5 больных 51-67 лет (среднее – 58), им реконструкция выполнена из мини-лапаротомного доступа; 3-я группа: 4 больных от 49 до 67 лет (средее – 56,5), которым выполнено эндоваскулярное лечение в объеме реканализации и стентирования. У всех больных анализировался характер поражения аорты, в т.ч. выявлялась высокая окклюзия с закрытием устья нижней брыжеечной артерии, исследовались артерий нижних конечностей для исключения многоэтажных поражений (дистальный блок), определялась степень хронической ишемии нижних конечностей и критическая ишемия (КИНК) – III и IV степень по Фонтейну-Покровскому). Также проводилось комплексное обследования для выявления сопутствующей патологии: клинически значимые формы ишемической болезни сердца (ИБС), дисциркуляторной энцефалопатии (ДЭП). По этим признакам существенных различий в характеристиках пациентов при ретроспективном анализе не выявлено (таблица 1), но в 3-й группе было 2 больных с хронической обструктивной болезнью легких (ХОБЛ) с противопоказаниями к эндотрахеальному наркозу.
Таблица 1
Характеристика больных до операции
|
Группа |
КХИНК |
Высокая окклюзия аорты |
Дисталь-ный блок |
ИБС |
ДЭП |
|
1 группа (4) |
3 |
2 |
3 |
2 |
1 |
|
2 группа (5) |
5 |
4 |
2 |
3 |
2 |
|
3 группа (4) |
3 |
3 |
2 |
2 |
- |
Всем пациентам 3-й группы выполнялась мультиспиральная компьютерно-томографическая ангиография для планирования вмешательства (рис.1).
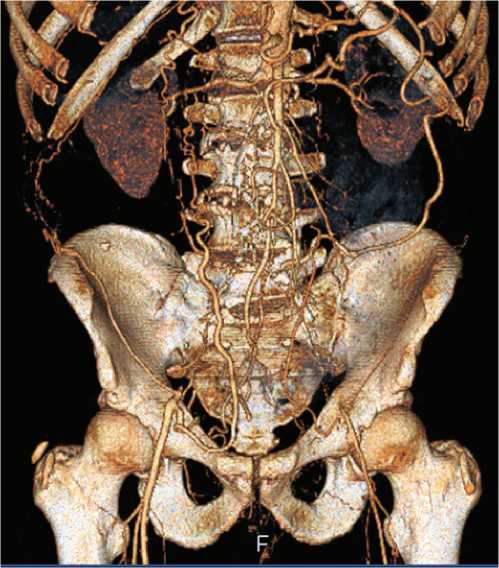
Рис. 1. МСКТ – ангиография субренальной окклюзии аорты и подвздошных артерий
Операции в 1 и 2 группе выполнялись под эндотрахеальным наркозом, в ходе лапаротомии (длиной 27-30 см в 1-й группе и 8-14 см – во 2-й группе), выделялся субренальный отдел аорты и устья почечных артерий, выполнялась перевязка аорты над бифуркацией в 1-й группе, либо полное поперечное пересечение во 2-й (рис. 2); тромбэктомия с формированием проксимального анастомоза бифуркационного протеза соответственно конец-в-конец или конец-в-бок. Бранши протеза проводились забрюшинно к доступам на бедрах, где формировались дистальные анастомозы с общими бедренными артериями.
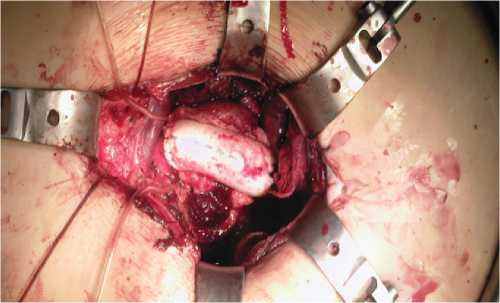
Рис. 2. Протезирование аорты из минилапаротомного доступа
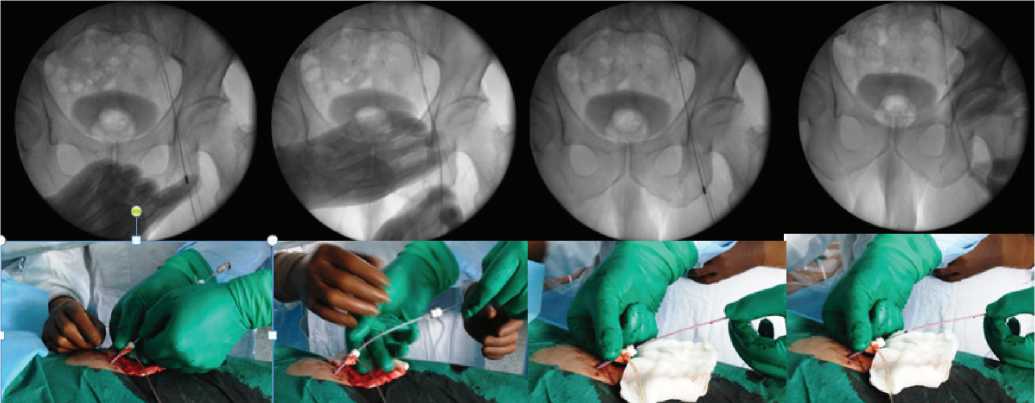
Рис. 3. Экстернализация гидрофильного проводника
Операции в 3-й группе выполнялись у 3 из 4 больных под спинномозговой анестезией, начинались с пункции и катетеризации плечевой артерии, проведением катетера в нисходящую и брюшную аорту, антеградной реканализации инфраре-нальной аорты и левой подвздошной артерии с использованием гидрофильного 0,035 проводника HiWi («COOK», США) ретроградной пункции левой и правой общей бедренных артерий (в 3 из 4 случаев) под ультразвуковым наведением.
Экстернализация проводника, необходимая для усиления поддержки и сохранения просвета реканализированного сегмента, потребовалась у 3 из 4 пациентов и проводилась путем проведения гидрофильного проводника под рентгеноскопическим контролем через ретроградно установленный интродьюсер диаметром 7 French и коаксильно проведенный в его клапан интро-дьюсер диаметром 5 French (рис.2), ретриверы не использовались.
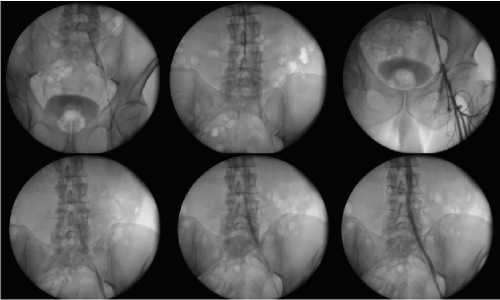
Рис. 4. Ангиографическое изображение этапов реканализации аорты и подвздошной артерии
В дальнейшем проводилась замена проводника на жесткий диагностический, баллонная ангиопластика, последовательная имплантация нитиноловых стентов и их постдилатация.
Ретроспективно были проанализированы особенности вмешательства, длительность пребывания в отделении реанимации, объем крово-
Таблица 2
|
Группа |
П/о - к/д (средн.) |
АРО, час (средн.) |
Крово-потеря, мл (сред.) |
Гемотрансфузия (средн.) мл |
|
1 группа (4) |
13-21 (15,5) |
16-288 (84) |
500-2000 (950) |
0-1500 (950) |
|
2 группа (5) |
10-17 (13,4) |
15-17 (16) |
300-1200 (710) |
0-640 (313) |
|
3 группа (4) |
5-7 (6) |
4-6 (4,8) |
0-200 (125) |
0 |
Таблица 3
|
Пациент |
ХИНК, ст. |
Бифуркация |
Рост, см |
Количество ВО и диаметр стентов |
|
№ 1 |
III |
- |
176 |
3: 10,9, 8 мм |
|
№ 2 |
II Б |
да |
178 |
4: 10, 9, 8 мм |
|
№ 3 |
III |
да |
172 |
4: 12,10, 9 мм |
|
№ 4 |
IV |
- |
188 |
4: 12, 10, 9, 8 мм |
потери, гемотрансфузии, длительность госпитализации после операции, отдаленная проходимость, повторные вмешательства.
Результаты и обсуждения
Течение периоперационного периода отличалось во всех группах.
У одного из пациентов 1-й группы в связи с прорезыванием швов возникло кровотечение, потребовавшее массивных гемотрансфузий и длительного пребывания в анестезиологореанимационном отделении (АРО). У пациентов 2-й группы функция кишечника восстанавливалась самостоятельно на вторые сутки, в то время как у большинства (3 из 4) больных 1-й группы требовалась полная его стимуляция на 2-3 сутки. Пребывание пациентов 3-й группы было менее продолжительным и обуславливалось необходимостью ликвидации спинального блока. У одного пациента 2-й группы с ХОБЛ возникла пневмония в послеоперационном периоде, потребовавшая антибактериальной терапии в течение 7 суток. Послеоперационный койко-день (П/о к/д), пребывание в АРО, кровопотеря, объем гемотрансфузии отражены в таблице 2.
В ходе операций в 3-й группе, в 2-х случаях из 4-х, помимо аорты была реканализирована только левая подвздошная артерия (1 – запланировано, 1 – из-за невозможности ретроградной реканализации), имплантировались нити-ноловые стенты, рентгеноконтрастный препарат вводился вручную в объеме 250-320 мл, не отмечено нарушения функции почек и местных осложнений в местах доступов (гематом). Особенности вмешательств в этой группе отражены в таблице 3.
У всех пациентов ишемия была купирована. Проходимость реконструированных сегментов контролировалась ультразвуковым дуплексным сканированием при выписке, а также через 3, 6 и 12 месяцев, затем – по клиническим показаниям. 2 пациентам из 3-й группы для уточнения результатов стентирования выполнялась контрольная МСКТ – ангиография (рис. 5).
Пациенты 1-й и 2-й групп принимали вар-фарин (4 из 9) или препараты ацетилсалициловой кислоты. Пациентам 3-й группы назначалась стандартная двойная антиаггрегантная терапия на 6 месяцев с последующим переходом на аспирин.
В 1-й группе в сроки наблюдения 39-60 месяцев (средн. – 54,8): 1 пациент дважды (через 32 и 43 месяца после первой операции) оперирован по поводу тромбоза протеза аорты на фоне пароксизмальных нарушений ритма, с третьим
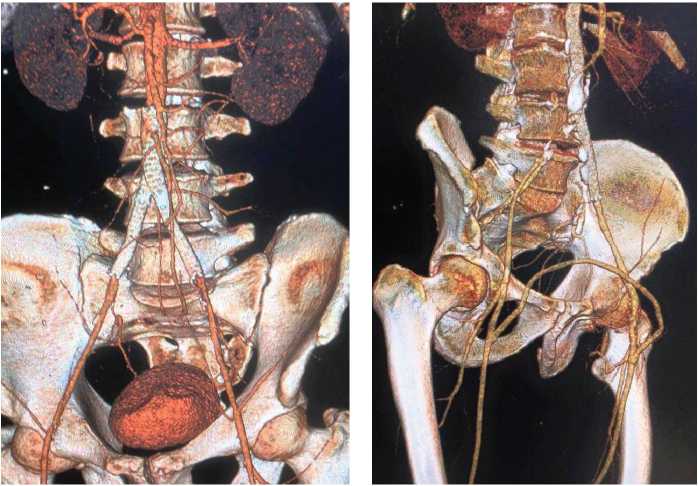
Рис. 6. Результат реканализа ции и унилатерального стентирования аорты и левой подвздошной артерии и отсроченного перекрестного бедренно-бедренного аутовенозного шунтирования
Рис. 5. Результат реканализации и бифуркационного стентирования аорты повторным тромбозом и рецидивом ишемии конечности; 1 пациент скончался от инфаркта миокарда чрез 3 года после операции на аорте.
Во 2-й группе в сроки наблюдения от 3 до 60 месяцев (средн. – 31,8) 1 пациент оперирован по поводу острой спаечной тонкокишечной непроходимости через 6 месяцев после операции из мини-доступа.
В 3-й группе в сроки наблюдения от 3 до 37 месяцев (средн. – 19,3): 1 пациент сразу после выписки самостоятельно прекратил прием анти-аггрегантов и через 35 дней был экстренно госпитализирован с рецидивом критической ишемии и реокклюзией аорты и левой подвздошной артерии. Ему была успешно выполнена эндоваскулярная операция – баллонная ангиопластика, регионарный тромболизис с восстановлением просвета сосудов; 1 пациенту через 18 месяцев после реканализации и стентирования аорты и левой подвздошной артерии планово выполнено перекрестное бедренно-бедренное аутовенозное шунтирование слева-направо по поводу хронической ишемии правой нижней конечности II Б ст. (рис. 6).
Заключение. Первый опыт эндоваскулярного лечения окклюзий инфраренального отдела брюшной аорты показал высокий процент технического успеха при унилатеральном решении, хорошие непосредственные и среднеотдаленные результаты, отсутствие кровопотери, нарушений функции почек, короткий период пребывания пациента в отделении реанимации и стационара, возможность выполнения повторных опе- раций и реализации гибридного подхода. Отмечена необходимость строгого соблюдения схемы приема двойной антиаггрегантной терапии. Использование саморасширяющихся нитиноло-вых стентов, местной анестезии, наряду с вышеперечисленными особенностями, выгодно отли- чающими от операции открытого протезирования, делает эти операции по-видимому и экономически целесообразными, что требует отдельного анализа. Использование данной методики целесообразно у пациентов с противопоказаниями к общей анестезии.
Список литературы Возможности эндоваскулярного лечения пациентов с окклюзией инфраренального отдела аорты
- R. Leriche. Des obliterations arterielles hautes (obliteration de la terminaiso de l`aorte) comme cause des insuffisances circulatoires des members inferieurs/Bull Mem Soc Chir (Paris) 1923; 49:1404-1406
- Шалимов А.А., Дрюк Н.Ф. Хирургия аорты и магистральных артерий. Киев: Здоровье. 1979. 346 с.
- Покровский А.В. Клиническая ангиология. М.: Медицина, 1979. 400 с.
- Покровский А.В. Клиническая ангиология Т.2: Руководство/Под ред. А.В. Покровского. М.: ОАО «Издательство «Медицина», 2004. 888 с: ил. ISBN 5-225-04857-9
- Покровский А.В., Зотиков А.Е., Перспективы и действительность в лечении атеросклеротических поражений аорты. М.: BGC. 1996 г. 534 c.
- Cuong Lam; Ripal T Gandhi; Geogy Vatakencherry, et al. Iliac Artery Revascularization Overview of Current Interventional Therapies Katzen Interventional Cardiol. 2010;2(6):851-859
- Moise MA, Alvarez-Tostado JA, Clair DG, Greenberg RK, et.al. Endovascular Management of Chronic Infrarenal Aortic Occlusion. J Endovasc Ther. 2009 Feb;16(1):84-92 DOI: 10.1583/08-2526.1


