Возможности магнитно-резонансной томографии сердца и магнитно-резонансной ангиографии магистральных сосудов у детей с транспозицией магистральных сосудов
Автор: Малов А.А., Калиничева Ю.Б., Садыкова Д.И., Красноперова О.В., Петрушенко Д.Ю., Мельникова Ю.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.36, 2021 года.
Бесплатный доступ
Цель исследования: демонстрация возможностей магнитно-резонансной томографии (МРТ) и магнитно-резонансной (МР) ангиографии в комплексном обследовании пациентов с различными типами транспозиции магистральных сосудов (ТМС) на до- и послеоперационном этапах.Материал и методы. Проведено 38 МРТ исследований сердца и сосудов у 33 пациентов с различными формами транспозиции магистральных сосудов.Результаты. Основной целью проведения МРТ после операции артериального переключения при простой форме ТМС было выявление постоперационных осложнений. У 2 пациентов зарегистрированы рубцовые изменения в стенке левого желудочка (ЛЖ), что явилось основанием для проведения коронарографии. По данным коронарографии, значимых стенозов коронарных артерий, требующих оперативного вмешательства, зафиксировано не было. У 6 пациентов после операции артериального переключения отмечено расширение корня аорты в среднем до +2,85 Z-score, что требует дальнейшего динамического наблюдения. Стеноз ветвей легочной артерии (ЛА) за счет применения маневра Lecompte зарегистрирован у 1 пациента. По результатам МРТ проведено зондирование полостей сердца. Инвазивное измерение давления не выявило значимого стеноза и показаний к хирургическому лечению. МРТ у пациентов с корригированной транспозицией магистральных сосудов (КТМС) применялась в качестве одного из критериев готовности к анатомической коррекции, наряду с эхокардиографией и зондированием полостей сердца.Заключение. МРТ и МР-ангиография являются «золотым стандартом» в пред- и послеоперационном обследовании пациентов с различными формами ТМС. При использовании МР-ангиографии возможно проведение морфометрии, уточнение взаиморасположения сосудов, в том числе после коррекции ТМС. МРТ в большинстве случаев позволяет корректно дифференцировать морфологию камер сердца, их взаимное расположение, а также дает возможность провести волюметрию, оценить параметры локальной и глобальной сократительной функции желудочков, что играет важнейшую роль в предоперационной оценке и динамическом наблюдении на всех этапах коррекции порока.
Транспозиция магистральных сосудов, врожденные пороки сердца, магнитно-резонансная томография, магнитно-резонансная ангиография
Короткий адрес: https://sciup.org/149136646
IDR: 149136646 | УДК: 616.12/.13-073.86-073.756.8-053.2 | DOI: 10.29001/2073-8552-2021-36-2-115-122
Текст научной статьи Возможности магнитно-резонансной томографии сердца и магнитно-резонансной ангиографии магистральных сосудов у детей с транспозицией магистральных сосудов
Морфологическим субстратом транспозиции магистральных сосудов (ТМС) является дискордантное желудочково-артериальное соединение. При этом характер соединения предсердий с желудочками может быть как обычным (предсердно-желудочковая конкордантность), так и дискордантным (сочетание предсердно-желудочковой и желудочково-артериальной дискордантности). При изолированной желудочково-артериальной дискордант-ности формируется один из самых распространенных цианотических врожденных пороков сердца (ВПС), наиболее известный как D-ТМС [1]. Различают простую (в сочетании с открытым артериальным протоком и открытым овальным окном) и сложную формы ТМС (в сочетании с дефектом межжелудочковой перегородки – ДМЖП, стенозом легочной артерии – ЛА, коарктацией аорты и другими ВПС и сосудов) [2]. Вследствие того, что аорта отходит от анатомически правого желудочка (ПЖ), а легочной ствол – от анатомически левого желудочка (ЛЖ), малый и большой круги кровообращения разомкнуты и функционируют не последовательно, а параллельно [3]. Такая циркуляция крови может быть совместимой с жизнью ребенка при наличии шунта на уровне желудочков, предсердий или магистральных сосудов [4]. При сочетании предсердно-желудочковой и желудочково-артериальной дискордантности формируется корригированная транспозиция магистральных сосудов (КТМС), также известная как L-ТМС. При этом морфологически левое артериальное предсердие через трикуспидальный клапан соединяется с морфологически правым желудочком (мПЖ), от которого отходит аорта, располагаясь слева и спереди от легочного ствола. В свою очередь морфологически правое венозное предсердие посредством митрального клапана соединяется с право расположенным морфологически левым желудочком (мЛЖ), от которого отходит ЛА [5]. Системный венозный кровоток из правого предсердия через митральный клапан попадает в мЛЖ, а легочной венозный кровоток поступает из левого предсердия через трикуспидальный клапан в мПЖ [6]. При этом в аорту поступает артериальная кровь, а в ЛА – венозная. Таким образом, внешне пациенты с КТМС не имеют симптомов до определенного возраста. Но находясь в системном положении, мПЖ не способен реагировать на возрастающую нагрузку подобно мЛЖ, в результате чего развивается желудочковая дисфункция, а также дисфункция артериального атриовентрикулярного клапана, что приводит к неконтролируемой сердечной недостаточности во второй декаде жизни.
Методом коррекции ТМС является оперативное вмешательство с целью восстановления нормальных желудочково-артериальных и предсердно-желудочковых соединений, создания гемодинамических условий для дальнейшего оптимального функционирования сердечно-сосудистой системы.
Операцией выбора в настоящее время при лечении новорожденных с D-ТМС является артериальное переключение с использованием приема Lecompte (перемещение легочного ствола на переднюю стенку ПЖ перед аортой) в первые 1–2 нед. жизни [7]. Пациентам с простой формой ТМС и рестриктивным овальным окном рекомендуется баллонная атриосептостомия (процедура Рашкинда), которую проводят сразу после поступления в кардиохирургический центр [8]. Повышение артериального насыщения и восстановление перфузии перифериче- ских органов после атриосептостомии позволяет выбрать срок радикальной операции в пределах 1–2 нед. после рождения. У некоторых детей сочетание пороков может быть более благоприятным (наличие ДМЖП), и паллиативные вмешательства не требуются. Операция артериального переключения и пластики ДМЖП при таком варианте проводится в возрасте 3–4 нед. При сочетании транспозиции магистральных артерий, ДМЖП и стеноза ЛА оперативное лечение выполняется в более старшем возрасте (1–3 года). Существует несколько вариантов коррекции: операция Растелли, при которой поток крови из ЛЖ направляется через внутрижелудочковый тоннель в аорту, а ПЖ сообщается с ЛА через клапансодержащий кондуит [9]; операция Никайдо (транслокация корня аорты) или процедура REV [10, 11].
Немаловажным является и расположение коронарных артерий при ТМС, так как неправильная реимплантация их устьев при артериальном переключении может привести к тяжелой ишемии и некрозу участков миокарда. Среди множества предложенных классификаций в клинике часто используется Лейденская классификация.
Главной проблемой патофизиологии КТМС являются анатомо-физиологические особенности, при которых происходит ремоделирование и снижение сократительной функции ПЖ и, как следствие, развитие трикуспидальной недостаточности [12]. В настоящее время анатомическая коррекция КТМС у детей состоит из комбинации двух хирургических процедур (double switch – двойное переключение): предсердное переключение по методике W. Mustard или A. Senning в сочетании с артериальным переключением. При сопутствующем стенозе/атрезии ЛА операция предсердного переключения сочетается с операцией Растелли или Никайдо. В большинстве случаев перед операцией двойного переключения необходима тренировка мЛЖ для включения его в системное артериальное кровообращение. С этой целью применяют суживание ствола ЛА с последующим проведением операции двойного переключения.
Существует также метод усиленной тренировки мЛЖ, предложенный в 2015 г. P. Zartner (клиника Асклепиос, Германия). Его суть заключается в увеличении предна-грузки на мЛЖ путем создания ДМЖП и стандартном увеличении постнагрузки путем суживания ЛА [13]. Данный метод подготовки применяется в Детской Республиканской клинической больнице Министерства здравоохранения Республики Татарстан с 2016 г. Критериями готовности мЛЖ к операции двойного переключения являются способность его создавать давление более 80% от системного, индекс массы миокарда более 35 г/м2, соотношение индексированной массы мЛЖ к его объему более 1,5, а также синхронное сокращение всех участков мЛЖ с шифтом межжелудочковой перегородки в сторону мПЖ [14]. При значительной дисфункции ПЖ, умеренной гипоплазии ПЖ, а также аномалиях положения и формирования сердца данные операции дополняются созданием двунаправленного кавопульмонального анастомоза Гленна [15].
Пациенты, перенесшие кардиохирургические вмешательства по поводу различных форм транспозиции магистральных сосудов, имеют высокий коэффициент выживаемости (более 90%). В отдаленные сроки большую проблему представляют постоперационные осложнения. К ним относятся дилатация корня аорты, надклапанный стеноз ЛА, стенозы ветвей ЛА, стенозы внутрипредсерд- ных тоннелей, коронарные осложнения, нарушения ритма сердца.
Отсроченная диагностика и хирургическое вмешательство подвергают пациентов повышенному пери- и постоперационному риску. Объем и сроки операции основываются на знании пространственного соотношения магистральных артерий, а также волюметрическом анализе желудочков.
Цель исследования: демонстрация возможностей магнитно-резонансной томографии (МРТ) и магнитно-резонансной (МР) ангиографии в комплексном обследовании пациентов с различными типами ТМС на до- и послеоперационном этапах.
Материал и методы
В Детской Республиканской клинической больнице Министерства здравоохранения Республики Татарстан в течение 2 лет проведено 38 исследований сердца и сосудов у 33 пациентов с различными формами ТМС методом МРТ. В эту группу вошли 14 пациентов с простой формой транспозиции магистральных сосудов после операции артериального переключения, 4 пациента со сложными формами транспозиции до и после радикальной коррекции, а также 15 пациентов с КТМС до операции двойного переключения (табл. 1–3).
Таблица 3. Группа 3. Пациенты с корригированной транспозицией магистральных сосудов
Table 3. Group 3. Patients with congenital corrected transposition of the great arteries
37 мес.
Возраст (медиана) Age (median)
Мальчики/девочки, n
Boys/girls, n
Диагнозы:
Diagnoses:
-
• Изолированная КТМС
-
• КТМС, ДМЖП
-
• КТМС, situs inversus
-
• КТМС, множественные ДМЖП, коарктация аорты
КТМС, ДМЖП, атрезия легочной артерии
Isolated congenitally corrected transposition of the great arteries
-
• congenitally corrected transposition of the great arteries, ventricular septal defect
-
• congenitally corrected transposition of the great arteries, situs inversus
-
• congenitally corrected transposition of the great arteries, multiple ventricular septal defects, aortic coarctation
-
• congenitally corrected transposition of the great arteries, ventricular septal defect, pulmonary atresia
(3 мес.–9 лет) 37 months (3 months –
9 years)
11/4
Таблица 1. Группа 1. Пациенты с простой транспозицией магистральных сосудов после операции артериального переключения
Table 1. Group 1. Patients with simple transposition of the great arteries after arterial switching
Трикуспидальная регургитация 34 ст., %
Tricuspid regurgitation stage 34, %
Фракция выброса мПЖ, %
Ejection fraction of morphologic right ventricle, %
Мальчики/девочки, n
Boys/girls, n
Возраст (медиана), лет
Age (median), years
Прием Лекомпте, %
Lecompte maneuver, %
10/4
8,4
Аномалии коронарных артерий исходно, % Initial anomalies of the coronary arteries, %
26,6
Таблица 2. Группа 2. Пациенты со сложными формами транспозиции магистральных сосудов
Table 2. Group 2. Patients with complex forms of transposition of the great arteries
Мальчики/девочки, n
Boys/girls, n
Возраст, лет 0–16
Age, years
Диагнозы:
-
• ТМС, ДМЖП, стеноз легочной артерии, гипоплазия ЛЖ
-
• Двойное отхождение от ПЖ, ТМС, множественные ДМЖП
-
• Аномалия Тауссиг – Бинга после предсердного переключения, закрытия ДМЖП
-
• ТМС после предсердного переключения
Diagnoses:
-
• transposition of great arteries, ventricular septal defect, pulmonary artery stenosis, left ventricular hypoplasia
-
• Double-outlet right ventricle, transposition of great arteries, multiple ventricular septal defects
-
• Taussig-Bing anomaly after atrial switching, ventricular septal defect closure
-
• transposition of great arteries after atrial switching
Цель МРТ: определение возможности анатомической коррекции The purpose of MRI: to determine the possibility of anatomical correction
Исследования проводились на МР-томографе Toshiba Excelart Vantage-X 1.5T по протоколу. Все исследования у детей раннего возраста выполнялись на фоне медикаментозной седации (ингаляционный наркоз (Се-вофлуран)).
На сегодняшний день существует достаточно большой арсенал методов диагностики ТМС, среди которых все большее значение приобретает МРТ. Быстрое развитие МР-технологий, появление широкого спектра последовательностей и МР-совместимых наркозных аппаратов позволили получать диагностическое изображение и решать традиционные проблемы, которые возникают в области визуализации ВПС у детей и подростков, а именно: минимизация использования ионизирующих видов излучения, особенно при динамическом наблюдении, точная анатомо-морфологическая оценка сложной анатомии порока, включающая сравнительно малые структуры у ребенка при высоких значениях пульса и дыхания.
Для детальной оценки анатомии и функции сердечно-сосудистой системы у пациентов с ТМС используется широкий спектр последовательностей. Визуализация сердечных структур методом МРТ начинается с обзора пространственной ориентации сердца, взаиморасположения магистральных сосудов и камер сердца. С этой целью применяются короткоимпульсные последовательности спинового эха T1W-TSE/T2W-TSE. В полученных изображениях сигнал от текущей крови, как правило, подавляется, а окружающие ткани выглядят в различных оттенках серого цвета. Основное преимущество последовательностей спинового эха меньшая восприимчивость к артефактам, вызванным турбулентным потоком и металлическими имплантатами (в том числе
-
скобами грудины, окклюдерами). TSE представляет собой статическое изображение в конкретную фазу цикла без визуализации движения сердечной мышцы, тока крови и обычно используются для анатомической визуализации порока [16].
Другим наиболее часто используемым режимом визуализации порока является SSFP (steady-state free precession, GRE), применяемый в стандартных плоскостях исследования сердца. В GRE-последовательности кровь выглядит яркой. Режим SSFP обеспечивает более высокий контраст между полостью и миокардом по сравнению со стандартным спиновым эхом. Импульсная последовательность градиентного эхо в кинорежиме (cine) с электрокардиографической синхронизацией позволяет оценить объем желудочков (конечный диастолический/ систолический объемы, фракцию выброса и массу), что особенно актуально при сложном ремоделировании [17] (рис. 1). Кроме того, визуализация в различных плоскостях в последовательности SSFP дает дополнительную информацию о пространственных соотношениях сердца и окружающих структур на постоперационном этапе наблюдения пациентов с ТМС, особенно при возникновении осложнений (например, при обструкции кондуита). Ограничением для использования изображений SSFP является чувствительность к артефактам, вызванным дыханием, турбулентным током крови и металлическими имплантатами (внутрисердечными стентами или имплантатами клапанов) [18].
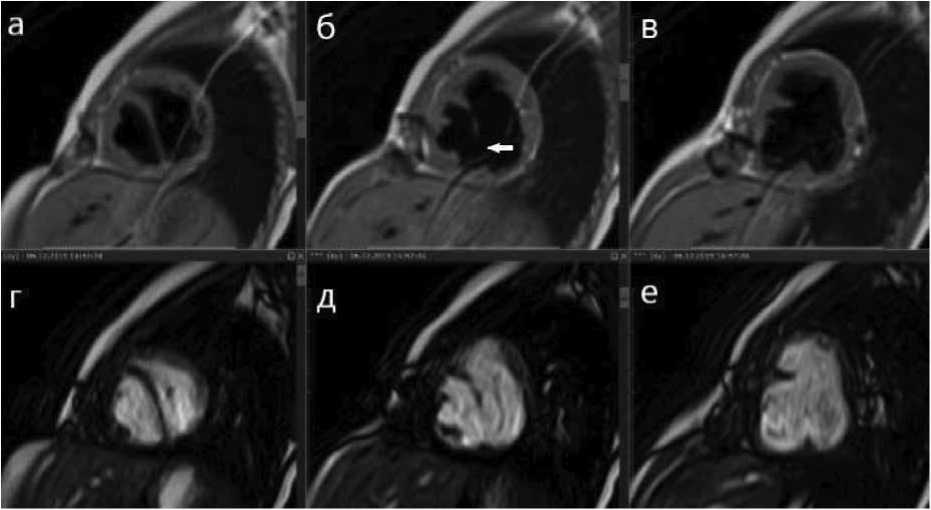
Рис. 1. Серия срезов по короткой оси сердца в режиме T1-TSE (а, б, в ) и SSFP ( г, д, е ) пациента с корригированной транспозицией магистральных сосудов. Стрелкой отмечен крупный дефект межжелудочковой перегородки мышечной части
Fig. 1. A series of sections along the short axis of the heart in the T1-TSE ( а, б, в ) and SFP ( г, д, е ) modes in patient with corrected transposition of the great arteries. The arrow indicates a large atrial septal defect of the muscular part
В оценке структуры и гемодинамики ТМС существенную роль играет МР-ангиография. Существует 2 основных ангиографических методики – бесконтрастная МР-ангиография (TOF, времяпролетная) и методика с применением контрастных веществ.
Преимуществом методики TOF является высокое разрешение 2D- и 3D-изображений сердца и сосудов без применения контрастных веществ [19]. Построение изображения при бесконтрастной ангиографии чаще формируется с помощью последовательности SSFP с использованием двойной ЭКГ- и дыхательной синхронизации. Используя толщину среза 0,8–1 мм, возможно визуализировать анатомию коронарных артерий, а также достаточно точно оценить взаимоотношение камер сердца, магистральных сосудов и септальных дефектов (рис. 2). Основными недостатками, препятствующими широкому применению данной методики, являются сложность получения ритмичного, равномерного по глубине дыхания у детей, чувствительность последовательности к направлению и турбулизации потоков крови.
Традиционно для контрастной МР-ангиографии используют парамагнетики на основе гадолинии, улучшающие пространственную визуализацию сосудов с использованием программ отслеживания болюса контрастного вещества (Visual Prep). МР-ангиография позволяет получать изображения и выполнять морфометрию аорты, ЛА и вен. Пакет 3D данных может быть отформатирован для получения 2D-срезов в любой ориентации или объемно визуализированы в 3D-изображение с толщиной среза 1–1,5 мм (рис. 3). К недостаткам методики можно отнести артефакты металлических стентов и протезов сосудов, затрудняющих визуализацию просвета, чувствительность к дыхательным артефактам, сложность анализа камер сердца в отсутствие ЭКГ-синхронизации, возможные осложнения и противопоказания к введению контрастных веществ.
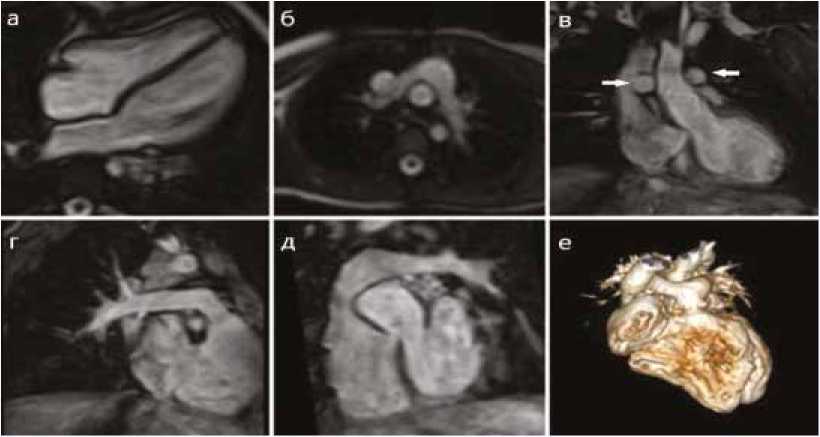
Рис. 2. TOF-ангиография с 3D-реконструкцией изображения ( е ), демонстрирующая аорту и ветви легочной артерии пациента с транспозицией магистральных сосудов после операции артериального переключения с маневром Lecompte
Fig. 2. Time of flight angiography-angiography with 3D reconstruction of the image ( e ) showing the aorta and branches of the pulmonary artery in patient with transposition of the great vessels after arterial switch operation with the Lecompte maneuver
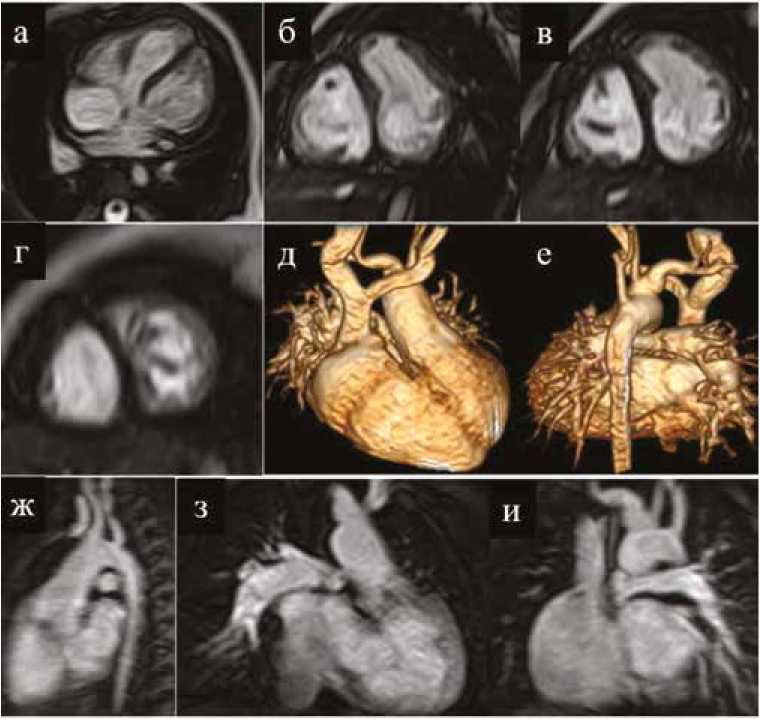
Рис. 3. 4-камерная проекция и серия срезов по короткой оси сердца в кинорежиме SSFP ( а, б, в, г ) пациента с корригированной транспозицией магистральных сосудов, атрезией легочной артерии 1-го типа, дефект межжелудочковой перегородки. Состояние после создания системно-легочного анастомоза. Контрастная магнитно-резонансная ангиография ( д, е, ж, з, и ) с 3D-реконструкцией, демонстрирующая аорту и ветви легочной артерии
Fig. 3. Four-chamber projection and a series of sections along the short axis of the heart in the SSFP movie mode ( а, б, в, г ) of a patient with Corrected TGA, type 1 LA atresia, and ASD. The condition after the creation of a systemic-pulmonary artery anastomosis. Contrast MR angiography ( д, е, ж, з, и ) with 3D reconstruction showing the aorta and branches of the pulmonary artery
Методика отсроченного контрастирования (Late gadolinium enhancement – LGE) является важным компонентом в постоперационном наблюдении за пациентами с ТМС. На изображениях, полученных с применением LGE, можно визуализировать зоны фиброза (рубца), возникшие как осложнение после реимплантации коронарных артерий при артериальном переключении (тромбоэмболические осложнения, интраоперационные повреждения артерий) или наличие сопутствующих коронарных аномалий, свойственных ТМС [20]. Повышение контрастного вещества с использованием препаратов гадолиния основано на укорочении времени T1W и распределении контрастного вещества внутри ткани. Механизм раннего и позднего усиления связан с различной кинетикой вымывания гадолиния из внеклеточного пространства нормального миокарда и рубцовой ткани. На изображениях, полученных при использовании методики отсроченного контрастирования, зоны рубца выглядят как зоны позднего усиления гадолиния на фоне темного здорового миокарда.
Результаты
У 2 пациентов зарегистрированы рубцовые изменения в стенке ЛЖ, что явилось основанием для проведения коронарографии, по данным которой значимых стенозов коронарных артерий, требующих оперативного вмешательства, выявлено не было. Изменения, определенные на МРТ, были трактованы как результат острого повреждения миокарда в раннем послеоперационном периоде. У 6 пациентов после операции артериального переключения отмечено расширение корня аорты в среднем до +2,85 Z-score, что требует дальнейшего динамического наблюдения. Стеноз ветвей ЛА за счет применения маневра Lecompte определен у 1 пациента. По результатам МРТ проведено зондирование полостей сердца. Инвазивное измерение давления не выявило значимого стеноза и показаний к хирургическому лечению. Проводится динамическое наблюдение.
Для 3 из 4 пациентов группы 2 со сложными формами ТМС была показана возможность выполнения анатомической коррекции.
МРТ у пациентов группы 3 (КТМС) применялась в качестве одного из критериев готовности к анатомической коррекции наряду с эхокардиографией и зондированием полостей сердца (табл. 4).
Дооперационная МР-диагностика проводилась с целью определения объема, сократимости и массы миокарда желудочков (использовались последовательности SSFP, TSE).
Таблица 4. Результаты магнитно-резонансной томографии у пациентов с корригированной транспозицией магистральных сосудов
Table 4. MRI results in patients with congenitally corrected transposition of the great arteries
Всего выполнено исследований Total studies completed
Модифицированная тренировка мЛЖ Modified training of the morphologic left ventricle МРТ до и после модифицированной тренировки мЛЖ
MRI before and after modified training of the morphologic left ventricle
Время после модифицированной тренировки мЛЖ
Time after modified training of the morphologic left ventricle
Результаты Results
Индекс массы миокарда (медиана) мЛЖ, г/м2 Morphologic left ventricle myocardial mass index (median), g/m2
Индекс объема мЛЖ (медиана), мл/м2
Morphologic left ventricle volume index (median), mL/m2
Трикуспидальная регургитация 12 ст.
Tricuspid regurgitation stage 12
Шифт межжелудочковой перегородки в сторону мПЖ
Shift of interventricular septum towards the morphologic right ventricle
Фракция выброса мПЖ
Morphologic right ventricle ejection fraction
20 исследований
20 studies
11 пациентов
11 patients
16 исследований
16 studies
14 мес.
14 months
10 пациентов (91%)
10 patients (91%)
10 пациентов (91%)
10 patients (91%)
55%
После проведения серии обследований, одним из основных составляющих которых является МРТ сердца, операция двойного переключения выполнена 8 пациентам (5 случаев – в Детской Республиканской клинической больнице Министерства здравоохранения Республики Татарстан).
Заключение
МРТ и МР-ангиография являются «золотым стандартом» в пред- и послеоперационном обследовании пациентов с различными формами ТМС. При использовании МР-ангиографии можно провести морфометрию, уточнить взаиморасположение сосудов, в том числе после коррекции ТМС. МРТ в большинстве случаев позволяет корректно дифференцировать морфологию камер сердца, их взаимное расположение, а также провести волю-метрию, оценить параметры локальной и глобальной сократительной функции желудочков, что играет важнейшую роль в предоперационной оценке и динамическом наблюдении на всех этапах коррекции порока.
Список литературы Возможности магнитно-резонансной томографии сердца и магнитно-резонансной ангиографии магистральных сосудов у детей с транспозицией магистральных сосудов
- O'Byrne M.L., Glatz A.C., Song L., Griffis H.M., Millenson M.E., Gillespie M.J. et al. Association between variation in preoperative care before arterial switch operation and outcomes in patients with transposition of the great arteries. Circulation. 2018;138(19):2119-2129. DOI: 10.1161/ CIRCULATIONAHA.118.036145.
- Chaix M.A., Khairy P. Dextro-transposition of the great arteries: Switching the switch. Transl. Pediatr. 2019;8(5):458-461. DOI: 10.21037/ tp.2019.05.01.
- Frescura C., Thiene G. The spectrum of congenital heart disease with transposition of the great arteries from the cardiac registry of the University of Padua. Front. Pediatr. 2016;4:84. DOI: 10.3389/ fped.2016.00084.
- Files M.D., Arya B. Preoperative physiology, imaging and management of transposition of the great arteries. Semin. Cardiothor. \/asc. Anesth. 2015;19(3):210-222. DOI: 10.1177/1089253215581851.
- Ma K., Qi L., Hua Z., Yang K., Zhang H., Li S. et al. Effectiveness of bidirectional Glenn shunt placement for palliation in complex congenitally corrected transposed great arteries. Tex. Heart Inst. J. 2020;47(1):15-22. DOI: 10.14503/THIJ-17-6555.
- Spigel Z., Ziyad M., Caldarone C. Congenitally corrected transposition of the great arteries: anatomic, physiologic repair, and palliation. Semin. Thorac. Cardiovasc. Surg. Pediatr. Card. Surg. Annu. 2019;22:32-42. DOI: 10.1053/j.pcsu.2019.02.008.
- Morgan C.T., Mertens L., Grotenhuis H., Yoo S.-J., Seed M., Gross-Wort-mann L. Understanding the mechanism for branch pulmonary artery stenosis after the arterial switch operation for transposition of the great arteries. Eur. Heart J. Cardiovasc. Imaging. 2017;18(2):180-185. DOI: 10.1093/ehjci/jew046.
- Slodki M., Axt-Fliedner R., Zych-Krekora K., Wolter A., Kawecki A., Enzensberger C. et al. New method to predict need for Rashkind procedure in fetuses with dextro-transposition of the great arteries. Ultrasound Obstet. Gynecol. 2018;51(4):531-536. DOI: 10.1002/uog.17469.
- Kumar T.K.S. Congenitally corrected transposition of the great arteries. J. Thorac. Dis. 2020;12(3):1213-1218. DOI: 10.21037/jtd.2019.10.15.
- Hazekamp M.G., Nevvazhay T, Sojak V. Nikaidoh vs reparation a l'Etage ventriculare vs Rastelli. Semin. Thorac. Cardiovasc. Surg. Pediatr. Card. Surg. Annu. 2018;21:58-63. DOI: 10.1053/j.pcsu.2017.10.001.
- Hermsen J.L., Chen J.M. Surgical considerations in D-transposition of the great arteries. Semin. Cardiothorac. Vasc. Anesth. 2015;19(3):223-232. DOI: 10.1177/1089253215584195.
- Kutty S., Danfor D.A., Diller G.P., Tutarel O. Contemporary management and outcomes in congenitally corrected transposition of the great arteries. Heart. 2018;104(14):1148-1155. DOI: 10.1136/heart-jnl-2016-311032.
- Chan A., Aijaz A., Zaidi A.N. Surgical outcomes in complex adult congenital heart disease: A brief review. J. Thorac. Dis. 2020;12(3):1224-1234. DOI: 10.21037/jtd.2019.12.136.
- Moe T.G., Bardo D. Long-term outcomes of the arterial switch operation for D-transposition of the great arteries. Prog. Cardiovasc. Dis. 2018;61(3-4):360-364. DOI: 10.1016/j.pcad.2018.08.007.
- Xie L.J., Jiang L., Yang Z.G., Shi K., Xu H., Li R. et al. Assessment of transposition of the great arteries associated with multiple malformations using dual-source computed tomography. PLOS One. 2017;12(11):e0187578. DOI: 10.1371/journal.pone.0187578.
- Muscogiuri G., Suranyi P., Eid M., Szemes A., Griffith L., Pontone G. et al. Pediatric cardiac MR imaging: Practical preoperative assessment. Magn. Reson. Imaging Clin. N. Am. 2019;27(2):243-262. DOI: 10.1016/j.mric.2019.01.004.
- Schicchi N., Secinaro A., Muscogiuri G., Ciliberti P., Leonardi B., Santan-gelo T. et al. Multicenter review: Role of cardiovascular magnetic resonance in diagnostic evaluation, pre-proceduralplanning and follow-up for patients with congenital heart disease. Radiol. Med. 2016;121(5):342-351. DOI: 10.1007/s11547-015-0608-z.
- Zucker E.J. Cross-sectional imaging of congenital pulmonary artery anomalies. Int. J. Cardiovasc. Imaging. 2019;35(8):1535-1548. DOI: 10.1007/s10554-019-01643-4.
- Mitchell F.M., Prasad S.K., Greil G.F., Drivas P., Vassiliou V.S., Raphael C.E. Cardiovascular magnetic resonance: Diagnostic utility and specific considerations in the pediatric population. World J. Clin. Pediatr. 2016;5(1):1-15. DOI: 10.5409/wjcp.v5.i1.1.
- Valsangiacomo Buechel E.R., Grosse-Wortmann L., Fratz S., Eichhorn J., Sarikouch S., Greil G.F. et al. Indications for cardiovascular magnetic resonance in children with congenital and acquired heart disease: An expert consensus paper of the Imaging Working Group of the AEPC and the Cardiovascular Magnetic Resonance Section of the EACVI. Eur. Heart J. Cardiovasc. Imaging. 2015;16(3):281-297. DOI: 10.1093/ehjci/jeu129.


