Возможности магнитно-резонансной томографии сердца в дифференциальной диагностике острого коронарного синдрома у пациентов с необструктивным атеросклерозом коронарных артерий
Автор: Гомбоева Саяна Баировна, Рябов Вячеслав Валерьевич, Шелковникова Татьяна Александровна, Усов Владимир Юрьевич, Баев Андрей Евгеньевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.32, 2017 года.
Бесплатный доступ
Цель исследования: оценить возможности магнитно-резонансной томографии (МРТ) сердца в дифференциальной диагностике острого коронарного синдрома (ОКС) у пациентов с необструктивным коронарным атеросклерозом (НОКА). Материал и методы. Проводимое исследование нерандомизированное, открытое, контролируемое. Зарегистрировано на ClinicalTrials.gov: NCT02655718. Мы представляем результаты субанализа исследования, который включает данные пациентов с ОКС, госпитализированных в отделение неотложной кардиологии (ОНК) в 2015-2016 гг. Критерии включения: 1. Клиника ОКС. 2. НОКА (нормальные коронарные артерии / атеросклеротические бляшки
Острый коронарный синдром, необструктивный коронарный атеросклероз, магнитно-резонансная томография сердца
Короткий адрес: https://sciup.org/14920297
IDR: 14920297 | УДК: 616-12-008.
Текст научной статьи Возможности магнитно-резонансной томографии сердца в дифференциальной диагностике острого коронарного синдрома у пациентов с необструктивным атеросклерозом коронарных артерий
Актуальность
Ранняя инвазивная стратегия лечения пациентов с ОКС выявила проблему увеличения частоты обнаружения клинических случаев, в которых морфологическим субстратом ОКС является невыраженный атеросклероз коронарных артерий или его отсутствие [1–3]. Согласно результатам мета-анализа 28 публикаций, распространенность этих случаев составляет 6% (95% CI, 5–7%) [4].
Эксперты Европейского общества кардиологов предлагают ввести понятие Myocardial infarction with nonobstructive coronary atherosclerosis – MINOCA, которое является “рабочим” диагнозом, аналогично понятию сердечной недостаточности – ОКС. Предпосылкой к внедрению данного определения явилась необходимость дообследования пациентов для выявления ведущих причин развития ОКС при НОКА [5]. Механизмы развития MINOCA могут быть как кардиальными, так и некардиальными, и требуют специфического лечения [6–7].
Высокая разрешающая способность МРТ сердца и возможность оценки функционального и структурного состояния миокарда позволяют говорить о высокой диагностической значимости его применения в дифференциальной диагностике ОКС у пациентов с НОКА и расценивать МРТ сердца как виртуальную биопсию миокарда [8].
В настоящее время усовершенствование методик визуализации МРТ сердца выявляет основные патофизиологические процессы в миокарде: отек, гиперемию и фиброз, что позволяет дифференцировать ишемические, воспалительные и генетические заболевания сердца [8].
Цель проводимого исследования: оценить возможности МРТ сердца в дифференциальной диагностике ОКС у пациентов с НОКА.
Материал и методы
Исследование утверждено локальным этическим комитетом НИИ кардиологии, Томский НИМЦ РАН, протокол №139 от 18.11.2015 г. Пациенты, включенные в исследование, подписали добровольное информированное согласие.
В проводимое исследование включены пациенты с клиникой ОКС [9] и НОКА (нормальные коронарные артерии / атеросклеротические бляшки <50%), подтвержденным инвазивной КАГ, старше 18 лет на момент рандомизации. Больные с ранее проведенной реваскуляризацией коронарных артерий были исключены из исследования.
Определены первичные конечные точки: госпитальная летальность, ОИМ [6], нестабильная стенокардия [9], синдром Такоцубо [10] и миокардит [11]. Смерть, рецидив инфаркта, инсульты, развитие сердечной недостаточности и повторные госпитализации в течение 6 мес. после выписки из стационара определялись как вторичные конечные точки.
Всем пациентам проводилась КАГ с целью оценки атеросклеротического повреждения коронарного русла, динамическое измерение количественного/качественного тропонина I, КФК, КФК–МВ с целью оценки закономерной динамики снижения кардиоспецифических ферментов.
Исследования сердца выполнялись на магнитно-резонансном томографе Vantage Titan (Toshiba) 1,5 Тл с ЭКГ-синхронизацией и получением изображений миокарда по короткой и длинной осям до и после введения контрастного препарата. Срезы выполнялись от верхушки до основания сердца толщиной 8 мм. Протокол МРТ-иссле-дования включал использование Т1-, Т2-взвешенных последовательностей и последовательности с подавлением сигнала от жировой ткани для визуальной оценки состояния миокарда (наличие области отека, жировой перестройки и т.д.), динамических SSFP последовательностей с задержкой дыхания для функционального исследования сердца, оценки его региональной и общей сократимости. Для определения характера контрастирования миокарда использовалась градиентная последовательность “инверсия–восстановление” (GR–IR) c получением изображений сердца в 2-, 4-камерных проекциях через 8–20 мин после внутривенного введения контрастного препарата.
Анализ полученных результатов проводился в программе STATISTICA 10. Сравнение между группами проводилось с использованием U-критерия Манна–Уитни и точного критерия Фишера. Значение р ≤ 0,05 рассматривалось как статистически значимое.
|
Таблица 1 Клиническая характеристика пациентов |
|||
|
Показатели |
Всего |
ОКСпST |
ОКСбпST |
|
Количество больных, n (%) |
23(100) |
11(48) |
12(52) |
|
Мужчины, n (%) |
17(73) |
7(41) |
10(59) |
|
Средний возраст, среднее ± стд. откл. |
55,7±9,4 |
54,9±10,4 |
56,5±8,8 |
|
Гипертоническая болезнь, n (%) |
19(83) |
9(47) |
10(53) |
|
Дислипидемия, n (%) |
15(65) |
7(47) |
8(53) |
|
Ожирение, n (%) |
8(35) |
2(25) |
6(75) |
|
Наследственность, n (%) |
8(34) |
4(50) |
4(50) |
|
Курение, n (%) |
12(52) |
4(33) |
8(67) |
|
Сахарный диабет, 2-й тип, n (%) |
3(13) |
1(33) |
2(67) |
|
ХБП, n (%) |
1(4) |
1(100) |
0 |
|
СКФ, среднее ± стд. откл., (мл/мин/1,73 м2) |
70,04±13,9 |
71,1±11,4 |
69±16,3 |
|
Атеросклероз, n (%) |
18(78) |
7(39) |
11(61) |
|
Стенозирующий, n (%) |
1(4) |
0 |
1(100) |
|
Стенокардия в анамнезе, n (%) |
12(52) |
5(42) |
7(58) |
|
Инсульт в анамнезе, n (%) |
2(9) |
0 |
2(100) |
|
Перенесенный ИМ, n (%) |
1(4) |
0 |
1(100) |
|
Врожденный порок сердца, n (%) |
3(13) |
1(33) |
2(67) |
|
Примечание: ХБП – хроническая болезнь почек, СКФ |
скорость клубочковой фильтрации, ОКСпST – |
ОКС с подъемом ST, ОКСбпST – |
ОКС без подъема ST. |
Таблица 2
Характеристика острого коронарного синдрома
|
Показатели |
Всего |
ОКСпST |
ОКСбпST |
р |
|
Шкала GRACE |
||||
|
Высокий риск, n (%) |
6(26) |
4(67) |
2(33) |
p>0,05 |
|
Средний риск, n (%) |
2(9) |
2(10) |
0 |
p>0,05 |
|
Низкий риск, n (%) |
15(65) |
5(33) |
10(67) |
p>0,05 |
|
Кардиоспецифические маркеры |
||||
|
Повышение ферментов при поступлении, n (%) |
13(57) |
8(62) |
5(38) |
p<0,05 |
|
Нет повышения ферментов при поступлении, n (%) |
10(44) |
2(20) |
8(80) |
|
|
КФК–МВ при поступлении |
Максимум, ед/л |
Минимум, ед/л |
||
|
1930 |
9 |
|||
|
Увеличение КФК–МВ в течение суток n (%) |
3(13) |
2(67) |
1(33) |
p>0,05 |
|
Вч. Тропонин I в течение первых суток |
Максимум, нг/мл |
Минимум, нг/мл |
||
|
7,71 |
0,01 |
|||
|
Повышение тропонина I в течение суток, n (%) |
17(74) |
8(47) |
9(53) |
p>0,05 |
|
Нет повышения тропонина I в течение суток, n (%) |
5(22) |
3(60) |
2(40) |
p>0,05 |
|
Время поступления в стационар от начала симптомов |
||||
|
6 ч от начала симптомов, n (%) |
10(43) |
6(60) |
4(40) |
p>0,05 |
|
6–24 ч, n (%) |
8(35) |
4(50) |
4(50) |
p>0,05 |
|
Более 24 ч, n (%) |
5(22) |
1(20) |
4(80) |
p>0,05 |
|
Инвазивная стратегия |
||||
|
КАГ в течение 2 ч, n (%) |
4(17) |
4(100) |
0 |
p>0,05 |
|
КАГ в течение 24 ч, n (%) |
10(43) |
2(20) |
8(80) |
p>0,05 |
|
КАГ в течение 72 ч, n (%) |
3(13) |
3(100) |
0 |
p>0,05 |
|
КАГ плановая, n (%) |
6(26) |
2(33) |
4(67) |
p>0,05 |
|
ТЛТ на догоспитальном этапе/эффективная, n (%) |
3/1(13/4) |
3/1(100/33) |
0 |
p>0,05 |
|
ТЛТ в стационаре/эффективная, n (%) |
2/2(9/9) |
1/1(50/50) |
1/1(50/50) |
p>0,05 |
|
Результаты коронарной ангиографии |
||||
|
Стеноз менее 50%, n (%) |
5(22) |
4(80) |
1(20) |
p>0,05 |
|
Стеноз менее 30%, n (%) |
6(26) |
2(33) |
4(67) |
p>0,05 |
|
Неизмененные коронарные артерии, n (%) |
12(52) |
5(42) |
7(58) |
p>0,05 |
|
Спазм коронарной артерии, n (%) |
1(4) |
1(100) |
0 |
p>0,05 |
|
Замедление коронарного кровотока выявлено/не выявлено, n (%) |
15/8(65/35) |
5/6(33/75) |
10/2(67/25) |
p>0,05 |
Примечание: КФК МВ – креатинфосфокиназа МВ, Вч. Тропонин I – высокочувствительный тропонин I, NKN – тромболитическая терапия.
Клиническая характеристика пациентов
В 2015–2016 гг. с клиникой ОКС в ОНК было госпитализировано 604 человека. В 23 (3,8%) случаях выявлен НОКА по результатам КАГ. В исследуемой группе пациентов преобладают мужчины – 17 (73%), средний возраст составил 56±9 лет. Клинико-анамнестические характеристики в обеих группах статистически не различались (p ≥ 0,05), таблица 1.
Риск госпитальных сердечно-сосудистых событий и смерти по шкале GRACE низкий у большинства пациентов – 15 (65%), повышение кардиоспецифических ферментов при поступлении отмечено у половины пациентов – 13 (57%). В группе с ОКСпST выявлено статистически значимое повышение уровня кардиоспецифических ферментов при поступлении. 10 (43%) больных госпитализировалось в течение первых 6 ч от начала заболевания, позднее поступление (6–24 ч/ ≥ 24 ч) характерно для пациентов с ОКСбпST – 4 (80%).
По результатам КАГ, интактные коронарные артерии выявлены у половины пациентов – 12 (52%). Замедление коронарного кровотока определялось у 15 (65%), выраженный спазм коронарной артерии до уменьшения просвета сосуда на 75% выявлен у 1 (9%) в группе с ОКСпST (табл. 2).
У пациентов с ОКСпST и ОКСбпST не было статистически значимой разницы в госпитальных исходах ОКС. 22 пациента выписано из стационара, один умер; у половины больных – 13 (56%) диагностирован ОИМ; у 3 (13%) пациентов диагностирована нестабильная стенокардия; псевдокоронарный вариант течения миокардита – у 7 (30%) человек (табл. 3).
Среднее количество дней, через которое проводилась МРТ сердца, от момента развития ОКС составило 10±6 дней (от 3 до 24 дней). Одному пациенту МРТ-исследова-ние не проведено из-за тяжести состояния, обусловлен- ного дыхательной недостаточностью и нестабильностью гемодинамики, второму не удалось выполнить инфузию контрастного вещества (КВ) из-за панической атаки. Среднее значение фракции выброса (ФВ) левого желудочка 59±9%.
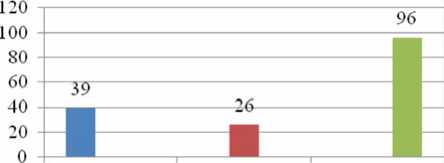
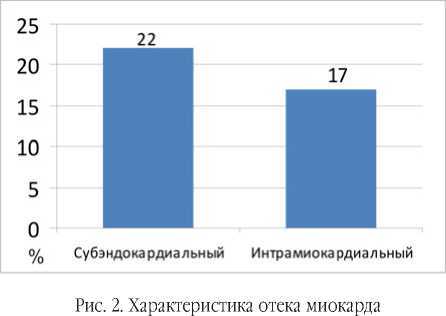
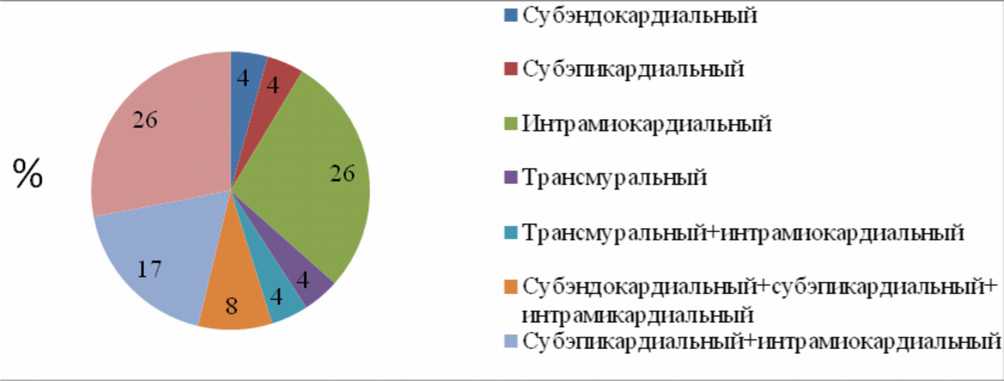
По полученным данным, усиление интенсивности Т2-сигнала, свидетельствующее об отеке миокарда, определяется у 39% человек, накопление контраста в раннюю фазу контрастирования/гиперемия – в 26%, в позднюю фазу/фиброз – в 96% (рис. 1). Субэндокардиальный отек выявлялся в 22%, интрамиокардиальный – в 17%, субэпикардиальный отек не визуализировался (рис. 2). Фиброз миокарда выявлялся в 96% случаев. В четверти случаев определялся интрамиокардиальный (26%) и в четверти случаев – сочетание субэндокардиального и интрамио-кардиального фиброза. В 17% выявлена комбинация субэпикардиального и интрамиокардиального накопления контраста в позднюю фазу контрастирования (рис. 3).
Все пациенты получали стандартную терапию ОКС согласно национальным рекомендациям: двойную дезаг-регантную терапию (100%), бета-адреноблокаторы (96%), статины (91%), ингибиторы ангиотензинпревращающе-го фермента (70%) или сартаны (17%), нефракциониро-ванный гепарин (91%) с последующим переводом на низкомолекулярные гепарины (78%). Необходимость в инотропной поддержке дофамином, внутриаортальной баллонной контрпульсации была у 4% (1) пациентов. Терапия корректировалась согласно результатам клиникоинструментального исследования.
Обсуждение
В группе исследуемых больных распространенность НОКА составляет 3,8%, что несколько ниже результатов мета-анализа 28 публикаций, где распространенность
Таблица 3
Диагноз больных при выписке из стационара
|
Показатели |
Всего |
ОКСпST |
ОКСбпST |
p |
|
Пациенты, n(%) |
23(100) |
11(48) |
12(52) |
|
|
ОИМ, n (%) |
13(56) |
7(54) |
6(46) |
p>0,05 |
|
С подъемом ST, n (%) |
5(22) |
5(100) |
о |
|
|
Без подъема ST, n (%) |
8(35) |
2(25) |
6(75) |
|
|
Нестабильная стенокардия, n (%) |
3(13) |
1(33) |
2(67) |
p>0,05 |
|
Миокардит, n (%) |
7(30) |
3(43) |
4(57) |
p>0,05 |
|
Псевдокоронарный вариант, n (%) |
7(30) |
3(43) |
4(57) |
|
|
Миокардит+ возможный АФС, n (%) |
2(9) |
2(100) |
0 |
|
|
ОИМ + миокардит, n (%) |
1(4) |
1(100) |
0 |
|
|
Миокардит + ТЭЛА, n (%) |
1(4) |
0 |
1(100) |
|
|
Миокардит + ФП, n (%) |
2(9) |
0 |
2(100) |
|
|
Врожденный порок сердца, n (%) |
3(13) |
1(33) |
2(67) |
p>0,05 |
|
Смерть, n (%) |
1(4) |
1(100) |
0 |
p>0,05 |
|
ТЭЛА, n (%) |
1(4) |
0 |
1(8) |
p>0,05 |
|
Гипертоническая болезнь, n (%) |
21(91) |
10(48) |
11(52) |
p>0,05 |
|
Тромбоз вен нижних конечностей, n (%) |
1(4) |
0 |
1(100) |
p>0,05 |
|
Рак легких, n (%) |
1(4) |
1(100) |
0 |
p>0,05 |
Примечание: АФС – антифосфолипидный синдром, ТЭЛА – тромбоэмболия легочной артерии, ФП – фибрилляция предсердий.
У сипение ПС в Накоппениев Накоппениев Т2-ВПотек EGE гиперемия LGE/фпброз
Рис. 1. Характеристика МРТ сердца
■ Субэндокардиальный
■ Субэпикардиальный
■ I 1нтр ам! юкард! 1ал ьнып
■ Трансмуральный
■ Трансмур ал ьнып+i играм! юкард! мл ьнып
■ Су бэнд окар Д11ал ьный+су бэт жар Д11альный+
I штрам! жард] ьал ьнып
■ Субэго жар Д11ал ьнып+i шц) акп юкард! мл ьнып
Рис. 3. Характеристика фиброза миокарда
MINOCA составляет 6% (ДИ 95%, 5–7%). Средний возраст больных составил 56±9 лет, что сопоставимо с данными S. Pasupathy et al., 2015. Доля женщин составила 27%, что ниже ранее полученных данных – 40% [4].
По результатам сравнительных исследований, которые включали пациентов с MINOCA и ИМ и обструктивным коронарным атеросклерозом (ОКА), выявлено, что пациенты с MINOCA менее склонны к дислипидемии по сравнению с пациентами с ИМ с ОКА: 21% (95% доверительный интервал, 6–35%) против 32% (95% доверительный интервал, 30–59%) соответственно. Другие сердечно-сосудистые факторы, в том числе артериальная гипертензия, сахарный диабет, курение, отягощенный семейный анамнез сходны в группах с MINOCA и ИМ ОКА [4]. По результатам мета-анализа G.M. De Ferrari et al. (2014), пациенты с MINOCA реже страдали сахарным диабетом, заболеваниями периферических сосудов или ишемической болезнью в анамнезе, что соответствует полученным данным: стенокардии (52%), перенесенного ИМ (4%), инсультов (9%) [12].
Высокая разрешающая способность, возможность оценки анатомических структур и функционального состояния сердца и миокарда определяют пользу внедре- ния в рутинную клиническую практику МРТ сердца для выявления ведущих причин развития ОКС у пациентов с НОКА. Возможность выявления отека, гиперемии и фиброза миокарда позволяет определить как ишемические, так и неишемические причины повреждения миокарда [13–17].
Повреждение миокарда ишемического генеза характеризуется его отеком и формированием очага некроза, соответствующего бассейну кровоснабжения определенной коронарной артерии [15–17]. Отек миокарда в острую фазу инфаркта может быть визуализирован в виде субэндокардиального усиления интенсивности сигнала в Т2-взвешенных изображениях, определяемым как “myocardium at risk”. Преимуществом этого метода является возможность дифференцировать ОИМ от постинфарктного кардиосклероза. Позднее накопление контраста на Т1-взвешенных изображениях в режиме инверсия– восстановление наблюдается при необратимых изменениях в миокарде – фиброзе/некрозе. Данный феномен позволяет дифференцировать постинфарктный некроз, локализующийся субэндокардиально или трансмураль-но (рис. 4), от фиброза неишемического генеза, при котором отмечается интрамуральное или субэпикардиаль-
MPT критерии ИМ:
-
> Локальное усиление Т2-сигнала/отек (позволяет дифференцировать ОИМ от перенесенного)
-
> Субэндокардиальное/трансмуральное накопление КВ при позднем контрастировании/ рубец
RSNA, 2013,1383-1412
Рис. 4. Критерии Lake–Louise
Крит ерии Lake-Louise (при выявлении 2 из 3 критериев диагностируется миокардит):
-
1. Локальное /ди(|х|)узнос усиление интенсивности Т2-сигнала/отск (рис. 1)
-
2. Увеличение отношения интенсивности раннего Т1-сигнала от миокарда к сигналу от скелетных мышц /гиперемия
-
3. Повышенное накопление КВ на отсроченных Т1 -взвешенных изображениях/фиброз (рис. 2) Cajorio A.L., Pankuweit S., ArbustiniE, European Heart Journal, 2013: 34 (33): 2636-48.
Рис. 5. МРТ-критерии ИМ ное распределение контраста, или миокардит, при котором регистрируется субэпикардиальное или фокальное контрастирование [8, 13, 14]. При микрососудистой ангиопатии внутри зон накопления контраста может быть ослабление интенсивности сигнала, что вызвано обструкцией капилляров некротизированными клетками [8, 17].
По результатам КАГ у 7 (30%) пациентов выявлены интактные коронарные артерии и увеличение кардио-специфических ферментов. Применение МРТ сердца у этой группы больных позволило определить наличие ишемических изменений в миокарде и поставить диагноз ОИМ 2-го типа. По МРТ сердца визуализировалась картина субэндокардиального усиления Т2-сигнала в сочетании с субэндокардиальным, субэпикардиальным и интрамиокардиальным накоплением контраста в позднюю фазу накопления в 1 (4%) случае.
Раннее накопление контраста субэндокардиально в сочетании с поздним субэпикардиальным и интрамио-кардиальным накоплением отмечено у 1 (4%) пациента, субэндокардиальное и интрамиокардиальное позднее накопление выявлено в 1 (4%) случае, субэндокардиальное позднее контрастирование – в 1 (4%), интрамиокар-диальное позднее накопление КВ – в 2 (8%). У всех этих пациентов имелись некоронарогенные причины повреждения миокарда, такие как пароксизм фибрилляции предсердий, гипертрофия левого желудочка, эритроцитоз в периферической крови, развитие ишемии на фоне коро-нариита в результате миокардита. У одного пациента ОИМ развился на фоне паранеопластического синдрома, подтвержденного на аутопсии.
При повреждении миокарда воспалительного генеза на МРТ выявляется усиление интенсивности Т2-сигнала. Для данного феномена характерно мезо- или субэпикардиальное распределение, и встречается оно только у 7 (30%) пациентов [13, 14]. Раннее накопление КВ на Т1- взвешенных изображениях, локализованное интрамио-кардиально или субэпикардиально, свидетельствует о гиперемии миокарда при острых воспалительных заболеваниях. Согласно разработанным Lake–Louise критериям (рис. 5), наличие 2 из 3 феноменов является диагностическим признаком для миокардита [11]. У 2 (8%) пациентов был выставлен диагноз миокардита на основании МРТ-критериев.
В настоящее время эндомиокардиальная биопсия является “золотым стандартом” диагностики миокардита, позволяя определить патофизиологические процессы в миокарде согласно дополненному определению A.L.P. Caforio еt al., миокардит верифицируется при обнаружении ≥ 14 лейкоцитов в 1 мм2 биоптата, в том числе до 4 моноцитов в 1 мм2, 7 и более CD 3+ T-лимфоцитов в 1 мм2. Однако, принимая во внимание возможные осложнения манипуляции, такие как гемотампонада, нарушения ритма и проводимости сердца, тромбоэмболические осложнения, показания к ее проведению ограничены [11].
По результатам клинико-инструментальных исследований, у 7 (30%) пациентов было подозрение на миокардит. По МРТ сердца визуализировалось интрамиокарди-альное и субэпикардиальное накопление КВ при отсроченном контрастировании у 3 (13%) пациентов, интра-миокардиальное усиление Т2-сигнала в сочетании с инт-рамиокардиальным накоплением КВ в позднюю фазу контрастирования – у 1 (4%); субэндокардиальное и интра-миокардиальное распределение КВ при позднем контрастировании – у 1 (4%); субэндокардиальное усиление Т2-сигнала в сочетании с субэндокардиальным, субэпикардиальным и интрамиокардиальным накоплением в позднюю фазу контрастирования – у 1 (4%); субэндокардиальное усиление Т2-сигнала в сочетании с субэндокардиальным накоплением в раннюю фазу контрастирования и интрамиокардиальным накоплением при отсроченном контрастировании – у 1 (4%) пациента.
По результатам эндомиокардиальной биопсии миокарда у 6 (26%) пациентов подтвержден вирусный миокардит. При иммунногистохимическом исследовании биоптатов миокарда выявлена экспрессия ВПГ-6, цитомегаловируса, энтеровируса и вируса Эпштейна–Барра. У 1 (4%) миокардит не подтвердился, по МРТ сердца у него выявлены признаки ОИМ в сочетании с интрамуральным и субэпикардиальным фиброзом миокарда.
Принимая во внимание полученные данные, есть основание говорить о пользе применения МРТ сердца в дифференциальной диагностике ОКС у пациентов с НОКА.
Выводы
Доля пациентов с ОКС и НОКА, госпитализированных в ОНК с ноября 2015 г. по май 2016 г., составляет 3,8%. Эти больные представляют гетерогенную группу пациентов с ОИМ, миокардитом, ТЭЛА, нестабильной стенокардией, гипертонической болезнью.
Возможности МРТ сердца визуализировать миокард позволяют безопасно применять его в дифференциальной диагностике ОКС у пациентов с НОКА.
Список литературы Возможности магнитно-резонансной томографии сердца в дифференциальной диагностике острого коронарного синдрома у пациентов с необструктивным атеросклерозом коронарных артерий
- Гомбожапова А.Э., Роговская Ю.В., Рябова Т.Р. и др. Случай псевдокоронарного варианта клинического течения воспалительной вирусной кардиомиопатии//Сиб. мед. журн. (Томск). -2015. -Т. 30(4). -С. 60-65.
- Planer D., Mehran R., Ohman E.M. et al. Prognosis of рatients with non-ST-segment-elevation myocardial infarction and nonobstructive coronary artery disease propensity-matched analysis from the acute catheterization and urgent intervention triage strategy trial//Circulation. -2014. -Vol. 7. -P. 285-293.
- Tornvall P., Gerbaud E., Behaghel A. et al. Myocarditis or "true" infarction by cardiac magnetic resonance in patients with a clinical diagnosis of myocardial infarction without obstructive coronary disease//Atherosclerosis. -2015. -Vol. 241(1). -P. 87-91.
- Pasupathy S., Air T.M., Dreyer R.P. et al. Systematic Review of Patients Presenting With Suspected Myocardial Infarction and Nonobstructive Coronary Arteries//Circulation. -2015. -Vol. 131. -P. 861-870.
- Agewall S., Beltrame J.F., Reynolds H.R. et al. ESC working group position paper on myocardial infarction with non-obstructive coronary arteries//Eur. Heart J. - (дата обращения 24.11.2016) DOI: 10.1093/eurheartj/ehw149
- Третье универсальное определение инфаркта миокарда//Рос. кардиол. журн. -2013. -№ 2(100).
- Pasupathy S., Tavella R., Beltrame J.F. The What, When, Who, Why, How and Where of Myocardial Infarction with Non-Obstructive Coronary Arteries (MINOCA)//Circulation. -2016. -No. 80. -P. 11-16.
- Rajiah P., Desai M.Y., Kwon D. et al. MR Imaging of Myocardial Infarction//RSNA. -2013. -P. 1383-1412.
- Roffi M., Patrono C., Collet J.P. et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation //Eur. Heart J. -2015. - DOI: 10.1093/eurheartj/ehv320
- Pilgrim T.M., Wyss T.R. Takotsubo cardiomyopathy or transient left ventricular apical ballooning syndrome: A systematic review//Int. J. Cardiol. -2008. -No. 124(3). -P. 283-292.
- Caforio A.L., Pankuweit S., Arbustini E. et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases//Eur. Heart J. -2013. -No. 34(33). -P. 2636-2648.
- De Ferrari G.M., Fox K.A., White J.A. et al. Outcomes among non-ST-segment elevation acute coronary syndromes patients with no angiographically obstructive coronary artery disease: observations from 37,101 patients//Eur. Heart J. Acute Cardiovasc. Care. -2014. -Vol. 3(1). -P. 37-45.
- Esposito A., Francone M., Faletti R. Lights and shadows of cardiac magnetic resonance imaging in acute myocarditis//Insights Imaging. -2016. -No. 7. -P. 99-110.
- Ferreira V.M., Piechnik S.K., Dall’Armellina E. T1-mapping for the diagnosis of acute myocarditis using CMR//JACC Cardiovasc. Imaging. -2013. -No. 6(10). -P. 1048-1058.
- Herzog B., Greenwood J., Plein S. CMR Pocket Guide, 2013 . -URL: https://www.escardio.org/static_file/Escardio/Subspecialty/EACVI/CMR-guide-2013.pdf (дата обращения 01.12.2016).
- Mulia E., Wicaksono S.H., Kasim M. Role of cardiac MRI in acute myocardial infarction//Med. J. Indones. -2013. -Vol. 22. -P. 46-53.
- Стукалова О.В., Староверов И.И., Жукова Н.А. и др. Магнитно-резонансная томография сердца у больных инфарктом миокарда//Кубанский научн. мед. вестн. -2010. -№ 6. -С. 134-139.


