Возможности merge-методики интраоперационной визуализации при имплантации электрода для постоянной кардиостимуляции в проводящую систему сердца: промежуточные результаты исследования
Автор: Медведь М.С., Рудь С.Д., Труфанов Г.Е., Карпова Д.В., Подшивалова Е.П., Лебедев Д.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.38, 2023 года.
Бесплатный доступ
Введение. Имплантация электрода в проводящую систему сердца (ПСС) на данный момент является наиболее физиологичным методом электрокардиостимуляции. Однако, несмотря на наличие специализированных электродов и систем доставок, доля нецелевых имплантаций весьма существенна. Существует потребность в методике интраоперационной визуализации (МИВ), поскольку контроль положения электрода осуществляется посредством электрофизиологического и флюороскопического методов, чего не достаточно.Цель: оптимизация имплантации электродов в ПСС посредством применения merge-методики интраоперационной визуализации.Материал и методы. В рамках проспективного исследования cформировано 2 группы. Участникам исследуемой группы имплантирован электрод в ПСС (в левую ножку пучка Гиса - ЛНПГ) с использованием оригинальной МИВ, участникам контрольной группы - по классической методике. Всем пациентам после имплантации проведена оценка положения электрода с использованием мультиспиральной компьютерной томографии (МСКТ), трансторакальной эхокардиографии (ЭхоКГ) в раннем послеоперационном периоде, электрокардиографии (ЭКГ). МСКТ до имплантации выполнена пациентам исследуемой группы.Результаты. В рамках исследования полный протокол исследования выполнен у 10 пациентов исследуемой группы и у 10 пациентов контрольной. Всем пациентам исследуемой группы подтверждена имплантация электродов в межжелудочковую перегородку (МЖП) (ЭхоКГ, МСКТ), в ПСС (ЭКГ). Продолжительность операции составила 87,5 [70; 120] мин, время флюороскопии - 225 [125; 421] с. Осложнений, нецелевых имплантаций нет. В контрольной группе продолжительность операции - 100 [100; 110] мин, время флюороскопии - 775 [500; 1230] с; стимуляция ПСС подтверждена у 4 (40%) пациентов; зафиксированы 2 (20%) случая перфорации МЖП, 1 (10%) случай имплантации в область верхушки, 1 (10%) случай интраоперационной дислокации правожелудочкового электрода, 1 (10%) случай гемоперикарда в раннем послеоперационном периоде. Средняя погрешность измерений по данным МИВ в сравнении с КТ: расстояние от эндокарда (левый желудочек -ЛЖ) до электрода - 0,98 ± 0,51 мм; от электрода до кольца трехстворчатого клапана (ТК) - 3,1 ± 0,92 мм. По данным трансторакальной ЭхоКГ, структурно-функциональных изменений ТК, участков локального нарушения сократительной способности миокарда, значимых изменений порогов чувствительности, стимуляции, а также послеоперационных дислокаций электродов у пациентов обеих групп нет.Выводы. Применение merge-методики интраоперационной визуализации при имплантации электрода в ПСС позволяет снизить количество нецелевых имплантаций, время флюороскопии, лучевую нагрузку на оператора, не увеличивая продолжительность операции.
Проводящая система сердца, имплантация электрода, интраоперационная система визуализации
Короткий адрес: https://sciup.org/149143633
IDR: 149143633 | УДК: 616.124.7-089.843:577.352.522:004.923 | DOI: 10.29001/2073-8552-2023-39-3-128-134
Текст научной статьи Возможности merge-методики интраоперационной визуализации при имплантации электрода для постоянной кардиостимуляции в проводящую систему сердца: промежуточные результаты исследования
Medved M.S., Rud S.D., Trufanov G.E., Karpova D.V., Podshivalova E.P., Lebedev D.S. Possibilities of the merge technique for intraoperative imaging in a lead implantation into the cardiac conduction system for permanent cardiac pacing: interim results of the study. The Siberian Journal of Clinical and Experimental Medicine. 2023;39(3):128–134. https://doi. org/10.29001/2073-8552-2023-39-3-128-134.
Электрокардиостимуляция твердо вошла в медицинскую практику как эффективный метод терапии различного рода нарушений ритма. С введением в практику в середине 50-х гг. XX в. имплантируемого трансвенозным доступом электрода продолжительное время имплантацию производили в область верхушки правого желудочка (ПЖ), что было обусловлено отсутствием механизма активной фиксации электрода [1]. Однако уже в 90-е гг. XX в. было доказано, что стимуляция области верхушки приводит к отрицательному инотропному эффекту, что обусловлено явлением диссинхронии, поскольку волна деполяризации достигает левого желудочка (ЛЖ) с неким запозданием [2]. С введением активной фиксации появилась возможность имплантировать электроды практически в любую область сердца, минимизировав риск дислокации. С учетом электрофизиологических особенностей распространения волны деполяризации на желудочки наиболее перспективным для стимуляции, как с точки зрения более физиологичной стимуляции, так и отдаленных результатов, являются базальные отделы межжелудочковой перегородки (МЖП), где проходит ПСС.
В 1992 г. P. Karpawich и соавт. описали метод постоянной стимуляции ПСС, в частности пучка Гиса, на открытом сердце собаки. В 2000 г. P. Deshmukh и соавт. показали возможность проведения постоянной селективной стимуляции ПСС (пучка Гиса) у пациентов с фибрилляцией предсердий (ФП) и нормальной шириной комплекса QRS. Было доказано, что стимуляция МЖП, в частности области локализации пучка Гиса, имеет преимущество по сравнению со стимуляцией верхушки ПЖ [3, 4].
Стимуляция ПСС является перспективным методом кардиостимуляции, поскольку позволяет проводить стимуляцию наиболее физиологично. В настоящее время при данном типе стимуляции электрод должен быть имплантирован в область пучка Гиса либо в проксимальные отделы левой ножки пучка Гиса (ЛНПГ). Необходимо отметить, при сохранной ПСС при имплантации электрода в область пучка Гиса распространение потенциала действия происходит по обеим ножкам пучка Гиса, что является альтернативой полноценной бивентрикулярной стимуляции [5, 6].
Успех проведения стимуляции ПСС во многом зависит от места имплантации электрода: при использовании специализированных систем доставок удается добиться стимуляции проводящей системы более чем в 90% случаев, без использования систем доставки успех имплантации не превышает 50% [7–11]. На данный момент позиционирование электрода осуществляется с использованием специализированных доставок под флюороскопическим и электрофизиологическим контролем [12].
Флюороскопический контроль заключается в контроле положения электрода в стандартных рентгенологических проекциях: прямой (АР), левой косой (LAO 30˚), правой косой (RAO 30˚). Необходимо учитывать, что изображение, получаемое ангиографом, – суммацион-ное, проекция всех теней объемной фигуры на плоскость под различными углами. Ситуация усугубляется тем, что МЖП не образует четкой тени при флюороскопии. В результате может создаться мнимая уверенность в корректной позиции электрода, но фактически электрод может быть имплантирован в парасептальной области или на свободной стенке ПЖ.
Некоторые нефлюороскопические навигационные системы позволяют визуализировать электрод для постоянной кардиостимуляции, а также осуществить с его помощью построение анатомической и активационной карт. Однако с помощью данных систем невозможно построить левожелудочковую поверхность МЖП без использования навигационного электрода и дополнительного артериального бедренного доступа. В связи с этим даже при использовании нефлюороскопической навигации отсутствует возможность определить позицию электрода относительно МЖП: невозможно определить, когда необходимо остановить дальнейшее внедрение электрода в МЖП, что особенно важно при имплантации электрода в область ЛНПГ.
Предприняты попытки улучшения интраоперационной визуализации с помощью интраоперационной транспищеводной эхокардиографии (чреспищеводной – ЧПЭхоКГ). Использование ЧПЭхоКГ позволяет безопасно имплантировать электрод в область МЖП, оценить степень исходной и интраоперационной регургитации на трехстворчатом клапане (ТК), повреждение внутрисердечных структур (хорды, створки клапана). Однако данный метод имеет свои недостатки, к числу которых относится выраженный дискомфорт для пациента, что может с большой вероятностью потребовать седации или даже использования наркоза [13].
Альтернативной методикой в данной ситуации может стать применение «Способа интраоперационной визуализации и контроля положения электрода при имплантации электрода в проводящую систему сердца» (заявка на регистрацию объекта интеллектуальной собственности № 2022108573), основанного на интеграции трехмерной реконструкции сердца, полученной на основе данных компьютерной томографии (КТ) и флюороскопического изображения ангиографа.
Цель: усовершенствование методики имплантации электрода для постоянной электрокардиостимуляции в ПСС с использованием экспериментальной МИВ, основанной на интеграции флюороскопического изображения ангиографа с трехмерной реконструкцией сердца, полученной на основе данных КТ.
Материал и методы
Проспективное рандомизированное исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен локальным этическим комитетом (протокол № 02-21).
Критерии включения пациентов в исследование: наличие показаний для имплантации электрокардиостимулятора (ЭКС); подписанное информированное согласие; достижение возраста 18 лет. Критерии невключения пациентов в исследование: наличие внутрисердечных тромбов; повторные вмешательства; поражение коронарного русла, требующее реваскуляризации; активные воспалительные и аутоиммунные заболевания; наличие противопоказаний для использования рентгеноконтрастных веществ; наличие психических расстройств; женщины в период беременности, родов, грудного вскармливания. Критерии исключения пациентов из исследования: появление аллергических реакций на рентгеноконтрастное вещество; отказ пациента от исследования; смерть пациента. Включение пациентов в исследование проводилось после ознакомления с протоколом исследования, подписания информированного согласия на участие в клиническом исследовании.
В рамках исследования сформированы 2 группы. Минимально допустимый объем выборки, рассчитанный по формуле Лера, составил 10 пациентов. Протокол исследования выполнен у 10 пациентов исследуемой группы и у 10 пациентов контрольной группы. Рандомизация пациентов в группы проведена с помощью генератора случайных чисел. Пациентам исследуемой группы выполнена имплантация электрода в ПСС с использованием МИВ, пациентам группы контроля – по классической методике. Первичная конечная точка: стимуляция ПСС, в частности ЛНПГ. Вторичные конечные точки: нецелевые имплантации электродов, осложнения, продолжительность операции, время флюороскопии. Согласно протоколу исследования, на предоперационном этапе всем пациентам выполнена электрокардиография (ЭКГ) с целью оценки морфологии комплекса QRS, оценки наличия патологии ПСС, а также ЭхоКГ – с целью определения структурно-функциональных особенностей сердца. При выполнении ЭКГ оценены: ритм, ширина QRS, наличие патологии ПСС, при выполнении ЭхоКГ оценены параметры: фракция выброса – ФВ (по Simpson), толщина МЖП, параметры ТК (наличие и степень регургитации, наличие аномалий строения). Пациентам исследуемой группы с целью построения трехмерной реконструкции сердца выполняли КТ сердца с контрастированием на предоперационном этапе. При выполнении КТ добивались превышения степени контрастирования левых камер сердца над правыми не менее, чем 60–70 HU. Во время проведения операции пациентам исследуемой группы были выполнены построение и интеграция сегментированной трехмерной модели сердца (рис. 1) в ангиографический комплекс с созданием маски трехмерной модели на фоне флюороскопического изображения (рис. 2).
На интраоперационном этапе во всех случаях оценены: возможность стимуляции ПСС, порог стимуляции, продолжительность операции, время флюороскопии, число и спектр интраоперационных осложнений. Пациентам исследуемой группы проведена оценка позиции электрода с использованием МИВ (ПЖ, ЛЖ, МЖП).
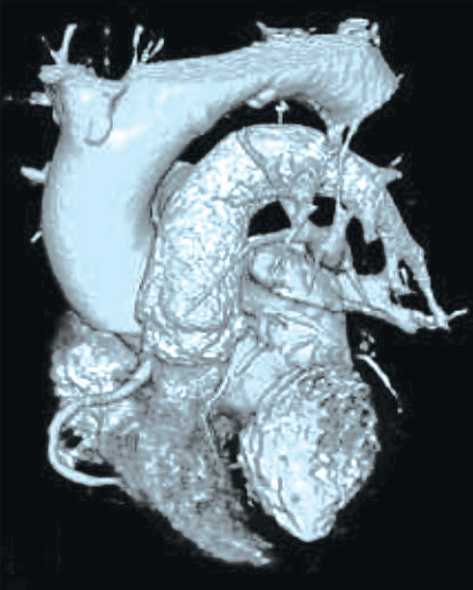
Рис. 1. Трехмерная реконструкция сердца по данным компьютерной томографии
Fig. 1. 3 D-reconstruction of the heart according to computed tomography
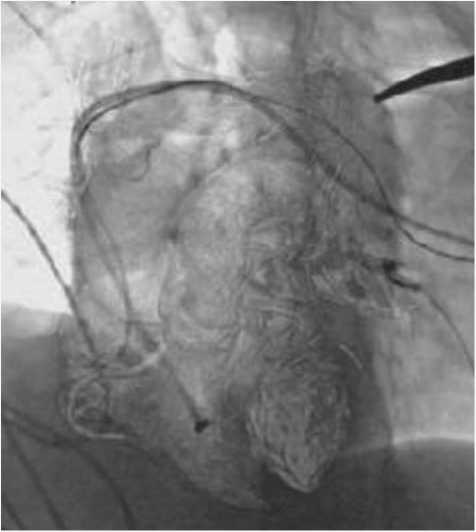
Рис. 2. Трехмерная реконструкция сердца, интегрированная в ангиограф в виде маски на фоне флюороскопии
Fig. 2. 3D-reconstruction of the heart integrated into the angiograph in the form of a mask against the background of fluoroscopy
В раннем послеоперационном периоде всем пациентам выполнены ЭхоКГ и ЭКГ. ЭхоКГ проведена с целью оценки структурно-функциональных характеристик ТК, а также диагностического поиска возможных осложнений; оценивались параметры: ФВ (по Simpson), регургитация
на ТК, структурные изменения ТК, осложнения (при наличии). Для определения погрешности МИВ принято решение провести измерения 2 расстояний во взаимно перпендикулярных плоскостях интраоперационно с помощью МИВ и в послеоперационном периоде по данным КТ: расстояние от дистального конца электрода (RVtip) до границы эндокарда ЛЖ (расстояние А) и от места вхождения электрода в МЖП (по правожелудочковому краю МЖП) до кольца ТК (расстояние Б, рис. 3). Таким образом, расстояние А отражает погрешность относительно «поперечника» сердца, расстояние Б – относительно «длинника». Помимо пациентов исследуемой группы КТ в послеоперационном периоде выполнено пациентам контрольной группы в следующих случаях: ложносептальная имплантация электрода, отсутствие возможности визуализировать на всем протяжении электрод в МЖП по данным ЭхоКГ, подозрение на перфорацию МЖП по данным ультразвукового исследования.
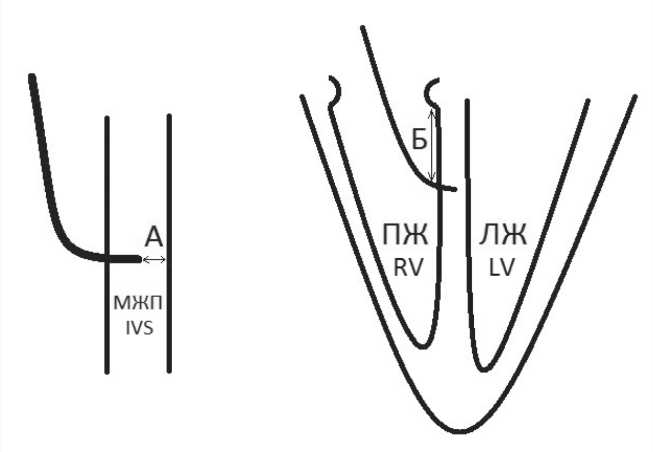
Рис. 3. Размеры, оцениваемые для определения погрешности методики интраоперационной визуализации
Pic. 3. Dimensions assessed to determine the uncertainty of the intraoperative visualization technique
Для подтверждения стимуляции ПСС, а также исключения интраоперационных повреждений ППС в послеоперационном периоде (ранний послеоперационный, 6 мес. после операции) выполнена ЭКГ на фоне программирования ЭКС, оценена морфология и ширина нативного и стимулированного комплекса QRS.
Статистический анализ полученных данных проведен с использованием программного пакета STATISTICA 10. Для проверки соответствия распределения количественных показателей нормальному распределению использован критерий Шапиро – Уилка (Shapiro – Wilk test). Нормально распределенные количественные показатели представлены средним значением и стандартным отклонением m ± SD , при отсутствии нормального распределения – медианой и интерквартильным промежутком в формате Me [ Q 1; Q 3]. Категориальные показатели представлены абсолютными ( n ) и относительными (в %) частотами встречаемости. Для оценки статистической значимости различий между количественными показателями в сравниваемых группах применялся критерий серий Вальда – Вольфовица (Wald – Wolfowitz runs test), для сравнения категориальных показателей в группах – точный критерий Фишера. Пороговый уровень статистической значимости составил p = 0,05.
Результаты
Протокол исследования выполнен у 10 пациентов исследуемой группы и у 10 пациентов контрольной группы. Средний возраст пациентов исследуемой группы составил 74,5 ± 8,7 лет, контрольной группы – 63,8 ± 18,23 лет, статистически значимых различий по возрастному составу между исследуемыми группами не выявлено ( p > 0,05). Пароксизмы ФП зафиксированы у 3 пациентов исследуемой группы и 2 пациентов контрольной группы ( p > 0,05), синдром слабости синусового узла (CCCУ) и сино-атриальная блокада (СА-блокада) – у 7 пациентов исследуемой группы и 3 пациентов контрольной группы ( p > 0,05), атриовентрикулярная блокада 2-й степени (АВБ) – у 5 пациентов исследуемой и у 5 пациентов контрольной группы ( p > 0,05), блокада ветвей ЛНПГ – у 3 пациентов исследуемой группы и 6 контрольной ( p > 0,05). Среднее значение нативного комплекса QRS в исследуемой группе составило 157 ± 25,18 мс, в контрольной – 130 ± 45,62 мс ( p > 0,05).
Все имплантации осуществлены одним оператором, имеющим опыт имплантации электродов в ПСС. Модель имплантируемого электрода была идентична в обеих группах. Выбор системы доставки производился индивидуально, исходя из антропометрических данных пациента и данных МСКТ, в частности у пациентов исследуемой группы. Статистически значимых различий в используемых системах доставки у пациентов двух групп не выявлено ( p > 0,05). Выбор системы доставки не оказывал статистически значимого влияния на исход имплантации электрода ( p > 0,05) в анализируемой выборке.
Целевое место имплантации – ЛНПГ. Всем пациентам исследуемой группы подтверждена имплантация электродов в ПСС (с использованием ЭКГ), в МЖП. Среднее значение комплекса QRS при стимуляции составило 117,5 ± 15.25 мс, продолжительность операции – 87,5 [70; 120] мин, время флюороскопии – 225 [125; 421] с. Осложнений, нецелевых имплантаций зарегистрировано не было. В контрольной группе продолжительность операции составила 100 [100;110] мин, время флюороскопии – 775 [500; 1230] с. Стимуляция ПСС подтверждена у 4 (40%) пациентов, среднее значение комплекса QRS при стимуляции составило 152,1 ± 34,9 мс. Также в контрольной группе зафиксировано 2 (20%) случая перфорации МЖП, 1 (10%) случай имплантации в апикальную область ПЖ, 1 (10%) случай интраоперационной дислокации правожелудочкового электрода, 1(10%) случай гемоперикарда в раннем послеоперационном периоде. Средняя погрешность измерений по данным МИВ в сравнении с КТ: расстояние А – 0,98 ± 0,51 мм, расстояние Б – 3,1 ± 0,92 мм. По данным трансторакальной ЭхоКГ, структурных изменений, связанных с нарушением функционального статуса ТК, появления локальных участков миокарда с нарушениями сократительной способности, значимых изменений порогов чувствительности, стимуляции, а также послеоперационных дислокаций электродов выявлено не было.
Обсуждение
В данном исследовании впервые применена на практике МИВ при имплантации электрода для постоянной электрокардиостимуляции в ПСС, не требующая использования сторонних навигационных систем. Одной из особенностей данной методики является выполнение КТ на предоперационном этапе. Современные многосрезовые компьютерные томографы позволяют выполнить сканирование сердца с толщиной среза менее 1 мм [14]. Высокая разрешающая способность КТ, возможности базового программного обеспечения ангиографа позволяют выполнить высокоточную сегментированную трехмерную реконструкцию сердца (см. рис. 1). Помимо постройки трехмерной модели, необходимой для МИВ, оператор получает большой объем информации: положение сердца, наличие или отсутствие структурных аномалий сердца, толщина и особенности строения МЖП. Эти данные позволяют на предоперационном этапе определить предполагаемое место имплантации электрода в МЖП, подобрать и сформировать оптимальную по конфигурации систему доставки электрода.
Представленная МИВ позволяет «визуализировать» МЖП, межпредсердную перегородку (см. рис. 2). Помимо визуализации структур сердца методика позволяет с высокой точностью интраоперационно определить позицию электрода посредством выполнения ротационной томографии. В случае выявления некорректного положения электрода появляется возможность скорректировать его позицию до ушивания операционной раны, предотвратив тем самым повторное оперативное вмешательство. Данные преимущества предоставляют возможность снизить количество нецелевых имплантаций, время флюороскопии, лучевую нагрузку на оператора, не увеличивая продолжительность операции.
По предварительным результатам исследования применение методики не увеличивает продолжительность операции (p > 0,05), при этом уменьшается время флюороскопии (p = 0,048), а также количество нецелевых имплантаций (p = 0,025), что подтверждается статистически значимым различием ширины стимулированного комплекса QRS у пациентов двух групп (p = 0,03). Достаточно показательным является отсутствие в исследуемой группе осложнений, как в интраоперационном, так и в раннем послеоперационном периоде – против 5 зафиксированных случаев осложнений в контрольной группе. Однако статистически значимых различий по данному параметру выявлено не было (p > 0,05), что связано скорее всего с малым объемом выборок.
Необходимо отметить, что большинство современных ангиографов позволяет выполнить интеграцию трехмерной модели сердца в ангиограф с созданием маски трехмерной реконструкции на фоне флюороскопии с использованием базовых модулей и стандартного программного обеспечения.
Важным этапом интеграции трехмерной модели сердца в ангиограф является процедура «совмещения объемов»: объемного изображения пациента по данным КТ с объемным изображением пациента, находящегося на операционном столе. Данная процедура выполняется по реперным точкам. Реперная точка – это условная точка, относительно которой происходит совмещение. Реперной точкой может быть как анатомический ориентир, так и искусственно созданный, например, пластырь с рентгеноконтрастным материалом, прикрепленный на поверхность тела пациента. Стандартизация выбора реперных точек при выполнении КТ исследования, более стабильное положение базальных отделов перегородки в зависимости от сердечного цикла позволяют снизить погрешности при интеграции в ангиограф созданной трехмерной модели сердца. Финальная ротационная томография, являющаяся обязательным компонентом МИВ, позволяет с высокой точностью интраоперационно определить положение имплантированного электрода.
Выводы
Применение merge-методики интраоперационной визуализации доступно в современной аритмологической операционной. Данная методика позволяет снизить количество нецелевых имплантаций, время флюороскопии, лучевую нагрузку на оператора, не увеличивая при этом продолжительность операции. Необходимо отметить, что оптимизация и совершенствование методики позволит минимизировать погрешность и повысить ее точность.
Список литературы Возможности merge-методики интраоперационной визуализации при имплантации электрода для постоянной кардиостимуляции в проводящую систему сердца: промежуточные результаты исследования
- Furman S., Schwedel J.B. An intracardial pacemaker for Stokes-Adams seizures. N. Engl. J. Med.1959;261:943–948. DOI: 10.1056/NEJM195911052611904.
- Sutton R. Ventricular pacing: what docs it do? Eur. JCPE. 1993;3:194–196.
- Karpawich P., Gates J., Stokes K. Septal His-Purkinje ventricular pacing in canines: a new endocardial electrode approach. PACE. 1992;15:2011–2015. DOI: 10.1111/j.1540-8159.1992.tb03012.x.
- Deshmukh P., Casavant D.A., Romanyshyn M., Anderson K. Permanent, direct His-bundle pacing: А novel approach to cardiac pacing in patients with normal His-Purkinje activation. Circulation. 2000;101(8):869–877. DOI: 10.1161/01.cir.101.8.869.
- Arnold A.D., Shun-Shin M.J., Keene D., Howard J.P., Sohaib S.M.A., Wright I.J. et al. His resynchronization versus biventricular pacing in patients with heart failure and left bundle branch block. J. Am. Coll Cardiol. 2018;72(24):3112–3122. DOI: 10.1016/j.jacc.2018.09.073.
- Vijayaraman P., Zalavadia D., Haseeb A., Dye C., Madan N., Skeete J.R. et al. Clinical outcomes of conduction system pacing compared to biventricular pacing in patients requiring cardiac resynchronization therapy. Heart Rhythm. 2022;19(8):1263–1271. DOI: 10.1016/j.hrthm.2022.04.023.
- Abdelrahman M., Subzposh F.A., Beer D., Durr B., Naperkowski A., Sun H. et al. Clinical outcomes of his bundle pacing compared to right ventricular pacing. J. Am. Coll Cardiol. 2018;71(20):2319–2330. DOI: 10.1016/j.jacc.2018.02.048.
- Mala A., Osmancik P., Herman D., Curila K., Stros P., Vesela J. et al. Can QRS morphology be used to differentiate between true septal vs. apparently septal lead placement? An analysis of ECG of real mid-septal, apparent midseptal, and apical pacing. Eur. Heart J. Suppl. 2020;22(Supplement F):F14–F22. DOI: 10.1093/eurheartj/suaa094.
- Ponnusamy S.S., Arora V., Namboodiri N., Kumar V., Kapoor A., Vijayaraman P. Left bundle branch pacing: A comprehensive review. J. Cardiovasc. Electrophysiol. 2020;31:2462–2473. DOI: 10.1111/jce.14681.
- Zanon F., Abdelrahman M., Marcantoni L., Naperkowski F., Subzposh F.A., Pastore G. et al. Long term performance and safety of his bundle pacing: A multicenter experience. J. Cardiovasc. Electrophysiol. 2019;30(9):1594–1601. DOI: 10.1111/jce.14063.
- Keene D., Arnold A.D., Jastrzębski M., Burri H., Zweibel S., Crespo E. et al. His bundle pacing, learning curve, procedure characteristics, safety and feasibility: Insights from a large international observational study. J. Cardiovasc. Electrophysiol. 2019;30(10):1984–1993. DOI: 10.1111/jce.14064.
- Devabhaktuni S., Mar P.L., Shirazi J., Dandamudi G. How to perform his bundle pacing: tools and techniques. Card. Electrophysiol. Clin. 2018;10(3):495–502. DOI: 10.1016/j.ccep.2018.05.008.
- Богачевский А.Н., Богачевская С.А., Бондарь В.Ю. Имплантация постоянных кардиостимуляторов под ультразвуковым контролем. Вестник аритмологии. 2014;(78):42–46. [Bogachevsky A.N., Bogachevskaya S.A., Bondar V.Yu. Ultrasound- guided permanent pacemaker implantation. Journal of Arrhythmology. 2014;(78):42–46. (In Russ.)].
- Кавтеладзе З.А., Глаголев В.Э. Возможности высокоскоростной 64-спиральной компьютерной томографии в диагностике поражений периферических и коронарных артерий. Диагностика. 2007;12:33–44. [Kavteladze Z.A., Glagolev V.E. Possibilities of high-speed 64-slice computed tomography in the diagnosis of lesions of peripheral and coronary arteries. Journal of Diagnostic. 2007;12:33–44. (In Russ.)].


