Возможности мультимодальной терапии при метастатическом колоректальном раке: случай полного клинико-рентгенологического ответа метастазов в печени
Автор: Добродеев А.Ю., Костромицкий Д.Н., Тарасова А.С., Афанасьев С.Г., Бабышкина Н.Н., Пономарева А.А., Ларионова И.В., Дронова Т.А., Азовский Д.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.23, 2024 года.
Бесплатный доступ
Актуальность. Колоректальный рак (КРР) является одним из наиболее распространенных злокачественных заболеваний в мире и занимает 2-е место в структуре смертности от рака. Популяционные исследования показали, что у 25-30 % больных КРР на момент постановки диагноза выявляются синхронные метастазы в печени. Несмотря на современные достижения в онкологии, только у 25 % больных можно выполнить резекцию печени, которая считается единственным способом излечения. В последние годы показания к радикальному лечению метастазов КРР (мКРР) в печень расширились. В связи с внедрением в клиническую практику новых таргетных препаратов частота ответа опухоли на предоперационное лечение увеличилась, что позволяет перевести процесс в резектабельное состояние. При этом у части больных наблюдается полный клинический ответ, который по данным визуальных методов исследования определяется как полное исчезновение метастатических очагов в печени. Однако в 30-70 % случаев в течение первого года наблюдения за больными выявляется рецидив заболевания в печени, и в настоящее время даже при наличии полного регресса метастазов рекомендуется выполнять резекции исходно пораженных сегментов печени. Описание клинического случая. В представленной статье описан случай полного клинико-рентгенологического ответа метастазов в печени со стойкой ремиссией у больного раком сигмовидной кишки, достигнутой в результате химиотаргетной терапии. В связи с тем, что при молекулярно-генетическом исследовании выявлен дикий тип генов Kras, Nras и Braf, больной получил 3 курса предоперационной терапии по схеме FOLFOXIRI + + Цетуксимаб. Хирургическое лечение включало лапароскопическую резекцию сигмовидной кишки с лимфодиссекцией D3. В последующем проведена адъювантная химиотерапия с использованием оксалиплатина и 5-фторурацила - до 12 курсов. Период наблюдения за больным после окончания лечения составил 16 мес, в течение этого времени признаков рецидива в толстой кишке и метастазов в печени не отмечено.
Колоректальный рак, метастазы в печень, предоперационная химиотерапия, таргетная терапия, полная регрессия
Короткий адрес: https://sciup.org/140303743
IDR: 140303743 | УДК: 616.34-006.6-033.2:611.36]-08 | DOI: 10.21294/1814-4861-2024-23-1-162-169
Текст научной статьи Возможности мультимодальной терапии при метастатическом колоректальном раке: случай полного клинико-рентгенологического ответа метастазов в печени
Колоректальный рак (КРР) является серьезной медико-социальной проблемой, занимая 3-е место в структуре онкологической заболеваемости (10 %) и 2-е место среди причин смерти от рака (9,4 %) [1]. На момент постановки диагноза у 25–30 % больных КРР регистрируются метастазы в печени [2]. В данной ситуации резекция первичной опухоли и метастатических очагов в печени в сочетании с химиотерапией остается единственным вариантом лечения, позволяющим добиться 5-летней общей выживаемости у 50–70 % больных [3]. Однако у 80 % больных КРР с метастазами в печени провести хирургическое лечение не представляется возможным из-за неоперабельности процесса в печени [4, 5], у 50–60 % прооперированных больных развивается внутрипеченочный рецидив [6].
В последние годы активно разрабатываются новые подходы к лечению метастатического КРР (мКРР) с использованием мультимодальной противоопухолевой лекарственной терапии, ко- торая позволяет в ряде случаев добиться полного регресса метастатических очагов в печени. Так, если после химиотерапии объективный ответ опухоли достигает 54–56 %, то частота полных ответов не превышает 2,8–4,5 % [7]. Вместе с тем, существует проблема «исчезнувших метастазов», которая создает серьезные сложности при выборе дальнейшей тактики лечения, поскольку известно, что при резекции печени после полного клиникорентгенологического ответа микроскопически определяемая остаточная опухолевая ткань подтверждается более чем в 80 % наблюдений [8]. В связи с этим определение оптимальной тактики лечения больных мКРР с изолированным поражением печени до сих пор является актуальной задачей.
В статье представлен клинический случай полного клинико-рентгенологического ответа синхронных метастазов в печени со стойкой ремиссией у больного раком сигмовидной кишки.
Клинический случай
Больной Л., 66 лет, самостоятельно обратился в НИИ онкологии Томского НИМЦ с жалобами на дискомфорт в брюшной полости, запоры до 4 сут, примесь крови в стуле. При видеоколоноскопии (24.06.21) в сигмовидной кишке выявлена опухоль до 5 см, которая на 2/3 обтурировала просвет кишки. Гистологическое исследование (№№ 18681–84/21, 29.06.21): аденокарцинома высокой степени дифференцировки. По данным МРТ ОМТ (09.07.21) определяется циркулярная опухоль сигмовидной кишки до 50 мм по длиннику с метастатическим поражением сигмовидных и верхних прямокишечных лимфатических узлов. Уровень РЭА (05.07.21) – 21,95 нг/мл, СА 19-9 – 137,4 Ед/мл. При СКТ органов брюшной полости (12.07.21) в печени выявлено 3 метастатических очага: в VI сегменте – до 12 мм, в VII сегменте – до 13 мм, в VIII сегменте – до 15 мм в диаметре. По данным молекулярно-генетического исследования (23.07.21) выявлен дикий тип генов Kras, Nras, Braf.
По результатам обследования сформулирован клинический диагноз: Рак сигмовидной кишки, обтурационный синдром, компенсированный опухолевый стеноз; метастатическое поражение
VI + VII + VIII сегментов печени; wtKras, wtNras, wtBraf, MSS; стадия IVa, cT4aN1M1a . В рамках комбинированного лечения, разработанного в НИИ онкологии ТНИМЦ [9], больному проведено 3 курса предоперационной химиотаргетной терапии по схеме FOLFOXIRI + Цетуксимаб. Предоперационное лечение завершено больному в полном объеме. Нежелательные явления в виде тошноты и лейкопении I степени не требовали коррекции лечения.
При контрольном обследовании со стороны первичной опухоли была отмечена частичная регрессия: по данным видеоколоноскопии (14.10.21) зафиксировано сокращение протяженности опухоли до 3 см и восстановление просвета кишки на 2/3, что было подтверждено при МРТ органов малого таза (13.10.21) – уменьшение размеров опухоли до 30 мм и отсутствие признаков поражения лимфатических узлов. При оценке метастазов в печени установлен полный клинико-рентгенологический ответ: по результатам СКТ органов брюшной полости (12.10.21) признаков метастатического поражения печени не выявлено (рис. 1, 2). Одновременно с этим при лабораторном контроле выявлено снижение уровня РЭА (14.10.21) до 2,3 нг/мл, СА 19-9 – до 13,8 Ед/мл.
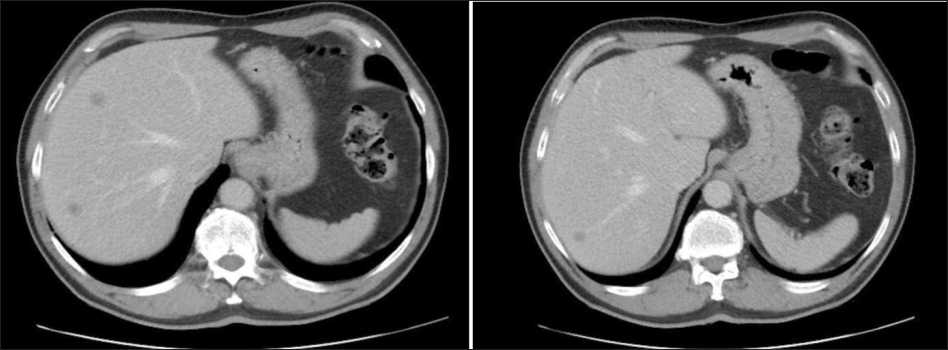
Рис. 1. СКТ печени до начала лечения. Определяются метастатические очаги в VI сегменте до 12 мм, в VII сегменте до 13 мм, в VIII сегменте до 15 мм в диаметре. Примечание: рисунок выполнен авторами
Fig. 1. Spiral CT of the liver before treatment. Metastatic lesions measuring up to 12 mm in diameter are visualized in segment VI, 13 mm in segment VII, and 15 mm in segment VIII. Note: created by the authors
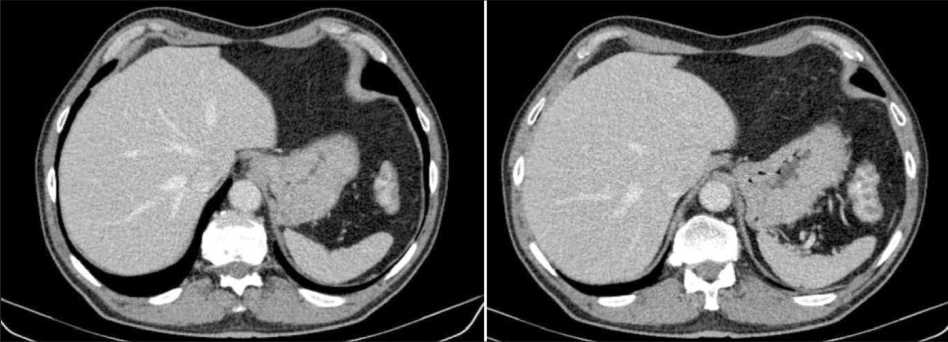
Рис. 2. СКТ печени после 3 курсов предоперационной химиотаргетной терапии. Метастазы в печени не определяются. Примечание: рисунок выполнен авторами
Fig. 2. Spiral CT of the liver after 3 cycles of preoperative chemotherapy with targeted therapy. Liver metastases are not visualized. Note: created by the authors
Для определения дальнейшей тактики лечения проведен мультидисциплинарный консилиум (16.10.21) с участием хирурга, химиотерапевта и анестезиолога, по результатам которого принято решение о выполнении лапароскопический резекции сигмовидной кишки с последующей адъювантной химиотерапией с использованием оксалиплатина и 5-фторурацила (до 12 курсов). В связи с исходным глубоким интрапаренхиматозным расположением метастазов и вовлечением в процесс 3 сегментов печени от выполнения правосторонней гепатэк-томии было решено отказаться.
Больному выполнена лапароскопическая резекция сигмовидной кишки с лимфодиссекцией D3 (17.10.21), при этом диссеминации по брюшине и метастазов в печени выявлено не было. Послеоперационный период протекал гладко. По данным послеоперационного гистологического исследования зафиксирован лечебный патоморфоз опухоли II степени (TRG 2 по шкале А.М. Mandard), без прорастания серозной оболочки кишки и метастатического поражения лимфатических узлов.
Таким образом, сформулирован окончательный клинический диагноз: Рак сигмовидной кишки, обтурационный синдром, компенсированный опухолевый стеноз; метастатическое поражение VI + VII + VIII сегментов печени. wtKras, wtNras, wtBraf, MSS; стадия IVa, cT4aN1M1a . Состояние после 3 курсов предоперационной химиотаргетной терапии по схеме FOLFOXIRI + Цетуксимаб с эффектом частичной регрессии опухоли сигмовидной кишки и полной регрессией метастазов в печени. Лапароскопическая резекция сигмовидной кишки с лимфодиссекцией D3 (17.10.21.). Патологоанатомическая стадия IIa, уpT3N0M0.
На 12-е сут после операции начата адъювантная химиотерапия. Больной завершил адъювантное лечение в запланированном объеме. Через 16 мес после окончания химиотерапии при контрольном обследовании (октябрь 2023 г.) признаков рецидива в толстой кишке и метастазов в печени не отмечено. В настоящее время больной продолжает находиться под динамическим наблюдением в НИИ онкологии ТНИМЦ.
Обсуждение
В настоящее время при КРР с изолированными синхронными метастазами в печени перспективным является мультимодальной подход [10], включающий химио- и таргетную терапию в сочетании с хирургическим лечением. Из противоопухолевой лекарственной терапии наиболее часто применяется химиотерапия (в основном дуплеты на основе препаратов из группы фторпирими-динов – FOLFOX, CAPOX, XELOX и FOLFIRI), а также таргетная терапия с использованием моноклональных антител, блокирующих эндотелиальный фактор роста VEGF (бевацизумаб) или эпидермальный фактор роста EGFR (цетуксимаб или панитумумаб). Объективный ответ опухоли при данной химиотаргетной терапии составляет 44,8–62 % [11].
С позиций интенсификации лечения для усиления непосредственного эффекта химиотерапии, повышения резектабельности метастазов в печени и улучшения выживаемости больных КРР в последние годы активно стали применяться триплеты, состоящие из фторпиримидинов, оксалиплатина и иринотекана. В частности, данными исследования GONO [12] показано, что частота радикальных резекций печени после химиотерапии по схеме FOLFOXIRI была достоверно выше и составила 36 % по сравнению со схемой FOLFIRI – 12 %. Кроме того, современная химиотерапия может оказывать выраженное повреждающее действие на метастазы в печени, что позволяет выполнять паренхимосберегающие оперативные вмешательства [7]. Однако если неоадъювантная химиотерапия приводит к полному исчезновению печеночных метастазов, то это снижает возможности хирургического лечения, поскольку возникают сложности для интраоперационной идентификации очагов поражения [10].
По данным литературы, частота «исчезнувших метастазов» варьирует в широком диапазоне (6–37 %) и зависит от используемых методов визуализации и схем противоопухолевой лекарственной терапии [13]. При этом доля больных, у которых после неоадъювантного лечения исчезли все метастазы в печени, крайне невелика (0–6 %). В нашем клиническом наблюдении полный клинико-рентгенологический ответ достигнут по всем 3 метастазам в печени. Вместе с тем, полное исчезновение метастазов обычно является рентгенологическим, а не биологическим фактом. В систематическом обзоре 11 исследований показано, что у 65 % больных с рентгенологически подтвержденными «исчезнувшими метастазами» при лапаротомии определялось метастатическое поражение печени [14].
Как известно, при химиотерапии одним из факторов, достоверно влияющим на улучшение выживаемости больных мКРР, является полный патоморфологический ответ (pCR) опухоли. Так, если у больных с pCR отмечается достоверное повышение 10-летней общей и безрецидивной выживаемости до 85,2 и 73,3 %, то у больных без pCR выживаемость составляет всего 31,3 и 15,2 % соответственно (р<0,05) [15].
При сопоставлении клинико-рентгенологического и патоморфологического ответа метастазов в печени зачастую выявляются несоответствия в полученных результатах [8]. В частности, в ранее проведенной нами работе [9] установлено, что из 2 (8,7 %) полных клинико-рентгенологических ответов при морфологическом исследовании послеоперационного материала в 1 (4,4 %) случае подтверждено отсутствие опухоли (TRG1), в 1
(4,4 %) случае имелись единичные остаточные опухолевые клетки (TRG2). Похожие результаты получены в исследовании R. Adam [16], pCR наблюдался у 4 % больных, перенесших резекцию печени по поводу метастазов КРР, но ни у одного из них не было полного рентгенологического ответа. В связи с этим в настоящее время большое внимание уделяется поиску дополнительных прогностических факторов, позволяющих выбрать оптимальную тактику лечения больных мКРР. На данный момент известны следующие независимые предикторы полного ответа и благоприятного течения заболевания: размеры метастазов в печень <3 см и исходный уровень РЭА <20 нг/мл [15], что согласуется с нашими результатами и подтверждается представленным клиническим наблюдением.
При «исчезнувших метастазах» перед хирургами встает достаточно сложный выбор – производить резекцию печени с определявшимися ранее метастазами или нет? В литературном обзоре [17], в который было включено 15 исследований с участием 2955 больных мКРР с поражением печени, показано, что у пациентов, которым выполнялась резекция печени с «исчезнувшими метастазами», отмечался более длительный безрецидивный период, по сравнению с пациентами без оперативного вмешательства на печени, однако значимых различий в общей выживаемости больных в зависимости от тактики лечения не выявлено.
В настоящее время к основным методам оценки печеночных метастазов относится КТ с контрастным усилением, МРТ и интраоперационное УЗИ. При этом если «исчезнувшие метастазы», установленные по данным КТ, подтверждаются результатами интраоперационного УЗИ, то частота полных ответов составляет 24–96 % (медиана – 77,5 %); если в дополнение к КТ используются МРТ и интраоперационное УЗИ с контрастным усилением, то частота полных ответов повышается до 75–94 % (медиана – 89 %). Таким образом, сочетание КТ с контрастным усилением, МРТ и интраоперационным УЗИ обеспечивает точную диагностику «исчезнувших метастазов» с полным ответом. При наличии данных условий динамическое наблюде- ние «исчезнувших метастазов» может рассматриваться как альтернатива резекции печени.
Список литературы Возможности мультимодальной терапии при метастатическом колоректальном раке: случай полного клинико-рентгенологического ответа метастазов в печени
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. https://doi.org/10.3322/caac.21660.
- Engstrand J., Strömberg C., Nilsson H., Freedman J., Jonas E. Synchronous and metachronous liver metastases in patients with colorectal cancer-towards a clinically relevant definition. World J Surg Oncol. 2019; 17(1): 228. https://doi.org/10.1186/s12957-019-1771-9.
- Calderon Novoa F., Ardiles V., de Santibañes E., Pekolj J., Goransky J., Mazza O., Sánchez Claria R., de Santibañes M. Pushing the Limits of Surgical Resection in Colorectal Liver Metastasis: How Far Can We Go? Cancers (Basel). 2023; 15(7): 2113. https://doi.org/10.3390/cancers15072113.
- Mohamad I., Barry A., Dawson L., Hosni A. Stereotactic body radiation therapy for colorectal liver metastases. Int J Hyperthermia. 2022; 39(1): 611-9. https://doi.org/10.1080/02656736.2021.1923836.
- Afanas'ev S.G., Tuzikov S.A. Nerezektabel'nye opukholi pecheni (obzor literatury). Sibirskii onkologicheskii zhurnal. 2006; 1: 49-54.
- de Jong M.C., Pulitano C., Ribero D., Strub J., Mentha G., Schulick R.D., Choti M.A., Aldrighetti L., Capussotti L., Pawlik T.M. Rates and patterns of recurrence following curative intent surgery for colorectal liver metastasis: an international multi-institutional analysis of 1669 patients. Ann Surg. 2009; 250(3): 440-8. https://doi.org/10.1097/SLA.0b013e3181b4539b.
- Tournigand C., André T., Achille E., Lledo G., Flesh M., Mery-Mignard D., Quinaux E., Couteau C., Buyse M., Ganem G., Landi B., Colin P., Louvet C., de Gramont A. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol. 2004; 22(2): 229-37. https://doi.org/10.1200/JCO.2004.05.113. Corrected and republished in: J Clin Oncol. 2023; 41(19): 3469-77.
- Benoist S., Brouquet A., Penna C., Julié C., El Hajjam M., Chagnon S., Mitry E., Rougier P., Nordlinger B. Complete response of colorectal liver metastases after chemotherapy: does it mean cure? J Clin Oncol. 2006; 24(24): 3939-45. https://doi.org/10.1200/JCO.2006.05.8727.
- Dobrodeev A.Yu., Kostromitskii D.N., Tarasova A.S., Afanas'ev S.G., Babyshkina N.N., Ponomareva A.A., Ermolenko R.V., Frolova I.G., Cheremisina O.V. Neposredstvennye rezul'taty neoad"yuvantnoi khimioterapii u bol'nykh metastaticheskim kolorektal'nym rakom s izolirovannym porazheniem pecheni. Sibirskii onkologicheskii zhurnal. 2022; 21(6): 17-24. doi.:10.21294/1814-4861-2022-21-6-17-24.
- Chow F.C., Chok K.S. Colorectal liver metastases: An update on multidisciplinary approach. World J Hepatol. 2019; 11(2): 150-72. https://doi.org/10.4254/wjh.v11.i2.150.
- Ardito F., Panettieri E., Vellone M., Ferrucci M., Coppola A., Silvestrini N., Arena V., Adducci E., Capelli G., Vecchio F.M., Giovannini I., Nuzzo G., Giuliante F. The impact of R1 resection for colorectal liver metastases on local recurrence and overall survival in the era of modern chemotherapy: An analysis of 1,428 resection areas. Surgery. 2019; 165(4): 712-20. https://doi.org/10.1016/j.surg.2018.09.005.
- Falcone A., Ricci S., Brunetti I., Pfanner E., Allegrini G., Barbara C., Crinò L., Benedetti G., Evangelista W., Fanchini L., Cortesi E., Picone V., Vitello S., Chiara S., Granetto C., Porcile G., Fioretto L., Orlandini C., Andreuccetti M., Masi G.; Gruppo Oncologico Nord Ovest. Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol. 2007; 25(13): 1670-6. https://doi.org/10.1200/JCO.2006.09.0928.
- Martin J., Petrillo A., Smyth E.C., Shaida N., Khwaja S., Cheow H.K., Duckworth A., Heister P., Praseedom R., Jah A., Balakrishnan A., Harper S., Liau S., Kosmoliaptsis V., Huguet E. Colorectal liver metastases: Current management and future perspectives. World J Clin Oncol. 2020; 11(10): 761-808. https://doi.org/10.5306/wjco.v11.i10.761.
- Araujo R.L.C., Milani J.M., Armentano D.P., Moreira R.B., Pinto G.S.F., de Castro L.A., Lucchesi F.R. Disappearing colorectal liver metastases: Strategies for the management of patients achieving a radiographic complete response after systemic chemotherapy. J Surg Oncol. 2020; 121(5): 848-56. https://doi.org/10.1002/jso.25784.
- Xu D., Yan X.L., Liu J.M., Li J., Xing B.C. The characteristics and long-term survival of patients with colorectal liver metastases with pathological complete response after chemotherapy. J Cancer. 2020; 11(21): 6256-63. https://doi.org/10.7150/jca.47911.
- Adam R., Wicherts D.A., de Haas R.J., Aloia T., Lévi F., Paule B., Guettier C., Kunstlinger F., Delvart V., Azoulay D., Castaing D. Complete pathologic response after preoperative chemotherapy for colorectal liver metastases: myth or reality? J Clin Oncol. 2008; 26(10): 1635-41. https://doi.org/10.1200/JCO.2007.13.7471.
- Barimani D., Kauppila J.H., Sturesson C., Sparrelid E. Imaging in disappearing colorectal liver metastases and their accuracy: a systematic review. World J Surg Onc. 2020; 18. https://doi.org/10.1186/s12957-020-02037-w.


