Возможности оптической диффузионной спектроскопии в диагностике рака молочной железы (клинический случай)
Автор: Павлов Михаил Викторович, Пегов Сергей Анатольевич, Орлова Анна Геннадьевна, Голубятников Герман Юрьевич, Шкалова Любовь Владимировна, Малинина Полина Александровна, Рыхтик Павел Иванович, Турчин Илья Викторович, Масленникова Анна Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.18, 2019 года.
Бесплатный доступ
Рак молочной железы (РМЖ) является одной из ведущих проблем клинической онкологии. Общепринятыми методами диагностики РМЖ являются рентгеновская маммография и ультразвуковое исследование, которые имеют существенные ограничения при отсутствии «классических» визуальных симптомов рака в ткани молочной железы. В сложных клинических ситуациях для дифференциальной диагностики РМЖ применяются такие методы, как МРТ и ПЭТ. В течение последних 20 лет возможности уточняющей диагностики РМЖ расширились благодаря внедрению в клиническую практику оптических методов, основанных на различиях оптических свойств нормальных и патологических тканей. Использование различных длин волн зондирующего излучения позволяет детектировать различные тканевые составляющие в зависимости от их спектра поглощения. Использование оптических методов позволяет получить косвенную информацию об оксигенации, кровенаполнении, доставке и потреблении кислорода в ткани молочной железы, а также об изменении ее рассеивающих свойств. В представленном клиническом случае метод оптической диффузионной спектроскопии (ОДС) позволил выявить существенные изменения оптических свойств образования молочной железы, не имеющего никаких «классических» визуальных симптомов рака. У пациентки заболевание проявилось увеличением аксиллярных лимфоузлов. После выполнения core-биопсии лимфатического узла при гистологическом исследовании был выявлен метастаз рака молочной железы. При этом в молочных железах по стандартным методам исследования (цифровая рентгеновская маммография, УЗИ) данных за наличие злокачественной опухоли не было. Однако методом ОДС в небольшом участке ткани молочной железы слева были выявлены изменения коэффициентов поглощения и рассеяния, характерные для злокачественной опухоли. По данным УЗИ и рентгеновской маммографии этот участок соответствовал доброкачественным изменениям. После пункции образования под ультразвуковым контролем цитологически были обнаружены раковые клетки. Таким образом, метод ОДС позволил выявить изменения, присущие злокачественной опухоли, в случае образования, не имеющего признаков малигнизации при использовании рутинных методов диагностики.
Рак молочной железы, ранняя диагностика, ультразвуковая диагностика, рентгеновская маммография, оптические методы диагностики, оптическая диффузионная спектроскопия, кислородный статус опухоли, оптические свойства опухоли
Короткий адрес: https://sciup.org/140254279
IDR: 140254279 | УДК: 618.19-006.6-073.584 | DOI: 10.21294/1814-4861-2019-18-4-92-101
Текст научной статьи Возможности оптической диффузионной спектроскопии в диагностике рака молочной железы (клинический случай)
В России рак молочной железы (РМЖ) сохраняет лидирующие позиции среди онкологических заболеваний у женщин. Заболеваемость РМЖ в настоящий момент составляет 20,9 % от общей онкологической заболеваемости женского населения в стране, а темпы ее роста в год равны 2-3 % в России и 1-2 % в мире [1]. Диагностика рака молочной железы в настоящее время в большинстве случаев не представляет значительных трудностей; «золотым стандартом» является маммография, чувствительность и специфичность которой колеблется от 62,9–89,1 % (у женщин с высокой плотностью молочных желез) до 87,0–96,9 % (у женщин с большим содержанием жировой ткани в молочных железах) [2–4]. У молодых женщин в возрасте до 35 лет широко используется ультра- звуковое исследование, которое способно отличить более плотную ткань опухоли от окружающей нормальной ткани [4]. Получившая широкое распространение в последнее время соноэластография позволяет в режиме реального времени сравнивать эхо-сигнал, получаемый от участка ткани при нагрузке (мягкое давление, осуществляемое стандартным ультразвуковым датчиком) и без неё, и оценивать таким образом механические свойства, отличающиеся в нормальных и опухолевых тканях [5]. Общеизвестным и труднопреодолимым недостатком всех типов ультразвуковых исследований является оператор-зависимость метода.
Однако данные методы имеют существенные ограничения при отсутствии «классических» симптомов рака в ткани молочной железы, в случае очень небольшого размера новообразования или при поиске первичной опухоли при выявлении диссеминированного опухолевого процесса. В этой ситуации для постановки диагноза используются современные методы визуализации. Одним из таких методов является МРТ. Наиболее часто для обследования молочных желез используются высокопольные МР-томографы, позволяющие дифференцировать доброкачественные и злокачественные поражения с чувствительностью 94 % и специфичностью 65 %, оценить размер и локализацию любого патологического образования более 5 мм в диаметре [5–7]. Существенными недостатками МРТ являются невысокая специфичность, дороговизна и дефицит специалистов, имеющих соответствующую квалификацию для оценки состояния ткани молочной железы [6, 8].
Еще одним методом, позволяющим дифференцировать доброкачественные и злокачественные образования, является позитронно-эмиссионная томография (ПЭТ). В зависимости от стадии чувствительность метода при первичном выявлении рака молочной железы составляет 48–96 %, специфичность – 73–100 % [9]. Возможности ПЭТ в диагностике РМЖ зависят от размеров патологического очага, и в силу относительно низкой разрешающей способности метода результаты исследования опухолей размером менее 10 мм часто являются ложноотрицательными.
В течение последних 20 лет возможности уточняющей диагностики рака молочной железы расширились благодаря внедрению в клиническую практику оптических методов, обладающих высокой молекулярной чувствительностью, основанных на различиях оптических свойств нормальных и патологических тканей [10–12]. Использование различных длин волн зондирующего излучения позволяет детектировать различные тканевые составляющие в зависимости от их спектра поглощения. Основными хромофорами в красном и ближнем инфракрасном диапазоне длин волн являются окси- (HbO2) и дезоксигемоглобин (HHb), вода и липиды, которые значительно отличаются друг от друга по спектрам поглощения [13]. Исследование их концентрации позволяет получить косвенную информацию об оксигенации, кровенаполнении, доставке и потреблении кислорода (по соотношению концентраций окси-и дезоксигемоглобина), а также об изменении рассеивающих свойств ткани [14]. Перечисленные свойства могут существенно отличаться в нормальных и опухолевых тканях.
Оптическая диффузионная спектроскопия (ОДС) более 15 лет используется как метод, позволяющий уточнить биологические свойства и прежде всего кислородный статус новообразований молочной железы [10–12], а также их изменения под влиянием лечебных воздействий [15–19].
В статье представлен клинический опыт уточняющей диагностики рака молочной железы с помощью оптической диффузионной спектроскопии.
Пациентка В., 1952 г.р., обратилась в ФБУЗ «Приволжский окружной медицинский центр» ФМБА России в октябре 2017 г. с жалобами на увеличение аксиллярных лимфатических узлов с обеих сторон.
За неделю до обращения обнаружила болезненное уплотнение в левой подмышечной области, которое с течением времени уменьшилось; несколько дней спустя обнаружила аналогичное, менее отчетливое, уплотнение справа. В начале заболевания уплотнения были очень болезненными, принимала анальгин. Повышение температуры тела отрицает. Наследственный анамнез по раку молочной железы не отягощен. Менархе в 14 лет, менопауза с 40 лет.
При осмотре молочные железы симметричные. Кожа физиологической окраски. Сосковоареолярные комплексы не изменены. Выделений из сосков нет. В молочных железах очаговых изменений при пальпации нет. С обеих сторон в зоне Зоргиуса, более отчетливо слева, пальпируются увеличенные до 3 см плотные малоподвижные малоболезненные лимфатические узлы. Надключичные и подключичные лимфатические узлы не пальпируются.
Рентгеновская маммография (рис.1) выполнена на цифровом маммографе SIEMENS INSPIRATION (Siemens, Germany): кожа и подкожная клетчатка нормальной толщины, обычной прозрачности для рентгеновского излучения, симметричны. Соски симметричны, не деформированы, без втяжения. Структурный рисунок симметричен. Развитие стромальных и железистых структур соответствует возрасту: фиброзно-жировая инволюция с нерезковыраженным фиброзом стромы (ACR тип А). На этом фоне справа узловых образований, участков атипичной перестройки структуры, скоплений микрокальцинатов не выявлено. Слева в средней трети нижнего внутреннего квадранта визуализируется изоденсное объемное образование округлой формы с ровным четким контуром, размером 8×7мм. С обеих сторон визуализируются тени многочисленных лимфатических узлов размером от 10 мм до 36 мм, преимущественно жирового строения с «подчеркнутым» корковым слоем; слева определяются единичные гиперденс-ные лимфатические узлы с потерей дифференцировки на мозговой и корковый слои. Заключение: Единичная протоковая киста левой молочной железы. Измененные аксиллярные лимфатические узлы слева (лимфопролиферативное заболевание?). Категория BI-RADS слева 3. BI-RADS справа 1.
УЗИ молочной железы и периферических лимфоузлов проводилось на цифровом сканере MEDISON ACCUVIX V20 (Samsung, Korea) мульти-частотным линейным датчиком 8–13 MГц (рис. 2): в молочных железах фиброзно-жировая инволю- ция. Слева на 8 часах условного циферблата, в 7 см от соска лоцируется гипоэхогенное образование овальной формы с ровным четким контуром, размером 6×3,4×5,2 мм. В режиме энергетического допплеровского картирования пери- или интранодулярный кровоток не регистрируется. В аксиллярной области с обеих сторон лоцируются множественные увеличенные лимфоузлы, размером до 36 мм, с резко утолщенным корковым слоем и наличием выраженного интранодулярного кровотока. Заключение: объемное образование левой молочной железы (дифференциальный диагноз между фиброаденомой и кистой с густым содержимым). Больше данных за метастазы в аксиллярные лимфоузлы справа и слева. Категория BI-RADS справа 1, слева 3.
Под ультразвуковым контролем была выполнена core-биопсия аксиллярного лимфоузла слева. Гистологически был подтвержден метастаз рака молочной железы, трипл-негативный иммунофенотип (рецепторы эстрогена 0 баллов, рецепторы прогестерона 0 баллов, Her2neu отрицательный, индекс пролиферации 80 %).
Таким образом, у пациентки были выявлены метастазы РМЖ в подмышечные лимфатические узлы. Хотя при использовании рутинных методов исследования было обнаружено образование левой молочной железы, убедительных данных за его злокачественный характер не получено. Для получения дополнительной информации о биологических свойствах образования левой молочной железы была выполнена оптическая диффузионная спектроскопия. Исследование выполняли на установке для оптической диффузионной спектроскопии, созданной в Институте прикладной физики РАН (Нижний Новгород, Россия) [20]. Источниками излучения в установке служат лазеры видимого и ближнего ИК-диапазона с длинами волн 684 нм (близкой к максимуму поглощения HHb), 850 нм (близкой к максимуму поглощения HbO2) и 794 нм – длина волны, на которой коэффициенты поглощения окси- и дезоксигемоглобина совпадают. Для разделения показателей поглощения и рассеяния применяется высокочастотная амплитудная модуляция (140 МГц). В установке используется синхронное пошаговое сканирование в конфигурации «на просвет» с использованием источников и детектора, расположенных с противоположных сторон исследуемого объекта с шагом 1 мм. В каждой позиции производится считывание данных от всех трех источников.
Первым этапом исследования было получение ОДС-изображений непосредственно в процессе сканирования. На них отображались амплитуда и фаза прошедшего через исследуемую ткань излучения на 3 длинах волн. Локальное изменение соответствующих показателей свидетельствовало о наличии оптической неоднородности в исследуемой зоне. На втором этапе путем численной обработки полученных изображений воссоздавали картину распределения коэффициента поглощения и транспортного коэффициента рассеяния ( m s ). Конечным этапом было восстановление двумерного распределения концентраций окси- и дезоксигемоглобина и уровня сатурации крови (StO2 ). Уровень насыщения крови кислородом определяли как StO2=[HbO2 ]/[НHb+HbO2 ]×100% [21]. Полученные данные были использованы для восстановления распределения концентраций общего, окси- и дезоксигемоглобина для ткани молочной железы в зоне опухоли.
В ткани молочной железы наблюдались равномерное распределение и стабильная концентрация общего, окси- и дезоксигемоглобина, а также
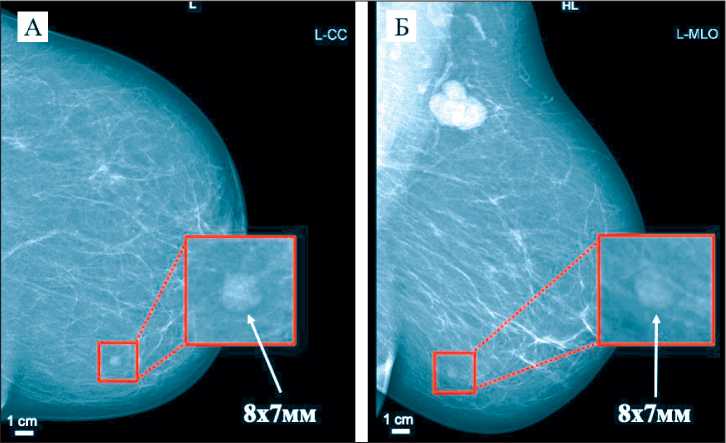
Рис. 1. Пациентка В. Цифровая рентгеновская маммография (левая молочная железа): А – прямая проекция, Б – боковая косая проекция
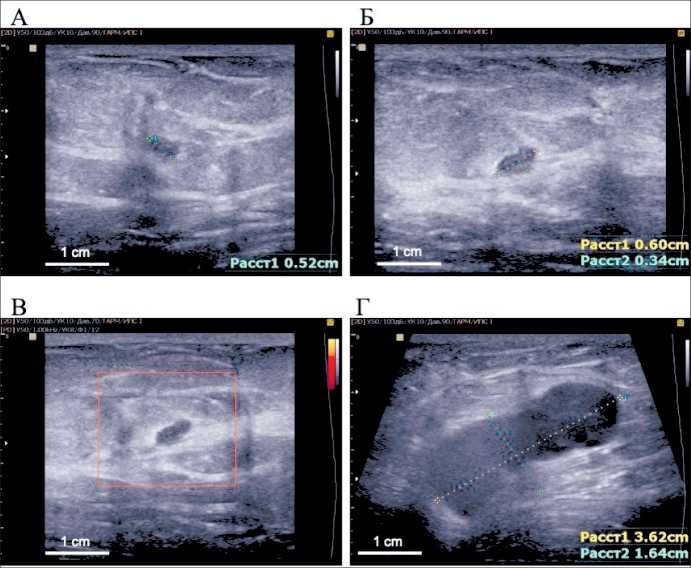
Рис. 2. Пациентка В.
УЗИ молочных желез:
А – объемное образование молочной железы; В-режим (аксиальная плоскость); Б – объемное образование молочной железы, В-режим (сагиттальная плоскость); В – объемное образование молочной железы, режим энергетического допплеровского картирования;
Г – аксиллярный лимфоузел, В-режим
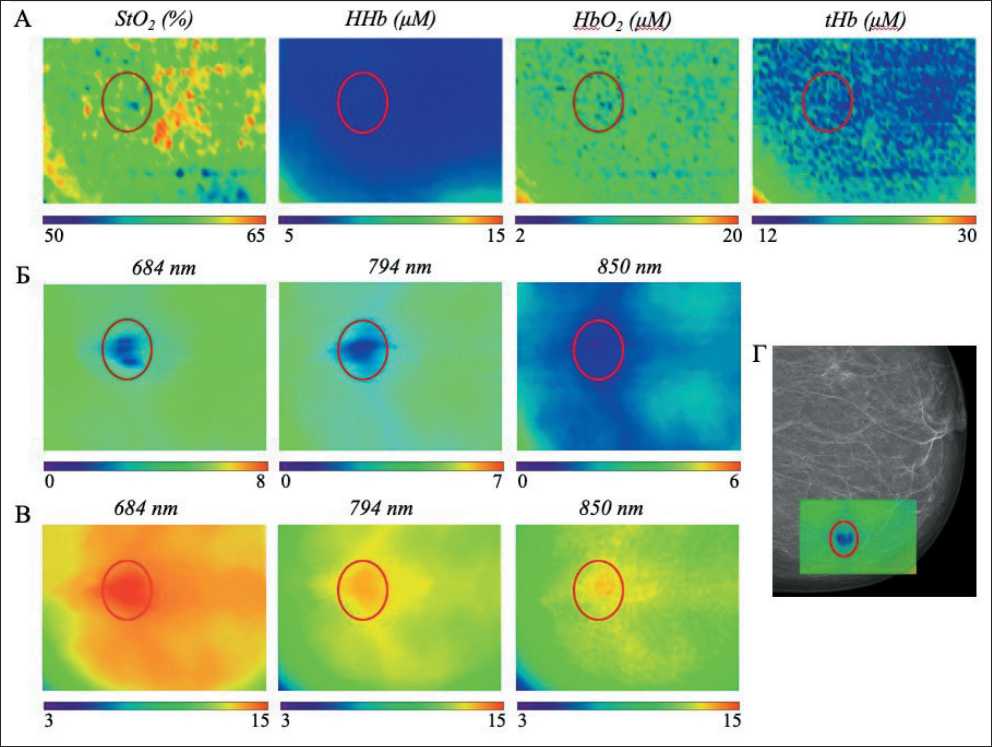
Рис. 3. Результаты ОДС-исследования молочной железы пациентки В. (красным овалом отмечена область опухоли):
А – двумерное распределение уровня насыщения крови кислородом (ЅtO2), дезокси- (HHb), окси- (HbO2) и общего (tHb) гемоглобина. Размер ОДС-изображения 60×50 мм; Б – амплитуда сигнала, усл. ед.; В – распределение транспортного коэффициента рассеяния (ms), см-1; Г – совмещенные маммография и ОДС-изображение равномерное насыщение крови кислородом (рис. 3А). В области новообразования на всех длинах волн фиксировались снижение амплитуды сигнала (рис. 3Б) и повышение транспортного коэффициента рассеяния (рис. 3В).
Под ультразвуковым контролем иглой 21G была выполнена тонкоигольная аспирационная биопсия опухоли нижне-внутреннего квадранта левой молочной железы. При цитологическом исследовании были обнаружены клетки рака (рис. 4).
Таким образом, метод оптической диффузионной спектроскопии позволил выявить изменения, присущие злокачественной опухоли, в случае «безобидного» с виду образования, не имеющего признаков малигнизации при использовании рутинных методов диагностики.
Для сравнения приводим данные обследования пациентки с гистологически подтвержденной фиброаденомой правой молочной железы.
Пациентка Н., 1958 г.р., обратилась в ФБУЗ «Приволжский окружной медицинский центр» ФМБА России в январе 2018 г. для плановой рентгеновской маммографии. Жалоб у пациентки со стороны молочных желез не было. Наследственный анамнез по раку молочной железы не отягощен. Менархе в 13 лет, менопауза с 46 лет.
При осмотре молочные железы симметричные. Кожа физиологической окраски. Сосковоареолярные комплексы не изменены. Выделений из сосков нет. В молочных железах очаговых изменений при пальпации нет. Аксиллярные, надключичные и подключичные лимфатические узлы не увеличены.
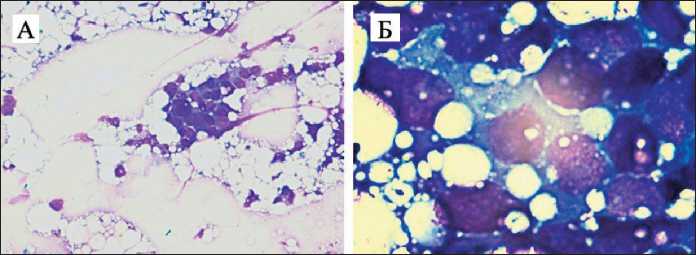
Рис. 4. Пациентка В. Микрофото. Цитологическое исследование, окраска по Романовскому: А – ×20; Б – ×100
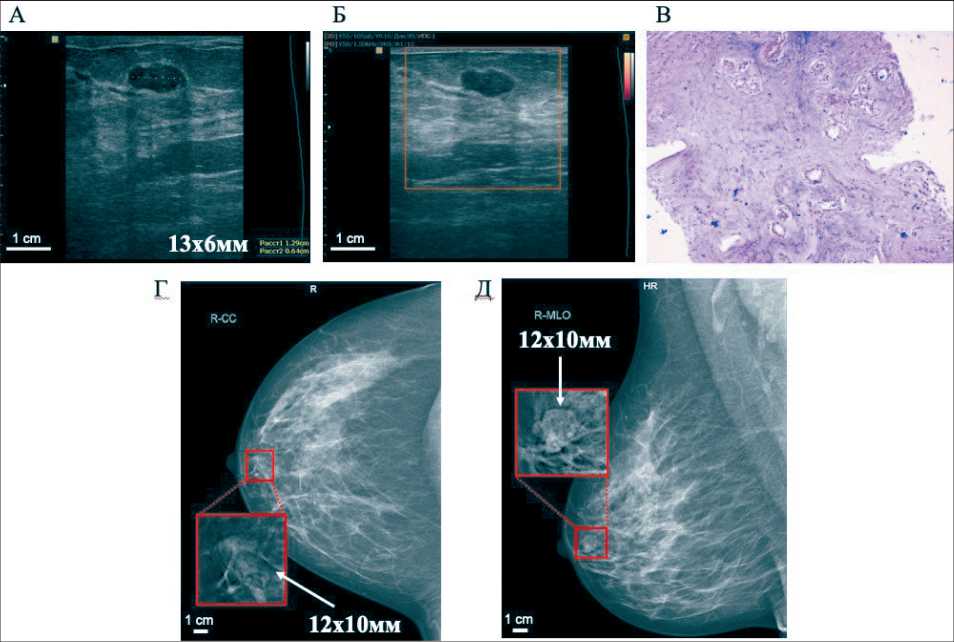
Рис. 5. Пациентка Н. Фиброаденома:
А – ультразвуковое изображение, В-режим; Б – ультразвуковое изображение, режим энергетического допплеровского картирования; В – гистологический образец после core-биопсии (окраска гематоксилин-эозин, ×50); Г – цифровая рентгеновская маммография (прямая проекция); Д – цифровая рентгеновская маммография (боковая косая проекция)
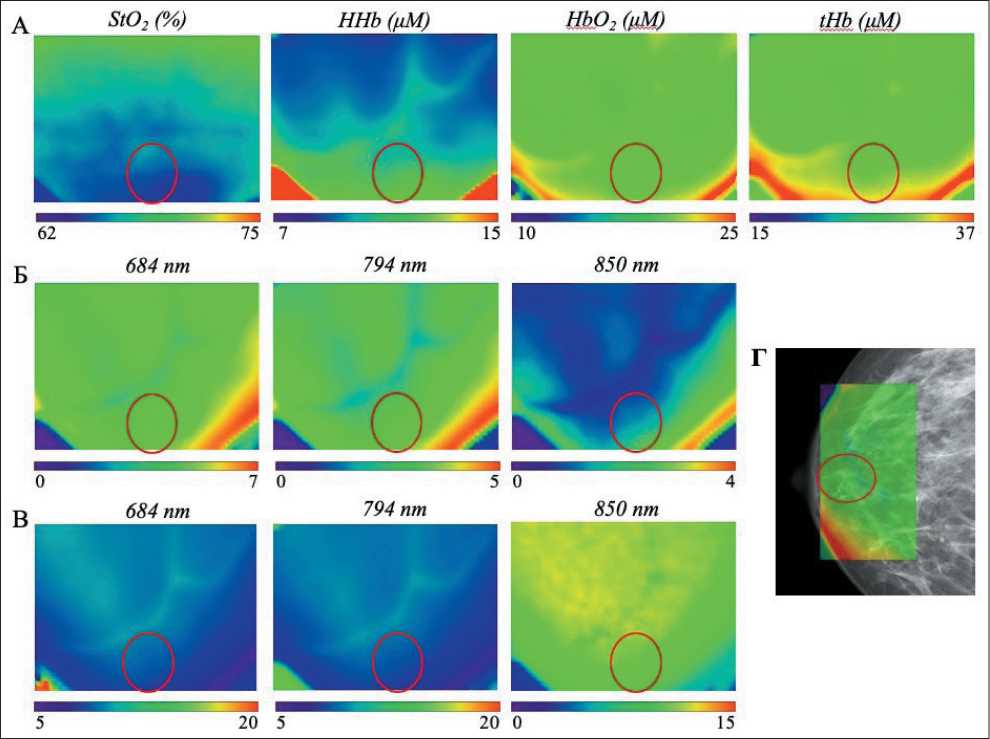
Рис. 6. Результаты ОДС-исследования пациентки Н. (красным овалом отмечена область опухоли):
А – двумерное распределение уровня насыщения крови кислородом (ЅtO2), дезокси- (HHb), окси- (HbO2) и общего (tHb) гемоглобина. Размер ОДС-изображения 60×50 мм; Б – амплитуда сигнала, усл. ед.; В – распределение транспортного коэффициента рассеяния ( m s), см-1; Г – совмещенные маммография и ОДС-изображение
Рентгеновская маммография выполнена на цифровом маммографе SIEMENS INSPIRATION (Siemens, Germany) (рис. 5Г, Д): в центральном квадранте правой молочной железы определяется изоденсное объемное образование овальной формы с ровным четким контуром, размером 12×10 мм. Заключение: фиброаденома? киста? правой молочной железы. Категория BI-RADS справа 3.
УЗИ молочных желез и периферических лимфоузлов проводилось на цифровом сканере MEDISON ACCUVIX V20 (Samsung, Korea) мультичастотным линейным датчиком 813 MГц (рис. 5А, Б): в правой молочной железе ретроареолярно определяется ги-поэхогенное образование овальной формы с неровным четким контуром, размером 12,9×6,4×7,1 мм. В режиме энергетического допплеровского картирования интранодулярный кровоток не регистрируется. Заключение: эхоскопически больше данных за фиброаденому правой молочной железы. Категория BI-RADS справа 3.
Таким образом, по данным УЗИ и рентгеновской маммографии объемное образование имело схожие характеристики с новообразованием у предыдущей пациентки. Выполнена core-биопсия под ультразвуковым контролем. Гистологически подтверждена интраканаликулярная фиброаденома (рис. 5В).
Пациентке проведено исследование правой молочной железы методом оптической диффузионной спектроскопии, по его данным в области новообразования не выявлено неоднородности амплитуды сигнала излучения на всех трех длинах волн (рис. 6Б). Изменений концентрации общего, окси- и дезоксигемоглобина выявлено не было (рис. 6А), как и изменения транспортного коэффициента рассеяния в соответствующей зоне.
Обсуждение
Возможности оптической диффузионной спектроскопии как метода дифференциальной диагностики очаговых образований молочной железы изучаются в течение последних 15 лет. Основным признаком, позволяющим отличить доброкачественные и злокачественные новообразования, является различие оптических свойств (поглощения и рассеяния) инвазивного рака и до- брокачественных опухолей [10, 11, 22–24]. Другим важным симптомом является снижение уровня оксигенации опухоли, так как гипоксия является одной из характерных черт злокачественных новообразований [12].
В представленном случае ОДС-исследование позволило выявить существенные изменения оптических свойств небольшого образования молочной железы, не имеющего «классических» визуальных симптомов рака. Основным признаком, характеризующим опухоль, было снижение амплитуды прошедшего сквозь ткань молочной железы излучения, что соответствует данным Q. Zhu et al. [22]. Подобные изменения могут быть вызваны как увеличением поглощения излучения биологическими тканями за счет локального повышения концентрации соответствующих хромофоров, так и увеличением рассеяния излучения за счет повышения концентрации элементов, обладающих сильными рассеивающими свойствами. В биологических тканях к ним относятся митохондрии, ядра, структурные элементы соединительной ткани (коллагеновые и эластиновые волокна) [11, 25]. Существуют данные, что коэффициент рассеяния для РМЖ может быть в 2 раза выше, чем для доброкачественных новообразований [26]. В нашем случае источником локального снижения амплитуды сигнала стало существенное изменение рассеивающих свойств злокачественной опухоли молочной железы, отличающейся от нормальной ткани высоким содержанием клеточных элементов,
Список литературы Возможности оптической диффузионной спектроскопии в диагностике рака молочной железы (клинический случай)
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). М., 2017. 10.
- Carney P.A., Miglioretti D.L., Yankaskas B.C., Kerlikowske K., Rosenberg R., Rutter C.M., Geller B.M., Abraham L.A., Taplin S.H., Dignan M., Cutter G., Ballard-Barbash R. Individual and combined effects of age, breast density, and hormone replacement therapy use on the accuracy of screening mammography. Ann. Intern Med. 2003; 138: 168-175. DOI: 10.7326/0003-4819-138-3-200302040-00008
- Комарова Л.Е. Роль и место скрининговой маммографии в диагностике рака in situ. Опухоли женской репродуктивной системы. 2008; 3: 20-23.
- Кушлинский Н.Е., Портной С.М., Лактионов К.П. Рак молочной железы (клинические наблюдения, эндокринологические, биохимические и молекулярно-биологические методы исследования). Бюллетень экспериментальной биологии и медицины. 2005; 139(5): 556.
- Popiel M., Mroz-Klimas D., Kasprzak R., Furmanek M. Mammary carcinoma current diagnostic methods and symptomatology in imaging studies. Pol J Radiol. 2012 Oct; 77(4): 35-44.


