Возможности повторных оптимальных циторедуктивных операций в комбинированном лечении рака яичников. Клинический случай
Автор: Молчанов Сергей Валериевич, Коломиец Лариса Александровна, Шпилева Ольга Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.16, 2017 года.
Бесплатный доступ
На сегодняшний день четко не разработан алгоритм лечения рецидива рака яичников, до конца не разработаны критерии отбора пациентов для выполнения вторичных циторедуктивных операций. При этом показана эффективность данного рода оперативных вмешательств при условии отсутствия остаточной опухоли в результате проведенного вмешательства. В ряде исследований разработаны прогностические модели возможности выполнения полных вторичных циторедукций. Приводим собственное наблюдение - случай неоднократных вторичных циторедуктивных оперативных вмешательств в сочетании с химиотерапией по поводу рецидивов рака яичников. Описанный клинический пример указывает на возможности выполнения неоднократных вторичных циторедуктивных вмешательств у больных с рецидивами рака яичников при локальной форме рецидива, оптимальных предшествующих циторедукциях, отсутствии асцита, удовлетворительном состоянии пациенток
Рак яичников, комбинированное лечение, циторедуктивные операции
Короткий адрес: https://sciup.org/140253990
IDR: 140253990 | УДК: 618.11-006.6-089-059 | DOI: 10.21294/1814-4861-2017-16-3-99-103
Текст научной статьи Возможности повторных оптимальных циторедуктивных операций в комбинированном лечении рака яичников. Клинический случай
Рак яичников (РЯ) занимает первое место в структуре смертности среди онкогинекологической патологии. В большинстве случаев выявляется рак яичников III–IV стадий, поэтому, несмотря на проводимое специальное лечение, в 75 % случаев отмечается рецидив заболевания [1, 2].
Роль вторичной циторедуктивной операции при рецидиве РЯ до конца не ясна [3, 4]. В ретроспективном исследовании у пациенток с полной вторичной циторедукцией медиана выживаемости составила 62 мес [5]. Три исследования были посвящены выявлению предикторных факторов выполнения таких операций у пациенток с рецидивом рака яичников. Ретроспективное исследование DESKTOP I под эгидой Arbeitsgemeinschaft Gynakologische Onkologie (AGO) выявило 3 про- гностических фактора оптимальной циторедукции: хороший общий статус пациентки, отсутствие или малый объем асцита (<500 мл) и полная циторедукция при лечении первичной опухоли либо I–II стадия процесса по FIGO. У пациенток со всеми тремя положительными прогностическими факторами вторичная циторедуктивная операция носила характер оптимальной в 79 % случаев [6]. Также было отмечено, что только полная циторедукция улучшает отдаленные результаты комбинированного лечения рецидивного рака яичников. При этом отмечено, что оптимальная циторедуктивная операция (при наличии остаточной опухоли менее 1 см) не улучшает результатов лечения этой категории пациентов. Помимо отсутствия остаточной опухоли в результате оперативного вмешательства среди прогностических факторов выживаемости
Таблица 1
Модель риска вторичной циторедуктивной операции по поводу рецидива РЯ
Исследование DESKTOP II, проводимое AGO и носившее проспективный характер, показало возможность выполнения полной циторедукции в 76 % случаев при условии наличия всех трех предикторных факторов [7]. В исследовании W.J. Tian et al. у пациенток с рецидивом рака яичников выделяли 6 предикторных факторов: стадию по FIGO, наличие или отсутствие остаточной опухоли при первичной операции, время до прогрессирования (в месяцах), общий статус по ECOG, уровень СА-125 при рецидиве и наличие или отсутствие асцита при рецидиве [8]. Согласно предложенной модели, пациенты разделялись на группу низкого (<4,7 балла) и высокого (≥4,7 балла) риска (табл. 1). Так, в группе низкого риска частота полных вторичных циторедукций составила 53,4 %, в то время как у пациенток высокого риска этот показатель был равен 20,1 %.
Среди факторов, обусловливающих целесообразность вторичной циторедуктивной операции, отмечено удаление плохо васкуляризированных опухолей, которые являются нефармакологическими источниками лекарственной резистентности [9]. Кроме того, отмечено, что уменьшение массы рецидивной опухоли способствует снижению количества курсов химиотерапии, что также снижает вероятность возникновения устойчивости к лекарственной терапии. Еще одним фактором является улучшение показателей иммунной системы в результате удаления большой рецидивной опухоли вследствие оперативного вмешательства [10].
Таким образом, на настоящее время показана целесообразность выполнения вторичной циторедукции при условии отсутствия видимой остаточной опухоли в результате оперативного вмешательства, для чего разработан ряд прогностических моделей. Кроме того, одним из факторов благоприятного течения являются наследственные формы рака яичников, наличие мутации BRCA.
Клинический пример
Пациентка Н., 57 лет, находится под наблюдением в Томском НИИ онкологии с 2006 г., когда был поставлен диагноз: Рак яичников IIIa ст. (T3aNxM0). Из анамнеза: в мае 2006 г. при обследо- вании у гинеколога по месту жительства обнаружены двусторонние опухоли яичников до 5 см в диаметре с наличием пристеночного компонента. СА-125 составил 25 Ед/мл. В гинекологическом стационаре выполнена лапароскопия, двусторонняя аднексэктомия. Гистологическое заключение – двусторонняя папиллярная аденокарцинома, преимущественно умеренной степени дифференцировки. Для дальнейшего лечения пациентка направлена в Томский НИИ онкологии. При обследовании (УЗИ малого таза, брюшной полости, СКТ малого таза и брюшной полости) объемные образования, свободная жидкость в малом тазу и брюшной полости не обнаружены, уровень СА-125 в пределах нормы. Учитывая нерадикальность оперативного вмешательства, пациентке проведено 2 курса химиотерапии по схеме САР (циклофосфан 600 мг/м2 + адриамицин 50 мг/м2 + цисплатин 75 мг/м2 в 1-й день, интервал 4 нед.). При проведении химиотерапии наблюдалась лейкопения II–III ст., анемия I ст., выраженный интоксикационный синдром. 23.08.06 выполнена операция – экстирпация матки, оментэктомия. Гистологическое заключение (№15030–050, 1.09.06): микрометастаз папиллярной аденокарциномы умеренной степени дифференцировки в сальник. Учитывая плохую переносимость предыдущей схемы химиотерапии, принято решение о смене режима химиотерапии на СС (карбоплатин AUC 5 + ци-клофосфан 600 мг/м2 в 1-й день, интервал 3–4 нед). Проведено 5 курсов химиотерапии, из осложнений отмечались лейкопения III ст., анемия III ст. При контрольном обследовании после завершения комбинированного лечения при УЗИ и СКТ малого таза и брюшной полости объемные образования не определялись, уровень СА-125 – 7,35 Ед/мл.
В октябре 2010 г. при контрольном обследовании выявлено повышение уровня СА-125 до 160 Ед/мл (время до прогрессирования составило 45 мес). При УЗИ малого таза левее средней линии, выше проекции подвздошных сосудов определялось жидкостное двухкамерное анэхогенное образование, размером 55×61 мм, неправильной формы с неровными четкими контурами. При СКТ органов малого таза и брюшной полости в области заднего полюса селезенки подкапсульно выявлено образование 37×28 мм, накапливающее
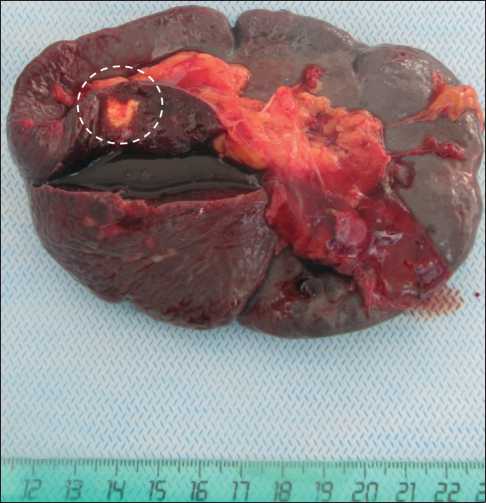
Рис. 1. Удаленная селезенка с метастазом
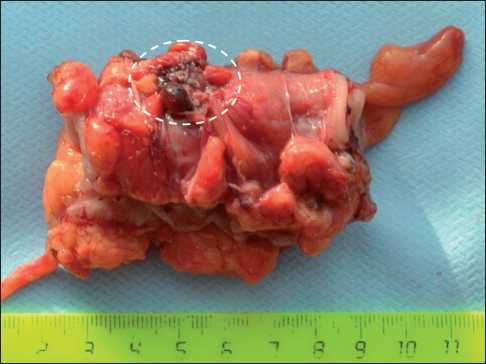
Рис. 2. Резецированная сигмовидная кишка с рецидивной опухолью РЯ
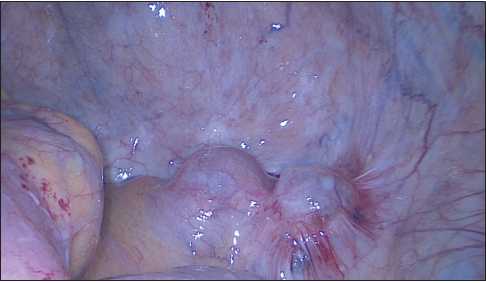
Рис. 3. Эндофото. Рецидивные образования малого таза при лапароскопии
контрастное вещество, в полости малого таза слева определялось объемное образование с бугристыми контурами, размерами 65×44×57 мм, которое тесно прилегает к нисходящему отделу толстой кишки. При анализе на наличие мутации BRCA1 выявлен положительный BRCA-статус. Принято решение в начале противорецидивной химиотерапии провести химиотерапию по схеме СС (карбоплатин AUC 5 + циклофосфан 600 мг/м2 в 1-й день, интервал 3–4 нед). Проведено 4 курса химиотерапии по указанной схеме, из осложнений отмечена лейкопения II ст., анемия I ст. При обследовании наблюдалось снижение уровня СА-125 до 8,99 Ед/мл, по данным МРТ малого таза определялось уменьшение размеров образования в области сигмовидной кишки до 44×16 мм, изменение его характера на жидкостное, а также уменьшение образования в селезенке до 18×11 мм по данным СКТ брюшной полости.
25.03.11 выполнена операция. При ревизии в малом тазу в области брыжейки сигмовидной кишки осумкованная жидкость до 40 мм в диаметре, солидного компонента нет. Произведено удаление образования малого таза, спленэктомия (рис. 1). Учитывая отсутствие видимой остаточной опухоли, операция носила характер полной циторедукции. Гистологическое заключение (№ 6467–74/11, 4.04.11): метастаз серозной аденокарциномы в селезенку, лечебный патоморфоз II степени. Послеоперационный период протекал удовлетворительно, осложнений не наблюдалось. В послеоперационном периоде проведено 3 курса химиотерапии по схеме СС, отмечалась лейкопения I ст., анемия I ст. При контрольном обследовании уровень СА-125 – 7,23 Ед/мл, при УЗИ малого таза и брюшной полости, МРТ малого таза и СКТ брюшной полости объемных образований не выявлено.
В июле 2013 г. при очередном обследовании (время до прогрессирования – 24 мес) по данным УЗИ малого таза выявлено образование 42×24 мм с четкими неровными контурами, неоднородной структуры с наличием солидного пристеночного компонента по латеральной стенке малого таза с выраженным кровотоком, относительно однородной структуры. По данным МРТ в левых отделах малого таза ближе к боковой стенке визуализировалось опухолевое образование кистозно-солидного строения, размерами 41×20×38 мм, оттесняющее сигмовидную кишку медиально, граница между образованием и кишкой на протяжении 40 мм была не видна. Уровень СА-125 – 35,4 Ед/мл, НЕ-4 – 76,5 нг/мл. Проведено 5 курсов химиотерапии по схеме СС. При контрольном обследовании уровень СА-125 – 21,1 Ед/мл, НЕ-4 –70,2 нг/мл. При УЗИ в полости малого таза слева сохранилось изоэхоген-ное образование 41×20 мм с неровными, местами нечеткими контурами, неоднородной структуры за счет точечных и линейных гиперэхогенных включений с умеренно выраженным кровотоком. В феврале 2014 г. выполнена повторная оптимальная циторедуктивная операция по поводу локального рецидива рака яичников в объеме лапаротомии, резекция сигмовидной кишки, т.к. при интраоперационной ревизии выявлено, что рецидивное образование до 2 см в диаметре интимно спаяно со стенкой сигмовидной кишки (рис. 2).
Гистологическое заключение (№ 3538–45/14, 26.02.14): серозная папиллярная аденокарцинома умеренной степени дифференцировки с врастанием в кишку до слизистого слоя. Послеоперационный период протекал удовлетворительно, осложнений не наблюдалось. В послеоперационном периоде проведено 3 курса химиотерапии по схеме СС, отмечалась лейкопения I ст. При контрольном обследовании уровень СА-125 – 6,41 Ед/мл, при УЗИ малого таза и брюшной полости, МРТ малого таза и СКТ брюшной полости объемных образований не выявлено.
В марте 2015 г. (время до прогрессирования – 10 мес) при плановом обследовании, при УЗИ обнаружены объемные образования малого таза 16×11 и 40×33 мм с четкими ровными контурами, анэхогенным содержимым, с солидным пристеночным компонентом. Значения СА-125 и НЕ-4 оставались в пределах нормы – 10,5 Ед/мл и 80,2 рМ соответственно. По данным МРТ малого таза определялось жидкостное образование 33×31×35 мм с наличием пристеночного солидного компонента, медиальнее выявлено аналогичное образование 24×12×16 мм. При СКТ брюшной полости дополнительных образований не обнаружено. Противорецидивное лечение начато с проведения 4 курсов химиотерапии по
Список литературы Возможности повторных оптимальных циторедуктивных операций в комбинированном лечении рака яичников. Клинический случай
- Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2012 г. 2014; 226.
- Ferrero A., Ditto A., Giorda G., Gadducci A., Greggi S., Daniele A., Fuso L., Panuccio E., Scaffa C., Raspagliesi F., Sismondi P., Biglia N. Secondary cytoreductive surgery for isolated lymph node recurrence of epithelial ovarian cancer: A multicenter study. Eur J Surg Oncol. 2014; 40: 891-8. DOI: 10.1016/j.ejso.2013.11.026
- Chuang C.M., Chou Y.J., Yen M.S., Chao K.C., Twu N.F., Wu H.H., Wen K.C., Chen Y.J., Wang P.H., Lai C.R., Chou P. The Role of Secondary Cytoreductive Surgery in Patients with Recurrent Epithelial Ovarian, Tubal, and Peritoneal Cancers: A Comparative Effectiveness Analysis. Oncologist. 2012; 17: 847-855. DOI: 10.1634/theoncologist.2011-0373
- Афанасьев С.Г., Добродеев А.Ю. Циторедуктивные операции (Нужно ли удалять первичную опухоль? Где предел разумной циторедукции? Практическая онкология. 2014; 15 (2): 93-100.
- Bristow R.E., Puri I., Chi D.S. Cytoreductive surgery for recurrent ovarian cancer: a meta-analysis. Gynecol Oncol. 2009; 112: 265-274.
- Harter P., Du Bois A., Hahmann M., Hasenburg A., Burges A., Loibl S., Muenstedt K. Surgery in recurrent ovarian cancer: the Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) DESKTOP OVAR trial. Ann Surg Oncol. 2006; 13: 1702-1710.
- Harter P., Sehouli J., Reuss A., Hasenburg A., Scambia G., Cibula D., Hanker L. Prospective validation study of a predictive score for operability of recurrent ovarian cancer: the Multicenter Intergroup Study DESKTOP II. A project of the AGO Kommission OVAR, AGO Study Group, NOGGO, AGO-Austria, and MITO. Int J Gynecol Cancer. 2011; 21: 289-295. aaafd. DOI: 10.1097/IGC.0b013e31820
- Tian W.J., Chi D.S., Sehouli J., Tropé C.G., Jiang R., Ayhan A., Rabbitt C.A. A risk model for secondary Cytoreductive surgery in recurrent ovarian cancer: an evidence-based proposal for patient selection. Ann Surg Oncol. 2012; 19: 597-604. DOI: 10.1245/s10434-011-1873-2
- Sammartino P., Cornali T., Framarino dei Malatesta M., Piso P. Cytoreductive surgery after recurrent epithelial ovarian cancer and at other timepoints. World J Obst Gynecol. 2013; 2: 101-107. 10.5317/ wjog.v2.i4.10. DOI: 10.5317/wjog.v2.i4.10
- Eisenkop S.M., Friedman R.L., Spirtos N.M. The role of secondary surgery in recurrent ovarian cancer. Cancer. 2012;, 88 (1): 144-153.


