Возможности современных методов нейровизуализации в диагностике и нейромониторинге восстановительного процесса у пациентов после ишемического инсульта
Автор: Екушева Евгения Викторовна, Кипарисова Елена Сергеевна, Курзанцева Ольга Олеговна, Смирнова Ольга Анатольевна
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.9, 2018 года.
Бесплатный доступ
Ишемический инсульт по-прежнему лидирует по первичной инвалидности, обусловленной резидуальным неврологическим дефектом у большей части пациентов. Стойкие двигательные нарушения наблюдаются даже после своевременно и адекватно проведенных реабилитационных мероприятий. В статье обсуждаются возможности современных инструментальных технологий для диагностики и дальнейшего мониторинга процесса восстановления постинсультного дефицита, в основе которого лежит феномен нейропластичности.
Ишемический инсульт, нейровизуализация, магнитно-резонансная томография, нейропластичность
Короткий адрес: https://sciup.org/143166543
IDR: 143166543
Текст научной статьи Возможности современных методов нейровизуализации в диагностике и нейромониторинге восстановительного процесса у пациентов после ишемического инсульта
Большинство заболеваний центральной нервной системы (ЦНС) сопровождаются двигательными нарушениями, приводящими к значительной инвалидизации, социальной дезадаптации и снижению качества жизни пациентов. Среди этих заболеваний церебральный инсульт по-прежнему занимает лидирующие позиции, находясь на втором месте в структуре общей смертности в России и на первом – среди причин первичной инвалидности [1; 8], обусловленной резидуальным неврологическим дефектом у большей части пациентов [6]. Это определяет высокую актуальность, социально-экономическую значимость и необходимость дальнейшего всестороннего изучения проблемы инсульта для уточнения теоретической основы и методологии диагностики и дальнейших путей оптимизации восстановительного процесса у пациентов после ишемического инсульта.
Многочисленные фундаментальные и прикладные клинические исследования последних десятилетий позволили расширить и углубить наши знания о структурной и функциональной реорганизации или пластичности нервной ткани на протяжении всей жизни [3; 5; 11; 17; 18]. Процесс нейропластичности осуществляется во всех клетках и тканях организма и имеет большое значение для физиологического развития, обучения, адаптации и восстановления нарушенных после повреждения функций [3; 15; 18]. Подавляющая часть исследований нейропластического потенциала и реализующих его механизмов с применением высокоинформативных нейровизуализационных методов были проведены при патологии головного мозга, в частности после инсульта, поскольку именно церебральная кора от-

личается наибольшим адаптационным ресурсом [11; 15; 21; 22]. Значительное число работ были посвящены восстановлению двигательных функций [3; 5; 11; 15]. Это связано с большим процентом представленности моторного дефицита, его определенной «стойкостью» и выраженностью у большей части больных, перенесших инсульт, даже после проведения интенсивного восстановительного лечения.
Биологический феномен нейропластичности играет ключевую роль в реабилитации пациентов с неврологическими заболеваниями. Разнообразные технологии и методы восстановительного лечения основаны на знаниях о механизмах и процессах пластической перестройки. В частности, полученные в экспериментальных исследованиях данные позволили постулировать один из важных принципов процесса нейропластичности, активно используемый в настоящее время при определении программы реабилитации у пациентов с заболеваниями ЦНС: возникновение и существование нейрональных связей напрямую зависят от их функциональной активности [2; 11; 19].
Нейровизуализационные методы исследования позволяют изучать разнообразные процессы реорганизации в ЦНС, клинически сопровождающиеся функциональным улучшением [26]. Наиболее распространенными среди этих методов являются различные варианты магнитно-резонансной томографии (МРТ) и позитронно-эмиссионная томография (ПЭТ). Применение современных методов структурной и функциональной визуализации позволяет выявлять различные изменения уже в первые часы появления неврологической симптоматики; оценивать вероятность и степень спонтанного восстановления и планировать в соответствии с полученными данными программу реабилитационных мероприятий у больных с двигательным дефицитом [4].
МРТ представляет собой неинвазивный, высокоинформативный и высокочувствительный (от 60 до 100%) метод исследования внутренних органов и тканей, в основе которого лежит феномен ядерного магнитного резонанса [9; 12]. Стандартное магнитно-резонансное сканирование с использованием различных последовательностей импульсов позволяет получить T1-, Т2-взвешенные изображения исследуемой ткани в нескольких плоскостях. Применяя различные вариации подачи импульсов, можно анализировать больший объем информации о характере, локализации и распространенности патологического процесса в исследуемой ткани [5; 12]. Использование дополнительного контрастирования тканей при МРТ с помощью внутривенного введения препаратов на основе гадолиния (например, магневиста, омнискана, гадовиста), сокращающих продолжительность T1-, Т2-релаксации, позволяет получить более четкую визуализационную картину и соответственно повысить информативность проводимой томографии.
МРТ является безопасным диагностическим методом с возможностью многократного повторного выполнения исследования. При этом абсолютное противопоказание для проведения всех вариантов МРТ – наличие в теле пациента металлических инородных тел и электронных приборов; относительные противопоказания – клаустрофобия, некупированный судорожный синдром, непроизвольная двигательная активность пациента и психические заболевания. В последнем случае у больных в тяжелом состоянии, как и у детей, используют средства для анестезии до проведения процедуры сканирования [9; 12]. Стандартный режим МРТ при исследовании головного и спинного мозга с высокой степенью достоверности позволяет диагностировать неврологические заболевания на ранних стадиях развития, и сегодня этот метод является неотъемлемой составляющей диагностического алгоритма в ежедневной работе невролога.
Томографы последнего поколения с мощностью магнитного поля 1,5–3 Тл и выше имеют быстро нарастающие градиенты, обеспечивающие точную локализацию радиочастотного сигнала и селективную активацию протонов в определенной области МР-исследования, что способствует сокращению времени сканирования. Специализированные режимы МРТ (диффузионная, перфузионная, функциональная МРТ и магнитно-резонансная спектроскопия), называемые еще методами молекулярной визуализации, предоставляют новые диагностические возможности, позволяя более детально изучать различные процессы как на клеточном, так и на молекулярном уровне и выявлять минимальные патологические изменения нейрональной функции [9; 25]. В частности, с помощью МР-трактографии возможно визуализировать диффузионное движение протонов в тканях, посредством перфузионной и функциональной МРТ – перемещение этих частиц с региональным кровотоком; на основе полученных с помощью диффузионной томографии данных изучать активные нейронные связи. Однако эти технически усовершенствованные варианты МРТ требуют дополнительной математической обработки полученного набора изображений.
Диффузионно-взвешенная МРТ является одним из наиболее быстрых, неинвазивных и информативных методов диагностики церебрального ишемического инфаркта без введения контрастного вещества на самых ранних его стадиях (в течение первых минут после сосудистой катастрофы) и дальнейшего наблюдения за развитием патологических изменений в тканях головного мозга [5; 18].
▼ATAT

Оперативное определение признаков ишемического поражения церебральной ткани (до 6 часов) позволяет использовать временной промежуток так называемого терапевтического окна для тромболизиса и частичного или полного восстановления кровотока в пораженных тканях мозга. Данный вариант МРТ (рис. 1) позволяет дифференцировать свежие сосуди- стые очаги от более старых по относительной гипер-денсивности (повышенной интенсивности) первых [24] и тем самым определять формирование повторного инфаркта головного мозга на фоне существующих постишемических изменений, что имеет большое практическое значение для выбора тактики ведения больных после инсульта (табл. 1).
Рис. 1. Диффузионно-взвешенная МРТ головного мозга
А: диффузионно-взвешенное изображение; Б: диффузионная цветовая карта на этом уровне
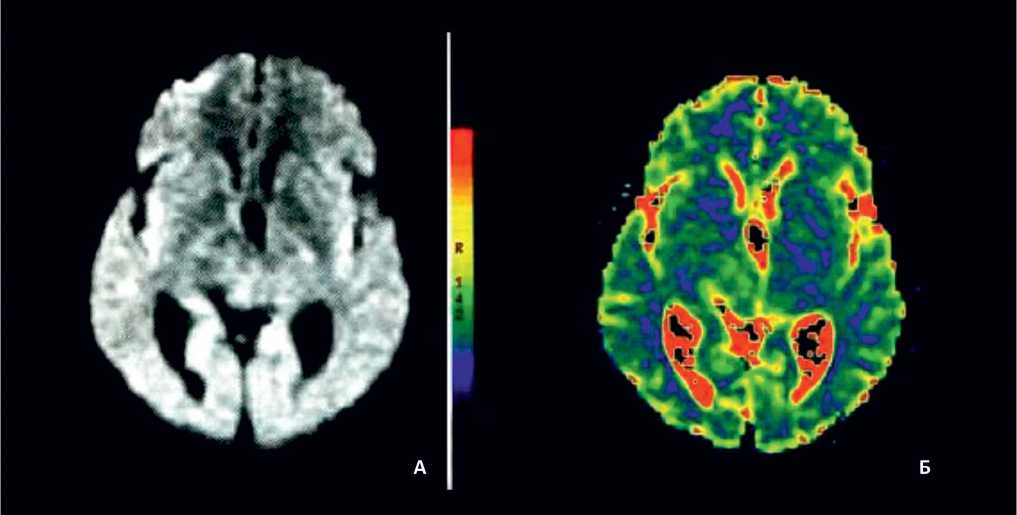
Таблица 1
|
Характеристики сигнала в разных режимах МРТ головного мозга у больных с ишемическим инсультом в динамике [23] |
|||
|
Период после инсульта |
Интенсивность сигнала в зависимости от используемого режима МРТ головного мозга у больных после инсульта |
||
|
Т2-взвешенное изображение |
Диффузионно-взвешенное изображение |
ИКД-изображение |
|
|
0-6 часов |
Нормальная |
Повышенная |
Пониженная |
|
6-48 часов |
От нормальной до повышенной |
||
|
3-10 дней |
Повышенная |
Повышенная или нормальная |
|
|
10 дней |
От повышенной до пониженной |
Повышенная |
|
Примечание: ИКД – измеряемый коэффициент диффузии.

клиническая; ?П1Я поактика.™
Показано, что значимыми факторами в процессе восстановления произвольной моторной активности после поражения головного мозга являются степень повреждения проводящих путей и активация ипсилатеральных двигательных трактов [1; 5; 14]. Оценка структурной целостности кортикоспинального тракта возможна при использовании методики диффузионно-взвешенной МРТ и в меньшей степени – стандартного режима исследования; однако при небольших повреждениях мозга это не всегда осуществимо (см., например: [4; 16]). Более удобным и информативным методом оценки структурной целостности белого вещества является диффузионно-тензорный режим МРТ.
В белом веществе мозга молекулы воды легко диффундируют вдоль аксонов нервных клеток, при этом их движение поперек волокон ограничено непроницаемой миелиновой оболочкой [10]. Данное явление зависимости проникающей способности молекул от направления их перемещения называют анизотропией диффузии, для визуализации которой в ткани применяют диффузионнотензорную МРТ. В сером веществе и цереброспинальной жидкости данный биологический процесс стремится к нулю, так как диффузия молекул одинакова во всех направлениях [7]. С помощью данного режима томографии, называемого МР-трактографией, исследуют траекторию волокон, составляющих нервные тракты, реконструируя в виде пучка кривых трехмерную макроскопическую картину проводящих путей, составляющих белое вещество мозга. Важным преимуществом этого метода является относительное постоянство полученных данных:
при выполнении исследования оцениваются основные направления диффузии молекул воды в зависимости от расположения волокон в пространстве, что позволяет узнать как величину диффузии в этой точке, так и ориентацию волокон в трехмерном пространстве [7].
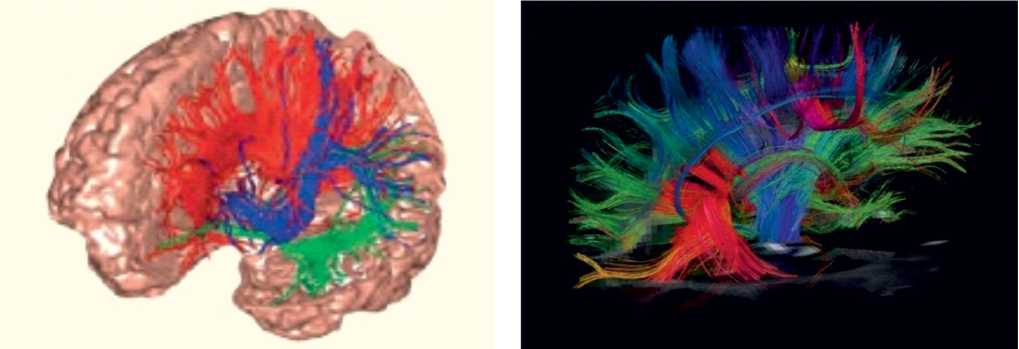
Для проведения МР-трактографии применяются аппараты с индукцией магнитного поля 1,5–3 Тл. После получения изображений выделяется область исследования, в которой будет проводиться реконструкция трак-тограмм, в частности кортикоспинальный тракт на аксиальных изображениях, мозолистое тело на сагиттальных. Реконструкция трактограмм осуществляется при обработке исходных данных с помощью специального программного обеспечения. В результате получаются векторные карты, в которых направление диффузии визуализируется тремя цветами: зеленым – для изображения волокон, ход которых спереди назад и наоборот (у-элементы); красным – для волокон, расположенных слева направо и справа налево (х-элементы); синим – для представления вертикально идущих нервных волокон (z-элементы). Так создаются трехмерные изображения проводящих трактов (рис. 2). Диффузионно-тензорная МРТ позволяет количественно оценить структурную целостность белого вещества, в том числе кортикоспинального тракта, и более точно локализовать поражение функционально значимых проводящих путей, а у постинсультных больных соотнести эти данные с зоной инфаркта [10; 16]. Использование этого метода также позволяет получить определенную информацию и о микроструктуре серого вещества головного мозга [12; 19; 26].
Рис. 2. Диффузионно-тензорная МРТ головного мозга (МР-трактография) Изображение проводящих путей головного мозга
Перфузионная МРТ, как и перфузионная компьютерная томография, применяется для наиболее ранней верификации патологических изменений в веществе головного мозга и анализа степени выраженности ишемии и гипоксии при церебральном поражении: количественной оценки зон гипер- и гипоперфузии, объема мозгового кровотока и других по- казателей [13], в связи с чем последние годы все чаще перфузионно-взвешенные изображения становятся неотъемлемой частью диагностического протокола у больного с подозрением на церебральную ишемию (рис. 3). Следует отметить, что большая информативность перфузионной МРТ достигается при сочетании с диффузионными исследованиями, МР-ангиографией
▼ATAT

и MP-спектроскопией [1]. Диффузионная и перфузионная МРТ используются в острейшем и остром периодах ишемического инсульта для выявления изменений нейрональных структур головного мозга. Сопоставление данных, полученных с помощью обоих методов сканирования, имеет прогностическое значение, в частности позволяет дифференцировать обратимые и необратимые ишемические повреждения нейрональных структур [20], что важно для ведения больных с инсультом [12].
Рис. 3. Разные режимы МРТ головного мозга у больного с ишемическим инсультом
А: Т2-изображение при стандартной МРТ – отсутствие видимых изменений вещества головного мозга; Б: ишемический очаг повышенного сигнала при диффузионно-взвешенной МРТ; В: зона гипоперфузии при карте при перфузионной МРТ превышает очаг поражения при диффузионно-взвешенной МРТ
ДВИ
ПВИ
Функциональная МРТ (фМРТ), как и ПЭТ, является методом исследования функционально обусловленных изменений нейрональной активности головного мозга в зависимости от уровня метаболизма и скорости локального мозгового кровотока [4; 12] (рис. 4).
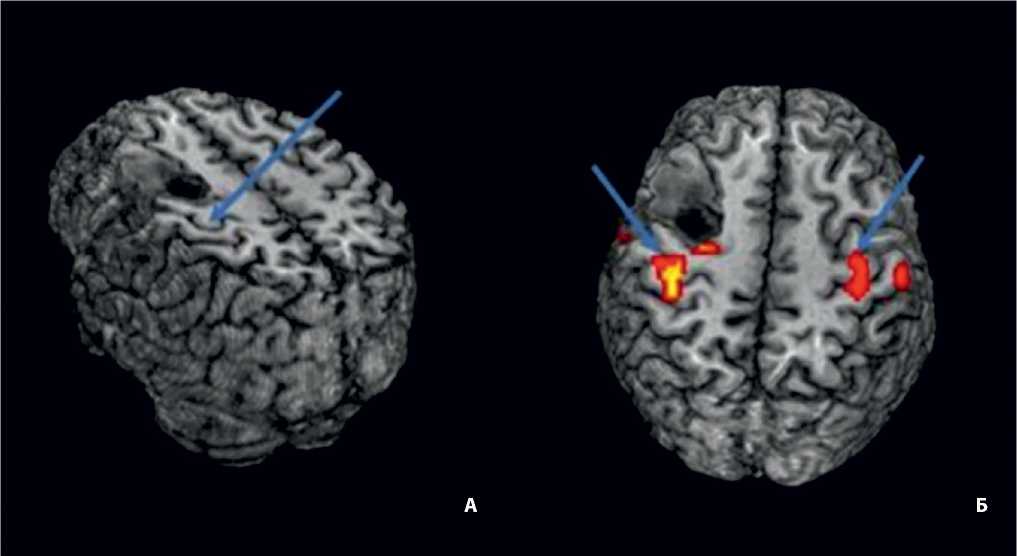
Рис. 4. Функциональная МРТ головного мозга
А: стрелкой указано расположение моторной коры в прецентральной извилине;
Б: карта функциональной МРТ-активности в прецентральной извилине при движении рукой
клиническая; ?П1Я поактика.™
Пространственное разрешение фМРТ наиболее высокое среди всех методов функциональной диагностики, что позволяет применять данную технологию для картирования функционально-специализированных церебральных зон, изучать функциональную активность различных структур головного мозга в норме и при различных патологических состояниях, а также осуществлять динамическое наблюдение за реорганизацией зон церебральной активации в ответ на проводимую фармакологическую терапию или реабилитационные мероприятия на всем протяжении восстановительного периода [12; 13]. Это помогает определить прогностическое значение различных вариантов пластических изменений церебральной коры для восстановления нарушенных функций и выработать оптимальные алгоритмы лечения [4]. Вместе с тем фМРТ является достаточно сложной (как в интерпретации данных, так и в условиях применения) и дорогостоящей методикой и имеет ряд ограничений при ее использовании, влияющих на достоверность и чувствительность полученной информации [4]. В частности, с помощью фМРТ невозможно исследовать изменение кровоснабжения в периинфарктной зоне головного мозга и в прилежащем белом веществе, которое может оказывать значимое влияние на функциональную активность церебральных нейронов в процессе восстановления [1].
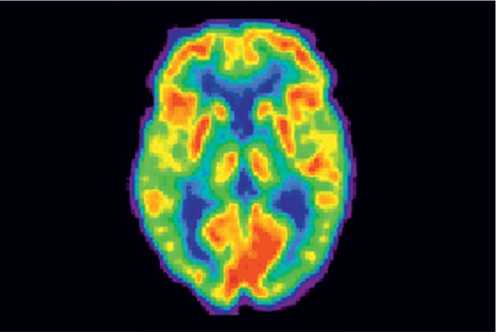
Позитронно-эмиссионная томография позволяет оценивать функциональные изменения на уровне клеточного метаболизма еще на ранних, «доклинических» стадиях заболевания, когда структурные методы нейровизуализации не обнаруживают каких-либо патологических отклонений [4] (рис. 5). Применение этого метода позволяет решать достаточно разнообразные задачи в неврологической практике, в частности прогнозировать течение болезни, в том числе оценить возможность восстановления поврежденной ткани после нарушения мозгового кровообращения, и анализировать эффективность проводимой терапии [19]. Однако ПЭТ также имеет ряд ограничений при ее использовании, препятствующих широкому применению метода в клинической и научно-исследовательской практике [4]. Многие из рассматриваемых вариантов МР-сканирования, как и ПЭТ, не входят в число стандартных или рутинных диагностических методов и используются преимущественно в научно-исследовательских целях. Это касается также воксельной МРТ-морфометрии – одного из наиболее распространенных вариантов МРТ-морфометрии, позволяющей вычислять объем серого и белого вещества головного мозга как в целом, так и в отдельности; выявлять фокальные очаги ишемии и изучать функциональное значение происходящих с течением времени изменений, например более точно оценивать влияние церебральных ишемических очагов на степень утраты тех или иных функций у больных после инсульта [1].
Рис. 5. Позитронно-эмиссионная томография головного мозга
Современные методы нейровизуализации позволяют оценивать структурные и функциональные изменения нейрональных структур и систем ЦНС, в том числе изучать многие процессы в динамике, например церебральный метаболизм и кровоток, функциональное состояние различных отделов головного мозга и многие другие процессы, что, безусловно, значимо влияет на развитие и дальнейшие направления и перспективы всей нейронауки. Поскольку любое повреждение нервной системы приводит к активации процессов нейропластичности в различных структурах на разных уровнях всей системы [15], совершенно очевидно, что разнообразные реабилитационные методы могут способствовать более значительному восстановлению существующего дефекта [3; 15]. При этом неясно, насколько полно использован потенциал ЦНС для компенсации существующих нарушений, какие структуры нервной системы наиболее значимы при пластической реорганизации и какие механизмы лежат в основе данного процесса [5; 13; 26].
В последние годы различные нейровизуализацион-ные технологии и нейрофизиологические методы исследования стали все чаще использоваться на всех этапах медицинской реабилитации для оценки прогностических факторов восстановления нарушенных функций, улучшения критериев отбора пациентов после инсульта, направляемых на реабилитацию, а также в качестве динамического нейромониторинга для анализа структурно-функциональных изменений в процессе лечения, своевременного внесения необходимой коррекции в текущую восстановительную терапию и, следовательно, оптимизации проводимых мероприятий. Непрерывное техническое совершенствование методов МРТ (повышение скорости получения и обработки изображений, создание новых технологий процесса сканирования и других особенностей исследования), наблюдаемое в настоящее время во всем мире, позволяет предположить, что в ближайшем будущем и эти нейровизуализа-ционные технологии станут рутинными в повседневной неврологической практике.
▼ATAT
Список литературы Возможности современных методов нейровизуализации в диагностике и нейромониторинге восстановительного процесса у пациентов после ишемического инсульта
- Бархатов Ю.Д., Кадыков А.С. Прогностические факторы восстановления нарушенных в результате ишемического инсульта двигательных функций//Анналы клинической и экспериментальной неврологии. 2017. № 11(1). С. 80-89.
- Дамулин И.В., Екушева Е.В. Деменция вследствие поражения мелких церебральных сосудов: патогенез, клиника, лечение//Неврология, нейропсихиатрия, психосоматика. 2014. № 4. С. 94-100.
- Дамулин И.В., Екушева Е.В. Инсульт и нейропластичность//Журнал неврологии и психиатрии имени С.С. Корсакова. 2014. № 114(8). С. 136-142.
- Добрынина Л.А. Возможности функциональной и структурной нейровизуализации в изучении восстановления двигательных функций после ишемического инсульта//Анналы клинической и экспериментальной неврологии. 2011. № 5(3). С. 53-56.
- Екушева Е.В. Сенсомоторная интеграция при поражении центральной нервной системы: клинические и патогенетические аспекты: Автореф. дисс.. д-ра мед. наук. М.: РНИМУ им. Н.И. Пирогова, 2016.
- Ишемический инсульт и транзиторная ишемическая атака у взрослых: Клинические рекомендации Министерства здравоохранения Российской Федерации. М., 2015.
- Пирадов М.А., Танашян М.М., Кротенкова М.В. и др. Передовые технологии нейровизуализации//Анналы клинической и экспериментальной неврологии. 2015. № 9(4). С. 11-17.
- Скворцова В.И. Реперфузионная терапия ишемического инсульта//Медицинский консилиум. 2004. № 6(8). С. 610-614.
- Труфанов Г.Е. Лучевая диагностика. М.: ГЭОТАР-Медиа, 2011.
- Basser P.J., Pierpaoli C. Microstructural and physiological features of tissues elucidated by quantitative-diffusion-tensor MRI//Journal Magnetic Resonance. 1996. Vol. 111. P. 209-219.
- Di Pino G., Pellegrino G., Assenza G. et al. Modulation of brain plasticity in stroke: A novel model for neurorehabilitation//Nature Reviews Neurology. 2014. Vol. 10. No. 10. P. 597-608.
- EEG-fMRI. Physiological basis, technique, and applications/Ed. by A. Schmuel. Berlin; Heidelberg: Springer-Verlag, 2010.
- Hara Y. Brain plasticity and rehabilitation in stroke//Journal of Nippon Medical School. 2015. Vol. 82. No. 1. P. 4-13.
- Jang S.H. The role of the corticospinal tract in motor recovery in patients with a stroke: A review//NeuroRehabilitation. 2009. Vol. 24. No. 3. P. 285-290.
- Johansson B.B. Brain plasticity in health and disease//The Keio Journal of Medicine. 2004. Vol. 53. No. 4. P. 231-246.
- Lee J.S., Han M.K., Kim S.H. et al. Fiber tracking by diffusion tensor imaging in corticospinal tract stroke: Topographical correlation with clinical symptoms//NeuroImage. 2005. Vol. 26. P. 771-776.
- Leukel C., Taube W., Beck S., Schubert M. Pathway-specific plasticity in the human spinal cord//European Journal of Neuroscience. 2012. Vol. 35. No. 10. P. 1622-1629.
- McDonnell M., Koblar S., Ward N.S. et al. An investigation of cortical neuroplasticity following stroke in adults: Is there evidence for a critical window for rehabilitation//BMC Neurology. 2015. Vol. 109. No. 15.
- Moller A.R. Neural plastisity and disorders of the nervous system. Cambridge: Cambridge University Press, 2006.
- Moser E., Meyerspeer M., Fischmeister F. et al. Windows on the human body -in vivo high-field magnetic resonance research and applications in medicine and psychology//Sensors (Basel, Switzerland). 2010. Vol. 10. No. 6. P. 5724-5757.
- Murphy T.H., Corbett D. Plasticity during stroke recovery: From synapse to behavior//Nature Reviews Neuroscience. 2009. No. 10. P. 861-872.
- Rossini P.M., Burke D., Chen R. et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee//Clinical Neurophysiology. 2015. Vol. 126. No. 6. P. 1071-1107.
- Warach S., Dashe J.F., Edelman R.R. Clinical outcome in ischemic stroke predicted by early diffusion weighted and perfusion magnetic resonance imaging: A preliminary analysis//The Journal of Cerebral Blood Flow & Metabolism. 1996. Vol. 16. P. 53-59.
- Winnubst J., Cheyne J.E., Niculescu D., Lohmann C. Spontaneous activity drives local synaptic plasticity in vivo//Neuron. 2015. Vol. 87. No. 2. P. 399-410.
- Wissel J., Olver J., Stibrant Sunnerhagen K. Navigating the poststroke continuum of care//Journal of Stroke Cerebrovascular Disease. 2013. Vol. 22. No. 1. P. 1.
- Zorowitz R., Brainin M. Advances in brain recovery and rehabilitation 2010//Stroke. 2011. Vol. 42. No. 2. P. 294-297.


