Возможности ультразвукового исследования и маммографии при дифференциальной диагностике гинекомастии
Автор: Пахомова Р.А., Клименко К.В., Михопулос Т.А., Колесник В.Я., Карамурзаев И.А., Сергеев Д.И.
Журнал: Московский хирургический журнал @mossj
Рубрика: Литературные обзоры
Статья в выпуске: 1 (87), 2024 года.
Бесплатный доступ
В данном литературном обзоре мы рассмотрели диагностику и характерные клинические проявления такого распространенного заболевания среди мужчин, как гинекомастия. Ведущая роль при проведении диагностики с подозрением на гинекомастию отводится ультразвуковому исследованию и маммографии, поэтому в данной статье мы акцентируем внимание на этих исследованиях, как наиболее приоритетных и информативных. При этом в молочной железе могут развиваться как другие доброкачественные, так и злокачественные образования, которые необходимо выявлять на ранних стадиях. Именно поэтому, при постановке диагноза гинекомастии необходимо выполнить диагностические исследования, которые, одновременно не являясь дорогостоящими и трудоемкими, могут помочь достоверно поставить тот или иной диагноз. При этом, понимая, что у пациентов с различным соотношением толщины подкожно-жировой клетчатки, кожного покрова необходимо использовать различные виды диагностики, в том или ином случае в связи с разницей в их эффективности. И будем анализировать на что обращать внимание при различных формах гинекомастии, а также преимущества и недостатки обоих методов диагностического исследования в случае дифференциации гинекомастии с другими патологическими процессами.
Диагностика, гинекомастия, маммография, ультразвуковое исследование
Короткий адрес: https://sciup.org/142240747
IDR: 142240747 | УДК: 618.19-007.61 | DOI: 10.17238/2072-3180-2024-1-92-99
Текст обзорной статьи Возможности ультразвукового исследования и маммографии при дифференциальной диагностике гинекомастии
Гинекомастия как заболевание имеет достаточно высокую частоту встречаемости. Так, по исследованиям, проведенным в 2020 году в Турции на выборке из 1877 пациентов с компьютерной томограммой грудной клетки (для предварительной диагностики пневмонии, вызванной COVID-19) распространенность гинекомастии составила 32,3 % [1], что говорит о большом количестве пациентов с данным синдромом. По результатам другого исследования 30 % мужчин среднего возраста и 60 % мужчин старше 70 лет имеют доброкачественную гистологическую гинекомастию (хотя и в 95 % случаев двусторонняя гинекомастия связана с незлокачественными состояниями) [2].
Дополнительно уже в другом исследовании с 4-хлетним ретроспективным анализом было обнаружено, что гинекомастия является статистически значимым фактором риска (причем абсолютно независящим от индекса массы тела) в этиологии рака грудной железы у мужчин [3, 4].
В настоящее время ультрасонография грудных желез (УЗГ) широко используется в диагностике случаев гинекомастии и более удобна для пациентов мужского пола [5]. В отличие от маммографии ультразвуковое исследование не имеет ограничений по частоте и остаточным следам, однако в настоящее время мы не имеем достаточного количества подтвержденной информации по данному варианту исследования именно в контексте гинекомастии, когда мы рассматриваем патологическую ткань и нормальный вариант развития грудной железы.
На текущий момент можно обнаружить недостаточное количество исследований по диагностики гинекомастии. Самое большое количество трудов было зафиксировано за последние 20 лет XX столетия, далее происходило снижение объема научных работ в данном направлении, при этом без динамического отслеживания результативности или сравнения эффективности [6].
Цель исследования. Обобщение известных данных, касающихся методов инструментальной диагностики разных видов гинекомастии, синтез знаний из разных областей медицинской науки для удобства использования врачами разных специальностей.
Материалы и методы
В качестве материала статьи были использованы исследования, которые базировались на диагностике пациентов преимущественно европеоидной расы от 25 до 65 лет. Максимальное внимание уделялось ретроспективному анализу, а также перекрестным исследованиям, где диагностика проводилась не только при помощи ультразвукового исследования и маммографии, но также биопсии грудной железы с дальнейшим гистологическим исследованием и точной верификацией диагноза.
Результаты и обсуждение
Большинство выявленных образований у мужчин в грудной железе являются доброкачественными, и наиболее частой причиной является гинекомастия. Дифференциальная диагностика чаще всего проводится между основным диагнозом – истинной гинекомастией и такими заболеваниями, как ложная гинекомастия и злокачественная опухоль [7]. Гинекомастия чаще всего развивается в ранний период полового созревания или после 60 лет [8], морфологически гинекомастия соответствует фиброаденоматозу молочной железы у женщин [9].
Ультразвуковое исследование является основным инструментом визуализации для диагностики и классификации гинекомастии, что позволяет избежать дополнительных рентгеновских исследований или инвазивных исследований в случае диффузной гинекомастии [10]. Конечно, гистологическое исследование имеет высокую специфичность с точки зрения верификации диагноза, однако в рутинной практике возможно уменьшить количество травматизации, которая происходит во время проведения биопсии при применении ультразвукового исследования [11].
Преимущества ультразвукового исследования в диагностике:
– Не имеет лучевой нагрузки (в отличие от маммографии и компьютерной томографии).
– Не имеет противопоказаний для повторных исследований, имеется возможность наблюдать пациента в динамике.
– Не имеет противопоказаний.
– Простота исследования.
– Можно исследовать как ткани грудной железы, так и прилегающих областей (в том числе лимфатические узлы) [12].
Диагностическая картина у пациента без патологий соответствует следующим параметрам. При исследовании как мужских, так и женских грудных желез они будут идентичны:
– кожа прослеживается в виде гиперэхогенной ровной линии толщиной 5–7 мм;
– гипоэхогенное изображение подкожной жировой клетчатки с редкими и тонкими слабо интенсивными эхопозитивными сигналами от соединительнотканных септ;
– сосково-ареолярный комплекс визуализируется в виде образования с низкой эхогенностью округлой формы, за ним имеется акустическая тень;
– грудные мышцы – разнонаправленные волокна, параллельны коже. Между большой и малой грудными мышцами имеется гиперэхогенная перегородка. Присутствует фасция в виде гиперэхогенной линии;
– межреберные мышцы – гипоэхогенные. Хорошо визуализируется перимизий и эндомизий на фоне мышечной ткани;
– гипоэхогенные образования между грудной мышцей, ее фасцией и задним листком расщепленной фасции являются жировой тканью;
– ребра – образования с акустической тенью, которые имеют высокую эхогенность, а также визуализируются в виде овала;
– плевра – гиперэхогенная линия;
– все, что находится под ареолой, выявляется в виде гиперэхогенного образования [12, 13, 14].
При этом нужно учитывать, что люди разного возрастного диапазона имеют специфические характеристики на ультразвуковом исследовании:
Пациенты до 20 лет имеют неоднородную структуру грудной железы из-за процессов перестройки организма с отдельными гипоэхогенными участками жировой ткани. Протоки визуализируются в ретроалеолярной зоне как гипоэхогенные структуры. Отдельно необходимо отметить, что подростковая гинекомастия считается вариантом нормы, не требующим специального лечения [15, 16].
У пациентов от 20-и до 50-и лет, в отличие от периода полового созревания, жировая ткань гипоэхогенна, но дерма выявляется в качестве гиперэхогенной линии. Фиброзная ткань визуализируется в виде мелких гиперэхогенных образований.
Пациенты старше 50-и лет, дерма делится на две гиперэхогенные линии, между которыми выявляется гипоэхогенная прослойка из жировой ткани. Визуально определяется большое количество жировых отложений, в виде гипоэхогенных структур с четкой гиперэхогенной границей [3, 13].
Патологические образования чаще всего обнаруживаются в ретроареолярной области [12].
Злокачественные образования в грудной железе при помощи ультразвукового исследования чаще всего обнаруживают при помощи цветного допплеровского исследования (рис. 1) [17], когда выявляется увеличение количества сосудов, выполняется дифференциальная диагностика и позволяет отделить от картины гинекомастии, когда такого роста не происходит [18].
Происходит дублирование сосудистой сети вокруг опухоли, где новые сосуды располагаются в хаотичном направлении с большим количеством анастомозов, и это позволяет предположить ее злокачественность. Некоторые диагносты считают достаточным оценивать только два параметра: максимальную скорость кровотока в сосудах и индекс резистентности/ пульсативности [5, 19, 20, 21]. Однако присутствует мнение, что оба индекса не являются достоверными для оценки злокачественности процесса. И даже в самой оценке индексов есть расхождения. Одни источники считают, что резистентность ниже 0,78 четко показывает злокачественность, другие считают диапазон в 0,7–0,8 процессом малигнизации1.
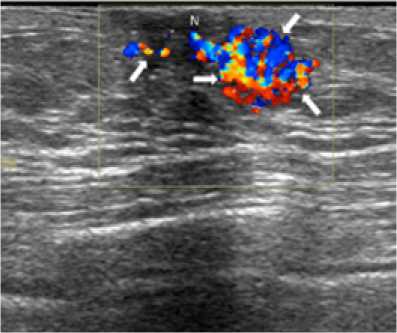
Рис. 1. Изображение карциномы при доплеровском исследовании
Fig. 1. Image of the carcinoma in the Doppler diagnostics
Допплерография увеличивает количество информации без проведения биопсии, что позволяет увеличить шансы ранней диагностики злокачественного процесса. При этом необходимо понимать, что ультразвуковое исследование позволяет найти изменения в ткани и сосудах грудной железы (что косвенно помогает исключить или подтвердить доброкачественность или злокачественность), но не позволяет установить стадию новообразования [18], а также нет четких критериев, чтобы отделить норму от патологии.
Дополнительно к вышесказанному – информативность ультразвукового исследования у разных авторов может сильно различаться. Средние диапазоны следующие:
– Чувствительность 70–95 %
– Специфичность 60–80 %.
Не проводилось обширной исследовательской работы для построения четких схем диагностики.
Следующим вариантом инструментальной дифференциальной диагностики является маммография. Производится в боковой проекции, билатерально, с прицельным снимком в случае необходимости (рис. 2) [22].
Она позволяет исследовать все составляющие грудной железы и анатомические образования, которые находятся на передней поверхности грудной клетки: жировую ткань, сосково-ареолярный комплекс, кожу, соединительную ткань и сосуды. Но результативность данного метода зависит от плотности желез и их размера [5, 23].
1 Методические рекомендации по выполнению программы популяционного скрининга злокачественных новообразований молочной железы среди женского населения / Беляев А.М [и авторский коллектив] / 2019
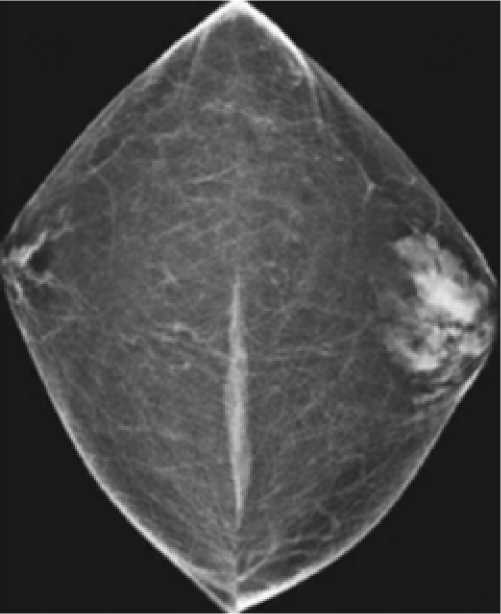
Рис. 2. Маммография мужской груди с диагнозом
«односторонняя гинекомастия»
Fig. 2. Mammography of a male breast diagnosed with unilateral gynecomastia
Гинекомастия классифицируется на диффузную и узловую формы [13]. Диффузная также делится на 2 клинические формы:
– Дендритическая – наиболее частый вариант, который обнаруживается в 55 % случаев обнаружения узлового образования в грудной железе.
– Паренхиматозная – достаточно редкая форма, ее иногда называют «гинекомастией типа железы взрослой женщины», из-за данных на маммографии и внешних признаков. Частота составляет около 10 % [18].
Паренхиматозную определяют на маммографии по следующим признакам:
– четкие контуры;
– поверхностные структуры без изменений;
– имеются как просветления, так и затемнения. Затемнения имеют неоднородную структуру, похожи на железистую ткань у женщин. Просветления единичные, до 5 мм;
– нет изменений в сосудистой сети [24, 25].
Дендритическую форму определяют на маммографии по следующим признакам:
– Также, как и в паренхиматозном варианте, отсутствуют изменения сосудов.
– Имеются затемнения в форме неправильного треугольника с вершиной, касающейся сосково-ареолярного комплекса изнутри, основания параллельны мышцам передней грудной стенки.
– В некоторых случаях можно обнаружить затемнения овальной или неправильной круглой формы.
– Имеются неровные разветвленные контуры, которые и дали название этому варианту гинекомастии [24, 25].
При дендритической гинекомастии, согласно литературным источникам, процесс идет за соском, в центре грудной железы и при маммографии выглядит как плотная небольшая тень, которая имеет четкие границы. При этом грудная железа не увеличена. Конечно, встречаются редкие случаи, когда при обследовании видны изменения на периферических участках. Однако эти изменения всегда связаны с ареолой через млечные протоки [3].
Узловую форму обнаруживают в 20 % случаев. Причем эта форма чаще всего является двусторонней по сравнению с другими – практически в 50% случаев. Многие отмечают сложность в дифференцировании со злокачественным процессом грудной железы. Изменения зачастую происходят за сосково-ареолярным комплексом, чаще всего непосредственно в центре железы. Увеличение грудной железы в данном случае происходит у 35 % всех пациентов [11, 12].
Узловую форму определяют на маммографии по следующим признакам:
– Практически всегда присутствует втяжение соска.
– Средняя интенсивность затемнения, имеет неправильную форму. Чаще всего – неправильный круг. Иногда можно отметить случаи визуализации образования звездчатой формы.
– Контуры нечеткие. Изредка обнаруживаются лучистые контуры (связаны с образованием радиально отходящих тяжей).
– Неоднородность затемнения зависит от разницы увеличения железистой ткани и стромы, когда в определенном участке превалирует тот или иной компонент.
– Размеры не превышают 4 см [24, 25].
Отдельного внимания заслуживают признаки злокачественных процессов при проведении маммографии (рис. 3) [22]. Они включают:
– однородное затемнение без просветления в виде «ободка» на рентгеновских снимках; (отсутствие «ободка» на рентгеновских снимках указывает с высокой долей вероятности на доброкачественность имеющегося образования);
– кальциноз в виде «дорожки», идущей к сосково-ареолярному комплексу;
– если область занимает больше 25 мм, то можно сразу отличить от доброкачественного процесса благодаря полицикличности и четкой очерченности. Если меньше, то диагностирование при помощи маммографии затруднено.
– наиболее значимым признаком злокачественности является образование с неровными лучистыми контурами – более 90 % случаев [26].
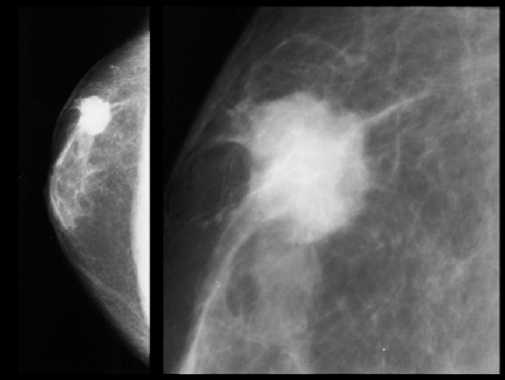
Рис. 3. Инвазивная протоковая карцинома
Fig. 3. Invasive ductal carcinoma
Маммография является приоритетным диагностическим методом при дифференциальной диагностике истинной и ложной гинекомастии (рис. 4) [22]. Частота ложной гинекомастии составляет порядка 15 % у мужского пола. Это случаи, когда на увеличение груди влияет только подкожно-жировая клетчатка, но без каких-либо образований в самой грудной железе. При помощи данного метода можно легко провести дифференциальную диагностику, когда мы видим только прозрачный широкий участок без уплотнений или образований, который находится под кожей. Но при этом результативность маммографии сильно зависит от соотношения тканей у конкретного пациента. При большом количестве жировой ткани чувствительность достигает 100 %, при обследовании пациентов с повышенной рентгеновской плотностью тканей чувствительность снижается на 10 – 40 %.
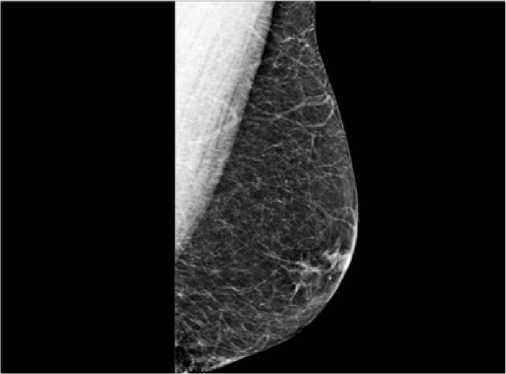
Рис.4. Маммографическая картина ложной гинекомастии
Fig. 4. Mammographic picture of false gynecomastia
Заключение
Многие специалисты считают гинекомастию всего лишь вторичным процессом, не учитывая вопросы малигнизации, неэффективности медикаментозного лечения и в целом качество жизни пациента, апеллируя к исключительно эстетической проблеме гинекомастии. При этом диагностические методы, которые на текущий момент присутствуют в медицине, позволяют с высокой эффективностью провести дифференциальную диагностику. Ультразвуковое исследование, а также маммография с морфологическим исследованием являются приоритетными в использовании для проведения дифференциальной диагностики между доброкачественными и злокачественными процессами в тканях грудной железы.
Список литературы Возможности ультразвукового исследования и маммографии при дифференциальной диагностике гинекомастии
- Aslan Ö., Bayraktaroğlu S., Çinkooğlu A., Ceylan N., Savaş R., Oktay A. Prevalence of Incidental Gynecomastia by Chest Computed Tomography in Patients with a Prediagnosis of COVID-19 Pneumonia. European Journal of Breast Health, 2021, vol. 17, № 2, pp. 173-179. https://doi.org/10.4274/ejbh.galenos.2021.6251
- Meguerditchian Ari-N., Falardeau M., Martin G. Male breast carcinoma. Canadian Journal of Surgery, 2002, Vol 45, № 4, pp. 296-302.
- Brinton L.A., Cook M.B., McCormack V., Johnson K.C., Olsson H., Casagrande J.T., Cooke R., Falk R.T., Gapstur S.M., Gaudet M.M., Gaziano J. M., Gkiokas G. at all. Anthropometric and hormonal risk factors for male breast cancer: male breast cancer pooling project results. J. Natl. Cancer Inst, 2014, Vol. 106. https://doi.org/10.1093/jnci/djt465
- Мошуров И.П., Воротынцева Н.С., Ганзя М.С., Знаткова Н.А., Овечкина М.В. Современные взгляды на диагностику рака молочной железы у мужчин. Вестник экспериментальной и клинической хирургии, 2016. Т. 9. № 4. С. 289-295. https://doi.org/10.18499/2070-478X-2016-9-4-289-295
- Cuhaci N, Polat S.B., Evranos B., Ersoy R, Cakir B. Gynecomastia: Clinical evaluation and management. Indian Journal of Endocrinology and Metabolism, 2014, vol. 18, № 2, pp. 150-158. https://doi.org/10.4103/2230-8210.129104
- Nguyen P.L., Alibhai S.M. H., Basaria S., D’Amico A.V., Kantoff Ph.W., Keating N.L., Penson D.F., Rosario D.J., Tombal B., Smith M.R. Adverse effects of androgen deprivation therapy and strategies to mitigate them. European Urology, 2015, vol. 68, pp. 909-910. https://doi.org/10.1016/j.eururo.2014.07.010
- Önder Ö., Azizova A., Durhan A., Elibol F.D., Akpınar M.G., Demirkazık F. Imaging findings and classification of the common and uncommon male breast diseases. Insights Imaging, 2020, vol. 11, № 1. https://doi.org/10.1186/s13244-019-0834-3
- Mekheal E., Kania B., Vishwakarma U., Joseph D., Kumar V., Maroules M. Gynecomastia and Malignancy: A Case of Male Invasive Ductal Breast Carcinoma Treated with Neoadjuvant Chemotherapy. Am J Case Rep, 2022, vol. 23. https://doi.org/10.12659/ajcr.937370
- Lapid O., Jolink F., Maijer S.L. Pathological findings in gynecomastia: analysis of 5113 breasts. Annals of Plastic Surgery, 2015, vol. 74, № 2, pp. 163-166. https://doi.org/10.1097/SAP.0b013e3182920aed
- Telegrafo M., Introna T., Coi L., Cornacchia I., Rella L., Stabile Ianora A.A., Angelelli G., Moschetta. M. Breast US as primary imaging modality for diagnosing gynecomastia. Official Journal of ACOI, 2016, vol. 37, № 3, pp.118-122. https://doi.org/10.11138/gchir/2016.37.3.118
- Акимова В.Б., Акимов Д.В. Сравнительный анализ результатов ультразвукового исследования и рентгеновской маммографии у мужчин с объемной патологией в проекции грудной железы. Опухоли женской репродуктивной системы, 2015. № 3. С. 35-42. https://doi.org/10.17650/1994-4098-2015-1-35-42
- Шаповалова А. Г. Ультразвуковое исследование как высший уровень клинической диагностики. Медицина и экология, 2013. № 1. C. 11-14.
- Яшина Ю.Н., Роживанов Р.В., Курбатов Д.Г. Современные представления об эпидемиологии, этиологии и патогенезе гинекомастии. Андрология и генитальная хирургия, 2014. № 3. С. 8-15. https://doi.org/10.17650/2070-9781-2014-3-8-15
- Moore D.C., Schlaepfer L.V., Luc P. Sizonenko P.C. Hormonal Changes During Puberty: V. Transient Pubertal Gynecomastia: Abnormal AndrogenEstrogen Ratios. J. Clin. Endocr. and Metab, 1984, vol. 58, Iss. 3, pp. 492-499. https://doi.org/10.1210/jcem-58-3-492
- Osler D.C. Management of Pubertal Gynecomastia. J. Pediatr, 1977, vol. 91, Iss. 5, pp. 856-857. https://doi.org/10.1016/s0022-3476(77)81079-2
- Carlson H.E. Approach to the patient with gynecomastia. The Journal of Clinical Endocrinology and Metabolism, 2011, vol. 96, Iss. 9, pp. 15-21. https://doi.org/10.1210/jcem.96.9.zeg15a
- Yuan W.H., Li A.F., Chou Y.H., Hsu H.C., Chen Y.Y. Clinical and ultrasonographic features of male breast tumors: A retrospective analysis. PloS one, 2018, vol. 13, Iss. 3. https://doi.org/10.1371/journal.pone.0194651
- Yuksekkaya R., Celikyay F., Ozcetin M., Yuksekkaya M., Asan Y. Assessment of color Doppler ultrasonography findings in gynecomastia. Med Ultrasonography, 2013, vol. 15, № 4, pp. 285-288. https://doi.org/10.11152/mu.2013.2066.154.ry2
- Ramadan S.U., Gökharman D., Kaçar M., Koşar P., Koşar U. Assessment of vascularity with color Doppler ultrasound in gynecomastia. Diagn Interv Radiol, 2010, № 16, pp. 38-44. https://doi.org/10.4261/1305-3825.dir.2395-08.1
- Котляров П.М., Сенча А.Н., Кашманова А.В. Роль ультразвуковой эластографии в диагностике очаговых образований молочных желез у мужчин. Вестник РНЦРР Минздрава России, 2015. Т. 15. http://vestnik-rncrr.ru/vestnik/v15/papers/kashmanova_v15.htm
- Bowman J.D., Kim H., Bustamante J.J. Drug-Induced Gynecomastia. Pharmacotherapy, 2012, Vol. 32, Iss. 12, pp. 1123-1140. https://doi.org/10.1002/phar.1138
- Glassman L. M. Pathology of the Male Breast. Radiology Assistant. Available at: https://radiologyassistant.nl/breast/male-breast/pathology-ofthe-male-breast
- Billa E., Kanakis G.A., Goulis D.G. Imaging in gynecomastia. American Society of Andrology and European Academy of Andrology, 2021, Vol. 9, Iss. 5, pp. 1444-1456. https://doi.org/10.1111/andr.13051
- Мошуров И.П., Воротынцева Н.С., Ганзя М.С. Гинекомастия как паранеопластический синдром. Вестник экспериментальной и клинической хирургии, 2018. Том XI. № 1. С. 38-45. https://doi.org/10.18499/2070-478X-2018-11-1-38-45
- Борисова М.С., Мартынова Н.В., Богданов С.Н. Рентгеновская маммография в диагностике рака молочной железы. Вестник РНЦРР Минздрава России, 2013. Т. 13. http://vestnik.rncrr.ru/vestnik/v13/papers/borisova1_v13.htm
- Терновой С.К., Абдураимов А.Б. Лучевая маммология. М.: ГЭОТАР-Медиа, 2007. С. 53-58.


