Возраст-ассоциированный канцерогенез: Оценка риска и его эволюция
Автор: В.М. Чигвинцев, П.В. Трусов
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 4 (51), 2025 года.
Бесплатный доступ
В исследовании разработана и параметризована феноменологическая математическая модель на основе системы эволюционных уравнений, предназначенная для количественной оценки влияния возраста на популяционный онкологический риск. Модель описывает динамику риска как функцию вероятности возникновения заболевания и его тяжести, используя ретроспективные популяционные данные. Для выделения фонового возраст-ассоциированного компонента, очищенного от влияния локальных канцерогенных факторов, использован 10-й перцентиль заболевае-мости по административным территориям. Параметры уравнений оценивались методом наименьших квадратов. Параметризация модели выявила значительную межнозологическую вариабельность ключевых параметров, отражающую специфику патогенеза различных типов опухолей. Анализ возрастной динамики структуры риска показал систематическое перераспределение вклада отдельных нозологий. Установлено прогрессирующее домини-рование в структуре риска злокачественных новообразований органов пищеварения, которые к старшим возрастным группам становятся ведущей возраст-ассоциированной патологией. Параллельно наблюдается существенное снижение относительного вклада ряда нозологий, в том числе рака молочной железы. Полученная картина возрастной эволюции онкологических рисков демонстрирует расхождение со сложившимися приоритетами в системе онкологической помощи, которые зачастую ориентированы на нозологии с высокой медианной заболеваемостью. Результаты моделирования указывают на необходимость смещения фокуса на патологии с наиболее интенсивным возрастным накоплением риска и летальности. К последним, в первую очередь, относятся опухоли пищеварительной системы, которые формируют основной вклад в возраст-ассоциированную онкологическую смертность, что не в полной мере учитывается в существующих подходах. Это подчеркивает необходимость адаптации профилактических и скрининговых стратегий с учетом биологически детерминированной структуры популяционного риска, смещая акцент в сторону целевой геронтоонкологии. Разработанная модель адекватно описывает возраст-ассоциированный канцерогенез и создает основу для оценки дополнительного риска от специфических эндо- и экзогенных воздействий и разработки целевых геронтоонкологических стратегий.
Онкологический риск, возрастная динамика, математическое моделирование, эволюционные уравнения, фоновый риск, тяжесть заболевания, нозологическая специфичность, канцерогенез, вероятность заболевания
Короткий адрес: https://sciup.org/142246706
IDR: 142246706 | УДК: 616-006, 519.2 | DOI: 10.21668/health.risk/2025.4.14
Текст научной статьи Возраст-ассоциированный канцерогенез: Оценка риска и его эволюция
Рост заболеваемости злокачественными новообразованиями во всем мире, включая Российскую Федерацию [1], обусловливает актуальность разработки точных методов количественной оценки вероятности их возникновения [2]. Особое значение приобретает прогнозирование индивидуальных и популяционных онкологических рисков, необходимое для планирования профилактических мероприятий и оптимизации системы здравоохранения.
Ключевым аспектом оценки онкологических рисков является анализ фоновой возраст-ассоцииро-ванной компоненты [3]. Возраст остается одним из наиболее значимых факторов риска развития злокачественных новообразований, при этом количественная связь между старением и канцерогенезом требует дальнейшего изучения. Выделение фонового риска необходимо для последующей оценки и категорирования влияний различных канцерогенных факторов –
Чигвинцев Владимир Михайлович – кандидат физико-математических наук, старший научный сотрудник отдела математического моделирования систем и процессов (e-mail: ; тел.: 8 (342) 237-18-04; ORCID: .
Трусов Петр Валентинович – доктор физико-математических наук, профессор, главный научный сотрудник отдела математического моделирования систем и процессов; заведующий кафедрой математического моделирования систем и процессов (e-mail: ; тел.: 8 (342) 239-16-07; ORCID: .
как экзогенных (химические канцерогены, радиация), так и эндогенных (гормональные нарушения, хронические воспаления) [4].
Биологические предпосылки связи старения и канцерогенеза включают несколько фундаментальных механизмов. Накопление соматических мутаций с возрастом увеличивает вероятность злокачественной трансформации клеток [5]. Ослабление иммунного надзора, известное как иммуносенесцен-ция, снижает эффективность элиминации опухолевых клеток [6]. Возрастные изменения микроокружения опухоли, включая хроническое воспаление и изменения во внеклеточном матриксе, создают благоприятные условия для прогрессии опухоли [7]. Эпигенетические изменения и укорочение теломер также вносят значительный вклад в возраст-ассо-циированный канцерогенез [8]. Накопление повреждений ДНК и нарушение репарационных механизмов с возрастом дополнительно увеличивают онкологический риск [9].
Сложность и многокомпонентность процессов канцерогенеза обусловливают необходимость использования математических методов для их описания. Существующие подходы можно условно разделить на два больших класса в зависимости от уровня детализации описываемых биологических процессов.
К первому классу относятся феноменологические модели, или модели «черного ящика»1. Эти подходы оперируют обобщенными, доступными для измерения параметрами на макроуровне, не углубляясь в описание внутренних механизмов. Классическим примером является модель Армитиджа – Долла, предполагающая многостадийный канцерогенез. Она хорошо описывает зависимость «доза – эффект» для отдельных канцерогенов, но не учитывает возрастную динамику спонтанного фонового риска [10].
Ко второму классу принадлежат механистические модели (модели «белого ящика»), направленные на прямое описание внутренних биологических процессов канцерогенеза. В эту группу входят стохастические модели, основанные на теории ветвящихся процессов, которые позволяют описывать динамику клеточных популяций. Однако их параметризация требует данных о кинетике клеточного обновления, часто недоступных в популяционных исследованиях [11]. Сюда же относятся современные многостадийные модели, включающие описание динамики стволовых клеток. Они предоставляют более точное биологически обоснованное описание канцерогенеза, но обладают высокой сложностью и требуют большого числа трудноизмеримых параметров [12].
В отличие от указанных подходов, использованная в настоящем исследовании модель на основе эволюционных уравнений занимает промежуточное по- ложение. Будучи феноменологической на макроуровне, она, однако, позволяет одновременно описывать динамику как вероятности возникновения заболевания, так и его тяжести, используя доступные данные популяционных регистров. Такой подход обеспечивает баланс между адекватностью описания и возможностью практической параметризации модели.
Цель исследования – разработать и параметризовать систему эволюционных уравнений для оценки влияния возраста на популяционный риск онкологических заболеваний.
Материалы и методы. Исследование выполнено на основе ретроспективных данных популяционного канцер-регистра Пермского края. Анализу подлежали зарегистрированные случаи онкологических заболеваний за 16-летний период (2003–2018 гг.). Общий объем выборочной совокупности составил свыше 150 тысяч наблюдений. Из общего массива были выбраны 13 нозологических форм злокачественных новообразований. По каждому случаю была доступна следующая информация: возраст пациента на момент установления диагноза, территория проживания в разрезе одной из 47 территориальных единиц (30 административных районов и 17 городов краевого значения), а также исход заболевания (факт смерти). Нижняя граница возрастного диапазона исследования установлена на уровне 20 лет. Данное ограничение обусловлено тем, что в более молодых возрастных группах этиология онкологических заболеваний в значительной степени ассоциирована с врожденными генетическими аномалиями и наследственными синдромами, тогда как вклад собственно возраст-зависимых механизмов канцерогенеза, таких как кумулятивное накопление соматических мутаций и ослабление иммунного надзора, становится статистически значимым именно в постпубертатном периоде. Верхняя возрастная граница анализа ограничена 70 годами. Это связано с редукцией репрезентативности данных в старших возрастных группах, вызванной как объективной редкостью событий в когортах долгожителей, так и потенциальными артефактами учета (сопутствующая патология, затрудняющая верификацию основного диагноза), что может приводить к нестабильным оценкам параметров модели.
Введем ключевое для данного исследования понятие онкологического риска как функции, связывающей вероятность развития заболевания с мерой его тяжести. Общая формула вычисления возрастного риска i -го онкологического заболевания может быть записана в виде:
R( t ) = p,( t ) ■ g i ( t ) , (1)
где Ri ( t ) – риск i -го онкологического заболевания в возрасте t (лет);
p i ( t ) - вероятность возникновения i -го онкологического заболевания в возрасте t (лет);
g i ( t ) - показатель тяжести i -го онкологического заболевания в возрасте t (лет).
Дифференциальное уравнение возрастной динамики вероятности заболевания можно определить с помощью следующего уравнения:
dpd ^ t ) = a i • p^ t ) , (2)
где p i ( t ) - вероятность i -го онкологического заболевания в возрасте t (лет); a i - коэффициент возрастного фонового накопления вероятности i -го онкологического заболевания на популяционном уровне в год.
Несмотря на наличие аналитического решения, уравнение (2) может быть представлено в рекуррентном виде, удобном для численной реализации модели и прямой подгонки параметров к дискретным эпидемиологическим данным:
Р,( t + 1 ) = P i ( t ) + a i • P i ( t ) , (3) где p i ( t + 1 ) - вероятность i -го онкологического заболевания в возрасте t+1 (лет);
p i ( t ) - вероятность i -го онкологического заболевания в возрасте t (лет);
a i - коэффициент возрастного фонового накопления вероятности i -го онкологического заболевания на популяционном уровне в год.
Идентификация параметров p i ( t = 20 ) и a i выполнена на основе данных о заболеваемости по всем административным территориям и возрастным группам (с шагом 5 лет). Для исключения влияния спектра канцерогенных факторов в каждой возрастной группе выделен 10-й перцентиль.
Определение 10-го перцентиля в качестве репрезентативного уровня для оценки фонового онкологического риска основано на необходимости решения двух взаимосвязанных методологических проблем. При использовании повышенных значений перцентиля (квантилей выше 50 %) происходит включение в анализ территорий с выраженным влиянием локальных канцерогенных факторов, таких как промышленное загрязнение или региональные экологические особенности. В данной ситуации модель перестает отражать фоновую возрастную динамику, начиная описывать комбинированный эффект геронтологических процессов и экзогенных воздействий, что искажает оценку собственно воз-раст-ассоциированного компонента риска. Параллельно существует проблема использования заниженных перцентилей (1–5 %), статистическая несостоятельность которых проявляется в условиях редких событий, характерных для онкологической заболеваемости в младших возрастных когортах.
При анализе малых территориальных единиц это приводит к включению в модель возрастных когорт с нулевой заболеваемостью, что делает невозможным параметризацию эволюционных уравнений. 10й перцентиль представляет собой сбалансированное методологическое решение, позволяющее одновременно элиминировать влияние локальных канцерогенных факторов и сохранить репрезентативность данных для всех анализируемых возрастных групп.
Подбор параметров осуществлен методом наименьших квадратов, обеспечивающим наилучшее соответствие модели наблюдаемому распределению данных. В качестве иллюстрации примененного метода на рис. 1 представлена возрастная динамика вероятности онкологических заболеваний органов дыхания и грудной клетки по всем административным территориям Пермского края. На графике визуализирован значительный пространственный разброс траекторий, а выделенная линия 10-го перцентиля демонстрирует репрезентативный уровень фонового риска, очищенного от влияния локальных канцерогенных факторов.
4,5Е-04 ---------------------------------------------------------
40Е-04 ..........................-............................................
35Е-04 ---------------------............................................
Л
5 3,0Е-04
О И 25Е-04 ..........................-............................................
О 2,0Е-04
д 1.5Е-04
Е0Е-04 .....................................
5,0Е-05
0,0Е+00 в Iе « « — • * — —
От 20 От 25 От30 От 35 От40 От 45 От 50 От 55 От 60 От 65
до 24 до 29 до 34 до 39 до 44 до 49 до 54 до 59 до 64 до 69
Возрастная группа
Рис. 1. Возрастная динамика вероятности онкологических заболеваний органов дыхания и грудной клетки по территориям Пермского края за 15-летний период с выделением 10%-ного перцентиля
Наблюдаемый на рис. 1 пространственный разброс возрастных профилей вероятности онкологических заболеваний между административными территориями является мультифакторным феноменом, обусловленным комплексным влиянием экзогенных и эндогенных детерминант. К числу значимых экзогенных факторов относятся дифференциация территорий по уровню загрязнения окружающей среды. Среди эндогенных факторов, опосредующих ответ на внешние воздействия, можно выделить эпигенетические модификации, индуцированные хроническим воздействием неблагоприятных средовых факторов.
Общий вид уравнения, описывающего динамику изменения тяжести онкологического заболевания во времени, записывается в следующем виде:
dgdt ) = qi' 81 ( t ) ’ (4)
где g i ( t ) - тяжесть i -го онкологического заболевания в возрасте t (лет); q i – коэффициент возрастного фонового накопления тяжести i -го онкологического заболевания на популяционном уровне в год.
Уравнение (4) может быть представлено в рекуррентном виде:
g i ( t + 1 ) = g i ( t ) + qi' g i ( t ) , (5)
где g i ( t + 1 ) - тяжесть i -го онкологического заболевания в возрасте t +1 (лет);
g i ( t ) - тяжесть i -го онкологического заболевания в возрасте t (лет);
q i – коэффициент возрастного фонового накопления тяжести i -го онкологического заболевания на популяционном уровне в год.
Показатель тяжести g i ( t ) является безразмерной величиной в интервале [0; 1], где 0 соответствует минимальным остаточным функциональным нарушениям после заболевания, а 1 – летальному исходу во всех случаях заболевания. Параметры q i и g i ( t = 20 ) формул (4), (5) оцениваются методом наименьших квадратов на основе данных о случаях заболевания и их смертельных исходах (в 5-летних возрастных группах) по всем территориям с использованием соотношения:
g ( t )= z^ • (6)
где g i ( t ) - тяжесть i -го онкологического заболевания в возрасте t (лет);
z i ( t ) - количество заболеваний i -й онкологической нозологией в возрасте t (лет), случаев;
s i ( t ) - количество смертельных исходов из числа заболевших по i -му онкологическому заболеванию в возрасте t (лет), случаев.
В случаях, когда количество заболеваний z i ( t ) равно нулю, показатель тяжести g i ( t ) принимается равным нулю, что соответствует отсутствию летальных исходов при отсутствии новых случаев заболевания.
Результаты и их обсуждение. В результате параметризации уравнений эволюции для 13 нозологических форм злокачественных новообразований получены количественные оценки ключевых параметров, определяющих возрастную динамику онкологических рисков (таблица). Расчетные значения начальной вероятности заболевания в 20-летнем возрасте p i ( t = 20 ) , коэффициента возрастного накопления вероятности a i , начального уровня тяжести патологии a i и коэффициента прогрессии тяжести q i демонстрируют значительную межнозологическую вариабельность, отражающую специфику патогенеза различных типов опухолей. Полученные параметры позволяют количественно охарактеризовать вклад возрастного фактора как в вероятность развития заболевания, так и в последующую динамику его исхода.
Анализ параметров, представленных в таблице, выявил существенную нозологическую специфичность возрастной динамики онкологических заболеваний. Полученные значения коэффициента возрастного накопления вероятности a i варьировались в диапазоне от 0,023 для новообразований мезотелиальных и мягких тканей до 0,143 для опухолей костей и суставных хрящей, что свидетельствует о различной скорости прогрессии риска с возрастом для разных нозологий.
Таблица 1
Параметры возрастного накопления вероятности и изменения тяжести
|
Вид заболевания |
p i ( t = 20 лет) |
a i |
g i ( t = 20 лет) |
qi |
|
Злокачественное новообразование молочной железы |
7,97E-05 |
0,037 |
0,299 |
0,0018 |
|
Злокачественное новообразование щитовидной железы и др. эндокринных желез |
1,44E-05 |
0,045 |
0,024 |
0,0396 |
|
Злокачественные новообразования глаза, головного мозга и других отделов ЦНС |
4,79E-06 |
0,070 |
0,397 |
0,0152 |
|
Злокачественные новообразования губы, полости рта и глотки |
9,99E-06 |
0,069 |
0,443 |
0,0100 |
|
Злокачественные новообразования женских половых органов |
9,90E-06 |
0,102 |
0,242 |
0,0089 |
|
Злокачественные новообразования костей и суставных хрящей |
2,29E-08 |
0,143 |
0,340 |
0,0191 |
|
Злокачественные новообразования лимфоидной, кроветворной и родственных им тканей |
1,47E-05 |
0,048 |
0,319 |
0,0133 |
|
Злокачественные новообразования мезотелиальных и мягких тканей |
1,33E-05 |
0,023 |
0,333 |
0,0110 |
|
Злокачественные новообразования мочевых путей |
1,02E-05 |
0,082 |
0,104 |
0,0317 |
|
Злокачественные новообразования мужских половых органов |
1,47E-06 |
0,092 |
0,256 |
0,0110 |
|
Злокачественные новообразования органов дыхания и грудной клетки |
1,50E-05 |
0,097 |
0,522 |
0,0101 |
|
Злокачественные новообразования органов пищеварения |
1,58E-05 |
0,107 |
0,657 |
0,0010 |
|
Меланома и другие злокачественные новообразования кожи |
8,33E-06 |
0,090 |
0,151 |
-0,0140 |
Начальные значения тяжести заболеваний g i ( t = 20 ) демонстрируют значительный разброс -от 0,024 при новообразованиях щитовидной железы до 0,657 при опухолях органов пищеварения, отражая различия в летальности в младших возрастах. Особый интерес представляет отрицательное значение коэффициента qi (-0,0140) для меланомы и других новообразований кожи, что может указывать на улучшение выживаемости при данных патологиях с возрастом, возможно, вследствие более ранней диагностики или эффективности лечения.
Наибольшие значения коэффициента q i наблюдаются при новообразованиях щитовидной железы (0,0396) и мочевых путей (0,0317), что свидетельствует о значительном возрастании летальности этих заболеваний с течением времени. Полученные параметры p i ( t = 20 ) коррелируют с известными эпидемиологическими данными о заболеваемости в молодом возрасте, подтверждая адекватность полученных параметров.
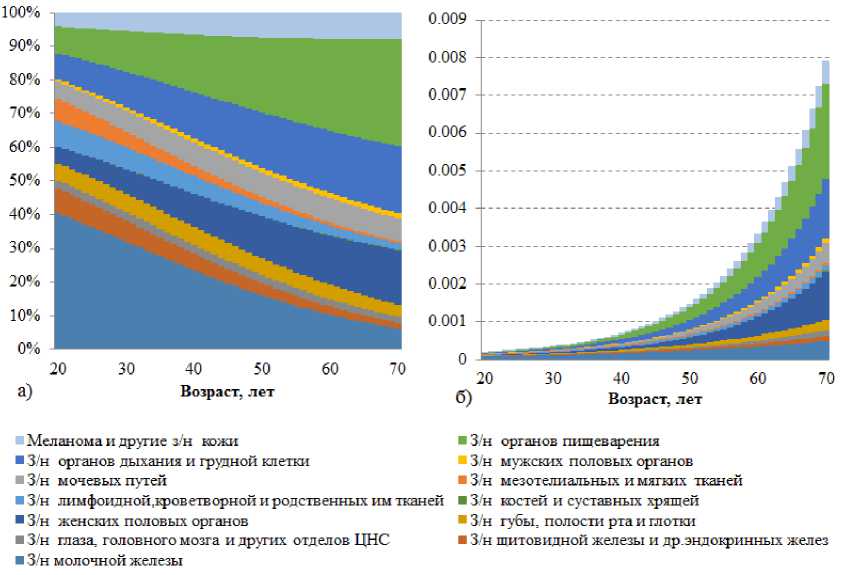
Анализ возрастной динамики структуры вероятности онкологической заболеваемости, рассчитанной с использованием параметров эволюции, показанный на рис. 2, выявил существенную перестройку относительного вклада различных нозологий в суммарную онкологическую вероятность на протяжении изучаемого возрастного периода. Наиболее выраженной тенденцией является прогрессии- рующее доминирование злокачественных новообразований органов пищеварения, доля которых возрастает с 8,0 % в 20 лет до 31,9 % к 70 годам, что позволяет классифицировать эту группу как ключевую возраст-ассоциированную патологию.
Параллельно наблюдается значительный регресс относительного вклада отдельных нозологий. Особенно показательной является динамика новообразований молочной железы, снижающихся с 40,4 до 6,3 %, и щитовидной железы – с 7,3 до 1,6 % за тот же период. Устойчивое снижение демонстрируют также новообразования мезотелиальных и мягких тканей (с 6,7 до 0,5 %) и центральной нервной системы (с 2,4 до 1,8 %).
Отдельные группы проявляют относительную стабильность в возрастном аспекте. Новообразования мужских половых органов сохраняют минимальный вклад (0,007–0,015 %), аналогичную динамику демонстрируют онкологические заболевания костной системы (0,0001–0,002 %). Нозологии органов дыхания и женских половых органов показывают сложную нелинейную динамику с пиковыми значениями в среднем возрасте.
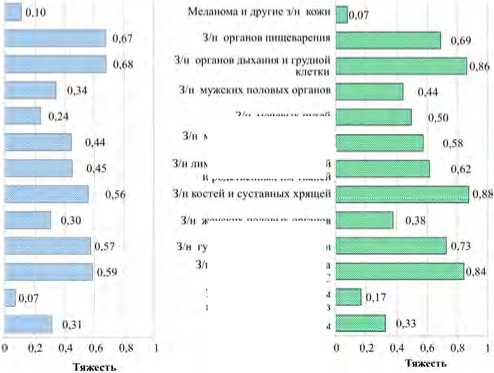
Анализ возрастной динамики тяжести онкологических заболеваний, показанный на рис. 3, выявил нозологические различия в прогрессии летальности. Наблюдается выраженная гетерогенность как абсолютных значений показателя тяжести, так и скорости его изменения на протяжении изучаемого возрастного периода.
а
б
Рис. 2. Диаграмма, отображающая вклад различных нозологических форм в суммарную онкологическую вероятность в каждой возрастной группе ( а ); абсолютные значения суммарной фоновой вероятности возникновения злокачественных новообразований в зависимости от возраста ( б )
Меланома и другие гн кожи
3 н органов пищеварения
З’Н opi анов дыхания и грудной клетки
3/н мужских половых органов
3/н мочевых путей _| 0,10
З н мезотелиальных и мягких тканей
З н лимфоидной, кроветворной н родственных нм тканей
3/н костей и суставных хрящей
3/н женских половых органов
3 н губы, полости рта и ittotkh 3/н папа, головного мозга н других отделов ЦНС 3'11 шитовидной железы и др.эндокринных желез З’И моточной железы

3/н органов дыхания и грудной клетки
3/н мочевых путей
Зи мезотелиальных и мя!ких тканей
3/н лимфоидной, кроветворной и родственных им тканей
З'н костей н суставных хрящей
а
Меланома и другие г и кожи
Ч и органов пищеварения
З и мужских половых органов
Зн женских половых органов
3/н губы, полости рта и глотки
3 н птоза. головного мозга н друг их отделов ЦНС Зи щитовидной железы и др-эндокринных желез 3 н молочной железы
половых opi анов убы. полости рта н глотки н глаза, головного мозга и других отделов ЦИС и дрлнлокрннных желез
3/н молочной железы
б
в
3/н мочевых путей |
мезотелиальных и мягких тканей Я мфоидиой. кроветворной и родственных нм тканей
Рис. 3. Значения тяжести онкологического заболевания в возрасте 20 лет ( а ), 45 лет ( б ) и 70 лет ( в )
Для большинства нозологий характерен монотонный рост тяжести заболевания с возрастом, однако интенсивность этого процесса варьируется. Наибольшие абсолютные значения тяжести на протяжении всего возрастного диапазона демонстрируют злокачественные новообразования органов пищеварения (0,657–0,691) и органов дыхания (0,522–0,863), что свидетельствует о высокой летальности этих патологий. Особого внимания заслуживает динамика новообразований щитовидной железы, показывающая наиболее интенсивный относительный рост тяжести – с 0,024 в 20 лет до 0,166 в 70 лет, что отражает увеличение агрессивности течения данного заболевания с возрастом. Сходную, хотя и менее выраженную динамику показывают новообразования мочевых путей.
Противоположную тенденцию демонстрирует меланома и другие новообразования кожи, для которых характерно снижение показателя тяжести с 0,151 до 0,075. Что согласуется с существующей гипотезой о возможных различиях в биологии опухолей кожи у пациентов разных возрастных групп. У более молодых пациентов могут преобладать более агрессивные гистологические варианты меланомы, в то время как у пожилых чаще диагностируются менее агрессивные формы кожных новообразований, такие как базальноклеточный и плоскоклеточный рак.
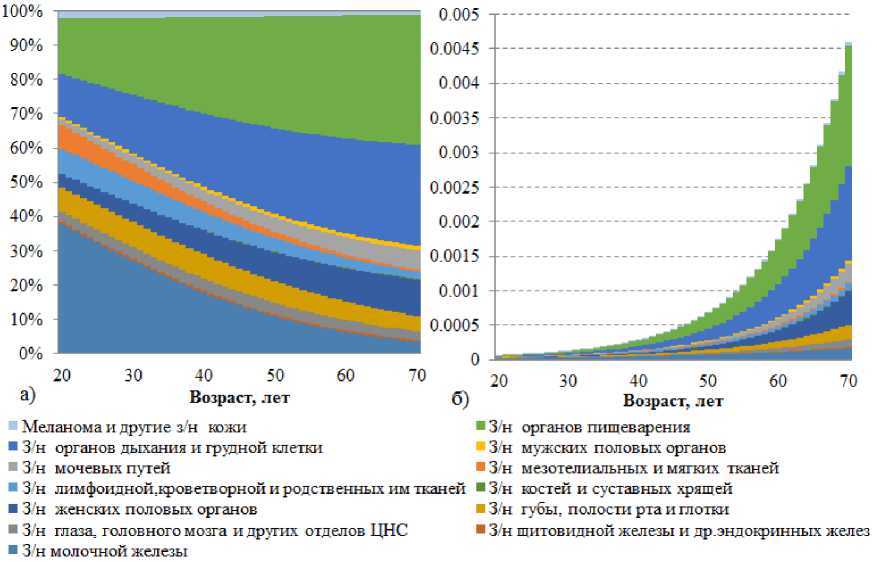
Анализ возрастной динамики онкологического риска, представленный на рис. 4, демонстрирует выраженную разнородность в уровне и скорости накопления риска для различных нозологических форм. Рассчитанные значения отражают комплексное влияние возраст-зависимой вероятности возникновения заболевания и его тяжести.
Наибольшие абсолютные значения риска во всех возрастных группах наблюдаются для злокачественных новообразований органов пищеварения и молочной железы. К 70-летнему возрасту риск развития онкопатологии пищеварительной системы достигает 1,75·10-3, демонстрируя наиболее интен- сивный рост среди всех изучаемых нозологий – увеличение в 168 раз за изучаемый период. Столь значительная величина риска обусловлена комбинированным эффектом высокой исходной вероятности заболевания и его исключительной летальности.
Злокачественные новообразования молочной железы, несмотря на снижение относительного вклада в структуру заболеваемости с возрастом, сохраняют существенный абсолютный риск, достигающий 1,62·10–4 к 70 годам. Особого внимания заслуживает динамика риска онкологических заболеваний щитовидной железы, показывающая интенсивный относительный рост – увеличение более чем в 62 раза за изучаемый период (с 3,43·10–7до 2,15·10–5).
Напротив, такие нозологии, как новообразования костной системы и мужских половых органов, характеризуются минимальными значениями риска на протяжении всего возрастного диапазона, не превышающими 1,64·10–5 и 5,42·10–5 соответственно к 70 годам. При этом меланома и другие новообразования кожи демонстрируют умеренный рост риска – в 36,7 раза за 50 лет, что коррелирует с выявленной ранее тенденцией к снижению летальности при данной патологии.
Выявленные закономерности соответствуют известным эпидемиологическим данным о структуре онкологической заболеваемости [2], что подтверждает адекватность использованной математической модели. Полученные данные отражают комплексное влияние возрастных изменений организма на патогенез онкологических заболеваний, включая снижение функциональных резервов, накопление коморбидной патологии и особенности ответа на терапию. Выявленные закономерности подчеркивают необходимость учета возраст-ассоциированных особенностей течения заболеваний при оценке канцерогенных рисков.
Разработанная в рамках настоящего исследования математическая модель, основанная на системе уравнений эволюции, продемонстрировала свою адекватность для количественного описания влияния
а
б
Рис. 4. Диаграмма, отображающая вклад различных нозологических форм в суммарный онкологический риск в каждой возрастной группе ( а ); абсолютные значения суммарного фонового риска злокачественных новообразований в зависимости от возраста ( б )
возраста на популяционный риск онкологических заболеваний. Полученные результаты выявили существенную нозологическую специфичность возрастной динамики как вероятности возникновения заболевания, так и его тяжести, что согласуется с общебиологическими представлениями о гетерогенности механизмов канцерогенеза [9, 13].
Параметризация модели подтвердила значительный разброс коэффициентов возрастного накопления вероятности ( α i ) и прогрессии тяжести ( q i ) между различными типами опухолей. Наибольшие значения αᵢ для новообразований костей и суставных хрящей (0,143) и органов пищеварения (0,107) указывают на выраженную возрастную зависимость риска для этих нозологий, что может быть связано с длительным латентным периодом и кумулятивным характером воздействия канцерогенных факторов, как это предполагается в классических мутационных моделях канцерогенеза [14]. В противоположность этому, относительно низкие значения α i для опухолей мезотелиальных и мягких тканей (0,023) предполагают меньшую зависимость их возникновения от возрастных изменений, что, вероятно, отражает преобладание в их этиологии генетической предрасположенности или специфических средовых воздействий, не связанных линейно с возрастом [15].
Особый интерес представляет анализ динамики тяжести заболевания. Выявленный рост летальности с возрастом для большинства нозологий, особенно выраженный для рака щитовидной железы и мочевых путей, может объясняться возрастным снижением функциональных резервов организма, накоплением коморбидной патологии и, возможно, более агрессивным течением заболевания в старших возрастных группах, что отмечается в ряде клиникоэпидемиологических работ [16, 17]. Влияние комор-бидности на онкологические исходы подробно изучено в крупных популяционных исследованиях [18]. В то же время отрицательное значение qi для меланомы и других новообразований кожи (-0,0140), свидетельствующее о снижении тяжести с возрастом, требует отдельного объяснения. Эта тенденция может быть связана с улучшением диагностики (выявление на более ранних, менее агрессивных стадиях), возрастными различиями в гистологической структуре опухолей (с преобладанием менее агрессивных базальноклеточного и плоскоклеточного рака у пожилых) или большей эффективностью лечения у пожилых пациентов по сравнению с другими локализациями, что частично находит подтверждение в современных исследованиях [19].
Реконструкция возрастной структуры риска выявила ключевые переходы в относительном вкладе различных нозологий. Прогрессирующее доминирование злокачественных новообразований органов пищеварения в общей структуре онкологического риска к 70 годам подтверждает их статус ведущей возраст-ассоциированной патологии, что хорошо согласуется с глобальными эпидемиологическими тенденциями [20]. Одновременное снижение относительного вклада рака молочной железы, несмотря на рост абсолютного риска, подчеркивает важность анализа как относительных, так и абсолютных показателей при оценке возрастной динамики, поскольку относительные показатели могут маскировать значимый абсолютный риск в популяции [21].
Анализ полученной возрастной динамики онкологических рисков выявил расхождение между сложившимися эпидемиологическими приоритетами в онкологической помощи и структурой фонового популяционного риска. На данный момент в системе здравоохранения и медийном пространстве наибольшее внимание уделяется нозологиям с высокой медианой заболеваемости, таким как рак молочной железы, легкого и предстательной железы [2]. Предлагаемый подход показывает иную, биологически детерминированную структуру рисков.
Ключевым отличием является главенствующая роль злокачественных новообразований органов пищеварения, совокупный риск которых не только превышает таковой для других локализаций на протяжении всего возрастного диапазона, но и демонстрирует наиболее интенсивный рост – увеличение в 168 раз к 70 годам по сравнению с 20-летним возрастом. Это указывает на то, что данная группа заболеваний, а не более часто публично обсуждаемые формы рака, представляет собой основное бремя возраст-ассоциированного канцерогенеза в популяции, что согласуется с глобальными тенденциями роста заболеваемости колоректальным раком и раком поджелудочной железы с возрастом [20]. В отличие от этого, риск рака молочной железы, несмотря на высокую абсолютную величину, характеризуется значительно более низким коэффициентом возрастного накопления (0,037), что свидетельствует об относительно меньшей зависимости от собственно геронтологических процессов по сравнению с экзогенными и наследственными факторами.
Также показательным является анализ редко обсуждаемых в контексте профилактики нозологий. Так, риск злокачественных новообразований костей и суставных хрящей, имея крайне низкое исходное значение, демонстрирует максимальный среди всех изученных форм коэффициент возрастного накопления вероятности (0,143). Это указывает на исключительную значимость возраст-зависимых механизмов, таких как накопление соматических мутаций в мезенхимальных стволовых клетках и возрастные изменения внеклеточного матрикса, в их патогенезе [14]. Однако данная особенность не находит отражения в текущих программах скрининга и профилактики, ориентированных преимущественно на более распространенные, но менее возраст-зависимые формы рака.
Полученные данные свидетельствуют о необходимости формирования принципа настороженности в отношении онкологических заболеваний с высокими возраст-ассоциированными значениями риска. Сме- щение акцента в сторону целевого скрининга, профилактики и разработки терапевтических стратегий для высоколетальных и сильно возраст-зависимых нозологий, таких как рак органов пищеварения, может оказать более существенное влияние на снижение общей онкологической смертности в стареющей популяции, чем дальнейшая интенсификация борьбы с заболеваниями, имеющими более низкие темпы возрастного накопления риска. Это согласуется с существующей концепцией перенаправления ресурсов на основе анализа «летальных потенциалов» различных типов рака, а не только их общей заболеваемости.
Полученная модель, базирующаяся на концепции фонового риска, выделенного с использованием 10-го перцентиля, позволяет абстрагироваться от влияния локальных канцерогенных факторов и оценить вклад собственно возраст-зависимых биологических процессов, таких как накопление соматических мутаций и ослабление иммунного надзора [13, 22]. Такой подход обеспечивает основу для последующей оценки дополнительного риска, индуцированного специфическими эндо- и экзогенными воздействиями, в рамках парадигмы «фоновый риск + дополнительный риск».
Исследование имеет ряд ограничений. Во-первых, снижение репрезентативности данных в старших возрастных группах (после 70 лет) не позволяет экстраполировать выводы на когорты долгожителей, для которых характерны уникальные траектории старения и профили заболеваемости [23]. Во-вторых, предложенная модель, будучи феноменологической, описывает процессы на макроуровне и не детализирует лежащие в их основе клеточно-молекулярные механизмы (такие как накопление мутаций, ослабление иммунного надзора и роль микросреды опухоли), которые являются предметом интенсивного изучения в современной онкологии [9, 24]. Это ограничение является принципиальным для выбранного класса моделей, фокусирующихся на системных закономерностях, а не на внутренних биологических процессах.
Существенным фактором, лимитирующим однозначную биологическую интерпретацию параметра прогрессии тяжести qi , является стадия заболевания на момент диагностики. В рамках используемого подхода показатель gi (t) является интегральным и не позволяет разграничить вклад истинной летальности (обусловленной биологией опухоли) и стадийного состава заболевших. Это ограничение может приводить к смещению в оценках qi. В частности, для нозологий с развитыми программами скрининга (например, рак молочной железы) смещение стадийной структуры в сторону ранних этапов в молодых возрастных группах может имитировать снижение тяжести, тогда как его рост в старших группах может быть связан с поздней диагностикой. Перспективным направлением развития модели является ее стратификация по стадиям TNM (международная классификация стадий онкологических заболеваний), что позво- лило бы оценить «чистый» возрастной вклад в летальность для каждой стадии отдельно.
Перспективы дальнейших исследований видятся в интеграции в модель дополнительных параметров, отражающих влияние известных канцерогенных факторов (курение, профессиональная вредность, экология) [25], а также в ее усложнении для описания процессов на микро- (клеточном) и мезо-(тканевом) уровнях, например, путем включения параметров, характеризующих мутационную нагрузку или состояние иммунного микроокружения опухоли [26]. Это позволит создать более комплексный инструмент для прогнозирования онкологических рисков и разработки целевых профилактических стратегий с учетом возрастного фактора.
Выводы. На основании проведенного исследования разработана и верифицирована математическая модель, основанная на системе эволюционных уравнений, которая позволяет количественно оценивать влияние возраста на популяционный риск онкологических заболеваний. Результаты моделирования, выявившие систематические и интерпретируемые различия в динамике риска для различных нозологических форм, подтверждают адекватность использованного математического аппарата для описания возраст-ассоциированного канцерогенеза.
Параметризация модели выявила значительную межнозологическую вариабельность ключевых параметров – коэффициента возрастного накопления вероятности ( α i ) и коэффициента прогрессии тяжести ( qi ). Установленные различия отражают специфику патогенеза различных типов опухолей и подтверждают гетерогенность механизмов возраст-ассоциированного канцерогенеза, что согласуется с современными биологическими концепциями.
Анализ возрастной динамики структуры онкологического риска показал принципиальные различия в траекториях развития различных нозологий. Наблюдается прогрессирующее доминирование злокачественных новообразований органов пищеварения, доля которых к 70 годам достигает 31,9 %, что позволяет классифицировать эту группу как ключевую возраст-ассоциированную патологию. Параллельно отмечается существенное снижение относительного вклада рака молочной железы и щитовидной железы.
Исследование выявило разнонаправленные тенденции в динамике тяжести заболеваний. Для большинства нозологий характерен монотонный рост летальности с возрастом, тогда как для меланомы и других новообразований кожи установлена тенденция к снижению тяжести, что требует дальнейшего изучения с учетом возрастных особенностей биологии опухолей, диагностики и лечения.
Предложенная методология, основанная на выделении фонового риска с использованием 10-го перцентиля, доказала свою эффективность для оценки вклада собственно возраст-зависимых биологических процессов. Данный подход создает теоретическую основу для последующей оценки дополнительного риска, индуцированного специфическими эндо- и экзогенными воздействиями.
Используемый подход позволяет выявить «слепые зоны» в системе онкологической помощи и обосновать необходимость разработки целевых геронто-онкологических стратегий, адекватных реальной структуре популяционного риска.
Перспективы дальнейших исследований связаны с развитием модели в трех основных направлениях. Во-первых, это интеграция параметров, отражающих влияние известных канцерогенных факторов, а также учет уровня медицинского обслуживания как ключевого модификатора показателя тяжести заболевания через эффективность скрининга и лечения. Во-вторых, представляет интерес учет взаимовлияния различных заболеваний (коморбидности), способного модифицировать как риск развития, так и исход онкологической патологии. В-третьих, перспективным направлением остается усложнение модели для описания процессов на микро- и мезоуровнях. Реализация этих направлений позволит создать комплексный инструмент для прогнозирования онкологических рисков и разработки целевых профилактических стратегий с учетом возрастного фактора, качества медицинской помощи и общего состояния здоровья популяции.
Финансирование. Результаты получены при выполнении государственного задания Министерства науки и высшего образования Российской Федерации на выполнение фундаментальных научных исследований (проект FSNM-2025-0001).


