Возрастная динамика интенсивности онкологической заболеваемости указывает на существование уязвимых подгрупп
Автор: Обеснюк В.Ф.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Профилактическая медицина: актуальные аспекты анализа риска здоровью
Статья в выпуске: 3 (43), 2023 года.
Бесплатный доступ
Проблема управления популяционными и профессиональными рисками онкологической заболеваемости или смертности предполагает знание биологических механизмов их формирования, определяющих динамику массовых процессов, регистрируемых статистикой. Однако до сих пор нет ясного понимания причинно-следственной связи между возможными факторами онкологической заболеваемости и ее реальной динамикой. В статье на количественном материале анализируется гипотеза о существенном влиянии на динамику показателей заболеваемости между состоянием «здоров» и состоянием «болен» процессов формирования промежуточного переходного и объективно существующего состояния «уязвимый», характеризующегося ускоренным выходом из-под наблюдения, по сравнению с интенсивностью, обусловленной общей изменчивостью индивидуальных свойств популяции. Статистически установлено, что динамика таких распространенных заболеваний, как рак желудка, рак легкого, рак молочной железы, рак предстательной железы, рак щитовидной железы, может быть объяснена тем, что практически все диагностированные случаи наблюдаются после попадания индивидуума в состав группы уязвимых задолго до постановки самого диагноза. С этой точки зрения следует различать два принципиально разных биологических механизма возникновения новообразований: индукцию как переход из состояния «здоров» в состояние «уязвимый», а также промоцию как переход «уязвимый - больной». Каждая из названных трансформаций должна характеризоваться в популяции своей интенсивностью и своей зависимостью от эндогенных или экзогенных факторов риска. С помощью численного моделирования (на примере модификации динамики заболеваемости раком щитовидной железы под действием ионизирующего излучения) показано, что ряд известных фактов парадоксального изменения показателей радиочувствительности может быть удовлетворительно истолкован в рамках концепции уязвимой подгруппы. Факты были установлены в 1994-2011 гг. и до сих пор не получали должного объяснения, поскольку обсуждаемая концепция авторами исследований не привлекалась.
Уязвимость, компартмент, интенсивность, гетерогенность, выживаемость, показатель, риск, когорта, популяция
Короткий адрес: https://sciup.org/142239916
IDR: 142239916 | УДК: 57.036, | DOI: 10.21668/health.risk/2023.3.03
Текст научной статьи Возрастная динамика интенсивности онкологической заболеваемости указывает на существование уязвимых подгрупп
Понятие уязвимости ( frailty , vulnerability ) предоставляет собой наглядный способ описания ненаблюдаемых причин возникновения случайных эффектов, прежде всего онкологических, при наличии признаков скрытой гетерогенности когорты в процессе анализа данных о ее выживаемости. По сути понятие восходит к работе Гринвуда и Юла о «склонности к несчастным случаям»1. Сам термин frailty, по всей видимости, впервые был введен в работе [1] при описании продольного анализа дожития когорт. Концепция уязвимости в дальнейшем успешно продвигалась также рядом других исследователей [2–4]. Вклад в ее развитие внесли и наши соотечественники [5, 6].
Основная сложность анализа в рамках концепции frailty заключается в том, что не найдено надежных индикаторов индивидуальной уязвимости, которые способствовали бы наблюдению медикобиологических эффектов в одной связке со своими сигнальными признаками, что позволило бы непосредственно установить причинно-следственные связи, если таковые объективно существуют. С одной стороны, это обстоятельство подталкивает исследователей к интенсивному поиску индикаторов уязвимости, но, с другой стороны, – выхолащивает само понятие frailty, подменяя работу с информативными маркерами анализом совокупности сопутствующих (вторичных) признаков физиологического
Обеснюк Валерий Фёдорович – кандидат физико-математических наук, доцент, старший научный сотрудник (e-mail: ; тел.: 8 (35130) 7-52-36; ORCID: .
Таблица 1
Показатели заболеваемости раком щитовидной железы среди женщин России [8]
Материалы и методы . Между тем в ряде случаев в когортных или популяционных исследованиях возможно непосредственно убедиться в объективном существовании уязвимых подгрупп. Например, сделать это позволит анализ возрастной динамики годовых показателей онкозаболеваемости или смертности, обобщенный мониторинг которых в Российской Федерации ведут специалисты Московского научно-исследовательского онкологического института имени П.А. Герцена [8]. Особо следует подчеркнуть, что в этом случае он будет основан на косвенных наблюдениях, поскольку в таблицах института не содержится никаких ненаблюдаемых или скрытых переменных, описывающих состояние повышенной уязвимости для части исследуемой популяции. Более подробно приведем данные о заболеваемости раком щитовидной железы среди женщин России в разных подгруппах, где возрастная зависимость является существенно немонотонной, увеличиваясь до 65 лет приблизительно по степенному закону и парадоксально снижаясь почти до нуля в группе «85+» лет (табл. 1).
Выполнить анализ можно методом математического моделирования. В отличие от традиционного описания условной выживаемости, предполагающего наличие однородной группы индивидов, имеющих одинаковые шансы выйти из-под эпидемиологического наблюдения, будем рассматривать неоднородную когорту, состоящую из двух подгрупп – основной и более уязвимой.
Ограничимся анализом заболеваемости, которая в Российской Федерации обычно выявляется по мере обследования в процессе обращаемости пациентов за медицинской помощью или, значительно реже, в результате скрининга. В отчетность, прежде всего, попадают первичные случаи онкологической заболеваемости, и со статистико-эпидемиологической точки зрения они фактически сразу становятся завершенными для наблюдения. Конкурирующим процессом для такой формы учета является смерть индивидуума. В итоге анализ допускает предположение о применимости следующей марковской компартмент-схемы (рис. 1).
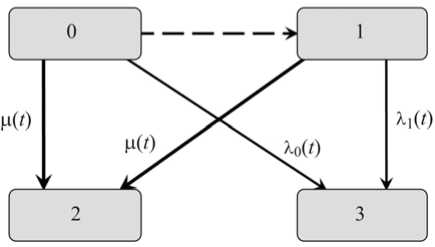
Рис. 1. Компартмент-схема моделирования интенсивности онкологической заболеваемости: 0 – основная часть когорты; 1 – уязвимая часть когорты; 2 – умершие по прочим причинам; 3 – выбывшие из-под эпидемиологического наблюдения из-за изучаемого онкологического заболевания; μ( t ) – конкурирующая интенсивность смертности по всем прочим причинам; λ0( t ),λ1( t ) - интенсивности заболеваемости в однородных подгруппах 0 и 1
На схеме между состояниями когорты 0 и 1 указан скрытый (неконтролируемый) переход некоторых индивидуумов из одной условно однородной группы в другую. Из любого исходного состояния индивидуум может с некоторой вероятностью умереть или заболеть изучаемой формой рака. Согласно методологии [8], в когорте или популяции отслеживается только численность индивидуумов в компартменте 3 (заболевшие) и общее число прожитых человеко-лет наблюдения. Собранные данные используются для публикации оценок [8] динамики дескриптивной функции h ( t ), зависящей от возраста t и называемой обычно годовым показателем риска заболеваемости, измеряемого в ожидаемом числе случаев за год когортного наблюдения для предположительно однородной группы из 100 тысяч человек, доживших до достигнутого момента регистрации t .
Если переход 0–1 происходит раньше и быстрее опустошения компартментов 0 и 1, этот процесс характерным образом может проявиться именно так, как указано в табл. 1. Несмотря на ограниченность данных, имеющихся в распоряжении, математическая модель для динамики в компартментах 0 и 1 может быть выписана в этом случае достаточно полно так, что начальную долю заселенности основного компартмента 0, то есть параметр β0 ( 0< β0 < 1) при отсутствии внешних факторов риска можно было бы считать практически постоянной величиной. Тогда динамику процесса регистрации описывает система уравнений:
= -( ц ( t ) + X 0 ( t , в ) ) - S 0 ( t ) ;
dS = -( ц ( t ) + X ( t , в ) ) - S i ( t ) ; (1)
S E( t ) = S о ( t ) + S i ( t ) .
Ее решение запишем для начальных условий Sо (0 ) = во, Si (0) = 1 -во, S 2 (0 ) = 0, Sз (0) = 0, пренебрегая инерционностью перехода 0–1. Здесь Si (t) - вероятности заселения компартментов; Se (t) -«кажущаяся» (дескриптивная) вероятность yсловно «здорового дожития» в неоднородной двухкомпарт-ментной когорте; X0 (t) = X0 (t, в) и Xi (t ) = Xi (t, в) _ параметризованные интенсивности заболеваемости в однородных подгруппах 0 и 1. Параметризация в данном случае необходима, потому что ни один из показателей условной заболеваемости не измерен и не известен, поскольку не определены сами подгруппы 0 и 1. Тем не менее ясен характер их специфической возрастной зависимости – степенной, наподобие вейбулловской аппроксимации интенсивности, присущей аналогиям с техническими системами со слабым звеном2 [9] или последовательной (и даже ветвящейся) цепью трансформируемых состояний [6]. Эмпирическим фактам этого типа уже более 70 лет [10]. Обычно их связывают с компартмент-моделью канцерогенеза Армитажа и Долла [11]. Имеется также прямое указание на возможную связь «закона 4–7 степени» с числом этапов тканевых трансформаций альтерированных клеток, возникших на стадии спонтанной инициации [12], что характерно для генеза эпителиальных опухолей, приводящих примерно к 70 % в структуре общей смертности от опухолей. Для широкого диапазона достигнутых возрастов (от 0 до ~70 лет) можно с хорошей точностью принять X0 = в1 (t/70)в2 и X1 = в3 (t/70)в2, где новые компоненты вектора параметров в также положительны. В отличие от показателей заболеваемости, общая интенсивность смертности ц(t) в такой параметризации не нуждается. В случае относительной редкости наступления специфических событий выбытия из-под наблюдения, слабо влияющих на показатели смертности, информацию об общей смертности можно получить из анализа демографических данных, собранных Росстатом3. Иными словами, функцию ц(t) можно считать известной, либо нужно воспользоваться известными ее приближениями – формулами Гомперца или Гомперца – Мейкхема [9]. Сама же система уравнений (1) без особых затруднений интегрируется в квадратурах, численное значение которых при заданном наборе параметров в прямо вычисляется с помощью современных математических пакетов программ MathCAD или Wolfram Mathematica. Более того, в силу очевидной одинаковой пропорциональности S0 (t) ~ exp (-M (t)) и t
S 1 ( t ) ~ exp ( - M ( t ) ) , где M ( t ) = | ц ( т ) d т , следует 0
ожидать очень слабой фактической зависимости дескриптивного показателя заболеваемости h ( t , в ) от конкурирующего влияния смертности ц ( т ):
h ( t , в ) = —
S e ( t , в )
dS e ( t , в )
dt
105 X 0 ( t , в ) - S 0 ( t , в ) + X 1 ( t , в ) - S 1 ( t , в ) S 0 ( t , в ) + S 1 ( t , в )
Это позволяет связать схему рис. 1 с наблюдениями специфических годовых показателей онкологического риска [8], рассчитав их предсказываемое значение в соответствии с определением дескриптивной интенсивности заболеваемости в когорте и выполнив приемлемую аппроксимацию путем варьирования компонент вектора в в пределах 4-пара-метрической модели (1).
В рассмотренных случаях не должно вызывать недоверия небольшое смысловое различие понятий когортной интенсивности заболеваемости и популяционного показателя годового риска заболеваемости, так как в случае наблюдений [8] в пределах коротких пятилетних страт оба показателя на практике оцениваются технически одинаково4. Возрастные страты популяционного исследования [8]
отличаются между собой лишь принадлежностью к разным когортам в силу различий по году своего рождения.
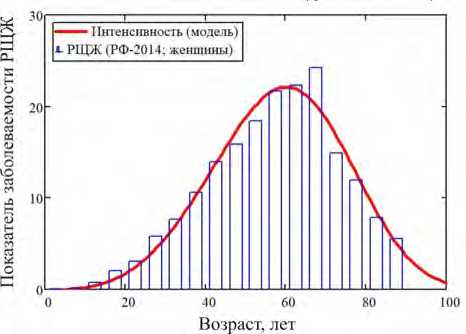
Рис. 2. Сопоставление модельной (по возрастам) и реальной (2014 г.) динамики показателя заболеваемости раком щитовидной железы у женщин России (на 100 тысяч доживших человек в год)
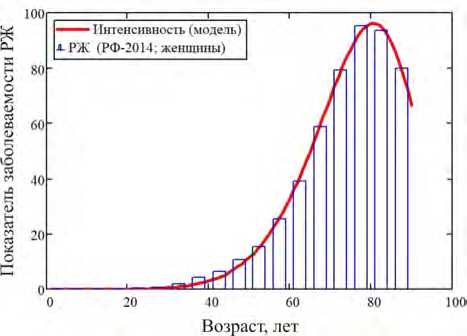
Важно также отметить, что дескриптивные по своей природе условные показатели риска N–A и RADS, основанные на операции интегрирования годового дескриптивного показателя h ( t , в ) , дают несколько завышенные кумулятивные оценки в сравнении с численностью уязвимой группы, если производить сопоставление в одинаковых единицах. В то же время фактически наблюдаемый дескриптивный кумулятивный риск онкологического заболевания оказывается примерно вдвое меньше доли уязвимой группы, так как в ней не все потенциально уязвимые индивидуумы доживают до «своего рака» вследствие конкуренции со стороны смертности от всех причин.
Не менее важно отметить, что не увенчалась успехом попытка с позиций концепции фиксированной численности frailty group дать столь же простое толкование динамике возрастной зависимости показателей ряда других спонтанных онкологических заболеваний. В первую очередь это относится к описанию онкозаболеваний системы кроветворения и лимфатической системы (С81–С96), имеющих выраженную бимодальную или даже тримодальную зависимость показателей заболеваемости от возраста, в особенности «молодежную компоненту». Сходное мультимодальное поведение показателей имели онкологические заболевания желудочнокишечного тракта (С00–С15; С17–С21), заболевания скелета (С40, 41), заболевания головного мозга и центральной нервной системы (С69–С72). Однако сам наблюдавшийся факт возможности существования уязвимых подгрупп вряд ли можно отрицать и в этих случаях. По-видимому, для указанного широкого класса онкологических заболеваний характерны динамическое изменение доли уязвимых лиц
Таблица 2
Оценочные показатели онкологической заболеваемости в России в 2014 г.
|
Локализация |
МКБ-10 |
Доля frailty, % |
Оценка степени β 2 |
Стандартизованный годовой показатель |
N–A |
RADS |
LR |
Отношение потоков (0–3 к 1–3) |
|
Желудок (мужчины) |
С16 |
4,4 |
6,5 |
25,2 |
5650 |
5494 |
2063 |
~ 0,14 |
|
Желудок (женщины) |
С16 |
2,9 |
6,2 |
11,4 |
2514 |
2482 |
1493 |
~ 10–5 |
|
Трахея, бронхи, легкое (мужчины) |
С33,34 |
8,3 |
6,6 |
53,4 |
10931 |
10354 |
4505 |
~ 0,11 |
|
Трахея, бронхи, легкое (женщины) |
С33,34 |
2,2 |
4,8 |
8,1 |
1718 |
1703 |
1070 |
~ 10–5 |
|
Молочная железа (мужчины) |
С50 |
0,45 |
4,3 |
0,69 |
163 |
163 |
56 |
~ 5·10–3 |
|
Молочная железа (женщины) |
С50 |
7,3 |
4,1 |
52,9 |
8049 |
7734 |
5878 |
~ 0,11 |
|
Предстательная железа (мужчины) |
С61 |
8,5 |
9,4 |
47,1 |
11758 |
11093 |
3937 |
~ 0,13 |
|
Щитовидная железа (мужчины) |
С73 |
0,27 |
3,3 |
2,03 |
253 |
253 |
140 |
~ 10–15 |
|
Щитовидная железа (женщины) |
С73 |
0,94 |
3,0 |
8,3 |
919 |
915 |
752 |
~ 10–6 |
П р и м е ч а н и е : все кумулятивные показатели (N–A, RADS и LR) указаны в расчете на 100 тысяч человек в год для интервала возрастов до 90 лет; прямая стандартизация выполнена по мировому стандарту населения [14]; показатель Нельсона – Аалена (площадь под кривой hazard) обозначен как N–A; показатель атрибутивно-связанного снижения выживаемости обозначен как RADS; показатель фактического условного пожизненного риска обозначен как LR.
в составе популяции или когорты вместе с более коротким скрытым периодом развития онкозаболевания как под действием эндогенных спонтанных причин, так и вследствие влияния внешних онкопровоцирующих факторов.
Наконец, отметим важный косвенный признак. Объективное существование внутреннего компартмента уязвимых в составе когорты или популяции неизбежно должно вызывать наблюдаемые особенности модификации возрастной динамики онкологической заболеваемости под действием внешних канцерогенных факторов риска, что может быть зарегистрировано статистико-эпидемиологическими методами. Среди наиболее изученных факторов особо следует выделить действие ионизирующего излучения на клетки и ткани организма. С момента опубликования (1927 г.) Германом Мюллером своих исследований, демонстрирующих генетические эффекты радиационного воздействия, прошло уже почти столетие. В 1928 г. был создан Международный комитет по рентгеновской и радиевой защите, ставший прототипом действующей по настоящее время постоянной Международной комиссии по радиологической защите (МКРЗ), координирующей исследовательскую деятельность в области радиационной эпидемиологии и радиобиологии среди ученых всего мира. Накоплено огромное количество статистической информации. В частности, общеизвестно и общепринято представление о том, что кумулятивная доза поглощенной ионизирующей радиации любой природы непосредственно способна увеличивать дескриптивную годовую интенсивность онкологической заболеваемости и индивидуальный пожизненный риск развития рака приблизительно по линейному закону [15, 16] – так называемая линейная беспороговая гипотеза (ЛБГ); она же – концепция пропорционального риска. На базе ЛБГ сформули- рованы все международные нормы радиационной безопасности, и в то же время в документах [15, 16] и ряде других публикаций имеются не всегда официально признаваемые упоминания о существовании несколько иных дозовых трендов, по крайней мере для некоторых локализаций рака.
Оказывается, концепция frailty group способна дать объяснение имеющимся расхождениям между общепринятыми представлениями и наблюдаемыми фактами, если обратить внимание, что на схеме рис. 1 переход между компартментами 0 и 1 соответствует индукции новообразований, а переход 1–3 ‒ их промоции под действием дозы ионизирующего излучения. То есть следует различать по меньшей мере два биологически различных радиационно-онкологических эффекта, если не обращать внимание еще и на существование третьей имеющейся, но более слабой дозовой зависимости интенсивности смертности от всех прочих причин ц ( t |D ) .
Покажем, какие следствия ожидают нас в рамках сделанного предположения. Это можно установить с помощью численного моделирования, например, для рака щитовидной железы, динамика показателей спонтанной заболеваемости которым уже была нами изучена (рис. 2). При этом, согласно рекомендациям [15, 16], не будем покидать рамки ЛБГ, распространяя их теперь уже на каждый из переходов 0–1 и 1–3. В этом случае для учета дозовой зависимости в рассматриваемых моделях следует всего лишь формально поменять долю уязвимых лиц (1 -Р0) на (1 -Р0 )-(1 + к1 D), и множитель Р3 в интенсивности Х1 на Р3 -(1 + к2D), где к1, к2 -коэффициенты радиочувствительности. Результат оценки возрастной зависимости потенциально наблюдаемого когортного показателя годовой заболеваемости при разном уровне радиационного воздей- ствия (фоновый и в дозе 1 Зв) показан на рис. 4 для подгруппы женщин, щитовидная железа которых была однократно и остро облучена в возрасте 0‒9 лет.
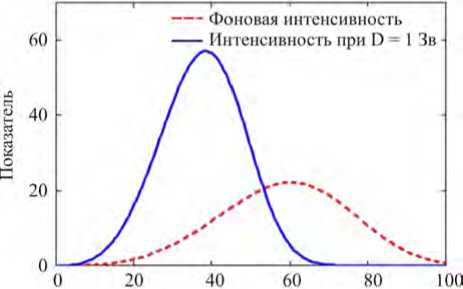
Достигнутый возраст, лет
Рис. 4. Возрастные зависимости показателей заболеваемости раком щитовидной железы (на 100 тысяч в год) среди необлученных женщин и облученных в раннем возрасте в дозе 1 Зв (в расчетах приняты параметры радиочувствительности: к 1 = 0,5 Зв - 1 и к 2 = 5,0 Зв - 1)
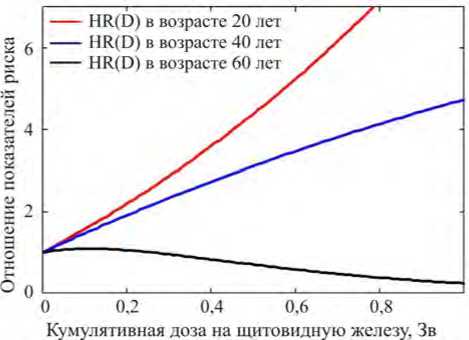
Рис. 5. Кажущаяся нелинейность зависимости отношения годовых показателей (hazard ratio) от дозы, демонстрирующая непригодность концепции пропорциональных рисков для описания радиационных эффектов
Из данных рис. 4 можно увидеть, что в результате наличия подгруппы уязвимых лиц отношение дескриптивных показателей риска дозовых групп в разных возрастах существенно изменяется. Оно может быть как больше единицы (вплоть до 50 лет), так и меньше единицы (для женщин преклонного возраста). Таким образом, в рамках правильно применяемой ЛБГ нарушается концепция пропорционального риска, а вместе с ней и сама ЛБГ дескриптивного типа. При этом пожизненный риск может иметь заметно более слабый дозовый тренд по сравнению с дозовым трендом годового показателя риска, да и сам тренд годового показателя вряд ли можно признать линейным (рис. 5). По приведенному графику нетрудно прийти к выводу, что расчетнономинальное значение избыточного относительного риска, приходящегося на 1 Зиверт (excess relative risk on unit dose ‒ ERR/Sv), может изменяться от 8,8 Зв‒1 в младших возрастных группах (без учета понижающего коэффициента DDREF = 2 [15]) до отрицательных значений в старших (более 55 лет), если в основу положить анализ годовых показателей. Если же анализировать избыток дозовой зависимости отношения стандартизированных показателей риска (SIR), то оценка снижается приблизительно до 2,3 Зв‒1 в силу усреднения по возрастам. Однако в обоих случаях она не соответствует истинной величине 5,0 Зв‒1, заданной в процессе моделирования. Еще более низкий дескриптивный коэффициент радиочувствительности около 0,87 Зв‒1 можно получить из заданной нами модели, если сделать оценку на основании дозового тренда фактического пожизненного риска заболеваемости раком щитовидной железы среди женщин, имевших острое облучение до наступления 15-летнего возраста. Последняя оценка на удивление хорошо соответствует мнению экспертов МКРЗ [17].
В завершение обсуждения укажем ссылку на нерецензированный материал5, в котором взаимопе-ресечение кривых возрастных зависимостей годового показателя риска для различных дозовых групп (подобно рис. 4) наблюдалось также при исследовании смертности от рака легкого среди персонала радиационно-опасного предприятия, что определенно указывает на ускоренное вымирание в онкологически уязвимой группе. Дополнительно к этому авторы упомянутого отчета публиковали результаты исследования заболеваемости раком предстательной железы [23], где прямо указано, что «…радиогенный риск заболевания [ERR/Gy] … в когорте работников ПО “Маяк” составил 5,24 … на 1 Гр в возрасте 50 лет и резко снижался с увеличением достигнутого возраста…», причем почти до нуля уже в возрасте 60 лет. Вероятно, в диапазоне «70+» лет достигались и отрицательные значения, скромно не упомянутые авторами, то есть возрастное распределение годового показателя риска при увеличении дозы гамма-излучения имело смещение в область более ранних возрастов наряду с растяжением графика по вертикали. Такое поведение показателя необъяснимо в рамках традиционного толкования ЛБГ, однако хорошо соответствует концепции frailty group.
Выводы. Таким образом, опираясь на сопоставление результатов численного моделирования динамики онкозаболеваемости и анализ статистико-эпидемиологических данных, с высокой вероятностью можно констатировать, что для многих локализаций заболевания динамика показателей определяется существованием в популяции онкологически уязвимых групп населения, сформированных преимущественно в период интенсивного роста организма вплоть до возраста 15–20 лет. Для значительной части такой группы (около половины) диагноз «рак» ставится при жизни. Внешние воздействия ксенобиотиков и канцерогенов могут ускорить процесс перехода из компартмента «уязвимые» в компартмент «больные», что необходимо учитывать при разработке норм безопасности при профессиональной деятельности.
Установленный факт подчеркивает актуальность исследований по раннему профилактическому выявлению надежных специфических биологических маркеров принадлежности конкретных лиц к объективно существующей группе онкологически уязвимых. При этом не всякая гиперплазия или гипертрофия ткани может квалифицироваться как переход к онкологически уязвимой группе. Об этом можно судить, сопоставив, например, распространенность frailty-состояний по раку предстательной железы (см. табл. 2) и распространенность доброка- чественной гиперплазии предстательной железы среди мужчин, которая способна достигать до 80 % в старших возрастах. Более того, для корректного прогноза нужны маркеры как ранних, так и поздних стадий индивидуального предракового состояния в уязвимой группе.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Возрастная динамика интенсивности онкологической заболеваемости указывает на существование уязвимых подгрупп
- Vaupel J.W., Manton K.G., Stallard E. The impact of heterogeneity in individual frailty on the dynamics of mortality // Demography. - 1979. - Vol. 16, № 3. - P. 439-454. DOI: 10.2307/2061224
- Aalen O.O., Tretli S. Analyzing incidence of testis cancer by means of a frailty model // Cancer Causes Control. -1999. - Vol. 10, № 4. - P. 285-292. DOI: 10.1023/a: 1008916718152
- Analysis of testicular cancer data using a frailty model with familial dependence / T.A. Moger, O.O. Aalen, K. Heim-dal, H.K. Gjessing // Stat. Med. - 2004. - Vol. 23, № 4. - P. 617-632. DOI: 10.1002/sim.1614
- Morley E., Perry H.M. 3rd, Miller D.K. Editorial: Something about frailty // J. Gerontol. A Biol. Sci. Med. Sci. -2002. - Vol. 57, № 11. - P. M698-M704. DOI: 10.1093/gerona/57.11.m698
- Михальский А.И., Петровский А.М., Яшин А.И. Теория оценивания неоднородных популяций. - М.: Наука, 1989. - 126 с.
- Studying health histories of cancer: A new model connecting cancer incidence and survival / A.I. Yashin, I. Akushe-vich, K. Arbeev, L. Akushevich, A. Kulminski, S. Ukraintseva // Math. Biosci. - 2009. - Vol. 218, № 2. - P. 88-97. DOI: 10.1016/j.mbs.2008.12.007
- GRACE Score among Six Risk Scoring Systems (CADILLAC, PAMI, TIMI, Dynamic TIMI, Zwolle) Demonstrated the Best Predictive Value for Prediction of Long-Term Mortality in Patients with ST-Elevation Myocardial Infarction / S. Litt-nerova, P. Kala, J. Jarkovsky, L. Kubkova, K. Prymusova, P. Kubena, M. Tesak, O. Toman [et al.] // PLoS One. - 2015. -Vol. 10, № 4. - P. e0123215. DOI: 10.1371/journal.pone.0123215
- Злокачественные новообразования в России в 2014 году (заболеваемость и смертность) / под ред. А.Д. Капри-на, В.В. Старинского, Г.В. Петровой. - М.: МНИОИ им. П.А. Герцена. - 2016. - 250 с.
- Гаврилов Л.А., Гаврилова Н.С. Биология продолжительности жизни. - 2-е изд., перераб. и доп. - М.: Наука, 1991. - 280 с.
- Wilkins A., Corbett R., Eeles R. Age distribution and multi-stage theory of carcinogenesis: 70 years on // Br. J. Cancer. - 2023. - Vol. 128. - P. 404-406. DOI: 10.1038/s41416-022-02009-9
- Armitage P., Doll R. The age distribution of cancer and a multi-stage theory of carcinogenesis. 1954 // Int. J. Epidemiol. - 2004. - Vol. 33, № 6. - P. 1174-1179. DOI: 10.1093/ije/dyh216
- Whittemore A.S. Quantitative theories of oncogenesis // Adv. Cancer Res. - 1978. - Vol. 27. - P. 55-88. DOI: 10.1016/s0065-230x (08) 60930-6
- On prognostic estimates of radiation risk in medicine and radiation protection / A. Ulanowski, J.C. Kaiser, U. Schneider, L. Walsh // Radiat. Environ. Biophys. - 2019. - Vol. 58, № 3. - P. 305-319. DOI: 10.1007/s00411-019-00794-1
- Age Standardization of Rates: A New WHO Standard / O.B. Ahmad, C. Boshi-Pinto, A.D. Lopez, C.J. Murray, R. Lozano, M. Inoue // GPE Discussion Paper Series: No. 31. - EIP/GPE/EBD: World Health Organization, 2001. - 14 p.
- The 2007 Recommendations of the International Commission on Radiological Protection. ICRP Publication 103 // Ann. ICRP. - 2007. - Vol. 37, № 2-4. - P. 1-332. DOI: 10.1016/j.icrp.2007.10.003
- Effects of Ionizing Radiation: UNSCEAR 2006 Report to the General Assembly, with scientific annexes. - NY: United Nations, 2008. - Vol. 1. - 383 p.
- ICRP Publication 147: Use of dose quantities in radiological protection / J.D. Harrison, M. Balonov, F. Bochud, C. Martin, H.-G. Menzel, P. Ortiz-Lopez, R. Smith-Bindman, J.R. Simmonds, R. Wakeford // Ann. ICRP. - 2021. - Vol. 50, № 1. - P. 9-82. DOI: 10.1177/0146645320911864
- Jacobi W. The concept of the effective dose - a proposal of the combination of the organ doses // Radiat. Environ. Biophys. - 1975. - Vol. 12, № 2. - P. 101-109. DOI: 10.1007/BF01328971
- Assessment of prospective cancer risks from occupational exposure to ionizing radiation // IAEA-TECDOC-1985. -Vienna: IAEA, 2021. - 76 p.
- Thyroid cancer after exposure to external radiation: a pooled analysis of seven studies / E. Ron, J.H. Lubin, R.E. Shore, K. Mabuchi, B. Modan, L.M. Pottern, A.B. Schneider, M.A. Tucker, J.D. Boice Jr. // Radiat. Res. - 1995. - Vol. 141, № 3. -P. 259-277. DOI: 10.2307/3579003
- Cancer incidence in atomic bomb survivors. Part II: Solid tumors, 1958-1987 / D.E. Thompson, K. Mabuchi, E. Ron, M. Soda, M. Tokunaga, S. Ochikubo, S. Sugimoto, T. Ikeda [et al.] // Radiat. Res. - 1994. - Vol. 137, Suppl. 2. - P. S17-S67. DOI: 10.2307/3578892
- Медицинские радиологические последствия Чернобыля для населения России: проблема рака щитовидной железы / В.К. Иванов, А.Ф. Цыб, М.А. Максютов, К.А. Туманов, С.Ю. Чекин, В.В. Кащеев, А.М. Корело, О.К. Власов, Н.В. Щукина // Медицинская радиология и радиационная безопасность. - 2011. - Т. 56, № 2. - С. 17-29.
- Оценка радиогенного риска заболеваемости раком предстательной железы от внешнего гамма-излучения в когорте работников ПО «Маяк», подвергшихся профессиональному пролонгированному облучению / Л.В. Финашов, И.С. Кузнецова, М.Э. Сокольников, С.Г. Скуковский // Вопросы радиационной безопасности. - 2020. - № 2 (98). -С. 37-48.


