Возрастная инволюция симпатической нервной системы, внезапная сердечная смерть и особенности диагностики инфаркта миокарда
Автор: Швалев Вадим Николаевич, Рогоза Анатолий Николаевич, Сергиенко Владимир Борисович, Реутов Валентин Палладиевич, Малыхина Татьяна Викторовна, Шитов Виктор Николаевич, Просвирин Антон Викторович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Обзорные и общетеоретические статьи
Статья в выпуске: 4 т.25, 2017 года.
Бесплатный доступ
Неврологическая природа основных кардиологических заболеваний связана с высоким социальным напряжением. Установление феномена ранней возрастной инволюции симпатического отдела вегетативной нервной системы в связи с проявлением закона Кеннона, способствует изучению механизма внезапной сердечно смерти и поиском диагностических методов ее предотвращения. В частности, метода время - частотного спектрального анализа вариабельности сердечного ритма в ранних фазах ортостатических проб. Методом радионуклеидной диагностики получены новые данные о взаимоотношениях при инфаркте миокарда кровеносных капилляров и симпатических нервных сплетений.
Симпатические сплетения, инволюция, вариабельность сердечного ритма
Короткий адрес: https://sciup.org/143177228
IDR: 143177228
Текст научной статьи Возрастная инволюция симпатической нервной системы, внезапная сердечная смерть и особенности диагностики инфаркта миокарда
Швалев В.Н., Рогоза А.Н., Сергиенко В.Б., Реутов В.П., Малыхина Т.В., Шитов В.Н., Просвирин А.В. Возрастная инволюция симпатической нервной системы, внезапная сердечная смерть и особенности диагностики инфаркта миокарда// Морфологические ведомости.- 2017.- Том 25.- № 4.- С. 7-13. (25).04.7-13
Shvalev VN, Rogoza AN, Sergienko VB, Reutov VP, Malykhina TV, Shitov VN, Prosvirin AV. Age-related involution of the sympathetic nervous system, sudden cardiac death and features of diagnosis of myocardial infarction. Morfologicheskie Vedomosti – Morphological Newsletter. 2017 Dec 30;25(4):7-13. (25).04.7-13
Введение . Одной из основных проблем современной медицины является анализ причин и предотвращения внезапной сердечной смерти (далее - ВСС) в связи с десятками тысяч ежедневных трагедий во всех странах мира. Естественно, изучение взаимоотношений сердечно-сосудистой и нервной систем необходимо начинать с анализа их пренатального развития, так как исследования значения нервной трофики для состояния тканей с помощью новых морфофункциональных методов и клинических наблюдений возможны лишь при рассмотрении последовательных этапов онтогенеза [1]. Иммунногистохимическими способами установлено, что в конце второго месяца развития эмбриона человека в нервные терминали сердца и сосудов проникают медиаторы – ацетилхолин и норадреналин. В результате с началом плодного периода на третьем месяце беременности наряду с образованием плаценты возникают адаптационнотрофические влияния нервных сплетений на развивающуюся сердечно-сосудистую систему. Таким образом, плодный период, наряду с дифференцировкой центральной нервной системы, характеризуется началом медиаторного этапа вегетативной нервной системы. В процессе формирования сердечно-сосудистой системы влияние процессов нервной трофики на нее возрастает [2]. У плода формируются спинномозговые узлы, образующие рецепторы и сердце у стенки сосудов. И уже в пренатальном онтогенезе у него могут возникнуть предпосылки к сердечно-сосудистым заболеваниям. Нарушения развития нервной системы могут быть основой врожденных заболеваний, в том числе и пороков сердца. Установлено, что фактором защиты от повреждений клеток и субклеточных структур является циклическая организация свободных радикалов азота и кислорода [3, 4]. Так курение, прием алкоголя и наркотиков беременными женщинами оказывают патологическое влияние на развитие ребенка. Ежедневно в мире умирает около 7000 новорожденных и постоянно нарастает количество детей с врожденными заболеваниями.
Активное развитие нервного аппарата сердца происходит в процессе полового созревания и в наибольшей степени концентрация афферентных и эфферентных сплетений определяется в сердце человека на втором и третьем десятилетиях. Именно тогда при нормальном образе жизни достигаются наивысшие спортивные результаты. Взаимоотношения «мозг - сердце» в течение первых тридцати – сорока лет жизни человека характеризуются оптимально высокой активностью, но затем возникает их прогрессирующее снижение [5]. Это связано, в частности, с уменьшением содержания медиаторов в симпатических нервных сплетениях сердца и сосудов, хотя одновременно возникает и нарастает компенсаторное повышение эндокринной регуляции кровеносной системы [1, 4].
Цель исследования - получить данные о состоянии и возрастных изменениях симпатических нервных окончаний сердца с помощью метода радионуклидной диагностики и их значении в диагностике инфаркта миокарда.
Материалы и методы исследования . Изучен биопсийный материал ранних вскрытий (в первые три часа после смерти) 73-х внезапно умерших людей в качестве контроля исследовались материалы 51-го погибшего при несчастных случаях. Использовались нейроморфологические методы, электронная микроскопия, морфо-биохимические методы. Исследованы функции симпатических окончаний сердца у 48-ми пациентов с инфарктом миокарда радионуклеидным методом, методом однофотонной эмиссионной компьютерной томографии (далее - ОЭКТ) с метайод бензил-гуанидином, меченым иодом-123 (далее - 1231-МИБГ). Для оценки нарушений симпатической активности миокарда и кровоснабжения рассчитывали площадь и глубине дефектов накопления 1231-МИБГ и 99 ГС-МИБИ. Определяли конечно-диастолический и конечно-систолический объем крови за один цикл сокращения левого желудочка и фракцию его выброса. Возраст пациентов: 1 -ая группа - до 50-ти лет (n=16); 2-ая группа - от 50-ти до 60-ти лет (n=17); 3-я группа - старше 60-ти лет (n=14). Срок наблюдения до 8-ми месяцев. У 180-ти пациентов с различными формами кардиопатий проводилось изучение антител к нервной ткани в сыворотке крови. Методом время-частотного спектрального анализа [6] изучен сердечный ритм у здоровых лиц и у больных с артериальной гипертензией в возрасте от 18-ти до 71-го года (n=79).
Результаты исследования и обсуждение . Изучение при ВСС плотности адренергических нервных сплетений сердца показало ее 3-6 кратное снижение по сравнению с контрольными материалами. В миокарде при ВСС были обнаружены возрастные изменения иннервации тканей водителя ритма и наблюдались очаги деструкции симпатических сплетений преимущественно в синусном узле и по протяжению проводящей системы. При ультраструктурных исследованиях выявлена светлая форма деструкции афферентных волокон, характеризующаяся увеличе6нием их диаметра и сопровождающаяся дегенераций рецепторных окончаний. Экспериментально-морфологические исследования А.Д. Ноздрачева и П.М. Маслюкова [2] убедительно подтверждают вывод о том, что «симпатическая нервная система подвергается более ранним инволюционным преобразованиям». Феномен ранней возрастной инволюции симпатического отдела вегетативной нервной системы, установленный нейроморфологами, был подтвержден в ряде клинических наблюдений. Так было выявлено выраженное снижение низкочастотной мощности кардиоинтервалов здоровых лиц после 40-ка лет [6]. При этом у больных артериальной гипертензией ее снижение происходит значительно интенсивнее. Были показаны так же изменения прироста низкой частоты спектра сердечных сокращений в ортостазе у здоровых людей и у больных гипертонической болезнью (далее - ГБ). Установлено, что продолжительное лечение бета-адреноблокаторами больных ГБ приводит к повышение отклика клеток-мишеней на симпатические воздействия, происходит заметное нарастание низкочастотной (далее - НЧ) мощности на фоне раннего ортостаза после приема бисопролола в течение 3-х недель. В исходном состоянии значительно снижаются амплитуды как НЧ, так и высокочастотном (далее - ВЧ) диапазонов. После ортостаза отмечается адекватный прирост мощности в НЧ-диапазоне. В целом время-частотный спектральный анализ вариабельности сердечного ритма позволяет ориентироваться в прогнозе состояния больных ГБ [6].
Проблема морфофизиологии симпатического отдела вегетативной нервной системы часто обсуждалась и обсуждается в литературе [7-12]. Авторы использовали электрофизиологические методы выделения НА из нервных окончаний, в частности определялась спонтанная активность адренергических нейронов. Флуоресцентно-гистохимический метод выявления катехоламинов позволял им определять механизмы их синтеза и резервирования ив формирующихся варикозностях нервных терминалей. Проводилось так же и изучение адренорецепторов и адреноблокаторов в миокарде. Однако до установления нами феномена ранней возрастной инволюции симпатического отдела вегетативной нервной системы [1] изменениям в симпатической иннервации в онтогенезе при ВСС и кардиологических заболеваниях не уделялось должного внимания. Ко времени открытия названного феномена было справедливым заключение Д. Бэрнстока и М. Коста: «О дегенерации симпатической системы в течение жизни или о соответствующих эффектах на уровне целостного организма известно мало. Данные о способности химических и иммунологических антигенов индуцировать дегенеративные изменения в адренергических нейронах вносят неоценимый вклад в исследование физиологии адренергической системы, а также открывают новое поле деятельности в деле изучения старения и патологии вегетативной нервной системы» [12, с. 142]. После 40-ка лет жизни установлены нарушения нервной трофики сердечно-сосудистой системы. Они выражаются в нарастании с годами инволюционных изменений симпатического отдела вегетативной нервной системы. Начальные реактивные изменения адренергических терминалей постепенно переходят к старости в деструктивные. Возникает вопрос -какова связь нарастания ВСС у пожилых и старых людей с установленным морфофункциональными исследованиями феноменом ранней возрастной инволюции симпатических нервных сплетений? Ответ на вопрос о причине фибрилляции сердца у пациентов после 40-летнего возраста и повышения к старости частоты ее возникновения, приводящей к ВСС, был установлен в результате морфофизиологического анализа значения степени концентрации нервных сплетений в иннервируемых тканях. В результате открытия В. Кенноном и А .Розенблютом [7] феномена повышения чувствительности денервированных структур, установлено, что: «Если в ряду эфферентных нейронов разрушается какая-либо единица, то в изолированной структуре или структурах развивается повышенная раздражимость к действию химических веществ, причем в непосредственно денервированных участках этот эффект максимален» [7, с. 205].
Таким образом, важно подчеркнуть, что в связи с феноменом ранней возрастной инволюцией симпатического отдела вегетативной нервной системы [13], согласно закону В. Кеннона и А. Розенблюта [7] нарастает гуморальная компенсация влияний на денервированные ткани. Происходит увеличение адренорецепторов в стенке сосудах и в сердце и повышение их чувствительности к катехоламинам. Это подтверждается физиологическими и биохимическими исследования [14]. Вместе с тем частота ВСС начинает с возрастом увеличиваться и как правило, половина их регистрируется к 55-65 -летнему возрасту. У здоровых людей после 40 лет установлены нарушения нервной трофики сердечно-сосудистой системы. Они выражаются в непрерывном нарастании инволюционных изменений симпатического отдела вегетативной нервной системы. Начальные реактивные изменения адренергических терминалей постепенно переходят к старости в деструктивные. Процессы инволюции симпатических сплетений резко возрастают при сердечных заболеваниях, в частности при инфаркте миокарда. Исследования В. Кеннона и его основного соавтора – А. Розенблюта, совпали по времени с годами деятельности Г.Ф. Ланга и А.Л. Мясникова [15]. Американский физиолог В. Кеннон, избранный иностранным почетным членом Академии наук СССР, признавал в своих трудах первостепенное значение исследований условных рефлексов и нервной трофики в трудах И.П. Павлова и других российских ученых.
Углубленное изучение системы «мозг-сердце» при высоких социальных нагрузках весьма перспективной [16-19]. А.Л. Мясников [9], характеризуя представления об общности развития гипертонической болезни и атеросклероза, отмечал, что исходный источник патологического процесса при той и другой болезни вначале сосредоточен в центральной нервной системе и по своему происхождению и характеру состоит в нарушении высшей нервной деятельности и подкорковой регуляции. Далее выступает звено вегетативной нервной системы с избыточным раздражением преимущественно симпатического ее отдела. Затем участвует гормональная часть изменений регуляции тканей, в частности, реакция со стороны мозгового слоя надпочечника и других отделов хромаффинной системы, продуцирующая катехоламины» [59, с.570]. Таким образом, раскрывая представления об общности развития кардиологических заболеваний, А.Л. Мясников выделял три последовательных периода патологических изменений регуляции сосудов: вначале активные влияния со стороны центральной нервной системы, затем нарушения регуляции вегетативной нервной системы и заключительные процессы – изменения гормональных влияния и отмечал, что со стороны тканей «развивается повышенная раздражимость к действию химических веществ».
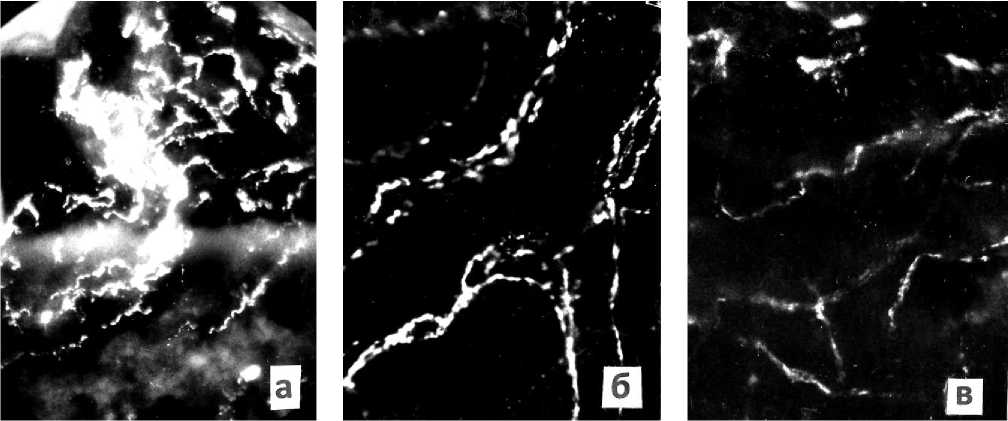
Рис. 1. Изменения плотности адренергических нервных сплетений в миокарде левого желудочка сердца; а – симпатическое нервное сплетение в миокарде 32-летнего здорового мужчины; б – снижение концентрации симпатического нервного сплетения в миокарде 62-летнего мужчины в условиях нормы; в - оставшиеся единичные адренергические нервные терминали в миокарде левого желудочка сердца у 62-летнего мужчины при инфаркте миокарда. Ув.: х400.
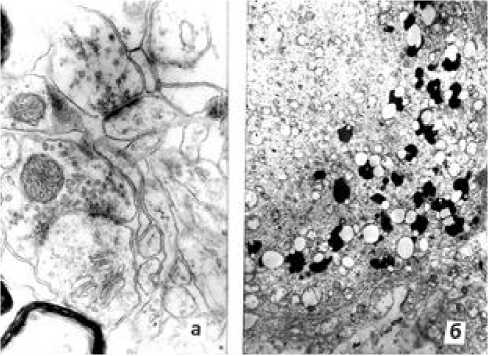
Рис. 2. Ультраструктура элементов симпатической нервной системы в норме и при инфаркте миокарда; а – участок шейно-грудного симпатического ганглия 32-летнего мужчины в норме; б - изменения звездчатого нервного ганглия мужчины 52-летнего мужчины узла при инфаркте миокарда. Ув.: х10000.
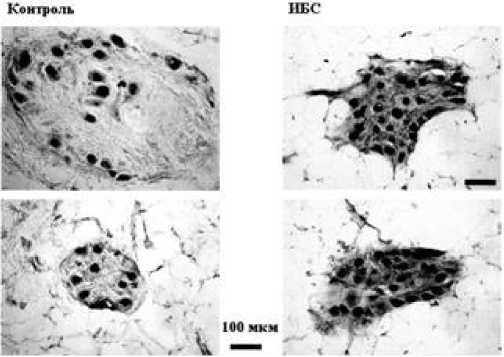
Рис. 3. Экспрессия NADPH-диафоразы в интрамуральных нервных ганглиях сердца человека при ишемии миокарда.
Ультраструктурный анализ симпатических ганглиев показал нарастание их инволюционных изменений после 40летнего возраста, особенно при ИМ и при других кардиологических заболеваниях. Наряду с нарушениями контуров ядер симпатических нейронов, в них возникает дегенерация крист митохондрий, а в цитоплазме скапливаются гранулы липофусцина [4]. Рецепторы венечных артерий также претерпевают вначале реактивные, а затем дегенеративные изменения. Но следует отметить, что парасимпатические нервные сплетения изменяются с возрастом медленнее.
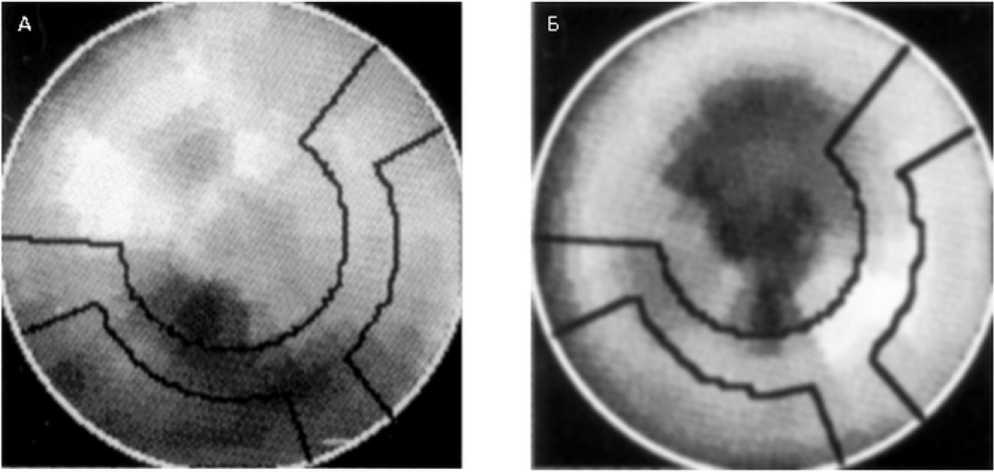
Рис. 4. Примеры полярных изображений миокарда левого желудочка сердца после введения 1231-МИБГ у пациентов с нижним (А) и передним (Б) инфарктом миокарда. Затемненные участки миокарда соответствуют зонам отсутствия накопления медиаторов.
Какие причины могут лежать в основе развития инволюции адренергических сплетений сердца? Установлено, что возбуждающая аминокислота глутамат и оксид азота (NO) с его продуктами метаболизма (нитритными ионами и др.) играют важную роль как процесс физиологических состояний, сопровождающихся активацией растворимой гемосодержащей гуанилатциклазы, так и в процессе гибели нейронов при инсультах, черепно-мозговых травмах и нейродегенеративных изменениях сосудов [14]. Оксид азота выделяется эндотелием на протяжении всей жизни. При ИБС в нервных ганглиях сердца увеличивается экспрессия NOS. Вместе с тем с возрастом в ганглиях доля NADPH-диафораза - позитивных нейронов в сердечных ганглиях непрерывно снижается. Диоксид азота, образующийся при нарушениях циклов оксида азота, может быть причиной разрушения адренергических волокон, особенно в местах бифуркации сосудов и способствовать возрастной десимпатизации сердца. При взаимодействии кислорода или супероксидного анион-радикала с NO образуются пероксинитриты, NO2 и ОН-радикалы которые возникают преимущественно в области бифуркации артерий, вследствие чего возникают условия для формирования атеросклеротических бляшек [3]. Пока в стенке артерии сохраняются нервные волокна, выделяющие норадреналин и другие медиаторы, являющиеся фенолами биологического происхождения, атеросклеротические бляшки развиваются медленно, поскольку биофенолы являются антиоксидантами, обладающими антирадикальными свойствами. По мере нарастания инволюции адренергических нервных волокон и снижения содержания медиаторов-биофенолов, в интиме артерии образование атеросклеротических бляшек активируется. Прекращение выделения норадреналина из претерпевающих инволюцию симпатических нервных волокон способствует, таким образом, стимуляции деструктивных изменений сосудистой стенки [3,4].
А.Л. Мясников отмечал, что по определению Г.Ф. Ланга, гипертоническая болезнь является следствием нарушения функции («невроза») высших корковых и гипоталамических центров, регулирующих кровяное давление [9, с. 13]. Во всех случаях ВСС наряду с очаговой дегенерации нервного аппарата сердца в гипоталамусе было установлено нарушение соотношения основных катехоламинов - норадреналина и адреналина. В гипоталамических ядер доминировал адреналин, в то время как в норме в них преобладает норадреналин [14].
Крупным вкладом в учение о нейрогенной природе кардиологических заболеваний и нарушений системы «мозг-сердце» являются исследования радионуклидной диагностики [4, 20, 21]. Радиодиагностические исследования с нейротропными препаратами показали возможность выявления ранних нарушений симпатической системы миокарда при гипертонической болезни, атеросклерозе, кардиомиопатиях, аритмиях, инфаркте миокарда (далее - ИМ) и при трансплантации сердца. Выявлялось состояние определенных отделов головного мозга и изменения различных отделов вегетативной нервной системы. Установлены преимущества применения в клинике диагностической сцинтиграфии с радиофармпрепаратом (РФП) 1231-мета-йод-бензилгуанидином (1231-МИБГ), как высокоинформативного метода оценки состояния симпатической нервной системы миокарда. Отмечено, что однофотонная (далее - ОЭКТ) и позитронная эмиссионная компьютерная томография (далее - ПЭТ) с высокой степенью достоверности позволяют обнаружить в тканях сердца развитие патологических очагов и установить признаки денервации миокарда. Исходя из особенностей фармакокинетики включения 123I-МИБГ в миокард, являющегося аналогом норадреналина, после его внутривенного введения при радионуклидном исследовании появилась возможность оценки плотности адренергических рецепторов миокарда. Работами сотрудников отдела РНД было впервые показано, что процессы восстановления иннервации миокарда после острого ИМ значительно замедлены по сравнению с восстановлением перфузии. У больных с коронарным атеросклерозом было показано наличие повреждений симпатических нейронов даже при начальной ишемии миокарда.
Примером, демонстрирующим клинические последствия локального снижения симпатической иннервации сердца, являются пациенты, перенесшие инфаркт миокарда. Установлено [22, 23], что нарушения функции симпатических окончаний сердца при инфаркте миокарда могут способствовать развитию недостаточности кровообращения постинфарктной стенокардии, жизнеопасным нарушениям ритма. У пациентов при ОЭКТ с 123I-МИБГ были выявлены регионарные нарушения симпатической активности левого желудочка, которые соответствовали на локализации инфаркту миокарда. Кроме того, была установлена положительная взаимосвязь между размерами регионарных нарушений симпатической активности и кровоснабжением левого желудочка как остром периоде заболевания, так и спустя 8-мь месяцев. Очевидно, что причиной нарушения функции симпатических окончаний при ИМ является их ишемическое повреждение, некроз и возрастная инволюция. В общей группе больных при динамическом наблюдении отмечалось достоверное улучшение кровоснабжения левого желудочка, что сопровождалось менее выраженным, но статистически значимым уменьшением дефектов иннервации (табл. 1).
Таблица 1
Соотношение зон инфаркта миокарда и зон симпатической денервации миокарда у пациентов различных возрастных групп (в %)
|
Группа пациентов |
Зона инфаркта (%) |
Зона денервации (%) |
||
|
1 неделя |
8 месяцев |
1 неделя |
8 месяцев |
|
|
1-я группа (<50 лет) |
26 |
31 |
30 |
30 |
|
2-я группа (50-60 лет) |
17 |
13 |
28 |
24 |
|
3-я группа (>60 лет) |
26 |
21 |
35 |
33 |
У пациентов 1-ой группы зона инфаркта миокарда занимала исходно 26% от общей площади левого желудочка и по истечении 8-ми месяцев несколько уменьшались (до 21%). Однако зона десимпатизации миокарда сохранялась на уровне 30% и в ранние и поздние сроки. У пациентов 2-ой и 3-ей групп, как и у пациентов 1-ой группы было констатировано снижение площади поражения миокарда к 8-муц месяцу (на 5%). При этом на 4% уменьшилась и зона денервации миокарда. Вместе с тем следует отметить, что у более пожилых пациентов – после 60-летнего возраста как правило наблюдалась наиболее обширная зона повреждения симпатических окончаний – 35% и улучшение состояния миокарда к 8му месяцу у некоторых больных не превышало 2%. Характерно, что как на первой неделе после ИМ, так и через 8-мь месяцев средне-групповые размеры зон с нарушенной симпатической активностью были значительно больше, чем размеры зоны ишемии миокарда. Несомненно, что это связано с большей чувствительностью нервной ткани к ишемии по сравнению с кардиомиоцитами.
Зоны миокарда с нарушенной симпатической активностью, но с сохраненной микроциркуляцией, согласно закона Кеннона – Розенблюта приобретают чрезмерную чувствительность к действию катехоламинов, так называемую «денервационную сверхчувствительность». Это способствует повышению электрической нестабильности миокарда активации процессов апоптоза кардиомиоцитов, что может приводить к возникновению жизнеугрожающих нарушений ритма. Подобные изменения с возрастом могут происходить и у казалось бы здоровых пациентов, являясь субстратом для таких трагических сердечно-сосудистых событий, как нарушения ритма сердца, фибрилляции предсердий и ВСС. Улучшение функции симпатических окончаний миокарда при динамическом наблюдении сопровождалось небольшим, но достоверным увеличением фракции выброса левого желудочка. Кроме того, при этом не происходило расширения полости левого желудочка, наблюдаемое у пациентов с отрицательной динамикой региональных нарушений симпатической активности. В подгруппе с «ухудшением» симпатической активности было значимо больше пациентов с сердечной недостаточностью (11% против 40%. Р=0,03).
Применение радионуклидных визуализирующих методов важно также при дилатационной кардиомиопатии, поскольку раздражение симпатической системы при прогрессировании данного заболевания стимулирует хроническую сердечную недостаточность [8, 22]. Таким образом, при использовании радионуклидных методов исследования стало возможным определить степень адаптационно-трофических воздействий на иннервацию миокарда при различных видах сосудистой патологии. Доказано, что при изучении симпатической иннервации сердца важно выявление участков миокарда с нарушенной функцией симпатических окончаний, определение их количества и степени влияния на сердце [8]. Так, у больных вазовагальными обмороками по данным томосцинтиграфии миокарда с 123I-МИБГ отчетливо выявляются нарушения региональной симпатической активности миокарда левого желудочка, которые на сцинтиграммах визуализируются как участки сниженного накопления радиофармпрепарата различной степени выраженности и распространенности.
В отделе новых методов диагностики НИИ кардиологии им .А.Л. Мясникова проводились исследования возрастных изменений функциональных показателей нервной регуляции кровеносных сосудов в кардиологической практике в сочетании с морфологическими исследованиями [45]. Ультразвуковыми методами исследования выявлялись ранние поражения стенки сонных артерий. При умеренной форме ГБ у пациентов определялись отрицательные возрастные корреляционные связи между вариабельностью артериального давления и эффективностью синокаротидного барорефлекса. В этих случаях при морфологических исследованиях было выявлено нарастание десимпатизации сонных артерий. Дефицит симпатического звена регуляции сердечно-сосудистой системы, проявляющийся наличием зон десимпатизации миокарда, наблюдается у большинства больных вазовагальными обмороками. После 35-40-летнего возраста у больных нарастает снижение барорефлекторной активности при денервации сердечно-сосудистой системы и возникающих нарушениях «мозг-сердце».
При изучении природы кардиомиопатий иммуноцитохимическими способами у пациентов определяются взаимосвязи поражения центральной и периферической нервной системы. Анализ сыворотки крови 180-ти больных различными формами кардиомиопатий позволил выявить антитела к нервной ткани. Количественные нейрогистохимические исследования показали, что изменениям миокарда сопутствуют глубокие поражения его симпатических сплетений. На экспериментальном материале наряду с десимпатизацией миокарда выявляется и его деафферентация. Исследования [4, 13] позволили выявить особенности нейротрофического контроля, осуществляемого чувствительными нейронами. Было доказано, что синтезируемые в нейронах цитокины семейства нейрорегулинов контролируют состояние клеток-мишеней, а стимуляция нейрорегуляторных процессов производится при посредстве генных нейротрофических факторов. Анализ вазовагального синдрома выявил дисфункцию гипофизарно-надпочечниковой и ренин-альдостероновой систем. Активация симпато-адреналовой системы и натрийуретических пептидов обуславливает развитие пейсмекерного синдрома при установке электрокардиостимуляторов. Исследования профессора В.П. Масенко, касающиеся иммунных систем в развитии депрессивных состояний, отмечены академиком Е.И. Чазовым [15] подчеркнувшим, что «Методические возможности медицинской науки ХХ века раскрыли не только разнообразие регуляторных механизмов - нейрогенных, гормональных, рецепторных, мембранных, но и показали всю сложность их функционирования и взаимозависимости. Они, как и целый ряд других регуляторных систем - иммунной, антикоагулянтной, фибринолитической и других, определяют защиту организма от вредоносных влияний среды».
Заключение . Изложенные в работе данные о возрастных изменениях системы «мозг-сердце» позволили расширить представления об их динамике и последствиях. В результате первоначального сорокалетнего повышения в течение жизни человека деятельности симпатической нервной системы ее адаптационно-трофические влияния на сердце и сосуды с увеличением возраста к старости снижаются и возникают нарастающие предпосылки к сердечным заболеваниям. Приходится, однако, констатировать, что изменения состояния центральной и вегетативной нервной системы в процессе динамики старения еще недостаточно оцениваются в практической медицине. Кардиологи при анализе жалоб на характер болей у пациентов не всегда консультируются со специалистами-вегетоневрологами, хотя изменения сердца и кровеносных сосудов, как следствие возрастных нарушений адаптационно-трофических и гуморальных воздействий нервной системы, необходимо постоянно учитывать в клинической практике. Как известно, в результате десимпатизации сердца и сосудов происходит повышение чувствительности денервированных структур. В десимпатизированных тканях их адренореактивность нарастает и кроме того, компенсаторно увеличивается гуморальная регуляция сердечно-сосудистой системы. Адреноблокаторы блокируют адренорецепторы, число которых возрастает в связи с проявлениями феномена ранних инволюционных изменений симпатического отдела вегетативной нервной системы. Таким образом сегодня наиболее актуальными проблемами кардиологии, в связи с непростыми социальными условиями, являются проблемы дальнейшего изучения различных периодов онтогенеза нервной системы, включая ее количественные нейрогистохимические и функциональные исследования способствующие профилактике сердечно-сосудистых заболеваний и предотвращения внезапной сердечной смерти.
Список литературы Возрастная инволюция симпатической нервной системы, внезапная сердечная смерть и особенности диагностики инфаркта миокарда
- Швалев В.Н., Сосунов А.А., Гуски Г. Морфологические основы иннервации сердца.-М.: Наука, 1992.-366с.
- Ноздрачев А.Д., Маслюков П.М. Возрастное развитие автономных ганглиев.-СПб.: Информ-Навигатор, 2014.-320с.
- Реутов В.П., Сорокина Е.Г. и др. Проблемы оксида азота в биологии и медицине и принцип цикличности.-М.: УРСС, 2003.-94с.
- Швалев В.Н., Реутов В.П., Рогоза А.Н. и др. Морфофункциональные исследования нейрогенной природы заболеваний сердечно-сосудистой системы//Морфологические ведомости.-2014.-№ 7.-С. 6-20.
- Швалев В.Н., Сосунов А.А. Этапность преобразования вегетативной нервной системы в онтогенезе//Арх. анат.-1989,-№ 5,-С. 5-17.
- Тарский Н.А., Швалев В.Н., Салтыков С.Ю. и др. Особенности время-частного спектрального анализа сердечного ритма у здоровых лиц и у больных с артериальной гипертензией при проведении ортостатической пробы//Кардиология.-2000.-№ 4.-С. 40-45.
- Кеннон В., Розенблют А. Повышение чувствительности денервированных структур.-М.: Изд. иностр. литер., 1951.-202с.
- Сергиенко В.Б., Аншелес А.А. Радионуклидная диагностика с нейротропными препаратами.-М.: Инфра-М., 2014.-112с.
- Мясников А.Л. Гипертоническая болезнь и атеросклероз.-М.: Медицина, 1965.-615с.
- Погосова Г.В. Депрессия -фактор развития ишемической болезни и предиктор коронарной смерти. 10 лет научного поиска//Кардиология.-2012.-№ 12.-С. 4-11.
- Albert CM1, Chae CU, Grodstein F et al. Prospective of sudden cardiac death among women in the United States. Circulation 2003;107:2096-2101.
- Sumstock Y, Bumstek Y. Evolution of the antonomic innervation of visceral and cardiovascular system in vertebrates. Eur Y.Med. 2003;162:1024-1036.
- Швалев В.Н., Тарский Н.А. Феномен ранней возрастной инволюции симпатического отдела вегетативной нервной системы//Кардиология.-2001.-№ 2.-С. 10-14.
- Швалев В.Н., Реутов В.Н., Рогоза А.Н. и др. Механизмы развития кардиологических заболеваний при возрастных нарушениях состояния нервной системы//Казанский мед. журнал.-2016.-№ 4.-С. 598-607.
- Чазов Е.И. Дисрегуляция и гиперреактивность организма как факторы формирования болезни//Кардиологический вестник.-2006.-№ 1.-С. 5-9.
- Ардашев А.В., Беленков Ю.Н. и др. Национальные рекомендации по определению риска и профилактике внезапной смерти//Клиническая практика.-2012.-№ 4.-С. 5-9.
- Кактурский Л.В. Внезапная сердечная смерть (клиническая морфология).-М.: Медицина, 2000.-124с.
- Myerburg R.J. Sudden cardiac death epidemiology, causes and mechanisms. Cardiology 1987;74(2):2-9.
- Schmidt R.E. Age-related sympathetic ganglionic neuropathology Human pathology and animal model. Auton. Neurosci. 2002;96(1):63-72.
- Аншелес А.А., Сергиенко В.Б. Томографические методы диагностики при оценке перфузии миокарда у больных с ишемической болезнью сердца//Медицинская радиология.-2011.-№ 3.-С. 5-20.
- Сыркин А.Л., Новикова Н.А., Новикова С.А., Терехин С.А. Острый коронарный синдром.-М.: МИА, 2010.-440с.
- Козловская И.Ю., Шитов В.Н. и др. Нарушения симпатической иннервации сердца у больных с острым инфарктом миокарда и нестабильной стенокардией//Кардиология.-2004.-№ 7.-С. 48-52.
- Павлович Е.Р., Просвиркин А.В., Ботчей В.М. К вопросу о топографии атриовентрикулярной системы проведения в сердцах мелких лабораторных животных//Современные наукоемкие технологии.-2014.-№ 12.-С.3-9.
- Рогоза А.Н., Бабаев А.А, Панфилов В.В. и др. Барорецепторная регуляция у здоровых лиц и у больных гипертонической болезнью//Кардиология.-2000.-№ 4.-С.40-45.
- Rogriguez JM, Chillon C et al. Age at onset and gender of patients with different types of supraventricular tachycardias. Amer. J. Cardiol. 1992;70:1213-1215.
- Shimizu M, Ynto Y et al. Heterogeneity of cardiac sympathetic nerve activity and systolic dysfunction in patients with hypertrophic cardiomyopathy. J Nucl Med. 2002;43(1):15-20.
- Seals DR, Esler MD. Human ageing and sympathoadrenal system. J Physiol. 2000;528:407-417.
- Zipes DK, Wellness HJ Sudden cardiac death. Circulation 1998;98:2334-2351.
- Barron HV. Autonomic nervous system and sudden cardiac death M.D.Cardiol. 1996;27(5):1053-1060.
- Bengel FM, Permenter B et al. Alteration on the sympathetic nerve system and metabolic performance of the cardiomyopathic heart. Eur J Nucl Med. 2002;29:198-202.
- Burgalova M, Sergienko J. Sympathetic innervations abnormalities in patients with hypertrophic cardiomyopathy. Eur J Med. 2003;162:1024-1028.


