Возрастные морфологические изменения глионейронального комплекса первичной зрительной области коры больших полушарий крыс, коррекция n-тирозолом
Автор: Свердева Юлия Олеговна, Варакута Е.Ю., Логвинов С.В., Жданкина А.А., Потапов А.В., Герасимов А.В., Солонский А.В., Суханова Г.А.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 4 (93), 2016 года.
Бесплатный доступ
В эксперименте, проведенном на 30 белых крысах-самцах линии Вистар, показано, что к 18-месячному возрасту в первичной зрительной области коры во II, IV и V слоях увеличивается процентное содержание деструктивно измененных нейронов и глиоцитов, преимущественно по темному типу. Изменяется глионейрональный индекс вследствие уменьшения численной плотности нейронов и закономерного увеличения численной плотности глии. Однако курсовое введение 18-месячным крысам n-тирозола сдерживает деструкцию, что выражается в снижении процентного содержания пикноморфных сморщенных нейронов и глиоцитов. На фоне коррекции у 18-месячных животных снижается также процентное содержание гиперхромных нейронов без сморщивания ядра, что, вероятно, связано с их переходом в нормохромное состояние.
Старение, нейрон, глия
Короткий адрес: https://sciup.org/14295948
IDR: 14295948 | УДК: 591.484.1.068.1:[611.843.1.018.84:611.813.1]-092.9
Текст научной статьи Возрастные морфологические изменения глионейронального комплекса первичной зрительной области коры больших полушарий крыс, коррекция n-тирозолом
Введение. В связи с увеличением средней продолжительности жизни и доли пожилого населения [2] возрастает исследовательский интерес как к изучению медико-биологических аспектов старения, так и к поиску лекарственных средств, предотвращающих возрастные патофизиологические изменения в органах и тканях. Известно, что ведущим фактором старения организма являются изменения в различных структурах центральной нервной системы [1, 8]. Определенный вклад в повреждение клеток при старении вносят свободные радикалы [12], что послужило патогенетическим обоснованием для использования антиоксидантов в качестве геропротекторов [10]. n-Тирозол, разработанный в Новосибирском институте органической химии им. Н. Н. Ворожцова СО РАН (НИОХ СО РАН), является синтетическим аналогом природного фенольного антиоксиданта родиолы розовой и, помимо антиоксидантного эффекта, проявляет гемореологические и антитромбоци-тарные свойства [7].
Цель исследования: изучить возрастные морфологические изменения глионейронально-го комплекса первичной зрительной области коры (OC1) у 18-месячных крыс-самцов линии Вистар на фоне коррекции n-тирозолом и без нее.
Материал и методы. Эксперименты выполнены на 30 белых крысах-самцах линии Вистар в возрасте 3 (n=15) и 18 (n=15) месяцев (табл. 1).
Таблица 1
Распределение животных по экспериментальным группам и подгруппам (абс.)
|
Группа |
Подгруппа |
Количество животных |
|
3-месячные крысы-самцы |
3 мес. (интактные) |
n=5 |
|
3 мес. + n-тирозол |
n=5 |
|
|
3 мес. + эквиобъемное к-во дистиллированной воды |
n=5 |
|
|
18-месячные крысы-самцы |
18 мес. (интактные) |
n=5 |
|
18 мес. + n-тирозол |
n=5 |
|
|
18 мес. + эквиобъемное к-во дистиллированной воды |
n=5 |
Животные каждой возрастной группы (3месячные и 18-месячные) были разделены на 3 равные подгруппы, по 5 животных в каждой подгруппе. Животные первой подгруппы – интактные. Животным второй подгруппы каждой возрастной группы (n=5) в течение 14 суток внутрижелудочно вводили n-тирозол в дозе 50 мг/кг массы. Животным из третьей подгруппы вводили эквиобъемное количество дистиллированной воды.
Всех животных содержали в условиях вивария на стандартном пищевом рационе, с искусственным световым режимом 12 часов день, 12 часов ночь, освещенность 25 лк. На 15-е сутки производили декапитацию крыс под эфирным наркозом, выделяли затылочную область коры, фиксировали в 10 % формальдегиде и заливали в парафин. Отвесные срезы толщиной 5—6 мкм окрашивали крезиловым фиолетовым по Нисслю, дифференцировали область OC1, подсчитывали процентное содержание нейронов с очаговым и тотальным хроматолизом, гиперхромных нейронов со сморщиванием ядра и без, процентное содержание глиоцитов с гиперхромией ядра и его пикнозом во II, IV и V слоях.
Все расчеты производили на 200 соответствующих клеток. Рассчитывали численную плотность нейронов и глии с помощью окулярной рамки известной площади на 1 мм² и определяли глионейрональный индекс. Для электронной микроскопии материал фиксировали в 2,5 % растворе глутаральдегида на какодилатном буфере (рН=7,4). Далее производили постфиксацию в 2 % растворе четырехокиси осмия и заливали в смесь эпона и аралдита М. Полутонкие срезы окрашивали азуром II. Значения всех подгрупп 3-месячных животных были объединены на основании морфолого-количественного анализа, показавшего отсутствие достоверных различий по изучаемым показателям, и считались контрольными. В подгруппе интактных 18месячных крыс и в подгруппе крыс с введением дистиллированной воды достоверных различий по изучаемым показателям также не обнаружено, что позволило нам использовать усредненные значения. Для оценки достоверности различий при сравнении средних величин использовали непараметрический критерий Манна-Уитни. Различия считались статистически значимыми при р<0,05.
Результаты и их обсуждение. К 18месячному возрасту в первичной зрительной области коры у крыс наблюдаются морфологические изменения нейронов по темному типу, причем как обратимого, так и необратимого характера. К обратимым изменениям относят ги-перхромию без сморщивания ядра, такие нейроны имеют нормальные размеры и четкие, ровные контуры ядра и цитоплазмы. В группе 18-месячных животных выявлено достоверное увеличение процентного содержания гипер-хромных нейронов без сморщивания ядра во II слое (рис. 1А) до 33,5 % (28,3—35,2) по сравнению с соответствующими показателями контрольной группы – 18,43 % (15,7—20,48) (p≤0,05). Появление темных нейронов является неспецифической реакцией нервной ткани и отражает их функциональное состояние.
Существуют данные, что гиперхромия является эквивалентом заторможенного состояния, углубление и длительное существование которого может приводить к сморщиванию ядра и гибели клетки [5]. Так, процентное содержание пикноморфных нейронов увеличивается у 18-месячных крыс до 3,5 (1,6—3,5) в V слое по сравнению с таковым у крыс контрольной группы – 0,5 (0—1,0) (p≤0,05). При морфологическом анализе глиальной популяции нами обнаружено, что в группе 18-месячных крыс встречаются глиоциты с высокой степенью конденсации хроматина (рис. 1Б), они характеризуются интенсивно прокрашенным, четко дифференцируемым ядром без признаков сморщивания. Процентное содержание таких гипер-хромных глиоцитов без сморщивания ядра увеличивается во всех исследуемых слоях в группе 18-месячных крыс: до 40 % (35,6—47,1) во II слое, до 29,6 % (28,6—32) в IV слое, до 37,5 % (32,5—39,7) в V слое против значений контрольной группы во II слое 26,17 % (21,5—32,7), в IV слое 20 % (19—24,6), в V слое 22 % (21,4— 32,5) соответственно (p≤0,05).
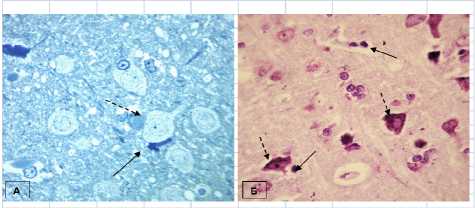
Рис. 1А. Гиперхромный глиоцит со сморщиванием ядра (черная стрелка), нейрон с тотальным хроматолизом (пунктирная стрелка) у 18месячной крысы в IV слое, область OC1. Полутонкий срез. Окраска азур II.
Ув. 1200
Рис. 1Б. Гиперхромные глиоциты (черные стрелки), гипер-хромные нейроны без сморщивания ядра (пунктирная стрелка) у 18-месячной крысы в V слое, область OC1. Парафиновый срез. Окраска крезоловым фиолетовым по Нисс-лю. Ув. 1200
Гиперхромное состояние нейроглии можно объяснить изменением метаболизма и функциональной активности этих клеток. Так, по мнению С. Мори и К. П. Лейблона, гиперхром-ное состояние олигодендроцитов свидетельствует об их зрелости, тогда как наиболее светлые клетки представляют активно делящуюся популяцию [13]. Светлые клетки присутствуют в молодом возрасте, в зрелом возрасте встречаются в норме в основном темные формы [9]. Обнаружено, что гиперхромия свойственна не только олигодендроглии, в области гиппокампа CA1 открыт новый темный тип микроглии, которая обладает повышенной фагоцитарной активностью, главным образом, в области синаптических контактов нейронов. Авторы считают, что такое патологическое состояние связано с развитием окислительного стресса [11].
У 18-месячных крыс во всех исследуемых слоях имеются глиоциты с неправильной угловатой формой, гомогенно интенсивно прокрашенные со сморщенными ядрами. Такие клетки, вероятно, являются исходом длительно существующего гиперхромного состояния. Морфометрический анализ показал, что процентное содержание пикноморфных глиоцитов увеличивается в V слое до 6 % (4—6,25) против соответствующих значений у животных контрольной группы 1,5 % (1—2,8) (p≤0,05).
Для изучения взаимоотношений между глией и нейронами принято использовать глионей-рональный индекс (ГНИ), который значимо увеличивается во всех исследуемых слоях в группе 18-месячных крыс (табл. 2).
Таблица 2
Распределение животных по экспериментальным группам
|
II слой |
IV слой |
V слой |
||||||
|
3 мес. (контроль) |
18 мес. |
18 мес. + n-тирозол |
3 мес. (контроль) |
18 мес. |
18 мес. + n-тирозол |
3 мес. (контроль) |
18 мес. |
18 мес. + n-тирозол |
|
0,25 |
1* |
0,3 |
1 |
1,5* |
1,3 |
0,5 |
0,75* |
0,6 |
|
0-05 |
0,3-0,7 |
0-0,6 |
0,7-1,5 |
0,8-1,5 |
0,5-2 |
0,3-0,8 |
0,5-1 |
0,25-2 |
Примечание. * – Достоверные различия по сравнению с показателями контрольной группы.
Увеличение ГНИ у 18-месячных крыс, наряду с обнаружением в IV и V слоях участков, полностью лишенных нейронов и замещенных глиоцитами, свидетельствует о гибели нейронов и пролиферации глии. Так, во всех исследуемых слоях численная плотность нейронов на 1 мм² среза достоверно уменьшается: до 120 (80—60) во II слое, до 200 (160—220) в IV слое, до 120 (80—160) в V слое по сравнению с соответствующими показателями контрольной группы во II слое 240 (200—240), в IV слое 320 (280—360), в V слое 200 (160—240) (p≤0,05). Численная плотность глии на 1 мм² среза, напротив, значимо увеличивается: до 120 (80— 140) во II слое, до 160 (120—180) в IV слое, до 160 (120—200) в V слое по сравнению с показателями контрольной группы во II слое 40 (40— 80), в IV слое 80 (40—120), в V слое 80 (40— 120) (p≤0,05).
Для коррекции изменений глионейронально-го комплекса был выбран препарат n-тирозол, который как адаптоген повышает сопротивляемость организма к вредному воздействию различных факторов, в том числе и биологических, способствует нормализации энергопродукции мозга в физиологических и стрессовых условиях [6]. При применении n-тирозола у 18месячных крыс отмечается достоверное повышение процентного содержания нейронов с очаговым хроматолизом: в IV слое до 8 % (6,5—10), в V слое до 15 % (9,6—16) по сравнению с таковым показателем у животных той же возрастной группы без коррекции в IV слое 2 % (1—2), в V слое 6 % (4—6,6) (p≤0,05). Очаговый хроматолиз является потенциально обратимым состоянием, которое может отражать повышенную функциональную активность нейрона [3]. Применение n-тирозола снижает процентное содержание гиперхромных нейронов без сморщивания во II слое до 23 % (21—26,5) и процентное содержание сморщенных гиперхром-ных нейронов у 18-месячных крыс в V слое до 1 % (0,8—1,6) по сравнению с аналогичными показателями 18-месячных крыс группы без коррекции (p≤0,05), не достигая при этом соответствующих показателей контроля. При оценке влияния n-тирозола на глиальную популяцию выявлено достоверное снижение процентного содержания гиперхромных пикноморфных глиоцитов: в V слое до 2 % (1,5—2) (p≤0,05), а также гиперхромных глиоцитов без сморщивания ядра в IV слое до 23 % (20,5—28), в V слое до 24 % (20—26,5) (p≤0,05) по сравнению со значениями аналогичных показателей в группе без коррекции, однако значений контроля данные показатели не достигают. Уменьшение содержания пикноморфных глиоцитов и гиперхромных нейронов со сморщиванием ядра на фоне коррекции, вероятно, обусловлено утилизацией погибших клеток и поддержанием адекватного функционального состояния неизмененных и гиперхромных клеток без сморщивания. Похожие результаты были получены нами при исследовании влияния ка-ровертина на радиальную глию сетчатки в условиях яркого света [4].
Выводы. Таким образом, у крыс к 18месячному возрасту без коррекции наблюдается снижение численной плотности нейронов в результате их гибели, главным образом, посредством сморщивания ядра и перикариона. Показано, что n-тирозол препятствует гибели нейронов и глиоцитов, вероятно, за счет своих антиоксидантных и антиагрегантных свойств, проявляя, таким образом, нейропротективный эффект.
Список литературы Возрастные морфологические изменения глионейронального комплекса первичной зрительной области коры больших полушарий крыс, коррекция n-тирозолом
- Анисимов В. Н. Молекулярные и физиологические механизмы старения: в 2-х т. -2-е изд., перераб. и доп. -СПб.: Наука, 2008. -Т. 1. -С. 270.
- Демографический ежегодник России. 2015: Статистический сб./Росстат. -М., 2015. -С. 20-21.
- Коломеец Н. С., Клещинов В. Н. Пластический обмен в нейронах при их изменениях по гипохромному типу//Архив анатомии, гистологии и эмбриологии. -1990. -Т. 98. -С. 30-38.
- Логвинов С. В., Плотников М. Б., Варакута Е. Ю., Жданкина А. А., Потапов А. В., Михуля Е. П. Влияние каровертина на реакцию пигментного эпителия и радиальной глии сетчатки при воздействии яркого света//Бюллетень экспериментальной биологии и медицины. -2007. -№ 7. -С. 112-114.
- Орловская Д. Д., Клещинов В. Н. Нейрон в гиперхром-ном состоянии//Журн. невропатологии и психиатрии. -1986. -Вып. 7. -C. 981-988.
- Саратиков А. С., Краснов Е. А. Родиола розовая. -4-е изд-е, перераб. и доп. -Томск: Изд-во Том. ун-та, 2004. -С. 292.
- Смольякова В. И., Чернышева Г. А., Плотников М. Б., Алиев О. И., Краснов Е. А. Антиоксидантные и кардиопротекторные эффекты n-тирозола при ишемии миокарда с реперфузией у крыс//Кардиология. -2010. -№ 11. -С. 50.
- Солонский А. В., Логвинов С. В. Ультраструктурные и морфометрические особенности синаптогенеза мозга эмбрионов и плодов человека в условиях пренатального воздействия этанола//Бюллетень сибирской медицины. -2008. -Т. 7, № 2. -С. 35-39.
- Хэм А., Кормак Д. Гистология/пер. с англ. -М.: Мир, 1983. -Т. 3. -С. 200-204.
- Ames B. N., Shigenaga M. K., Hagen T. M. Oxidants, antioxidants, and the degenerative diseases of aging//Proceedings of the National Academy of Sciences of the United States of America. -1993. -№ 17 (90). -P. 7915-7922.
- Bisht K., Sharma K. P., Lecours C., Gabriela Sanchez M., El Hajj H., Milior G, Olmos-Alonso A., Gomez-Nicola D., Luheshi G., Vallières L., Branchi I., Maggi L., Limatola C., Butovsky O., Tremblay M. È. Dark microGlia: A new phenotype predominantly associated with pathological states//Glia. -2016. -№ 5 (64). -P. 826-839.
- Miquel J., Juan E. de, Sevila I. Oxygen-induced mitochondrial damage and aging//EXS. -1992. -№ 62. -P. 47-57.
- Mori S., Leblond C. P. Electron microscopic identification of three classes of oligodendrocytes and a preliminary study of their proliferative activity in the corpus callosum of young rats//The Journal of Comparative Neurology. -1970. -№ 1 (139). -P. 1-8.


