Врожденная медуллобластома: пре- и постнатальное МРТ наблюдение
Автор: Коростышевская Александра Михайловна, Папуша Людмила Ивановна, Савелов Андрей Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 6 т.18, 2019 года.
Бесплатный доступ
Введение. Медуллобластома является наиболее распространенной злокачественной детской мозговой опухолью: её доля в общем числе детских опухолей составляет 15-20 %. Тем не менее врожденные медуллобластомы крайне редки и чаще всего диагностируются после родов. По нашим сведениям, только в одном случае опухоль была обнаружена до рождения с помощью ультразвука. Признаки внутриутробной медуллобластомы на МРТ ранее не описывались. Материал и методы. Представлены результаты динамического клинического и МРТ наблюдения медуллобластомы с 31-й нед гестационного развития до 5,5 мес постнатальной жизни, приведены патогистологическое, генетическое и молекулярное исследования, после частичного удаления и паллиативной химиотерапии прослежена динамика инволюции опухоли до полного ответа на терапию до 1 года и 5 мес жизни ребенка. Результаты. МРТ плода на 31-й нед гестационного развития выявила срединное образование в мозжечке размерами менее 2 см, благодаря минимальной гиперинтенсивности на Т1-ВИ и гипоинтенсивности на Т2-ВИ. Кроме того, образование имело признаки ограничения диффузии на ИКД-карте, которое позволило увидеть его более отчетливо. Преимущество диффузно-взвешенных изображений перед традиционными Т1- и Т2-ВИ связано с относительно более низким показателем коэффициента диффузии в опухоли (0,63*10-3 мм2/с) на ИКД-картах по сравнению с окружающим мозговым веществом мозжечка (0,98*10-3 мм2/с). Патогистологическое и генетико-молекулярные исследования показали десмобластический вариант медуллобластомы с повышенной нодулярностью, CMYC/NMYC-негативная, МхR+. ПХТ с применением 5 циклов HIT-SKK химиотерапии по протоколу HIT MED 2014 (версия 2017) в высокоспециализированном детском онкологическом центре привели к стойкой ремиссии опухоли. Выводы. МРТ в пренатальном периоде с использованием диффузно-взвешенных изображений является наиболее эффективным методом ранней диагностики врожденной медуллобластомы, которая при своевременной гистологической, генетической и молекулярной верификации, последующей таргетной химиотерапии может быть доведена до состояния стойкой ремиссии. Заключение. Ранняя пренатальная диагностика, а также постнатальная верификация и классификация врожденных медуллобластом имеют критическое значение для своевременного планирования лечения и хорошего прогноза.
Врожденная медуллобластома, опухоли мозга плода, магнитно-резонансная томография, мрт, диффузионно-взвешенные изображения
Короткий адрес: https://sciup.org/140254296
IDR: 140254296 | УДК: 616-006.48-073.756.8 | DOI: 10.21294/1814-4861-2019-18-6-122-128
Текст научной статьи Врожденная медуллобластома: пре- и постнатальное МРТ наблюдение
Медуллобластома является наиболее распространенной злокачественной детской мозговой опухолью и составляет 15–20 % среди всех детских опухолей [1, 2]. Тем не менее врожденные медуллобластомы крайне редки и чаще всего диагностируются после рождения [3]. По нашим сведениям, только в одном случае опухоль была обнаружена до рождения с помощью ультразвука [5]. Признаки медуллобластомы у плода на МРТ ранее не описывались. Мы представляем уникальное клиническое и МРТ наблюдение врожденной медуллобластомы от пренатального периода до 1,5 лет жизни с описанием течения заболевания после операции и лечения. Описанный случай также иллюстрирует дополнительную диагностическую роль количественного метода МРТ – диффузновзвешенных изображений, который недостаточно широко используется в пренатальных исследованиях мозга [6, 7].
Материал и методы
Эта работа была одобрена местным Комитетом по этике. От матери было получено письменное информированное согласие.
История пациента
Женщина, 31 года (первая беременность, первые роды) обратилась в отделение «МРТ Технологии» Международного томографического центра СО РАН (г. Новосибирск) для проведения МРТ плода на 31-й нед беременности после обнаружения вентрикуломегалии плода на рутинном акушерском УЗИ, проведенном неделей ранее. Протекание беременности и предшествующая трансвагинальная сонография на 12-й нед беременности были без особенностей. По МРТ плода было установлено срединное мозжечковое опухолеподобное поражение, с незначительным отклонением сигнальных характеристик на традиционных Т1- и Т2-ВИ. Роды в срок, самопроизвольные, трансвагинальным путем. У новорожденного (мужского пола) определили увеличенный диаметр головы, напряженный родничок и неврологические симптомы увеличенного внутричерепного давления. В последующие три месяца симптомы у ребенка прогрессировали. Ребенка направили в другое медицинское учреждение для проведения контрастной МРТ, в ходе которой обнаружилась окклюзионная гидроцефалия, вызванная опухолью задней черепной ямки. Затем была осуществлена срочная опе- рация по постановке вентрикулоперитонеального шунта, которая привела к частичной регрессии симптомов. Следующее МРТ-обследование было проведено на 5-м мес жизни ребенка и обнаружило увеличение размера опухоли, в сравнении с данными МСКТ в возрасте 3 мес. В возрасте 5,5 мес ребенку провели резекцию опухоли в высокоспециализированной нейрохирургической больнице (центр им. Рогачева, г. Москва) с последующим МРТ на четвертый день после операции. Патологический диагноз: медуллобластома десмопластическая с повышенной нодулярностью. Установление молекулярной подгруппы медуллобластомы было осуществлено матричным профилированием РНК с использованием образца nanoString (nanoString assay) с панелью экспрессии гена, описанной Норткоттом (Northcott) и др. [8]. В данном случае клетки опухоли обнаружили значительную выраженность генов PDLIM3, EYA1, HHIP, ATOH1 и SFRP1, что позволило отнести медуллобластому к молекулярной подгруппе SHH. Цитогенетический анализ не обнаружил амплификации генов N-MYC и C-MYC. В спинномозговой жидкости не было обнаружено клеток опухоли. С возраста 6 мес и до одного года было проведено 3 цикла химиотерапии HIT-SKK [9] в высокоспециализированном детском онкологическом центре. При помощи МРТ ответ на терапию был оценен как полный. Позже 2 модифицированных цикла химиотерапии SKK были проведены согласно протоколу HIT-SKK [9].
Ко времени написания данной статьи ребенку 1,5 года, рецидива опухоли нет, его неврологиче- ский дефицит минимален (сохраняется незначительная атаксия).
Пренатальное и второе постнатальное исследования МРТ выполнялись на 1.5 T томографе Achieva (Philips Medical Systems, Голландия). Первое постнатальное, постоперационное МРТ и МРТ, выполненное после лечения, производились в других учреждениях на сканере Magnetom Avanto (Siemens Medical Solutions, Эрланген, Германия), а также на сканерах General Electric Optima MR450w и General Electric SIGNA HDe (GE Medical Systems, США) соответственно. В дополнение к стандартным клиническим протоколам, пренатальное и второе постнатальное исследования включали количественный метод МРТ с определением измеряемого коэффициента диффузии (ИКД). Ключевые параметры для ДВИ были одинаковы в пре- и постнатальном протоколах, чтобы обеспечить возможность объективного количественного сопоставления данных. ДВИ были получены с использованием SSh-SE-EPI (TR/TE=2450/64 мс), b-факторы 0, 125, 250, 375, 500 с/мм2. Карты ИКД были получены с разрешением 2,0×2,5 mm2 и толщиной среза 5 мм.
Результаты
На МРТ мозга плода в 31 нед гестации (рис. 1а и 2) была обнаружена симметричная вентри-куломегалия, связанная с обструкцией четвертого желудочка. Срединное поражение мозжечка было едва заметно на T2-ВИ и T1-ВИ за счет слабой гипо- и гиперинтенсивности соответственно. На
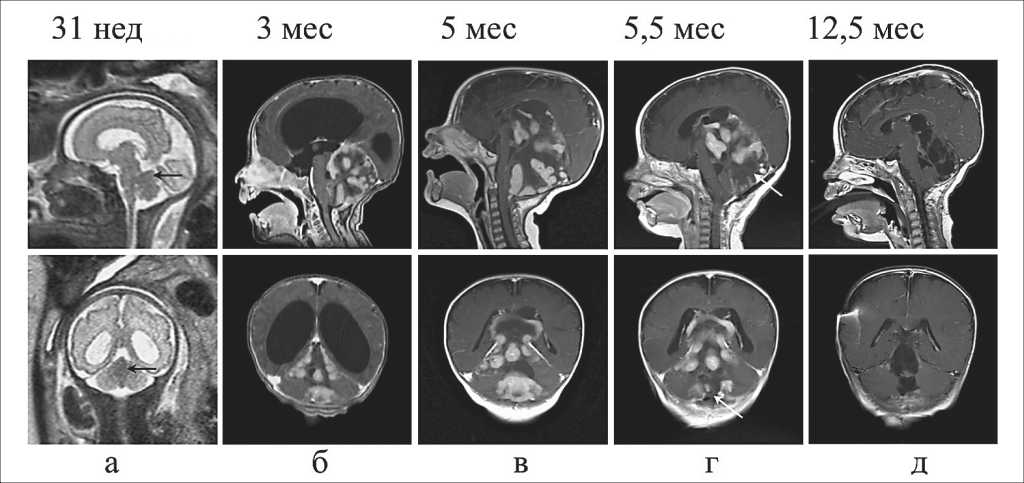
Рис. 1. Пре- и постнатальные МРТ головного мозга ребенка с врожденной медуллобластомой: а) Т2-ВИ головного мозга на 31 нед гестационного развития. Опухоль мозжечка имеет слабо гипоинтенсивный сигнал, обозначенный стрелкой; б) Т1-ВИ с контрастированием на 3 мес жизни ребенка. Гетерогенное контрастирование опухоли мозжечка с обструктивной гидроцефалией; в) Т1-ВИ с контрастированием на 5 мес жизни ребенка. Увеличение супратенториального распространения опухоли. Редукция гидроцефалии после вентрикулоперитонеального шунтирования; г) Т1-ВИ с контрастированием в 5,5 мес жизни ребенка после частичного удаления опухоли. Место резекции указано стрелкой; д) Т1-ВИ с контрастированием в 12,5 мес жизни ребенка после 3 циклов химиотерапии по схеме HIТ-ЅKK. Полная редукция контрастирования опухолевой ткани
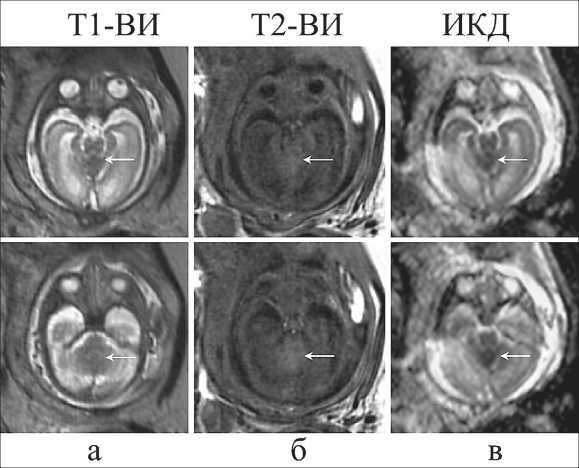
Рис. 2. Пренатальная МРТ. Врожденная медуллобластома у плода (31 нед гестационного развития) на Т2-ВИ (a), Т1-ВИ (б) и карте ИКД (в). Опухоль указана стрелкой. Серая шкала параметрических карт ИКД охватывает диапазон 0–3×10-3 мм2/с (в)
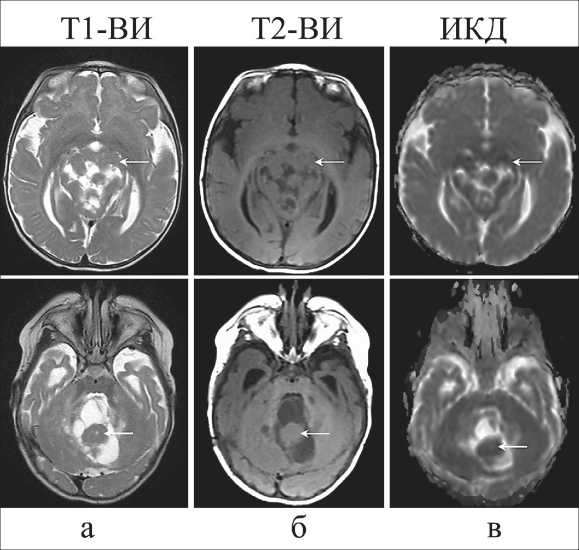
Рис. 3. Постнатальная МРТ головного мозга.
Врожденная медуллобластома у ребенка (5 мес) на Т2-ВИ (a), Т1-ВИ (б) и карте ИКД (в). Опухоль указана стрелкой. Серая шкала параметрических карт ИКД охватывает диапазон 0–3×10-3 мм2/с (в)
ИКД-карте (рис. 2) поражение заметно гипоинтенсивно и имеет размер порядка 15×16×13 мм. Значения ИКД в поражении, здоровой мозговой ткани и стволе мозга равны 0,63×10-3, 0,98×10-3 и 0,87×10-3 мм2/с соответственно. Постнатальная МРТ на 3-м мес жизни ребенка (рис. 1б) обнаружила окклюзионную гидроцефалию и экстенсивную опухоль задней черепной ямки (с солидными и кистозными компонентами, неравномерным контрастированием), которая привела к сдавлению ствола мозга и четвертого желудочка. Солидный компонент опухоли был изоинтенсивен окружающей мозговой ткани на T1- и изо-гиперинтенсивен на T2-ВИ. Лептоменингеального распространения не выявлено.
На следующем МРТ в 5 мес жизни ребенка (рис. 1в и 3) размер опухоли значительно увеличился с образованием грыжи через большое затылочное отверстие и смещением намета мозжечка и ствола мозга. Гидроцефалия сократилась из-за установки шунта. Визуализация опухоли на ИКД-карте изменилась из-за прогрессирующей миелинизации окружающего мозга, тогда как значения ИКД в солидном компоненте опухоли остались стабильны и близки к таковому показателю неизмененных отделов мозжечка (0,67×10-3 и 0,75×10-3 мм2/с соответственно).
МРТ после циторедуктивного вмешательства (рис. 1д) показала исчезновение каудальной части опухоли. Гистологический анализ образца опухоли выявил характерную узелковую структуру с разветвленной сетью ретикулиновых волокон (рис. 4). После завершения трех циклов химиотерапии в возрасте 12,5 мес на МРТ выявлена полная редукция ранее выявленных контрастированных опухолевых масс (рис. 1д).
Обсуждение
Врожденные опухоли головного мозга обнаруживаются у плода менее чем в 5 % случаев, и подавляющее большинство таких беременностей заканчиваются мертворождением или прерыванием беременности. Прогноз в случаях пренатально диагностированной опухоли головного мозга крайне неблагоприятный, с выживаемостью около 10 % в первый год жизни. Тем не менее описаны случаи и успешного лечения врожденных злокачественных опухолей головного мозга плода, включая тератомы и глиомы высокой степени дифференцировки [4]. Таким образом, ранняя диагностика и правильная классификация опухолей головного мозга плода имеют решающее значение для постнатального планирования лечения, определения сроков и тактики родов, а также принятия решения о прерывании беременности в случаях несовместимых с жизнью ребенка изменений или высокого материнского риска.
В представленной статье описан уникальный случай антенатально заподозренной медуллобластомы, которая постнатально наблюдалась нами на МРТ в динамике от периода резкой прогрессии и до успешного купирования после хирургического вмешательства и химиотерапии. К сожалению, в нашем случае лечение несколько затянулось (5,5 мес между родами и операцией) из-за нескольких факторов, включая неопределенность в пре- и ранней постнатальной диагностике, позднем обращении в специализированный диагностический центр (в 4,5 мес) и материально-технические вопросы, связанные с госпитализацией пациента в специализированные учреждения высокотехнологической помощи, расположенные в другом городе. Задержка на уровне первичной диагностической помощи может быть связана с редкостью данного вида патологии и отсутствием стандартных руководств по своевременной тактике диагностических мероприятий в неонатальном периоде. С другой стороны, операции по удалению опухоли чрезвычайно редко применяются у детей младше шести месяцев и представляют значительный риск периоперационной смертности [10]. Отмечается крайне низкая выживаемость у детей с врожденными новообразованиями IV степени злокачественности, по данным литературы [2, 4]. Тем не менее результат лечения в представленном случае можно считать очень успешным (ребенок жив спустя 13 мес после операции) с учетом изначально крупного размера и быстрого роста опухоли.
Успешный результат лечения связан, прежде всего, с высокой чувствительностью опухоли к химиотерапии. Десмопластический гистологический подтип данной медуллобластомы и молекулярная подгруппа SSH с отсутствием гиперэкспрессии семейства генов MYC, наблюдаемые в нашем случае, являются благоприятными прогностическими факторами. Точная диагностика опухолей головного мозга у плода может быть сложной задачей, потому что контраст поражения относительно окружающей мозговой ткани может существенно отличаться от наблюдаемого в мозге у детей и взрослых. В нашем случае интерпретация обычных T1- и T2-взвешенных изображений плода была неоднозначной, так как выявленная незначительная гипо- и гиперинтенсивность могла соответствовать и другим состояниям, например вызывать подозрение о кровоизлиянии. На ИКД-карте опухоль продемонстрировала ограниченную диффузию, типичную для медуллобластом [10]. Однако из-за присущих ДВИ ограничений и небольшого размера области поражения даже этот эффект не мог
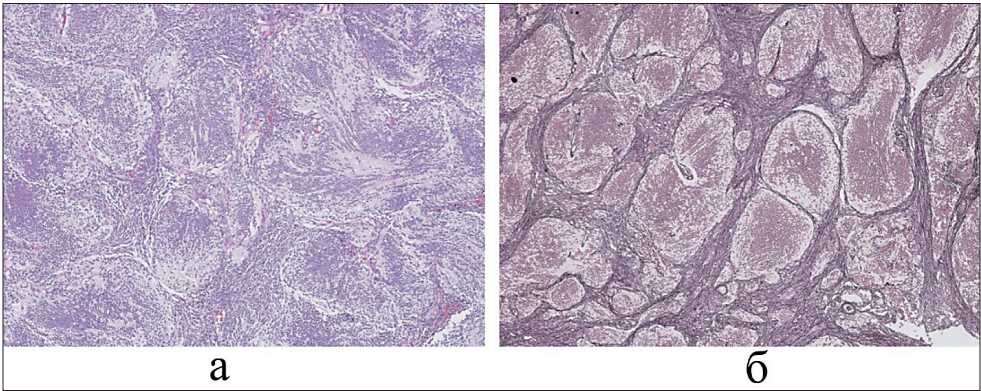
Рис. 4. Микрофото. Десмопластическая медуллобластома с повышенной нодулярностью. Множественные сливные разнокалиберные опухолевые узлы, окруженные большим количеством ретикулярной ткани/фиброзными волокнами с плотно-клеточной организацией: а) окраска гематоксилин и эозином, ×100, б) импрегнация серебром, ×100
быть однозначно интерпретирован и требовал ранней постнатальной верификации с помощью контрастной МРТ.
Гипоинтенсивность опухоли на ИКД-карте объясняется тем, что немиелинизированная окружающая ткань мозга создает относительно гиперинтенсивный фон [11]. Кроме того, ограничение диффузии в этой опухоли объясняется ее плотноклеточным тканевым строением. Высокое содержание в ее структуре коллагена, который является типичным компонентом десмопластической медуллобластомы, характеризуется чрезмерным формированием богатых коллагеном ретикулиновых волокон, заполняющих внеклеточное пространство [8] (рис. 4). В то же время низкий контраст опухоли на ИКД-картах у плода является транзиторным явлением, которое исчезает из-за ограничения процессов диффузии в окружающей ткани мозга в процессе постнатального созревания.
Заключение
МРТ в пренатальным периоде с использованием ДВИ является наиболее эффективным методом ранней диагностики врожденной медуллобасто- мы, которая при своевременных гистологической, генетической и молекулярной верификациях, последующей таргетной химиотерапии может быть доведена до состояния стойкой ремиссии. Представленный случай врожденной медуллобластомы мозжечка иллюстрирует развитие МР-контраст опухолевой ткани в ходе пре- до постнатального периодов развития мозга и демонстрирует дополнительную ценность ДВИ для пренатальной диагностики. Опухоль выявляется на ИКД-картах мозга плода, благодаря гистопатологическому происхождению, в частности высокой клеточной плотности. Учитывая высокую скорость и простоту протоколов сканирования ДВИ, мы предлагаем рассматривать этот метод в качестве диагностического приложения к стандартным протоколам в неясных диагностических случаях при проведении МРТ мозга плода и новорожденного. Это особенно важно, так как ранняя пренатальная диагностика, а соответственно, и своевременная постнатальная верификация врожденной медуллобластомы имеют критическое значение для планирования лечения и хорошего прогноза.
Список литературы Врожденная медуллобластома: пре- и постнатальное МРТ наблюдение
- Rickert C.H., Paulus W. Epidemiology of central nervous system tumors in childhood and adolescence based on the new WHO classification. Childs Nerv Syst. 2001; 17: 503-511. DOI: 10.1007/s003810100496
- Isaacs H.I. Jr. Perinatal brain tumors: a review of 250 cases. Pediatr Neurol 2002; 27: 249-261. DOI: 10.1016/s0887-8994(02)00472-1
- Nishio S., Morioka T., Fukui M. Medulloblastoma in the first year of life: A report of five cases. J Clin Neurosci 1998; 5: 265-269. 10.1016/ s0967-5868(98)90060-1. DOI: 10.1016/s0967-5868(98)90060-1
- Rickert C.H. Neuropathology and prognosis of foetal brain tumours. Acta Neuropathol. 1999 Dec; 98(6): 567-76. 10.1007/ s004010051120. DOI: 10.1007/s004010051120
- Mitchell D., Rojiani A.M., Richards D., Yachnis A.T., Powell S.Z. Congenital CNS primitive neuroectodermal tumor: Case report and review of the literature. Pediatr Pathol Lab Med 1995; 15: 949-56. DOI: 10.3109/15513819509027031


