Встречаемость мутаций в генах BRCA1 и BRCA2 у больных раком поджелудочной железы
Автор: Кашинцев А.А., Янус Г.А., Коханенко Н.Ю., Моисеенко В.М., Ханевич М.Д., Роман Л.Д., Иевлева А.Г., Соколенко А.П., Суспицин Е.Н., Будовский А.И., Того А.В., Волков Н.М., Фадеев Р.В., Диникин М.С., Иванова А.К., Шостко К.Г., Имянитов Е.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (59), 2013 года.
Бесплатный доступ
Мутации в генах BRCA1 и BRCA2 могут играть роль в формировании риска рака поджелудочной железы (РПЖ), однако критерии включения пациентов в BRCA-диагностику остаются неясными. Присутствие повторяющейся мутации BRCA1 5382insC анализировалось у 150 больных РПЖ, при этом выявлено 2 носителя упомянутого аллеля. Полный анализ кодирующей области гена BRCA2 выполнен у 8 пациентов, обнаружен 1 дефектный вариант (BRCA2 5197_5198delTC). Все 3 больных с мутацией имели собственный или семейный анамнез BRCA-ассоциированных онкологических заболеваний. Таким образом, BRCA-тестирование случаев РПЖ целесообразно ограничить только теми пациентами, у которых имеются клинические признаки наследственного характера заболевания
Рак поджелудочной железы, наследственный рак молочной железы и яичников
Короткий адрес: https://sciup.org/14056364
IDR: 14056364 | УДК: 616.37-006.6:575.113:575.24
Текст научной статьи Встречаемость мутаций в генах BRCA1 и BRCA2 у больных раком поджелудочной железы
OCCURRENCE OF BRCA1 AND BRCA2 MUTATION IN PANCREATIC CANCER PATIENTS
A.A. Kashintsev1, G.A. Yanus1,2, N.Yu. Kokhanenko1, V.M. Moiseenko3,4, M.D. Hanevich5, L.D. Roman6, A.G. Ievleva1,2, A.P. Sokolenko1,2, E.N.Suspitsin1,2, A.I. Budovskiy2, A.V. Togo1,2, N.M. Volkov2,4, R.V. Fadeev5, M.S. Dinikin5, A.K. Ivanova5, K.G. Shostko6, E.N. Imyanitov1,2,7
St.-Petersburg Pediatric Medical University1
N.N. Petrov Institute of Oncology, St.-Petersburg2
City Oncological Center, St.-Petersburg 3
S.M. Beresin Clinical Center, St.-Petersburg 4
City Oncological Hospital, St.-Petersburg5
Leningrad Regional Oncological Hospital, St.-Petersburg6
-
I.I. Mechnikov North-West Medical University, St.-Petersburg7
-
68, Leningradskaya Street, 197758-St. Petersburg, Pesochny, Russia, e-mail: evgeny@imyanitov.spb.ru2
Рак поджелудочной железы (РПЖ) занимает восьмое место по частоте в структуре онкологической заболеваемости и выходит на пятое место в структуре смертности от злокачественных новообразований в Российской Федерации [11]. Риск развития РПЖ в течение жизни приближается к 1 %, причем в северных регионах он, как правило, несколько выше по сравнению с тёплыми странами мира [43]. Факторы риска РПЖ носят скорее экзогенный характер: к ним относят курение, нерациональное питание, возможно, недостаток витамина D (объясняющий географические закономерности распределения частоты РПЖ), а также избыточный вес, сахарный диабет и хронический панкреатит [31, 43]. Тем не менее около 10 % случаев РПЖ могут быть связаны с генетической предрасположенностью [28, 52].
Наследственные факторы риска РПЖ гетеро-генны. Существуют широко распространенные низкопенетрантные аллели, ассоциированные с пограничным увеличением риска РПЖ. В качестве примера можно привести ассоциацию с группами крови системы AB0: в частности, у лиц с B(III) группой крови риск РПЖ повышается в 1,7 раза по сравнению с обладателями 0(I) группы крови [60]. Известны также исключительно редкие генетические синдромы, ассоциированные с резким увеличением риска РПЖ. Например, к ним относятся наследственные формы хронического панкреатита, на фоне которого у 30–55 % пациентов развивается РПЖ. Основная часть таких случаев ассоциирована с гетерозиготными мутациями гена PRSS1; реже наблюдаются мутации (обычно гомозиготные) генов SPINK1, CTRC и PRSS2. Хронический панкреатит у больных муковисцидозом также повышает риск РПЖ, но, в силу сниженной продолжительности жизни таких пациентов, РПЖ у них встречается редко [37]. Собственно наследственный панкреатит наблюдается с частотой менее 1:100000 [31, 45]. Риск РПЖ достаточно высок при синдромах Пейтца–Егерса (ген STK11/ LKB1) [33] и множественных диспластических невусов (ген p16/CDKN2A) [18]. В некоторых популяциях последний является одной из основных причин наследственного РПЖ [15]. Наконец, можно выделить частые раковые синдромы, для которых рак поджелудочной железы не относится к характерным локализациям, но тем не менее наблюдается с повышенной частотой – это семейный полипоз толстой кишки [19], синдром Линча [5, 27] и наследственный рак молочной железы (РМЖ) и яичников (РЯ) [6, 17, 22, 56, 58].
Наследственный РМЖ и РЯ ассоциированы в основном с мутациями в генах BRCA1 и BRCA2, меньшая часть случаев связана с мутациями в генах CHEK2, NBS1, PALB2, FANCJ, ATM, BRIP, PTEN, P53 и др. [22, 58]. Большинство этих генов отвечает за репарацию двухцепочечных разрывов и межнитевых сшивок ДНК посредством гомологичной рекомбинации. Мутации в некоторых из них способствуют развитию РПЖ, что впервые было установлено для BRCA2 [17, 56], а затем для BRCA1 [6], PALB2 [26], ATM [47], FANCC и FANCG [8, 21], а также RAD50 [59].
Кратность увеличения риска развития РПЖ при мутациях BRCA2 составляет от 2,1 до 6,6 [2, 3, 24, 38–40, 46, 54, 56]. Особняком стоят исландское [57] и шведское [25] исследования, а также анализ BRCA2-носителей из Польши [35], не показавшие повышенного риска РПЖ. Частота мутаций BRCA2 среди семейных случаев РПЖ варьирует от 2,8 до 17,2 % в европейских популяциях, США и Израиле [9, 10, 12, 16, 20, 41, 49]. В случайной выборке больных РПЖ встречаемость повреждений BRCA2 несколько меньше – 3 % в Канаде [30], 1,4 % – в Испании [44], 10–13 % среди евреев-ашкенази [13, 42]. Статистика в отношении евреев европейского происхождения должна рассматриваться отдельно, так как в этой этнической группе крайне высокая встречаемость мутации BRCA2 6174delT [56].
Сведения об относительном риске, связанном с дефектами BRCA1, неоднозначны, – по данным некоторых исследований, вероятность РПЖ у носителей мутаций этого гена увеличена примерно в 2–4 раза [6, 24, 38, 46, 55]. В то же время ряд работ не подтверждает взаимосвязи между BRCA1-гетерозиготностью и увеличением риска РПЖ [25, 32, 40]. Среди семейных случаев изолированного РПЖ мутации BRCA1, вероятно, встречаются редко; например, Axilbund et al. [4] не выявили повреждений этого гена в 66 родословных. Тем не менее если анализировать семьи, в которых помимо РПЖ наблюдались случаи РМЖ и РЯ, то на долю гена BRCA1 приходится более 10 % родословных [10, 16]. Исследования о вкладе BRCA1 в общую заболеваемость РПЖ немногочисленны; частота мутаций в случайных выборках больных колеблется в диапазоне 0–1 %, однако эти данные в существенной мере зависят от встречаемости BRCA1-гетерозиготности в популяции в целом [12, 30, 32]. В пользу причастности BRCA1 к формированию предрасположенности к РПЖ свидетельствуют как эпидемиологические, так и молекулярно-генетические исследования [1, 29, 36, 38, 53, 55].
Так как радикальное хирургическое вмешательство можно выполнить лишь в 10–20 % случаев РПЖ, при этом у 80 % прооперированных больных возникает рецидив заболевания, поиск эффективных путей терапии РПЖ является важной задачей [48]. К сожалению, для РПЖ характерна низкая чувствительность к цитостатикам, из-за чего результаты лечения остаются неудовлетворительными. Злокачественные опухоли, возникшие в результате наследственных повреждений, зачастую отличаются от спорадических «фенокопий» особенностями биологического поведения и спектром чувствительности к химиотерапии. Ярким примером являются BRCA-ассоциированные новообразования: опухоль обычно развивается за счет дефекта системы репарации двухцепочечных разрывов и межнитевых сшивок ДНК, поэтому терапия агентами, вызывающими подобные повреждения генома (препараты платины, митомицин С), может оказаться исключительно успешной. Положительный эффект такого лечения был показан в основном для наследственного РМЖ и РЯ [23]. Данные о применении BRCA-специфической терапии РПЖ пока ограничиваются отдельными случаями или небольшими сериями пациентов [7, 14, 34]. Тем не менее поиск BRCA-ассоциированных разновидностей РПЖ приобретает практическое значение, ввиду потенциальной химиочувствительности этой редкой категории больных. В данном исследовании мы предприняли попытку проанализировать частоту носительства мутаций генов BRCA1 и BRCA2 у больных раком поджелудочной железы, проживающих в Санкт-Петербурге и Ленинградской области.
Материал и методы
В исследование вошли больные раком поджелудочной железы (таблица), проходившие лечение в стационарах г. Санкт-Петербурга (СПб ГУЗ «Городская Мариинская больница», НИИ онкологии им. Н.Н. Петрова, НИИ скорой помощи им. Ю.Ю. Джанелидзе, СПб ГУЗ «Городская Покровская больница», СПб ГУЗ «Городской клинический онкологический диспансер», «Ленинградский областной онкологический диспансер» и ЛДЦ МИБС им. С.М. Березина). Периферическая кровь для анализа ДНК была доступна от 150 пациентов; из них 116 больных были отобраны случайным образом (2009–2011 гг.), а последующие 34 человек были привлечены к исследованию в связи с наличием РМЖ или РЯ у самих пациенток либо у кровных родственников больных (2011–2012 гг.).
В нашей стране подавляющее большинство мутаций в гене BRCA1 представлено единственным вариантом – аллелем 5382insC [50, 51], что значительно упрощает процедуру массового BRCA1-тестирования. Напротив, мутации гена BRCA2 встречаются в России относительно редко, при этом их спектр не ограничивается повторяющимися повреждениями [51]. Упомянутые обстоятельства повлияли на подход к молекулярно-генетическому анализу пациентов с РПЖ. У всех обследуемых определялось наличие мутации BRCA1 5382insC. Помимо этого, у 22 больных, в отношении которых ставился вопрос о назначении химиотерапии, анализировалось наличие «еврейской» повторяющейся мутации BRCA2 6174delT, а в 8 случаях было выполнено секвенирование полной кодирующей последовательности гена BRCA2. Для контроля популяционной встречаемости аллеля BRCA1 5382insC использовались образцы ДНК, полученные от 1007 здоровых лиц среднего возраста.
Выделение ДНК из лейкоцитов периферической крови проводилось с помощью модифицированного соль-хлороформного метода [51]. Анализ повторяющихся мутаций BRCA1 5382insC и BRCA2 6174delT осуществлялся посредством аллель-специфической ПЦР (рис. 1). Для постановки ПЦР использовались ПЦР-амплификаторы iCycler iQ Real-Time PCR Detection System и CFX-96 (Bio-Rad Laboratories, USA). Последовательности использовавшихся праймеров и методики детекции мутаций представлены в работе [51]. Исследование полной нуклеотидной последовательности BRCA2 проводили при помощи HRM-анализа (high-resolution melting analysis) с последующим секвенированием аномально плавящихся фрагментов. Последовательности праймеров и условия реакции предоставлены сотрудниками Медицинского центра г. Лейдена (Leiden University Medical Center, Dr. Ninke van der Stoep, персональное сообщение). Секвенирование осуществлялось на аппарате SEQ-8000 (Beckman-Coulter, США).
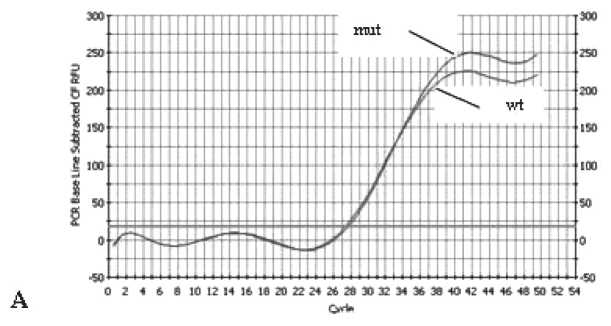
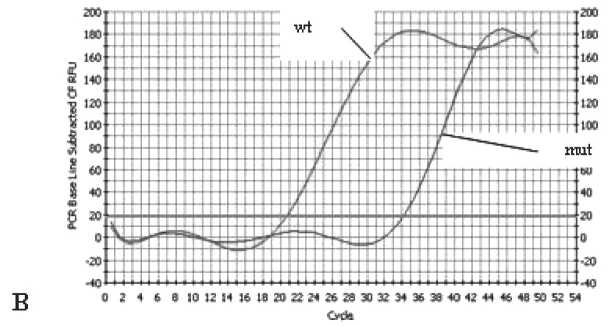
Рис. 1. Детекция мутации BRCA1 5382insC методом аллель-специфической ПЦР. Примечание: А – наличие мутации; В – отсутствие мутации
Результаты и обсуждение
Анализ историй болезни и семейного анамнеза установил наличие в исследованной группе 6 (4 %) пациентов с первично-множественным раком и 56 – с семейным онкологическим анам- незом. При этом 12 (8 %) больных сообщали о случаях РПЖ у родственников, а 15 (10 %) имели семейный анамнез РМЖ и/или РЯ. Нами были выявлены 2/150 (1,3 %) носителя мутации BRCA1 5382insC. Оба BRCA1-гетерозиготных пациента
Клинико-патологические характеристики больных рПж
Таблица
|
Характеристики |
Количество пациентов |
|
Пол |
|
|
Мужчины |
55 (36,7 %) |
|
Женщины |
95 (63,3 %) |
|
Возраст |
|
|
≥65 лет |
92 (61,3 %) |
|
< 65 лет |
58 (38,7 %) |
|
ECOG |
|
|
0 |
6 (4 %) |
|
1 |
27 (18 %) |
|
2 |
83 (55,3 %) |
|
3 |
31 (20,7 %) |
|
4 |
3 (2,0 %) |
|
Стадия заболевания |
|
|
IB |
4 (2,7 %) |
|
IIA |
11 (7,3 %) |
|
IIB |
25 (16,7 %) |
|
III |
47 (31,3 %) |
|
IV |
63 (42,0 %) |
|
Степень дифференцировки опухоли |
|
|
Высокая |
15 (16,3 %) |
|
Умеренная |
56 (60,9 %) |
|
Низкая |
21 (22,8 %) |
|
Радикальная операция |
|
|
Да |
33 (22,0 %) |
|
Нет |
117 (78,0 %) |
Таким образом, некоторые пациенты с РПЖ действительно являются носителями BRCA-мутаций. Примечательно, что обнаруженная нами частота аллеля BRCA1 5382insC превышает таковую в здоровой популяции (1/1007, 0,09 %), что подтверждает роль дефектов BRCA1 в формировании предрасположенности к РПЖ. Тем не менее скрининг повреждений генов BRCA1 и BRCA2 у больных РПЖ целесообразно ограничить теми пациентами, у которых имеется собственный или семейный анамнез BRCA-ассоциированных опухолей.
Данная работа выполнена при поддержке грантов Министерства образования и науки РФ (14.512.11.0041) и РФФИ (12-04-00535 и 12-0400928).


