Выбор методов лечения аутоиммунной гемолитической анемии
Автор: Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Передовая статья
Статья в выпуске: 3 т.21, 2025 года.
Бесплатный доступ
Аутоиммунная гемолитическая анемия (АИГА) определяется повышенным разрушением эритроцитов, опосредованным аутоиммунными механизмами. В то время как кортикостероиды остаются первой линией терапии в большинстве случаев АИГА с тепловыми антителами, холодовая агглютининовая болезнь лечится путем воздействия на лежащую в основе клональную пролиферацию В-клеток или классический путь активации комплемента. Несколько новых установленных или исследуемых препаратов и схем лечения появились в течение последних 1-2 десятилетий, что привело к улучшению вариантов терапии, но также выявило проблемы в отношении того, как выбрать лучшее лечение для отдельных пациентов. При тяжелой АИГА с тепловыми антителами есть данные о начальном добавлении ритуксимаба к преднизолону в первой линии. Новые агенты, нацеленные на В-клетки, внесосудистый гемолиз или удаление IgG, дают дополнительные возможности при острых и рецидивирующих/ рефрактерных формах заболеваний. При холодовой агглютининовой болезни разработка ингибиторов комплемента и агентов, направленных на В-клетки, позволяет индивидуализировать терапию на основе профиля заболевания и характеристик пациента. Для большинства пациентов с АИГА оптимальное лечение еще предстоит найти, и все еще существует потребность в более доказательной терапии.
Клинические исследования, ингибиторы комплемента, болезнь холодовой агглютинации, кортикостероиды, иммуносупрессия, ритуксимаб, терапия, аутоиммунная гемолитическая анемия
Короткий адрес: https://sciup.org/170210826
IDR: 170210826
Текст научной статьи Выбор методов лечения аутоиммунной гемолитической анемии
Таблица 1
Аутоиммунные гемолитические анемии
|
Аутоиммунная гемолитическая анемия с тепловыми антителами (wAIHA) |
Аутоиммунная гемолитическая анемия с холодовыми антителами (cAIHA) |
Атипичная аутоиммунная гемолитическая анемия |
|
Первичная wAIHA |
Холодовая агглютининовая болезнь (CAD) |
Смешанная c тепловыми и холодовыми антителами |
|
Вторичная wAIHA |
Синдром вторичный холодовой агглютинации (CAS) |
DAT-отрицательная АИГА |
|
Лекарственно-индуцированная АИГА |
Пароксизмальная холодовая гемоглобинурия (ПХГ) |
Выбор оптимальной терапии различается в зависимости от нозологической формы; поэтому для выбора соответствующего лечения требуется точная диагностика подтипа анемии [3].
Первый известный случай АИГА был описан в 13 веке византийским придворным врачом Johannis Actuarius, который наблюдал черную мочу у пациента после воздействия низких температур [9]. Вероятно, этот пациент страдал пароксизмальной холодовой гемоглобинурией (ПХГ). В 1903 году Karl Landsteiner открыл холодовые агглютинины [10] и только в 1938 году Dameshek и Schwartz провели различие между врожденной и приобретенной гемолитической анемией, а два года спустя они постулировали иммунный механизм, основанный на обнаружении гемолизина в сыворотках пациентов [11]. До начала нового тысячелетия лечение основывалось в основном на теоретических соображениях, клиническом опыте и мнении экспертов, но за последние два десятилетия ситуация изменилась. Было проведено несколько проспективных исследований по оценке эффективности различных лекарственных препаратов [1, 12, 13]. В настоящее время существуют достаточно эффективные методы лечения и, кроме того, проводится довольно много клинических исследований, способствующих выработке оптимальных лечебных подходов [14, 15]. Следует отметить, что со временем изменились не только варианты лечения, но и клинический ландшафт АИГА [16]. Сложность группы заболеваний и растущее число новых вариантов лечения подчеркивают необходимость тщательной диагностики, чтобы обеспечить основу для выбора “правильной терапии для каждого пациента” [17, 18].
Цель работы. Расширенный обзор текущих клинических, прогностических и терапевтических аспектов, обсуждение оптимального выбора терапии с учетом выявленного типа АИГА, особенностей заболевания и характеристик пациента, с особым акцентом на новые методы лечения.
Материалы и методы. Для достижения поставленной цели нами проанализированы основные научные публикации, посвященные аутоиммунной гемолитической анемии. Для изучения отобраны
100 работ, опубликованных в преобладающем большинстве в течение последние 10 лет. Включение более ранних работ допускалось в связи с высокоинформативными материалами либо, если это были первоисточники
Результаты
Существующая ситуация с АИГА и устоявшиеся методы лечения
АИГА с тепловыми гемолизинами/антителами
Примерно 70% случаев АИГА являются опосредованными тепловыми антителами (wAIHA). При wAIHA аутоантитела являются поликлональными, которые, главным образом, направлены на эритроцитарные антигены резус-системы, и имеют оптимальную температуру для связывания антигена 37°C. В основном тепловые антитела относятся к классу иммуноглобулинов G (IgG), но иногда могут быть задействованы IgA или IgM, реагирующие на тепло, отдельно или в комбинации с IgG [1, 8, 19]. Из подклассов IgG преобладающим является вовлечение IgG1, отдельно, либо в комбинации с другими подклассами [20]. Антитела IgG1 обладают свойствами, активирующими комплемент, а также высоким сродством к неонатальному Fc-рецептору (FcRn), который влияет на период полувыведения IgG [21, 22]. Оба эти свойства, как считается, способствуют тяжести и персистенции гемолиза.
Фагоцитоз иммуноглобулин-опсонизированных эритроцитов макрофагами мононуклеарной фагоцитарной системы, в значительной степени в селезенке, является важным механизмом внесосудисто-го гемолиза [23]. Опосредованное комплементом разрушение эритроцитов происходит примерно у 50% пациентов. Полиспецифический (“простой”) прямой антиглобулиновый тест (DAT) используется для подтверждения аутоиммунного патогенеза путем обнаружения связанного с антигеном иммуноглобулина и/или комплемента на поверхности эритроцитов [2, 24]. Конкретный класс(ы) иммуноглобулинов и наличие комплемента на эритроцитах могут быть идентифицированы с помощью моно-специфического (“расширенного”) DAT, в котором в качестве реагентов используются диагностические антитела, специфичные к IgG, IgM, IgA, фрагменту белка комплемента 3c (C3c) и C3d [1, 2, 24].
Аутоиммунная гемолитическая анемия, опосредованная тепловыми антителами (wAIHA), встречается как первичное заболевание чуть менее чем в 50% случаев, так и вторичная по отношению к другим заболеваниям [2, 8, 25-27]. Основные или ассоциированные заболевания во вторичных случаях перечислены в таблице 2.
Таблица 2
Основные или ассоциированные состояния при вторичной АИГА с тепловыми антителами
|
Лимфопролиферативные расстройства |
B-клеточная лимфома (хронический лимфоцитарный лейкоз, B-клеточные неходжкинские лимфомы) T-клеточная лимфома (T-LGL-лейкоз, ангиоиммунобластная T-клеточная лимфома) Лимфома Ходжкина Болезнь Кастлемана |
|
Другие гематологические расстройства |
Миелоидные новообразования (миелодиспластический синдром, первичный миелофиброз) Ассоциированная иммунная цитопения, обычно ИТП, синдром Фишера-Эванса |
|
Солидные опухоли |
Дермоидная киста или карцинома яичника Тимома |
|
Негематологические аутоиммунные и воспалительные заболевания |
Ревматологические заболевания (СКВ, ревматоидный артрит, синдром Шегрена) Антифосфолипидный синдром Аутоиммунный гепатит Язвенный колит Саркоидоз Эозинофильный фасциит |
|
Первичный иммунодефицит |
Общий вариабельный иммунодефицит Аутоиммунный лимфопролиферативный синдром |
|
Инфекции |
Вирусы (ВЭБ, гепатит, ЦМВ, ВИЧ, SARS-CoV-2) Бактерии (туберкулез, бруцеллез) Простейшие (бабезиоз) |
|
Трансплантация |
Аллогенная трансплантация костного мозга Органная трансплантация (печень, тонкая кишка) |
Примечание. ЦМВ – цитомегаловирус; ВЭБ – вирус Эпштейна-Барр; ВИЧ – вирус иммунодефицита человека; ИТП – иммунная тромбоцитопеническая пурпура; T-LGL-лейкоз – Т-клеточный крупнозернистый лимфоцитарный лейкоз; SARS-CoV – тяжелый острый респираторный синдром, обусловленный коронавирусом; СКВ – системная красная волчанка.
Как показано в таблице 2, это могут быть различные онкогематологические (в первую очередь лимфопролиферативные) заболевания и солидные опухоли, а также аутоиммунные и воспалительные заболевания, инфекции, трансплантация костного мозга и органная трансплантация. Иногда присутствует более одного ассоциированного заболевания. Среди других гематологических расстройств интересным является синдром Фишера-Эванса, который первоначально определялся как АИГА с тромбоцитопенией [28]; в настоящее время обычно представляется как одновременная или последовательная комбинация по крайней мере двух аутоиммунных цитопений, чаще всего АИГА с иммунной тромбоцитопенией [2, 29, 30]. Вызванное инфекцией обострение ранее существовавшей первичной wAIHA не рассматривается как вторичное. Прямая проба Кумбса – основной метод диагностики – положительна более чем в 98% случаев. Как правило, обнаруживают IgG в сочетании с С3 фракцией ком- племента или без него. При отрицательной прямой пробе Кумбса антитела к эритроцитам можно обнаружить при помощи агрегат-гемагглютационно-го теста (метод выявления антиэритроцитарных антител). Однако антитела могут не выявляться, особенно после гемолитического криза, о чем следует помнить.
В первой линии терапии wAIHA остается преднизолон (или преднизон), который назначается в высоких начальных дозах (фиксированная доза 100 мг или 1-1,5 мг/кг массы тела ежедневно), затем через 2-3 недели, после нормализации содержания гемоглобина, медленно снижается и прием прекращается примерно через 4-6 месяцев. Частота общего ответа составляет примерно 80% [1, 2, 31, 32]. Другие пероральные кортикостероиды не показали более высокой эффективности [33].
Пациентам, которые не реагируют на терапию первой линии, следует назначить повторное диагностическое обследование для выявления любого упущенного из виду основного или сопутствующего заболевания, которое может быть предметом специфической терапии (аутоиммунные состояния, лимфопролиферативные нарушения, другие новообразования или неиммунные гемолитические анемии) [1, 2, 8, 34]. В дополнение к тщательной клинической оценке и истории приема лекарств необходимы обширные анализы на выявление аутоантител, электрофорез сывороточных белков, исследование костного мозга, исключение пароксизмальной ночной гемоглобинурии и врожденных гемолитических анемий [2, 35].
В качестве второй линии при первичной wAIHA в настоящее время рекомендуется ритуксимаб в обычной дозе (375 мг/м2 в виде длительной внутривенной инфузии с интервалом в 1 неделю в течение 4 недель) или низкой дозе (фиксированная доза 100 мг по той же схеме) [1, 2, 36]. Эффективность терапии увеличивается в 1,5-2 раза при сочетании ритуксимаба с глюкокортикоидами.
Терапия третьей линии включает неспецифические иммуносупрессанты, такие как азатиоприн, циклоспорин, микофенолата мофетил и другие [1, 37). Спленэктомия, которая ранее часто рекомендовалась во второй линии, теперь рассматривается как вариант лечения в третьей или последующих линиях терапии [1, 2, 13, 38].
За некоторыми исключениями, рекомендуемое лечение первой линии при вторичной wAIHA, как правило, такое же, как и при первичной wAIHA [1, 3, 32]. Эффективность моноклональных антител особенно высока у больных, патогенез аутоиммунного процесса которых обусловлен проявлением В-клеточного лимфопролиферативного заболевания. Лечение основного или ассоциированного заболевания показано, если это заболевание требует лечения само по себе или если терапия первой линии АИГА оказалась безуспешной.
Аутоиммунная гемолитическая анемия с холодовыми агглютининами/антителами
Аутоиммунные гемолитические анемии, опосредованные холодовыми агглютининами, можно разделить на холодовую агглютининовую болезнь (CAD), которая является четко выраженной клинико-патологической формой и клональным лимфопролиферативным заболеванием, и вторичный холодовой агглютининовый синдром (CAS), при котором аналогичная картина холодовой гемолитической анемии возникает вторично по отношению к другому отчетливому клиническому заболеванию.
Холодовая агглютининовая болезнь
Холодовая агглютининовая болезнь (CAD) составляет 20-30% всех случаев АИГА [7]. Аутоантитела, ответственные за гемолиз при CAD, называются холодовыми агглютининами, что относится к их способности агглютинировать эритроциты при температурах ниже 37°C (антиген+антитело);
такие температуры обычно обнаруживаются в акральных частях тела [39]. Патогенез CAD существенно отличается от патогенеза поликлональных аутоиммунных заболеваний, таких как АИГА с тепловыми антителами. Большинство холодовых агглютининов при CAD представляют собой моноклональные IgMk. Только примерно в 7% случаев выявляется легкая цепь λ. Холодовые агглютинины класса IgG встречаются менее чем в 5%, а моноклональный IgA еще реже и может быть не идентичен холодовым агглютининам, а скорее быть наблюдателем. Следовательно, холодовые агглютинины при CAD являются моноклональными, обычно класса IgM с рестрикцией легкой цепи κ, которые взаимодействуют с антигенами системы I/i на поверхности эритроцита [2, 40]. Холодовая агглютининовая болезнь представляет собой четко выраженную клинико-патологическую форму и клональное низкодифференцированное лимфопролиферативное заболевание, которое можно обнаружить в крови или костном мозге у пациентов без клинических или рентгенологических признаков злокачественных заболеваний [4]. Это отдельное клинико-патологическое образование следует называть заболеванием, а не синдромом [41]. Таким образом, в патогенезе холодовой агглю-тининовой болезни определяющая роль отводится моноклональной пролиферации В-лимфоцитов.
Связывание холодового агглютинина с его антигеном на клеточной поверхности приводит к агглютинации эритроцитов, приводящей к опосредованному комплементом гемолизу и, часто, симптомам нарушения периферической микроциркуляции, таким как акроцианоз (пальцы, кончик носа, уши) и проявлениям, характерным для синдрома Рейно [3, 40]. Но симптомы агглютинации и нарушения циркуляторного кровообращения не опосредованы комплементом. Комплемент активируется по классическому пути, запускаемому фиксацией комплекса C1qrs к связанному с антигеном IgM. Активированный C1s расщепляет C4 и C2, что приводит к образованию C3-конвертазы, покрытию эритроцитов C3b и фагоцитозу опсонизированных эритроцитов макрофагами (внесосудистый гемолиз), главным образом в печени [42, 43]. У пациентов с тяжелым течением заболевания или при обострениях продукты расщепления также могут объединяться с образованием C5-конвертазы на поверхности клеток, что приводит к образованию комплекса C5b-9 и внутрисосудистому гемолизу. Как при CAD, так и при CAS гемолиз опосредован классическим путем комплемента и, следовательно, может приводить к образованию анафилотоксинов, таких как продукты расщепления комплемента 3a (C3a) и, в некоторой степени, C5a, которые обладают провоспалительны-ми свойствами и, как полагают, вызывают появление у многих пациентов с CAD таких симптомов, как слабость, утомление [15, 44]. Кроме того, пациенты
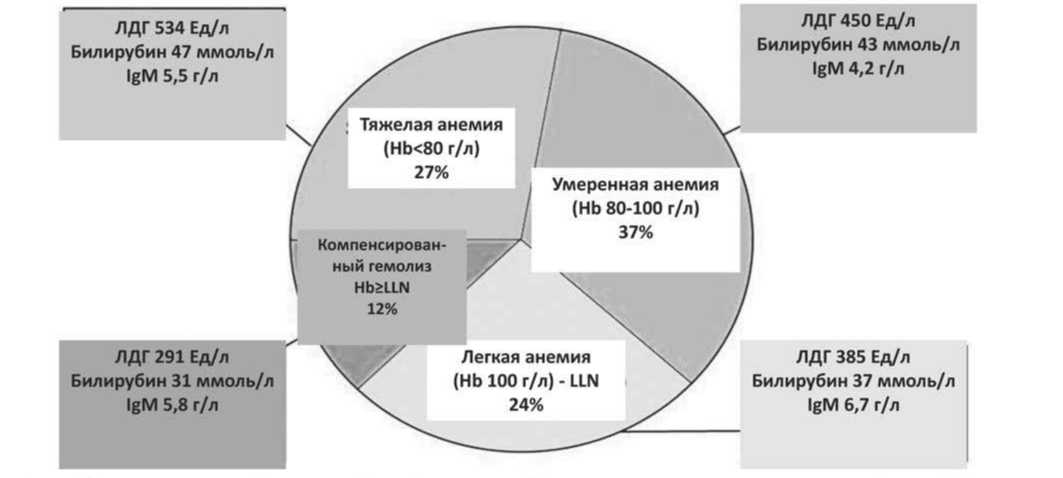
Рисунок 1. Тяжесть анемии при холодовой агглютининовой болезни (процент пациентов). Тяжесть анемии хорошо коррелирует с маркерами гемолиза (уровнями ЛДГ и билирубина), но не с уровнями IgM, которые могут быть связаны с комплемент-независимой агглютинирующей активностью эритроцитов, а также с гемолизом, опосредованным комплементом.
Примечание. Hb – уровень гемоглобина; LDH – лактатдегидрогеназа; LLN – нижняя граница нормы (Hb 11,5 г/дл у женщин и 12,5 г/дл у мужчин). Основано на данных Berentsen et al. [45]
имеют повышенный риск тромбозов.
Обострение гемолитической анемии может наблюдаться также после развития острой инфекции, серьезной травмы или обширной операции. Это явление лучше всего объясняется низкими уровнями компонентов классического пути, в частности С4, вызванными постоянным потреблением у пациентов с CAD. Вероятно, активация C4 ограничивает скорость опосредованного комплементом гемолиза. Когда возникает реакция острой фазы, вырабатывается повышенное количество белков комплемента, и наступает обострение. Прямая активация комплемента, например, микробными агентами, в некоторых ситуациях, также может способствовать обострению.
Диагностика CAD основывается на положительных результатах прямого антиглобулинового теста (пробы Кумбса) с моноспецифическими антителами к C3d и выявлении холодовых агглютининов в титре от 64 и выше при 40 С. В костном мозге и периферической крови больных выявляется популяция В-лимфоцитов без каких-либо клинических или радиологических признаков злокачественного процесса.
Тяжесть анемии при CAD хорошо охарактеризована в ретроспективном исследовании S. Berentsen et al. [45], согласно которому медиана уровня гемоглобина (Hb) у таких пациентов составила 9,2 г/дл (диапазон 4,5-15,3 г/дл). Гемолитическая анемия легкой степени (или иногда даже компенсированной) зарегистрирована у 36% пациентов (Hb> 10,0 г/дл), умеренной (Hb 8,0–10,0 г/дл) – у 37% и тяжелой (Hb <8,0 г/дл) – у 27%. Тяжесть анемии коррелировала с маркерами гемолиза, но не с уровнем IgM, что также может быть связано с комплемент-независимой агглютинирующей активностью эритроцитов (Рисунок 1).
По результатам многонационального обсервационного исследования, у 146 пациентов (69,5% из 210 пациентов, у которых имелись соответствующие данные) была выявлена гемолитическая анемия без симптомов нарушения периферического кровообращения или с нарушением легкой степени, у 44 (21%) – гемолитическая анемия с симптомами нарушения кровообращения, мешающими повседневной жизни, в то время как у 20 (9,5%) были симптомы нарушения кровообращения с компенсированным гемолизом [40]. Пациенты с отсутствием или слабыми симптомами не получили пользы от лечения. Однако симптоматическая анемия, характеризующаяся выраженной усталостью или беспокоящими симптомами нарушения периферического кровообращения, является показанием к лечению [3, 17, 46]. CAD не следует лечить кортикостероидами, неспецифическим иммуносу-прессантами или спленэктомией [1, 3, 17, 40). Спленэктомия неэффективна ввиду преимущественного разрушения эритроцитов в печени. Между тем, методы лечения, направленные на патогенный В-клеточный клон или классический путь комплемента, показали эффективность [40, 44, 46].
Ритуксимаб в дозе 375 мг/м2 в неделю в течение 4 недель является наиболее широко используемой терапией первой линии, хотя частота ответа скромна, а его продолжительность относительно невелика [45, 46]. Добавление бендамустина значительно улучшает частоту и продолжительность ответа, но связано с некоторой токсичностью
Синдром вторичной холодовой агглютинации (CAS)
При вторичном синдроме холодовой агглютинации (CAS) холодовая агглютинин-опосредован-ная АИГА вызывается или ассоциирована с другим клиническим заболеванием, таким как инфекция Mycoplasma pneumoniae, Listeria monocytogenes, Legionella pneumophila, Chlamydia psittaci, вирусом Эпштейна-Барр, цитомегаловирусом, SARS-CoV-2 или другими вирусами, или злокачественным заболеванием, чаще всего В-клеточной лимфомой [47-49]. Вторичный синдром, развившийся в ответ на инфекцию, характеризуется выявлением олигоклональных антител класса IgM (реже IgA или IgG), направленными против полисахаридных антигенов (анти-I или -i, анти-Rh) на поверхности эритроцитов. При CAS, ассоциированным с инфекцией, причинно-следственная связь между инфекцией и гемолитической анемией, опосредованной комплементом, иная, чем при CAD. При пневмонии Mycoplasma pneumoniae, холодовые агглютинины класса IgM продуцируются поликлональными лим-фоплазмоцитоидными клетками, вероятно, как часть физиологического иммунного ответа. Большинство из этих холодовых агглютининов не вызывают гемолиз, но иногда из-за высоких титров анти-I специфических антител может развиться глубокая гемолитическая анемия. Клинически значимый гемолиз наблюдается у 50–75% пациентов с микоплазменной инфекцией и примерно у 30% пациентов с другими инфекциями. Гемолитическая анемия обычно возникает довольно внезапно на второй неделе микоплазменной инфекции и проходит самостоятельно, обычно в течение 4-6 недель. При гемолитической анемии, вторичной по отношению к агрессивной В-клеточной лимфоме, фенотипом легкой цепи может быть как λ, так и κ [2, 47, 48].
Стандартной терапии CAS, основанной на результатах клинических исследований, не существует. В первую очередь следует обратить внимание на лечения основного заболевания [18, 22, 34].
Пароксизмальная холодовая гемоглобинурия
Пароксизмальная холодовая гемоглобинурия (ПХГ) представляет собой АИГА, опосредуемую поликлональными двухфазными антителами (антитела Доната-Ландштейнера), обычно IgG [50, 51]. Гемолиз происходит в основном во внутрисосуди- стом русле. Термин "двухфазный" подразумевает, что реакция антиген-антитело и фиксация ранних компонентов комплемента происходят при температурах ниже 37°C, тогда как дальнейшая активация комплемента происходит после повторного согревания до температуры тела [2, 51, 52]. Таким образом, гемолиз на холоде не происходит, для развития гемолитической реакции необходимо согревание. Сегодня большинство случаев этого редкого заболевания протекает как острая транзиторная гемолитическая анемия после вирусной или другой инфекции у детей [51, 53]. Хроническая пароксизмальная (у взрослых) форма гемоглобинурии чрезвычайно редкая форма гемолитической анемии и может возникать при третичном сифилисе, гематологических злокачественных новообразованиях или без какой-либо идентифицируемой причины.
Атипичная АИГА
Смешанная (mix) АИГА, при которой выявляются и тепловые и холодовые гемолизины/антитела, подтверждается прямым антиглобулиновым тестом, положительным как для IgG, так и для C3d, высоким титром холодовых агглютининов и сопутствующим присутствием тепловых антител IgG в сыворотке [17, 54]. Многие пациенты страдают тяжелой анемией и проходят несколько линий терапии, прежде чем получают ответ.
DAT-отрицательная АИГА. У 3-10% пациентов с АИГА прямой антиглобулиновый тест с поли-специфическими антителами отрицательный, в основном из-за опсонизации тепловых аутоантител ниже уровня обнаружения. Диагностика DAT-негативной АИГА остается сложной и требует исключения неиммунных причин гемолиза [1, 8, 33]. Более чувствительные методы определения иммуноглобулина на поверхности эритроцитов могут быть полезными, но обладают меньшей специфичностью. Моноспецифический DAT на IgA также обязателен, несмотря на отрицательный полиспеци-фический тест [3, 37].
Как выбрать терапию при аутоиммунной гемолитической анемии, опосредованной тепловыми антителами (wAIHA)
Когда добавлять ритуксимаб в первую линию?
Как указывалось выше, большинству пациентов с wAIHA в качестве первой линии терапии рекомендуется прием преднизолона (монотерапия). Однако низкий уровень длительной ремиссии после уменьшения дозы и отмены препарата (30-40% через 1 год) вызывает озабоченность, особенно у пациентов с тяжелым заболеванием [55, 56]. В клинической практике пациенты сталкиваются с риском длительного приема неоправданно высоких доз стероидов в течение многих лет [13]. В двух проспективных рандомизированных исследованиях оценивалась предварительная добавка ритукси-маба (либо 4 инфузии по 375 мг/м2 с интервалом в одну неделю, либо 2 инфузии фиксированной дозы 1000 мг с интервалом в две недели) [56, 57]. Результаты были почти идентичны, демонстрируя вдвое большую частоту долгосрочных реакций у пациентов, которым предварительно была назначена комбинация, по сравнению с теми, кто получал только преднизолон. Международная консенсусная группа экспертов рекомендовала рассмотреть возможность назначения пациентам с тяжелой анемией (определяемой как уровень гемоглобина < 8 г/дл) комбинированной терапии ритуксимабом с преднизолоном в первой линии терапии [1].
Когда следует применять средства, стимулирующие эритропоэз?
Использование средств, стимулирующих эритропоэз (ESA; эритропоэтин [ЭПО] или его аналоги) при АИГА, изучалось в двух ретроспективных сериях исследований [58, 59]. В самом крупном и последнем из них 51 пациент с АИГА с тепловыми или холодовыми антителами и сниженным уровнем ЭПО или неадекватным ответом на ЭПО, получал ESA, начиная в среднем через 24 месяца после постановки диагноза [59]. Пятьдесят пять процентов пациентов ответили в течение 15 дней и более 70% – в течение 3 месяцев; большинство ответов сохранялись при продолжении терапии, а медиана повышения уровня Hb составила 2,1 г/ дл. Попытка лечения ESA будет целесообразна у пациентов с неадекватным ретикулоцитозом и/или неадекватным уровнем эндогенного ЭПО в начале заболевания, а также после безуспешного лечения кортикостероидами, ритуксимабом и иммунодепрессантами. Для пациентов, которым необходима поддерживающая терапия кортикостероидами, ESA может быть эффективным стероидосберегающим препаратом.
Когда следует использовать внутривенный иммуноглобулин при wAIHA?
Предполагается, что введение внутривенного иммуноглобулина в общей дозе 2 г/кг массы тела (0,4 г/кг в день в течение 5 дней или 1 г/ кг в течение 2 дней) ингибирует гемолиз за счет насыщения ретикулоэндотелиальной системы и Fc-рецепторов (FcR) [60]. Насыщение FcRn также способствует выведению аутоантител [61]. Внутривенное введение может быть рассмотрено при гемолитическом кризе и быть особенно полезным пациентам с сепсисом и пациентам с основным аутоиммунным заболеванием или первичным иммунодефицитом.
Когда рекомендовать спленэктомию?
Спленэктомия – далеко не новое лечение wAIHA, но ее место в терапевтическом арсенале изменилось. Частота ответов высока: 70-80% [17, 62], но долгосрочных ответов меньше [63]. Недостатками являются риск ранней или поздней бактериальной инфекции, повышенный риск тромбоза и необратимость процедуры [2, 64]. Поэтому рекомендуется выполнять спленэктомию только в третьей или последующих линиях терапии. Некоторые эксперты предлагают отложить спленэктомию до тех пор, пока не будет испробован хотя бы один неспецифический иммунодепрессант, а кроме того, следует принимать во внимание предпочтения пациента [2, 13, 65]. Однако, учитывая трудности в лечении некоторых пациентов с wAIHA и относительно высокую эффективность удаления селезенки, от этого варианта не следует отказываться в случаях, невосприимчивых к лекарственным препаратам [1, 13]. Пациенты должны быть вакцинированы против инкапсулированных бактерий.
Ингибиторы неонатального Fc- рецептора
FcRn необходим для физиологической рециркуляции IgG, что объясняет длительный нормальный биологический период полураспада IgG1, IgG2 и IgG4, составляющий приблизительно 23 дня [66, 67]. FcRn связывает IgG при пониженной рН (6,0– 6,5), что позволяет избежать деградации в лизосомах. После возвращения к клеточной поверхности IgG высвобождается при физиологических значениях рН (7,0–7,5). В итоге эта система обеспечивает длительную рециркуляцию IgG – от 1 до 3 недель, в зависимости от подкласса. Таким образом, блокада этого рецептора приводит к заметному сокращению периода полувыведения IgG и снижению уровня IgG примерно до 10% от нормы без ингибирования выработки [68]. Нипокалимаб (M281), розаноликсизумаб (UCB7665) и ориланолимаб (SYNT001) представляют собой моноклональные антитела, нацеленные на FcRn [69, 70], безопасность и эффективность которых изучается в клинических исследованиях. Имеющиеся клинические данные не позволяют предположить их будущую роль в лечении. Однако очень быстрая и обратимая фармакодинамика, наблюдаемая в доклинических исследованиях, может свидетельствовать об их использовании в острых случаях.
Фостаматиниб
В настоящее время изучаются ингибиторы клеточных медиаторов фагоцитоза для лечения АИГА. Во второй фазе исследования было обнаружено, что один из этих препаратов, фостаматиниб, ингибитор селезеночной тирозинкиназы (syk), повышает уровень Hb до ≥10 г/дл или на 2 г/дл и более у 46% пациентов с wAIHA [71]. Однако у 42% пациентов при использовании фостаматиниба наблюдалась диарея; частыми побочными явлениями были усталость, гипертония, головокружение и бессонница. Фостаматиниб может оказаться вариантом в третьей линии терапии.
Другие ингибиторы преобразователей сигналов
Рилзабрутиниб – обратимый ковалентный ингибитор тирозинкиназы Брутона (BTK) [72], в настоящее время изучается в рамках фазы 2 клинического исследования (NCT05002777). Парсаклизиб, ингибитор фосфоинозитид-3-киназы δ, является препаратом-кандидатом для терапии wAIHA, а так- же CAD [73]. Предварительные результаты фазы 2 при рецидивирующем или рефрактерном течении wAIHA демонстрируют 64% ответов, хотя и с токсическими проявлениями, включая диарею, реактивацию цитомегаловируса и псориаз [74].
Терапия, направленная на плазматические клетки
Бортезомиб – мощный и селективный ингибитор протеасом, широко используемый для лечения множественной миеломы, показал многообещающие результаты при аутоиммунных заболеваниях, воздействуя на клетки, продуцирующие антитела, включая долгоживущие плазматические клетки. Благоприятный эффект бортезомиба при рефрактерном течении wAIHA, был описан в нескольких отчетах о случаях [75]. В ретроспективной серии 6 из 8 пациентов, получивших бортезомиб плюс дексаметазон, ответили уже после 2 (диапазон 1-4) циклов терапии [76]. Небольшое проспективное исследование выявило ответ на комбинацию бор-тезомиба с низкими дозами ритуксимаба и дексаметазона у 6 из 7 пациентов с рефрактерной wAIHA [77].
В настоящее время данные о применении бор-тезомиба при wAIHA ограничены, поскольку на оценку объединенных отчетов о случаях, вероятно, влияют предвзятость отбора и публикаций, а также потому, что два систематических исследования невелики. Несмотря на эти оговорки, терапия на основе бортезомиба может быть вполне эффективной при рефрактерных/рецидивирующих вариантах АИГА, у которых ритуксимаб оказался неэффективным или противопоказан.
В небольшой серии случаев терапия моноклональным антителом даратумумабом, нацеленным на CD38, была использована в качестве последнего средства у 3 пациентов с опасным для жизни рефрактерным течением wAIHA после трансплантации стволовых клеток [78]. У двух пациентов наблюдался полный и устойчивый ответ с незначительной токсичностью, в то время как у третьего пациента отмечено лишь временное улучшение в течение 8 месяцев, но затем произошел рецидив и летальный исход.
Сиролимус
Было обнаружено, что сиролимус, иммунодепрессивный ингредиент Streptomyces hygroscopicus, предотвращает отторжение трансплантата после трансплантации органов. После введения этого препарата у 4 детей с wAIHA была установлена ремиссия; у 2 из них выявлена перекрывающаяся чисто эритроцитарная аплазия [79]. Благоприятный эффект также наблюдался у детей с синдромом Фишера-Эванса. Ретроспективное исследование терапии сиролимусом у 45 взрослых и детей с рецидивирующими или рефрактерными ау- тоиммунными цитопениями, из которых у 14 была первичная wAIHA и у 12 – синдром Фишера-Эванса, сообщило о благоприятном ответе и вполне удовлетворительной переносимости сиролимуса [80]. В то же время вызывают беспокойство частые гематологические, желудочно-кишечные, сердечные и иммунологические побочные эффекты.
Что делать в чрезвычайных ситуациях?
Предлагаемые методы неотложной терапии у пациентов с критической анемией wAIHA с отсутствием или замедленным ответом на преднизолон включают внутривенное введение высоких доз метилпреднизолона, внутривенные иммуноглобулины, плазмообмен, экстренную спленэктомию или частичную эмболизацию селезенки [1, 2, 3, 81].
Что касается новых подходов в условиях неотложной помощи, быстрый эффект ингибирования комплемента при высоких, часто повторяющихся дозах С1-ингибитора плазменного происхождения был зарегистрирован в единственном случае тяжелой вторичной IgM-опосредованной wAIHA с вовлечением комплемента [82]. Однако предварительные результаты предполагаемого исследования кажутся неутешительными. Использование специфического C1s-направленного моноклонального антитела сутимлимаба, в этом контексте, имеет существенное обоснование, но систематически не изучалось. Тем не менее, основываясь на теоретических соображениях, наблюдениях за пациентами и непосредственном влиянии на классический путь комплемента, ингибирование C1 может рассматриваться как малотоксичный и потенциально эффективный вариант при угрожающем жизни wAIHA с положительным DAT для фрагментов C3 [1, 82]. Кроме того, исследование фазы 2 ингибитора комплемента C3 пегцетакоплана показало некоторую эффективность при wAIHA с C3-положительным DAT [83].
Комбинированные схемы лечения на основе бортезомиба, рассмотренные выше, также могут применяться в чрезвычайных ситуациях, учитывая высокую частоту ответов и относительно низкую токсичность [77]. Потенциальные будущие средства для лечения острых состояний могут также включать уже упомянутые ингибиторы FcRn, которые повышают клиренс аутоантител, ограничивая таким образом гемолитический криз [66, 67].
Как выбрать терапию при холодовой агглю-тининовой болезни (CAD)
Терапия, направленная на В-клетки или комплемент?
Сравнительные испытания В-клеточно-направленной терапии и ингибирования комплемента не проводились, однако некоторые выводы можно сформулировать (таблица 3).
Таблица 3
Терапия , направленная на В - клетки , в сравнении с комплемент - направленной терапией при CAD [40,44,45,46, 84,85]
|
Терапия |
Эффективность |
Время до ответа |
Влияние на гемолиз |
Продолжительность терапии |
Продолжительность ответа |
Токсичность |
|
Ритуксимаб (моно) |
Умеренная |
Иногда длительное |
Умеренное |
Короткое |
Кроткая; терапия может быть повторена |
Низкая |
|
Бендамустин + ритуксимаб |
Высокая |
Иногда длительное |
Высокое |
Короткое |
Длительно; некоторые пациенты выздоравливают |
Умеренная |
|
Сутимлимаб |
Высокая |
Короткое |
Высокое |
Неопределенное |
Длительно (терапия продолжительная) |
Низкая |
Преимуществами существующих методов лечения, направленных на В-клетки, являются ограниченное по времени лечение, высокая частота общих и полных ответов и длительность ответа при применении бендамустина в сочетании с ритуксимабом, влияние на симптомы нарушения кровообращения, а также гемолитическую анемию, и относительно низкая токсичность монотерапии ритуксимабом (таблица 3). Недостатками являются часто длительное время достижения эффекта, существующая, хотя обычно поддающаяся лечению, токсичность бендамустина в сочетании с ритуксимабом, а также относительно низкая частота и короткая продолжительность ответа при монотерапии ритуксимабом.
Сутимлимаб — первое в своем классе гуманизированное моноклональное антитело, разработанное для селективного воздействия на комплемент C1, сериновую протеазу C1 комплекса, ответственную за активацию классического пути комплемента иммунной системы. Ингибирование предотвращает отложение опсонинов комплемента на поверхности эритроцитов, что приводит к подавлению гемолиза у пациентов с CAD.
Это наиболее изученный ингибитор комплемента, который обладает очевидными преимуществами в очень быстром наступлении эффекта, высокой частоте ответных реакций и низкой токсичности.
Эффективность, длительность эффекта, безопасность и переносимость сутимлимаба у пациентов с первичной CAD была изучена в проспективном, открытом, многоцентровом исследовании фазы 3 CADENZA (NCT03347396). Исследование состояло из 2 частей А и В). После завершения 26-недельной основной фазы исследования (часть A) в 2019 году, 1-летней промежуточной в 2020 году и 2-летней долгосрочной расширенной фазы (часть B) в 2021 году, сутимлимаб продемонстрировал эффективность и хорошую переносимость. Лечение сутимли-мабом оказало быстрое и устойчивое воздействие на уровни Hb и гемолитические маркеры, а также привело к клинически значимому снижению утомляемости (вторичная конечная точка), при этом только легкие или умеренные нежелательные явления были оценены как связанные с лечением.
Часть А состояла из основного этапа исследования, а часть В - из дополнительного этапа, на котором оценивались долгосрочная безопасность и длительность реакции, включая результаты, о которых сообщали пациенты.
Так, A. Röth et al. [85] опубликовали результаты 26-недельного рандомизированного, плацебо-кон-тролируемое, двойного слепого исследования 3-й фазы CADENZA (часть А; завершено) с открытым периодом продления (часть В; продолжается), в ходе которого пациенты получали сутимлимаб в течение как минимум 1 года после завершения основного курса лечения. Исследование проводилось в 53 медицинских учреждениях из 14 стран.
В исследование вошли взрослые пациенты с подтвержденным диагнозом CAD, без недавних гемотрансфузий в анамнезе, с содержанием Hb <10,0 г/ дл, уровнем билирубина и ферритина выше нижней границы нормы. Диагноз подтверждался наличием хронического гемолиза, положительным полиспе-цифическим прямым антиглобулиновым тестом, моноспецифическим прямым антиглобулиновым строго позитивным тестом для C3d, IgG-прямым антиглобулиновым тестом <1, титром холодовых агглютининов ≥ 64 при 4°C и отсутствием признаков явного злокачественного заболевания. В течение 3 месяцев после обследования у пациентов должны были появиться симптомы заболевания, которые определялись как одно или несколько из следующих: симптоматическая анемия, акроцианоз, феномен Рейно, гемоглобинурия, нарушение кровообращения и/или серьезные неблагоприятные сосудистые события, включая тромбоз.
Сутимлимаб (6,5 г при массе тела <75 кг; 7,5 г при массе тела ≥75 кг) или плацебо вводили внутривенно (500 мл) в течение 60 минут в 0-й, 7-й и последующие каждые 14 дней в течение 26 недель. Пациенты должны были получать переливание эритроцитов, если у них были симптомы анемии с Hb <9 г/дл (90 г/л) или наблюдалось бессимптомное течение при
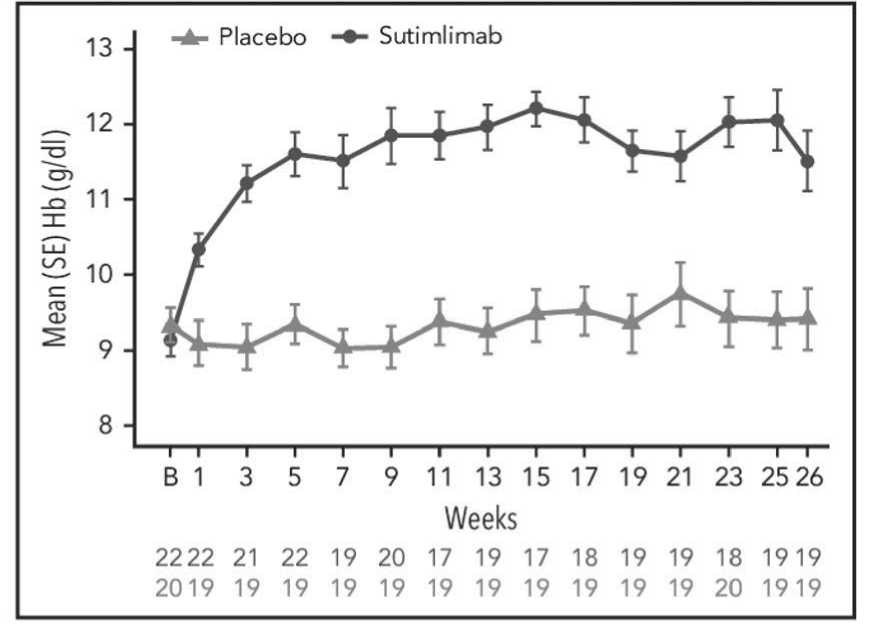
Рисунок 2. Эффект сутимлимаба на уровень гемоглобина в сравнении с плацебо в течение периода лечения, равного 26 недель.
Примечание. Верхняя кривая – сутимлимаб (Sutimlimab), нижняя – плацебо (Placebo)
содержании Hb <7 г/дл (70 г/л). Основной конечной точкой эффективности было повышение уровня гемоглобина по сравнению с исходным уровнем на 1,5 г/дл, отсутствие переливаний эритроцитов с 5-й по 26-ю неделю и отказ от приема запрещенных протоколом препаратов для лечения CAD с 5-й по 26-ю недели. Были рандомизированы 42 пациента для получения сутимлимаба (n=22) или плацебо (n=20).
Лечение сутимлимабом привело к быстрому (в течение 3 недель) и устойчивому повышению уровня гемоглобина, в то время как при приеме плацебо значимых изменений не наблюдалось (Рисунок 2).
Пациенты, получавшие сутимлимаб в течение 26 недель, имели значительно более высокие шансы на достижение критериев ответа. У 16 (72,7%) пациентов, получавших сутимлимаб и у 3 (15,0%) – плацебо, уровень гемоглобина повысился на 2 г/дл и 1,5 г/дл соответственно. В период с 5 по 26 неделю 18 (81,8%) пациентов в группе с сутимлимабом, и 16 (80,0%) пациентов, получавших плацебо, не нуждались в гемотрансфузиях.
В целом при лечении сутимлимабом, уже с 3-й недели его применения, Hb повысился до 11 г/дл (110 г/л) и оставался стабильным до конца курса лечения у 73,7% пациентов, в то время как в группе плацебо аналогичные показатели были зарегистрированы только у 4 (20,0%) пациентов. Кроме того, лечение сутимлимабом в течение 1-3 недель привело к полному контролю гемолиза. Пятнадцать (88,2%) пациентов, получавших сутимлимаб, и 4 (22,2%) – плацебо, достигли нормального уровня общего билирубина. Сходные результаты были обнаружены и для других маркеров гемолиза. У одиннадцати (57,9%) и у шести (30,0%) пациентов соответственно нормализовался уровень ЛДГ. Снижение количества ретикулоцитов и повышение уровня гаптоглобина при применении сутимлимаба соответствовало снижению уровня билирубина, в то время как в группе, получавшей плацебо, изменений не наблюдалось (рисунок 3).
Лечение сутимлимабом привело к почти полному подавлению активности классического пути комплемента, которое сохранялось на протяжении всего периода лечения [85].
Что касается нежелательных явлений (НЯ), следует отметить, что большинство из них не были связаны с лечением, проводимым в рамках исследования. Только у 8 (36%) пациентов было выявлено 28 случаев различных НЯ, которые были связаны с лечением сутимлимабом. В группе плацебо у 4 пациентов (20%) наблюдалось 7 побочных эффектов. У пациентов, получавших сутимлимаб, по сравнению с плацебо чаще отмечались головная боль (22,7% против 10,0%), повышенное напряжение (22,7%
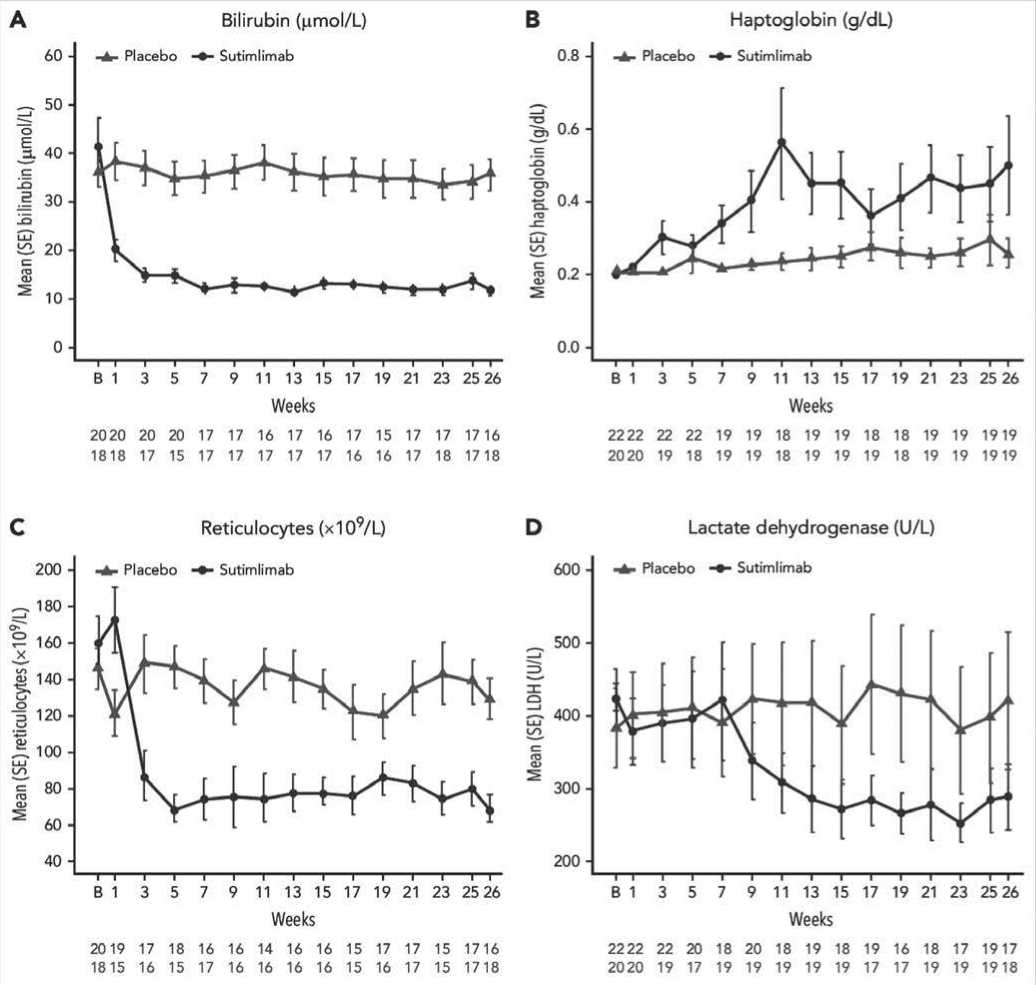
Рисунок 3. Влияние сутимлимаба на маркеры гемолиза от исходного уровня до 26 недели.
Примечание. (A) Анализ изменения билирубина от исходного уровня; (B) Изменение уровня гаптоглобина; (C) Параметры ретикулоцитов; (D) Активность ЛДГ
против 0%), ринит (18,2% против 0%), феномен Рейно (18,2% против 0%) и акроцианоз (13,6% против 0%). У 3 (14%) пациентов развились инфекционные осложнения. У пожилого пациента с сахарным диабетом в анамнезе на 86-й день развился тяжелый тромбоз вен головного мозга, лечение сутимлима-бом было временно прекращено. В группе плацебо у 1 (5%) пациента была выявлена анемия, которая возникла на 21-й и 63-й дни терапии и 1 случай инфекции на 64-й день.
В целом у 10 (45%) пациентов, получавших су-тимлимаб, и 10 (50%) – плацебо диагностированы инфекционные осложнения различной степени тяжести. Однако ни один случай не привел к прекращению лечения. Только у 3 (14%) больных из группы сутимлимаба пришлось прервать прием препарата из-за НЯ. Так, 1 пациент прекратил лечение из-за повышения уровня IgM в крови, позже у него была диагностирована В-клеточная лимфома низкой степени тяжести. Еще у одного пациента наблюдалась реакция, связанная с инфузией сутимлимаба (боль в поясничном отделе позвоночника и обеих ногах).
Таким образом, сутимлимаб приводил к нормализации гемоглобина и маркеров гемолиза, а также к клинически значимому снижению утомляемости у пациентов с CAD. Причем положительная реакция на сутимлимаб наблюдалась уже в течение первых трех недель и сохранялась до 26 недели. Эффективность сутимлимаба в исследовании CADENZA коррелировала с ингибированием активности классического пути комплемента с 1-й недели до окончания лечения. На 26-й неделе в группе, получавшей су-тимлимаб, средняя активность классического пути комплемента была почти полностью подавлена. Блокада C1s сутимлимабом в несколько раз повышала уровень циркулирующего C4 у пациентов, что является маркером активности сутимлимаба in vivo. Лечение сутимлимабом, как правило, хорошо переносилось. Летальных исходов и менингококковой инфекции не наблюдалось. Ни в одной из групп не было зарегистрировано случаев развития системной красной волчанки или серьезных реакций гиперчувствительности и/или анафилаксии. Ограничением данного исследования является то, что количество пациентов было небольшим, но оно соответствовало редкому заболеванию с клинической гетерогенностью.
Авторы [85] резюмируют, что сутимлимаб обладает новым механизмом действия, который конкретно направлен на устранение основной причины хронической гемолитической анемии. Cутимлимаб оказывает воздействие на классический путь комплемента C1s и представляет собой эффективный терапевтический подход к лечению CAD, не зависящий от статуса переливания крови, с реакцией на лечение уже через 1 неделю и благоприятным профилем переносимости.
В 2023 г. были опубликованы результаты исследования CARDINAL [86], в котором лечение сутим-лимабом также продемонстрировало улучшение по целому ряду показателей, оцениваемых с помощью функциональной оценки терапии хронических заболеваний (FACIT) – шкалы усталости и предварительных показателей, включающих краткий опросник состояния здоровья из 12 пунктов (SF–12), визуальную аналоговую шкалу EuroQol (EQ-VAS), а также опросники "Общее впечатление пациента о степени тяжести (усталости)" (PGIS) и "Общее впечатление пациента об изменениях" (PGIC).
Исследование CARDINAL – открытое, одногрупповое, многоцентровое (фаза 3) также из 2 частей. Часть A состояла из основной фазы исследования, а часть B — расширенная фаза, которая продолжалась 2 года для оценки долгосрочной безопасности, переносимости и стойкости ответа на лечение сутим-лимабом после 26 недельного периода основного цикла. По сути, CARDINAL можно расценить как продолжение исследования CADENZA или как 2 исследования, дополняющие друг друга. В этом исследовании авторы представляют данные по долгосрочным результатам, о которых сообщают пациенты (PRO), результаты, демонстрирующие устойчивое влияние на качество жизни, достигаемое при длительном лечении CAD с помощью сутимлимаба. Значимые преимущества для физического и психического здоровья (включая снижение утомляемости) были связаны с улучшением уровня гемоглобина, основного показателя клинического исхода CAD.
Все пациенты, завершившие часть A (22/24), включая тех, кому переливали эритроцитную массу, имели право на участие в исследовании и были переведены в часть B исследования CARDINAL. Они продолжали лечение той же двухнедельной дозой сутимлимаба в течение 2 лет после того, как последний пациент завершил часть A. Пропущенная доза (т. е. вне окна дозирования или >17 дней с момента последней дозы) была согласована с дополнительной ударной дозой за 1 неделю до следующей запланированной дозы, после чего возобновлялись двухнедельные визиты для введения препарата, который вводился также путем внутривенной инфузии в фиксированных дозах 6,5 г для пациентов с массой тела <75 кг и 7,5 г для пациентов с массой тела ≥75 кг. В исследование вошли пациенты в возрасте ≥18 лет с массой тела ≥39 кг, уровнем гемоглобина ≤10 г/ дл, признаками активного гемолиза (уровень общего билирубина выше нормы), недавним анамнезом переливания крови (в течение 6 месяцев) и наличие ≥1 симптома, связанного с CAD.
Все пациенты были обследованы во время контрольного визита в конце исследования через 9 недель после приема последней дозы препарата. Большинство пациентов составляли женщины (68,2%), медиана возраста – 71,5 года (диапазон 55-85 лет).
Качество жизни и профпригодность по указанным выше показателям оценивалось каждые 12 недель во время запланированных посещений как до, так и в течение всего периода лечения, а также во время 9-недельного последующего визита.
CAD – это хроническое, тяжелое заболевание, проявляющееся симптомами, негативно влияющими на качество жизни пациентов, на их способность выполнять повседневную деятельность и ограничивающее их социальную и профессиональную жизнь. По результатам исследования, исходный средний балл FACIT-Fatigue был равен 32,4, что сопоставимо с уровнем усталости, наблюдаемым при других серьезных хронических заболеваниях, включая ревматоидный артрит и анемию, связанную с раком. Обследование пациентов с CAD показало, что 44% пациентов испытывают эту усталость ежедневно. Поскольку CAD – это заболевание, которое чаще всего встречается у пожилых пациентов, оно, вероятно, усугубляет последствия старения. Данные гематологических результатов исследования CARDINAL, продемонстрировали, что длительное ингибирование C1s сутимлимабом приводит к устойчивому снижению показателей гемолиза и увеличению содержания гемоглобина. В этом исследовании анализ PROs, включая FACIT-Fatigue, SF-12, EQ-VAS, PGIC
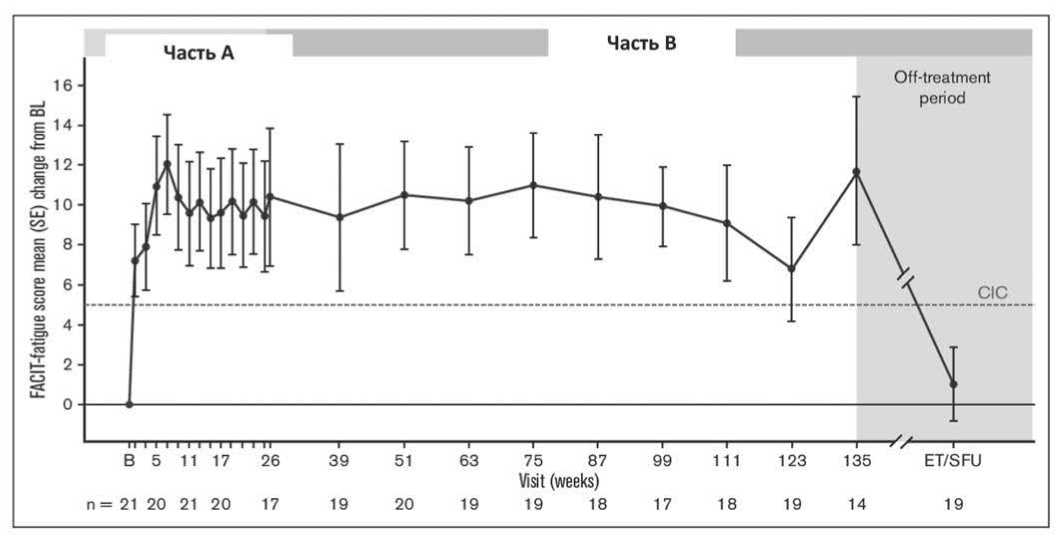
Рисунок 4. Медианное значение (SE) изменения показателя усталости по сравнению с исходным уровнем на протяжении основной (часть A) и продленной на 2 года (часть B) фаз CARDINAL, а также при последующем посещении ET/SFU через 9 недель после прекращения лечения сутимлимабом.
Примечание. CIC – клинически значимое улучшение; off-treatment period – период после окончания лечения
и PGIS, показал их существенное улучшение после лечения сутимлимабом по сравнению с исходным уровнем. Благоприятный эффект длительного лечения сутимлимабом в отношении утомляемости и других побочных эффектов сохранялся на протяжении всего периода лечения и уменьшился только после его прекращения (Рисунок 4).
На протяжении всего курса лечения улучшение показателей по шкале функциональной оценки терапии хронических заболеваний (FACIT-Fatigue) превысило заданное клинически значимое изменение на уровне ≥5 баллов по сравнению с исходным уровнем. Показатели физического и психического компонентов по результатам обследования здоровья оставались выше исходного уровня, при этом среднее изменение (SE) на 123-й неделе превысило клинически значимые изменения на 3,9 балла по физическому компоненту и на 2,8 балла по психическому компоненту, составив 4,7 (2,8) и 3,8 (5,7) балла соответственно. Визуальная аналоговая шкала EuroQol, по которой оценивалось самочувствие пациентов, также оставалась выше исходного уровня, изменившись на 17,1 (5,6) балла на 135-й неделе. Общее впечатление пациента о степени тяжести (усталости) улучшилось по сравнению с исходным уровнем, что подтверждает оценку FACIT- Fatigue.
Таким образом, результаты исследования CARDINAL часть B показывают, что продолжающееся ингибирование классического пути комплемента сутимлимабом обеспечивает устойчивые и долговременные преимущества лечения хронической CAD, включая продолжающееся значимое влияние на качество жизни пациента в долгосрочной перспективе.
Недостатками сутимлимаба являются отсутствие эффекта на симптомы нарушения кровообращения, вероятная необходимость в неопределенной продолжительности лечения, проведение внутривенных инфузий раз в две недели и очень высокая стоимость [87].
Как лечить пациентов с холодовой агглютинино-вой болезнью в критическом состоянии с анемией?
Обострения CAD часто провоцируются воздействием холода, инфекцией с лихорадкой, серьезной травмой или обширной операцией [40, 88]. В таких ситуациях разумно, при необходимости, устранить причину обострения, сделать пациенту переливание эритроцитной массы и, во многих случаях, подождать несколько недель до улучшения гемолитической анемии. У пациентов с CAD, у которых наблюдается глубокая анемия и которым требуется быстрый эффект от терапии, применение сутимли-маба в первой линии часто бывает успешным [44, 87]. После достижения стабильного ответа у тщательно отобранных пациентов может быть рассмотрен вопрос о переходе на ограниченную по времени терапию, нацеленную на В-клетки, в качестве альтернативы бессрочному приему сутимлимаба, с учетом зависимости от характеристик пациента (подходит или не подходит), клинических особенностей заболевания (выраженные симптомы нарушения кровообращения или нет) и предпочтений пациента [87, 89]. Однако этот “связующий” подход в настоящее время не основан на фактических данных.
Как лечить пациентов с выраженными симптомами нарушения кровообращения?
Как объяснялось выше, симптомы периферического кровообращения отсутствуют или слабо выражены примерно у двух третей пациентов с CAD, в то время как у одной пятой наблюдается гемолитическая анемия с симптомами нарушения кровообращения, мешающими повседневной жизни [2, 40]. У десятой части пациентов наблюдаются симптомы нарушения кровообращения с компенсированным гемолизом в качестве единственного или основного клинического проявления. Симптомы нарушения кровообращения могут быть показанием к началу лечения у 30% пациентов. Пациенты этой подгруппы должны получать терапию, направленную на В-клетки, которая потенциально может устранить симптомы нарушения кровообращения, а также гемолиз [15, 45].
Как выбрать наилучшую терапию для “типичного” пациента с CAD?
Большая доля пациентов с CAD, нуждающихся в терапии, имеет умеренную анемию, часто повышенную утомляемость и отсутствие или умеренные симптомы нарушения кровообращения (Рисунок 1). У таких пациентов текущие данные не позволяют давать какие-либо жесткие общие рекомендации, и терапия должна быть индивидуальной. В первой линии В-клеточный подход будет уместен для большинства этих пациентов [15]. При анемии от умеренной до тяжелой степени предпочтительнее ри-туксимаб плюс бендамустин, тогда как при легкой клинической форме заболевания целесообразнее монотерапия ритуксимабом. Ритуксимаб в дозе 375 мг/ м2 в неделю в течение 4 недель является наиболее широко используемой терапией первой линии, хотя частота ответа скромна, а продолжительность ответа относительно невелика [46]. Добавление бендамустина значительно улучшает частоту и продолжительность реакции, но связано с некоторой токсичностью [40].
В ретроспективный анализ, представленный S. Berentsen et al. [40], вошли 232 пациента с холодовой агглютининовой болезнью. Медиана уровня Hb составила 9,3 г/дл (медиана 9,2; диапазон 4,5-15,3). У 62 (26,7%) пациентов уровень Hb был <8,0 г/дл, а у 89 пациентов (38,4%) – Hb ≥10 г/дл. Из 104 пациентов, получавших от 1 до 4 (медиана, 1) линий монотерапии ритуксимабом, 61 (59%) достигли ответа. Медиана продолжительности ответа составила 15 месяцев (диапазон 1-60). Однако была обнаружена более высокая частота ответов и более длительная его продолжительность после терапии ритуксимабом в сочетании с бендамустином или флударабином. Большая часть ответов была полной в соответствии со строгими критериями. Данные последующего наблюдения указывают на еще более длительный ответ при применении ритуксимаба и бендамустина (средняя расчетная продолжительность ответа >88 месяцев; 5-летняя продолжительность ответа 77%), чем при применении ритуксима-ба и флударабина.
Принимая во внимание растущее число эффективных методов лечения, многие авторы рассматривают симптоматическую анемию, выраженную усталость или беспокоящие симптомы нарушения кровообращения как показания к лечению [2, 3, 18]. CAD плохо поддается терапии кортикостероидами, неспецифическим подавлением иммунитета или спленэктомией.
В этих условиях разумно рассматривать сутим-лимаб в качестве препарата второй линии, который может быть использован в первой линии у пациентов, имеющих противопоказания к химиоиммунотерапии. Следует принимать во внимание предпочтения пациента. Варианты второй линии, помимо сутимлимаба, могут включать бортезомиб или клиническое исследование, в то время как применение ритуксимаба в сочетании с флударабином должно быть ограничено тщательно отобранными пациентами.
Что касается будущих подходов, направленных на борьбу с В-клетками, лечение ингибитором BTK ибрутинибом показало весьма многообещающие результаты в ретроспективной серии исследований [90]. В этом исследовании 13 пациентов с CAD или гемолитической анемии, вторичной по отношению к неходжкинской лимфоме, ответили на лечение; ответы сохранялись при продолжении лечения, препарат в целом хорошо переносился.
Следует также продолжить изучение методов лечения, направленных на комплементарную терапию. Ингибитор С3 пегцетакоплан (APL-2) – пегили-рованный циклический пептид, разработанный для подкожной инфузии, дал благоприятный ответ при низкой токсичности в исследовании фазы 2 [91]. Применение Пэгцетакоплана при CAD в настоящее время проходит дальнейшее изучение в рандомизированном плацебо-контролируемом исследовании фазы 3 (ClinicalTrials.gov, NCT05096403). Другими агентами, нацеленными на комплемент, которые могут играть роль в лечении CAD, являются ANX005, ингибитор C1q [92], BIVV020, который нацелен на C1s [93] и ARGX-117, который ингибирует C2 [94].
Что делать в экстренных случаях?
Традиционной неотложной терапией при CAD является плазмообмен [95, 96]. Поскольку 80% IgM находится в кровотоке, теоретические шансы на успех должны быть высокими. Однако продолжительность ответа невелика, поэтому одновременное на- чало фармакологической терапии обязательно. Для замещения следует использовать альбумин вместо плазмы, чтобы избежать инфузии экзогенного комплемента [34].
Сегодня, учитывая очень быстрый эффект су-тимлимаба на гемолитическую анемию при CAD, ингибирование комплемента C1 может быть предпочтительным в качестве неотложной терапии [1, 18, 44]. Даже ингибирование C5 с помощью экулизумаба может быть полезным, поскольку опосредованный C5b-9 внутрисосудистый гемолиз может быть заметным у пациентов с критическим гемолизом [1, 18].
Как выбрать терапию при других АИГА
Синдром вторичного холодового агглютинина
Синдром вторичного холодового агглютинина (CAS), вызванный Mycoplasma pneumoniae или вирусами, пройдет спонтанно после устранения инфекции. Однако при микоплазменной инфекции гемолитическая анемия иногда может быть глубокой и длительной, и начало гемолитического осложнения обычно наступает на второй неделе, когда антибактериальная терапия часто уже начата или даже завершена [45]. Переливание эритроцитной массы безопасно при соблюдении тех же мер предосторожности, что и при CAD (см. ниже).
Как лечить смешанную АИГА?
Смешанная АИГА с холодовыми и тепловыми антителами часто трудно поддается лечению. В первой линии можно использовать кортикостероиды в высоких дозах вместе с ритуксимабом [1, 3]. Если клинические симптомы, связанные с холодовым агглютинином, выражены, целесообразно лечить этот подтип как CAD [3]. Спленэктомия не рекомендуется.
Каким пациентам с АИГА следует проводить переливание эритроцитов?
Переливание эритроцитной массы пациентам с АИГА требует особых мер предосторожности и зависит от температурного диапазона аутоантител [1, 3]. При wAIHA переливание эритроцитной массы может быть сопряжено с риском острой или отсроченной гемолитической реакции и риском аллоим-мунизации. Однако, когда переливание эритроцитов явно необходимо, не следует отказываться от этой поддерживающей терапии, и она, как правило, безопасна при соблюдении необходимых мер предосторожности [98]. Необходимо отказаться от старого представления об использовании “наименее несовместимой донорской крови” [99]. Вместо этого рекомендуется провести расширенное фенотипиро-вание, и по возможности предпочесть концентрат эритроцитов, идентичный фенотипу [100].
При CAD меры предосторожности другие. Переливание эритроцитов, как правило, безопаснее, чем при wAIHA. Однако существует потенциальный риск агглютинации и гемолиза эритроцитов пациента, а также донорских эритроцитов из-за охлаждения. Предтрансфузионный скрининг и перекрестное со- поставление, если выполняются при температуре 37°C, а температурная амплитуда холодового агглютинина приближается к 37°C, могут потребовать методы аутоадсорбции [15]. Пациент и его конечность, выбранная для переливания, должны находиться в тепле, и рекомендуется использовать встроенный подогреватель крови [1, 3, 18].
В настоящее время не существует валидированных прогностических инструментов для прогнозирования клинического течения АИГА. Однако выявлено несколько потенциальных факторов риска тяжелых исходов заболевания. Смертность может быть связана с синдромом Эванса, инфекциями, почечной недостаточностью, инфарктом миокарда, тромбоэмболией легочной артерии и полиорганной недостаточностью. Низкий уровень гемоглобина в начале лечения (<8 г/дл) является показанием для госпитализации в отделение интенсивной терапии, фактором риска развития рецидива и летальных исходов.
Заключение
Для определения тактики ведения и терапии пациента необходима комплексная диагностика формы АИГА. Правильно выбранная терапия позволяет достаточно быстро достигнуть ремиссии, уменьшить число осложнений и улучшить качество жизни пациента. Для большинства пациентов в настоящее время удается подобрать лечение для достижения длительной ремиссии. Преднизолон в высоких начальных дозах остается препаратом первой линии для лечения wAIHA, но в тяжелых случаях следует рассмотреть возможность предварительного добавления ритуксимаба. При CAD эффективные методы лечения направлены на патогенный В-клеточный клон или классический путь комплемента. За последнее десятилетие, как при АИГА, опосредованной тепловыми антителами, так и при воздействии холодовых антител, увеличилось число установленных и исследуемых вариантов лечения, а индивидуальный подход становится частью терапевтических соображений. Однако при любом типе АИГА идеальное лечение еще предстоит разработать, и некоторые рекомендации все еще основаны на относительно слабых доказательствах.
Состояние некоторых пациентов с глубокой анемией может быстро ухудшаться из-за неконтролируемого гемолиза, но данные о частоте и исходах тяжелой АИГА отсутствуют. Этот пробел в знаниях затрудняет распознавание пациентов, подверженных риску тяжелого течения заболевания. Поэтому проспективные клинические испытания важны для будущего улучшения терапии АИГА, опосредованной как тепловыми, так и холодовыми антителами. Будущие исследования должны быть сосредоточены на валидации факторов риска тяжелой АИГА, включающих клинические характеристики и иммунологические составляющие.


