Выбор оптимального варианта разметки метастатических лимфатических узлов у больных раком молочной железы
Автор: Петровский А.В., Солощенко А.И., Герасимов А.Н., Литвинов Р.П., Карпова М.С., Понедельникова Н.В., Притула С.И., Денчик Д.А., Хакуринова Н.Д., Солтанов Ц.Б., Стилиди И.С.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 т.13, 2023 года.
Бесплатный доступ
Нередко проведение неоадъювантного лекарственного лечения у пациенток с местно-распространенной формой рака молочной железы приводит к полной клинической и патоморфологической регрессии не только самой первичной опухоли, но и метастатических лимфатических узлов. В настоящее время продолжаются дискуссии относительно оптимального объема хирургического вмешательства на региональных лимфоузлах у этой категории больных. В качестве деэскалации классической лимфаденэктомии применяется такой метод, как таргетная аксиллярная диссекция (ТАД), а именно проведение биопсии «сторожевых» лимфоузлов (БСЛУ) с удалением ранее размеченного метастатического лимфоузла. Наше исследование нацелено на выбор наиболее оптимального способа маркировки метастатического лимфоузла. В работу были включены 63 пациентки с диагнозом рак молочной железы T1-3N1М0 стадии, все разделены на две группы сравнения: 29 пациенткам до проведения неоадъювантной терапии в метастатический лимфоузел была установлена рентгенконтрастная метка, а 33 больным - радиоизотопная метка (с I125). После окончания лекарственного лечения всем больным с полным лечебным патоморфозом на лимфоузлах выполнена таргетная аксиллярная лимфаденэктомия. В работе учитывалось время выполнения оперативного вмешательства, длина кожного разреза, наличие осложнений при использовании того или иного вида разметки. Опираясь на полученные результаты статистического анализа, для внедрения в клиническую практику мы предлагаем вариант с радиоизотопной меткой. Именно этот метод, на наш взгляд, представил наилучшие качества, а именно надежность и удобство для врача-хирурга, комфорт для пациента.
Рак молочной железы, разметка метастатических лимфатических узлов, таргетная аксиллярная лимфодиссекция
Короткий адрес: https://sciup.org/140297263
IDR: 140297263 | DOI: 10.18027/2224-5057-2023-13-1-11-16
Текст научной статьи Выбор оптимального варианта разметки метастатических лимфатических узлов у больных раком молочной железы
Наличие метастазов в лимфатических узлах у больных раком молочной железы является прогностическим фактором при выборе тактики лечения. Чаще всего на первом этапе таким больным показано проведение неоадъювантной полихимиотерапии, в том числе с целью деэскалации последующего хирургического лечения [1]. Если ранее классическим вариантом хирургического вмешательства для больных со статусом сN + лимфоузлов и на фоне лекарственного лечения, перешедших в сN-, являлась подмышечная лимфаденэктомия (ЛА), то в настоящее время аксиллярная ЛА для стадирования и прогноза рака молочной железы уходит в прошлое. Лимфаденэктомия связана с риском возникновения осложнений, в первую очередь это отек верхней конечности, возникающий из-за нарушения лимфатического и венозного оттока, ограничение подвижности в плечевом суставе на стороне операции, а также различные неврологические расстройства [2]. Освоение технологий для сокращения объема оперативного вмешательства на лимфатических узлах становится базовым рутинным методом в практике хирурга-онколога. Таким направлением является «таргетная аксиллярная лимфодиссекция» [3]. Понятие включает в себя проведение биопсии «сторожевых» лимфоузлов (БСЛУ) с удалением ранее размеченного метастатического лимфоузла. В этом случае при удалении «сторожевых» лимфоузлов вместе с маркированным лимфоузлом, при отсутствии в них метастазов, можно быть уверенным в радикальности оперативного вмешательства и в соблюдении всех онкологических канонов. [4,5]. В нашей работе мы сравниваем два вида разметки метастатических лимфатических узлов с целью выбора наиболее комфортного, практичного и надежного метода, как для пациента, так и врача-хирурга.
ЦЕЛЬ
Выбрать оптимальный способ маркировки метастатического лимфатического узла у больных раком молочной железы на этапе проведения неоадъювантной лекарственной терапии.
МАТЕРИАЛЫ И МЕТОДЫ
Период наблюдения: 2018–2022 гг. В исследование были включены 62 пациентки в возрасте от 30 до 60 лет с диагнозом: рак молочной железы любого молекулярного подтипа, T1–3N1М0 стадии, которым на первом этапе лечения проведена неоадъювантная лекарственная терапия (НАЛТ). Обязательным условием включения являлось наличие единичного цитологически (гистологически) верифицированного метастатического лимфатического узла. Двадцати девяти больным до проведения НАЛТ в метастатический лимфоузел под УЗИ-наведением была установлена рентгенконтрастная (р/к) метка, 33 пациенткам — радиоизотопная (р/з) метка (с I 125 ). Установка маркеров была идентична. Вторым этапом всем пациентам была выполнена операция на лимфатических узлах в НМИЦ онкологии имени Н. Н. Блохина.
РЕЗУЛЬТАТЫ
После лечения в обеих группах не было статистически значимых различий в отношении частичного клинического ответа, р = 0,382. Полный клинический эффект в группе с р/к метками наблюдался у 24 (82,75%) больных, с р/з у 27 (81,82%) пациентов, различия не достоверны с р = 0,353 (рис. 1). Отсутствие эффекта от лечения не на-
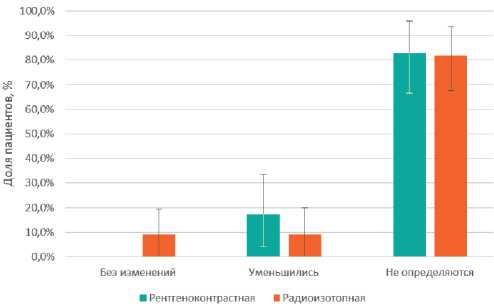
Рисунок 1. Распределение пациентов по эффекту лекарственного лечения на региональных лимфоузлах блюдалось у пациентов в группе с рентгенконтрастными метками, в группе с радиоизотопными метками отмечено у 3 (9,01%) больных, р < 0,144.
В нашем исследовании всем пациентам с отсутствием эффекта от лечения, а также с неполным клиническим ответом по лимфоузлам была выполнена подмышечная лимфо-диссекция. Остальным предложена таргетная аксиллярная лимфаденэктомия. В работе для выполнения БСЛУ использовался радиоизотопный (с наноколлоидом альбумина) или флуоресцентный (с индоцианином зеленым) метод. Обязательным условием являлось выполнение интраоперационного срочного гистологического исследования аксиллярных лимфоузлов. При обнаружении опухолевых клеток хотя бы в одном лимфоузле объем операции расширялся до подмышечной лимфаденэктомии.
Стоит отметить, что не всем больным с рентгенкон-трастной меткой удалось выполнить ТЛД. У 4 пациентов метка не определялась при контрольной маммографии (13,8% ДИ: 5,8% — 27,4%), в связи с чем этим пациенткам была выполнена подмышечная лимфаденэктомия (рис. 2).
Также пациенткам с рентгенконтрастными метками перед операцией была необходима установка якорной навигационной иглы в метастатический лимфоузел. Разметка осуществлялась под рентгенологическим контролем, что оказалось крайне затруднительно, учитывая полное исчезновение метастаза. Проводник-стилет с якорной иглой подводился непосредственно к рентгенконтраст-ному маркеру под контролем маммографии. После имплантации внешний компонент проволоки оставался снаружи и фиксировался к коже. В таком состоянии пациентки переводились в операционную, и 88% пациенток, с их слов, испытывали неудобство из-за наличия проволоки в подмышечной области. Наконец, несмотря на предоперационную разметку, у 3 троих пациентов метка во время операции так и не была найдена (12,0% ДИ: 4,5% — 26,0%). В итоге проблемы с обнаружением рентгенологических меток были у 7 из 29 больных (24,1 % ДИ: 12,7% — 39,7%)(рис. 3).
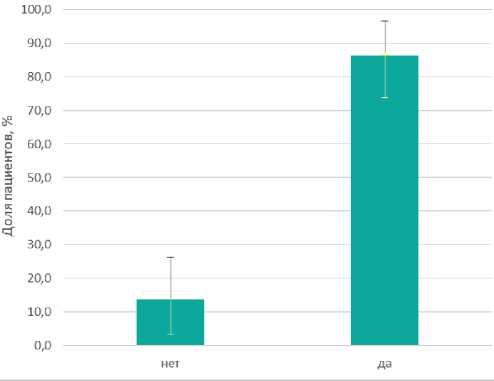
Рисунок 2. Наличие рентгеноконтрастной метки после НАЛТ при контрольной ММГ
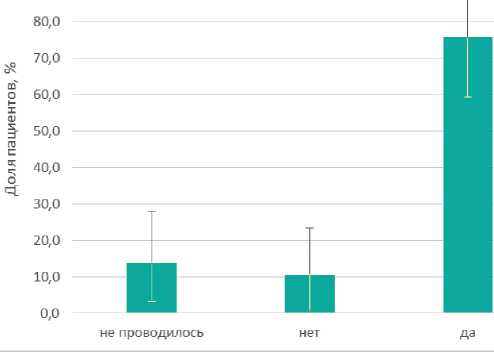
Рисунок 3. Обнаружение рентгенконтрастной метки на ММГ интраоперационно
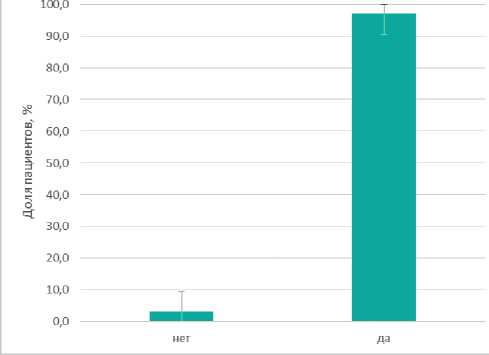
Рисунок 4. Наличие «сигнала» от радиоизотопной метки на после НАЛТ
В группе с радиоизотопной меткой всего лишь у одной больной не было «сигнала» от размеченного лимфоузла на момент оперативного вмешательства (3,0% ДИ: 0,7% — 10,6%), в связи с чем пациентка выбыла из исследования ещё до операции (рис. 4).
В случае использования флуоресцентного метода первым этапом выполнялась биопсия «сторожевых» лимфоузлов индоцианином зеленым, затем удаление метастатического лимфоузла. При радиоизотопном методе удалению подвергались все «звенящие» узлы. При установке радиоактивной метки, метастатический лимфоузел был идентифицирован и удален в 100% случаев.
В работе учитывалась длина кожного разреза в подмышечной области, она составила в обеих группах в среднем по 3 см, р = 0,499 (рис. 4). Различие во времени выполнения ТАД в двух группах близко к достоверному, р = 0,06, для группы с рентгенконтрастными метками составило 12,46 мин ± 2,04, с радиоизотопными — 17,12 мин ± 1,39 (рис. 5).
Не было значимых различий и по проценту пациентов, которым потребовалось выполнение лимфаденэктомии после срочного гистологического исследования, их процент- ное соотношение составило 10,3% для рентгенконтраст-ных и 12,1% для радиоизотопных меток, р = 0,574 (рис. 6).
ЗАКЛЮЧЕНИЕ
В работе мы рассмотрели две разновидности разметки метастатического лимфатического узла до НАЛТ. Оба варианта, на первый взгляд, могут использоваться в клинической практике. Однако нельзя не отметить, что довольно большой процент больных из группы с рентгенконтраст-ными метками выбыл из исследования еще до оперативного лечения, у 13,8% «метка» не определялась при контрольной ММГ. В сравниваемой же группе отсутствие «сигнала» от радиоизотопа на момент операции было лишь в 3% случаев. Установка маркеров в обеих группах была аналогична и не имела жалоб от пациентов. А навигация рентгеноконтрастных меток непосредственно перед операцией требовала дополнительной манипуляции, была некомфортна для пациенток, и, самое важное, ненадежна (12% меток так не найдено во время операции). Несмотря на то, что время выполнения ТАД было примерно
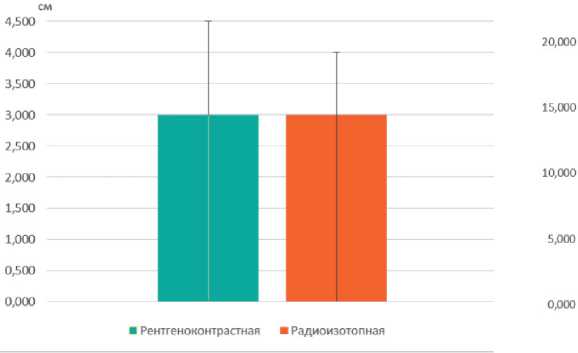
Рисунок 4. Длина кожного разреза в подмышечной области
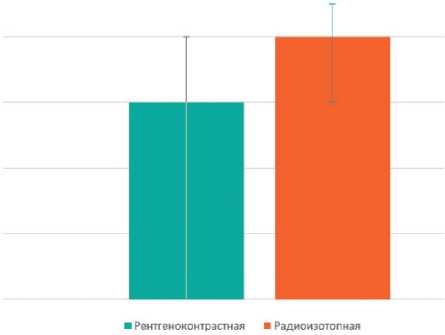
Рисунок 5. Время выполнения ТАД (мин.)
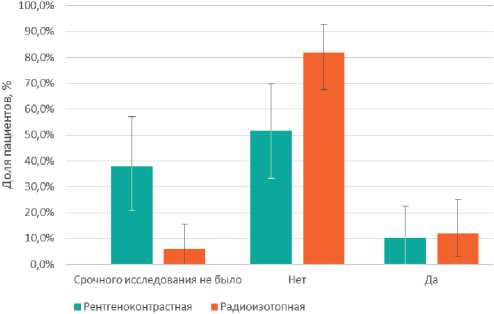
Рисунок 6. Необходимость выполнения подмышечной лимфаденэктомии после срочного гистологического исследования
одинаково в обеих группах, технически проще, со слов оперирующих хирургов, было удаление радиоизотопного маркера, в связи с чем можно сделать вывод, что этот именно метод является оптимальным способом маркировки метастатического лимфатического узла до НАЛТ. В нашем случае имплантация в метастатический лимфоузел зерна меченого I 125 . Возможно, с целью подсчета совпадения сторожевого и метастатического лимфоузла, имеет место подход к двойной идентификации, что в данной работе применялось только при флуоресцентном методе биопсии сигнальных лимфоузлов. Тем не менее метод показал высокую точность, что позволяет рекомендовать его для внедрения в клиническую практику.
Список литературы Выбор оптимального варианта разметки метастатических лимфатических узлов у больных раком молочной железы
- Клинические рекомендации "Рак молочной железы" Ассоциация онкологов России, 2021 г.
- Lucci A., McCall L.M., Beitsch P.D., Whitworth P.W., Reintgen D.S., Blumencranz P.W., Leitch A.M., Saha S., Hunt K.K., Giuliano A.E.; American College of Surgeons Oncology Group. Surgical complications associated with sentinel lymph node dissection (SLND) plus axillary lymph node dissection compared with SLND alone in the American College of Surgeons Oncology Group Trial Z0011. J Clin Oncol. 2007; 25 (24): 3657-3663.
- Boughey J.C., Ballman K.V., Le-Petross H.T., McCall L.M., Mittendorf E.A., Ahrendt G.M., Wilke L.G., Taback B., Feliberti E.C., Hunt K.K., et al. Identification and resection of the clipped node decreases the false negative rate of sentinel lymph node surgery in patients presenting with node-positive breast cancer (T0-T4, N1-2) who receive neoadjuvant chemotherapy - results from ACOSOG Z1071 (Alliance). Ann Surg. 2016; 263 (4): 802-807.
- Caudle A.S., Yang W.T., Krishnamurthy S., Mittendorf E.A., Black D.M., Gilcrease M.Z., Bedrosian I., Hobbs B.P., DeSnyder S.M., Hwang R.F., et al. Improved axillary evaluation following neoadjuvant therapy for patients with node-positive breast cancer using selective evaluation of clipped nodes: implementation of targeted axillary dissection. J Clin Oncol. 2016; 34 (10): 1072-1078.
- Donker M., Straver M.E., Wesseling J., Loo C.E., Schot M., Drukker C.A., van Tinteren H., Sonke G.S., Rutgers E.J., Vrancken Peeters M.J. Marking axillary lymph nodes with radioactive iodine seeds for axillary staging after neoadjuvant systemic treatment in breast cancer patients: the MARI procedure. Ann Surg. 2015; 261 (2): 378-372.


