Выбор режима фракционирования при глиомах 4 степени злокачественности в зависимости от возраста пациентов
Автор: Чугуев А.С., Герасимов В.А., Беликова А.А., Каприн А.Д., Даценко П.В.
Рубрика: Научные статьи
Статья в выпуске: 3 т.33, 2024 года.
Бесплатный доступ
Исследовано влияние двух режимов фракционирования на последующую общую выживаемость при глиомах 4 степени злокачественности в зависимости от возраста пациентов. У 140 пациентов с морфологически подтверждённой глиомой 4 степени злокачественности с помощью стратегии попарного моделирования поочередно использовалось фракционирование с предписанной дозой 2 и 3 Гр. В целом, летальный исход зафиксирован у 111 пациентов (79,3%), от прогрессирования глиомы скончалось 99 (70,7%). У пациентов моложе 50 лет медиана общей выживаемости на декабрь 2023 г. составила 31,11 мес. (95% ДИ: 21,0-41,2), в возрастной категории ³50 лет - только 18,99 мес. (95% ДИ: 16,0-21,0; p=0,014). При глиомах 4 степени злокачественности в возрастной группе ³50 лет для режима фракционирования 3 Гр медиана общей выживаемости составила 21,32 мес. (n=47; 95% ДИ: 12,1-30,6), для режима 2 Гр - 16,29 мес. (n=47; 95% ДИ: 12,3-20,3; p=0,037). При глиобластоме статистических различий между двумя программами лучевой терапии нет: медианы 20,0 и 16,4 мес. соответственно (p=0,118). При гипофракционном режиме умерло 35 из 44 пациентов (79,5%), при стандартном фракционировании - 41 из 45 пациентов (91,1%). При глиомах 4 степени злокачественности в возрастной группе function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Глиобластома, степень злокачественности, лучевая терапия, гипофракционный режим, стандартное фракционирование, предписанная доза, суммарная доза, возраст, монофакторный анализ, многофакторный анализ, общая выживаемость, медиана выживаемости
Короткий адрес: https://sciup.org/170206289
IDR: 170206289 | УДК: 616.831-006.484-085.849.1 | DOI: 10.21870/0131-3878-2024-33-3-143-153
Текст научной статьи Выбор режима фракционирования при глиомах 4 степени злокачественности в зависимости от возраста пациентов
Широкое распространение для астроцитарных опухолей высокой степени злокачественности получила шкала RPA (Recursive Partitioning Analysis), созданная RTOG (Radiation Therapy Oncology Group) в трёх испытаниях с 1974 по 1989 гг. [1]. Её упрощённый вариант 2010 г., как и оригинал, построен на возрасте, функциональном состоянии [2]. Возраст в рамках до и после 50 лет стал базовым критерием и для версии EORTC/NCIC 2006 г. (European Organisation for Research and Treatment of Cancer; National Cancer Institute of Canada) [3]. С целью оценки общей выживаемости в зависимости от возраста в 2011 г. Siker M.L. и соавт. ретроспективно оценили результаты лечения по двум крупным базам данных (RTOG и NCDB (National Cancer Data Base)). Обзор RTOG включал 3136 пациентов с глиобластомой, медианы выживаемости в подгруппах 18-30 лет,
31-49 лет и ≥50 лет составили 21,0, 13,5 и 9,1 мес. соответственно (р<0,0001). Данные обзора NCDB с 37260 пациентами с глиобластомой привели к аналогичным результатам: медианы выживаемости – 18,0, 12,8 и 6,3 мес. соответственно (p<0,0001) [4].
В крупном исследовании EORTC изучена роль лучевой терапии (ЛТ) на фоне ежедневного приёма темозоломида (ТМЗ) в суточной дозе 75 мг/м2 с последующими курсами ТМЗ (до 6 курсов). Использовался фракционный вариант с дозой 2 Гр, подведённой за 30 фракций. Только ЛТ использована у 286 пациентов, у 287 – ТМЗ+ЛТ с последующим приёмом ТМЗ. Различия в выживаемости отмечены для всех возрастных групп: у пациентов моложе 50 лет 2- и 5-летняя выживаемость составила 14,8 против 34,7% и 4,9 против 17% в группах ЛТ и ТМЗ+ЛТ, для пациентов старше 50 лет – 9,1 против 23,5% и 0,7 против 6,4% соответственно [5].
В исследовании Российского научного центра рентгенорадиологии при глиомах 3-4 степени злокачественности отмечено, что в возрастных группах до 50 лет (n=179) и ≥50 лет (n=253) общая 2-летняя выживаемость составила 74,3% и 31,6%, общая 3-летняя выживаемость – 66% и 28,1% соответственно (p=0,00001) [6].
Ряд авторов считают неблагоприятными для общей выживаемости другие возрастные категории. В 2010 г. Helseth R. и соавт., проанализировав результаты лечения 516 пациентов с глиобластомой, пришли к выводу, что возраст >60 лет и отсутствие химиолучевой терапии с ТМЗ были негативными факторами риска [7]. В 2016 г. Verlut C. и соавт. по данным многомерного анализа 103 пациентов с глиобластомой, пролеченных по протоколу EORTC и NCIC, выделили возраст старше 65 лет как неблагоприятный предиктор выживаемости (HR=1,88; p=0,01) [8]. В исследовании 2022 г., основанном на стандартном лечении 490 пациентов с глиобластомой, показан рост коэффициентов отношения рисков (HR) летального исхода в возрастных категориях 50-59 лет – 1,70 (1,26-2,30), 60-69 лет – 3,53 (2,65-4,70), старше 70 лет – 4,82 (3,54-6,56) по сравнению с пациентами моложе 50 лет [9].
Целенаправленных работ, позволяющих выбрать оптимальный режим фракционирования в зависимости от возраста пациентов, в доступной литературе нам не встретилось. В данной работе рассматривается влияние фракционирования на общую выживаемость при глиомах 4 степени злокачественности в разных возрастных группах.
Материалы и методы
В отделе лучевой терапии Московского научно-исследовательского онкологического института им. П.А. Герцена при первичных опухолях (grade 4) поочерёдно использовалось фракционирование с предписанной дозой 2 и 3 Гр (исследование с привлечением стратегии попарного отбора). С марта 2015 г. по ноябрь 2021 г. был осуществлён набор больных в группы исследования. Средний срок наблюдения за пациентами составил 22,7 мес. В группе с режимом фракционирования 2 Гр минимальный срок наблюдения у живых на сегодняшний день пациентов составляет 50,3 мес., максимальный – 91,6 мес., при режиме фракционирования 3 Гр – 38,6 и 96,5 мес. соответственно. Всего 140 пациентов имели морфологически подтверждённую глиому 4 степени злокачественности, из них у 19 пациентов обнаружена IDH1 (Isocitrate Dehydrogenase) мутация (13,5%; астроцитома G4), у остальных диагностирована глиобластома (86,5%; G4 IDH1-). Обязательным условием включения в протокол исследования был высокий функциональный статус перед началом ЛТ (индекс Карновского (ИК) не менее 70%).
С предписанной дозой 2 и 3 Гр пролечено по 70 пациентов. У пациентов в возрасте моложе 50 лет поочередно использовалось фракционирование с предписанной дозой 2 и 3 Гр. Тот же подход использован и для старшей возрастной группы (≥50 лет). В итоге в группах с двумя режимами фракционирования было по 23 пациента моложе 50 лет и по 47 пациентов старше 50 лет соответственно.
Не выявлено различий между группами с двумя вариантами фракционирования по возрасту (p=0,61) и первичному функциональному статусу (p=1,0), быстрой ранней прогрессии (REP; p=1,0). Группы были практически однородны по степени резекции после микрохирургического вмешательства (p=0,27), применению ТМЗ на фоне ЛТ (p=0,48), адъювантному ТМЗ (p=0,049), терапии 2-й линии с бевацизумабом (p=0,25), IDH1 (исследован у 96,5%; p=0,83) и MGMT-статусу (исследован у 95,7%; p=0,59).
У всех пациентов обязательно определялся первичный объём опухоли при оконтуривании в планирующей системе. Также зафиксирован объём остаточной опухолевой массы по данным МРТ-исследований на 1-2 сут после микрохирургического вмешательства и перед началом ЛТ. Опухолевая ткань чаще оценивалась в режиме Т1 с контрастным усилением, реже по режимам Т2/FLAIR (при IDH мутантной глиоме).
У 54 пациентов (38,6%) в связи с низким функциональным статусом после микрохирургического вмешательства (ИК<70%) или невозможностью осуществить программу ЛТ в текущем году по календарным срокам было проведено от 1 до 6 курсов с ТМЗ до начала ЛТ (ранняя химиотерапия). При режиме с предписанной дозой 2 Гр – у 24 из 70 (34,3%), с дозой 3 Гр – у 30 из 70 (42,9%; p=0,301). После улучшения функционального состояния запланированная ЛТ была проведена в полном объёме (пациенты включены в протокол исследования). У остальных пациентов ЛТ на фоне ТМЗ начата в стандартные сроки с медианой 5,2 недели (5,0-5,8).
Лучевой этап осуществлялся только на линейных ускорителях с использованием у всех пациентов 3D-технологий (IMRT, IGRT) или VMAT. Планируемый объём облучения определялся как:
-
• GTV – в объём GTV обязательно включалась послеоперационная кистозная полость и контрастируемая опухолевая масса (если она была).
-
• CTV – включал в себя GTV с отступом плюс 2 см, зона отёка входила в границы CTV. Дополнительных отступов для формирования PTV не проводилось (CTV=PTV).
-
• Средняя доза была максимально приближена к предписанной. Для режима с предписанной дозой 2 Гр средняя доза составила 2,02 Гр (95% ДИ: 2,01-2,03). Для режима с предписанной дозой 3 Гр – 3,03 Гр (95% ДИ: 3,02-3,04).
-
• 90% от предписанной дозы (1,8 Гр для режима 2 Гр и 2,7 Гр для режима 3 Гр) должны покрывать более 95% CTV, в исследовании медиана покрытия составила 99,64% (95% ДИ: 99,5-99,9).
Суммарная доза. В группе с предписанной дозой 2 Гр (n=70) у 63 пациентов осуществлён запланированный объём (30-32 фракции; 90%). У остальных больных курс ЛТ не завершён по разным причинам (рост с резким функциональным ухудшением (n=3), нагноение кожного лоскута (n=2), эпиприступ с переводом в реанимационное отделение (n=1), разрыв аневризмы (n=1)). В группе с предписанной дозой 3 Гр (n=70) у 68 пациентов закончен полный курс ЛТ (18-19 фракции; 97,2%), не закончен – у 2 (сепсис, массивный тромбоз).
В программу лекарственного лечения 1 линии ТМЗ включён у 130 пациентов (92,9%), у 7 (5%) в связи с продолженным ростом на фоне его приёма ранее в качестве терапии 1 линии использован бевацизумаб, трое больных умерли в процессе ЛТ (2,1%: прогрессирование глиобластомы, разрыв аневризмы, сепсис на фоне цитопении 4 степени). Полностью запланированную программу лекарственного лечения ТМЗ (10-12 курсов) удалось осуществить у 31 пациента (22,1%), у остальных зафиксирован продолженный рост на фоне адъювантного ТМЗ по данным МРТ и реже ПЭТ-КТ.
В качестве терапии 2 линии после констатации первичного прогрессирования (n=128) бе-вацизумаб (+/- иринотекан/ломустин) применён у 104 из 140 пациентов (71,3%). У остальных терапия 2 линии не осуществлена по различным причинам (отсутствие первичного прогрессирования (12 пациентов, 8,6%) или из-за отказа онколога в продолжении специального лечения).
Изучение результатов выполняли с помощью пакета программ “IBM SPSS Statistics” (26 версия). Различия между кривыми Каплана-Мейера (монофакторный анализ) определяли с использованием лог-рангового критерия, прогностические факторы считались значимыми при p<0,05. Многофакторный анализ проводился с помощью модели пропорциональных рисков (регрессия Кокса). В данной модели Exp(B) отражает изменение отношения шансов (odds ratio, OR), значимость определяется при уровне p<0,05.
Результаты
Средний возраст пациентов в исследовании составил 53,4 года (19-75). В целом, летальный исход зафиксирован у 111 пациентов (79,3%), от прогрессирования глиомы скончалось 99 (70,7%).
У пациентов моложе 50 лет медиана общей выживаемости составила 31,11 мес. (95% ДИ: 20,4-41,8), в возрастной категории >50 лет - только 18,99 мес. (95% ДИ: 16,0-21,9; p=0,010).
При глиобластоме различия между возрастными группами теряют достоверность - медианы 21,22 и 18,99 мес. соответственно (p=0,258). В возрастной категории ≥50 лет умерло 77 из 89 пациентов (86,5%), у пациентов моложе 50 лет - 25 из 32 пациентов (78,1%).
Общая выживаемость в зависимости от режима фракционирования у пациентом старше 50 лет
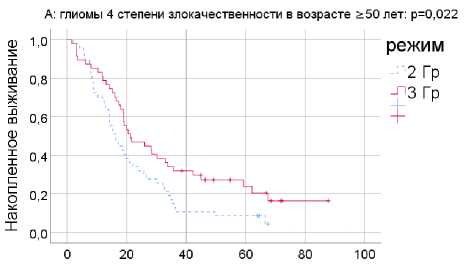
При глиомах 4 степени злокачественности в возрастной группе >50 лет для режима фракционирования 3 Гр медиана общей выживаемости составила 21,32 мес. (n=47; 95% ДИ: 12,1-30,6), для режима 2 Гр - 16,29 мес. (n=47; 95% ДИ: 12,3-20,3; p=0,022). Результаты представлены на рис. 1.
месяцы
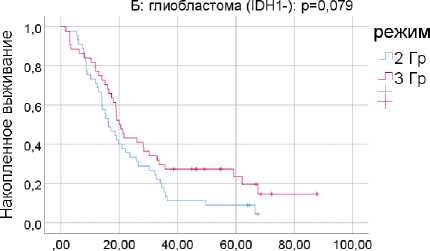
Рис. 1. Общая выживаемость для режимов фракционирования 3 и 2 Гр при глиомах 4 степени злокачественности (А) и при глиобластоме (Б) в возрастной категории >50 лет.
месяцы
При глиобластоме различия между двумя программами ЛТ близки к достоверным – медианы 20,0 и 16,4 мес. соответственно (p=0,079). При фракционировании с дозой 3 Гр умерло 35 из 44 пациентов (79,5%), при стандартном фракционировании – 42 из 45 пациентов (93,3%).
При IDH мутантной астроцитоме G4 статистических различий между двумя программами ЛТ нет – медианы 61,4 (не достигнута) и 25,8 мес. при режимах 3 и 2 Гр соответственно (p=0,096). При фракционировании с дозой 3 Гр умерло 4 из 10 пациентов (40%), при стандартном фракционировании – 6 из 9 пациентов (66,7%).
Для уточнения роли различных возрастных категорий на летальный исход при глиомах 4 степени злокачественности проведён дополнительный монофакторный анализ. Результаты представлены в табл. 1.
Таблица 1
Влияние различных возрастных категорий на медиану выживаемости для режимов фракционирования 3 и 2 Гр при глиомах 4 степени злокачественности у пациентов старше 40 лет
|
Возраст |
Число больных 2 / 3 Гр |
2 Гр (медиана в мес.) |
3 Гр (медиана в мес.) |
Значимость (p) |
|
≥ 40 лет |
60 / 60 |
17,87 |
21,65 |
0,023 |
|
≥ 45 лет |
54 / 58 |
16,36 |
22,34 |
0,010 |
|
≥ 50 лет |
47 / 47 |
16,29 |
21,32 |
0,022 |
|
≥ 55 лет |
37 / 39 |
16,36 |
20,01 |
0,039 |
|
≥ 60 лет |
21 / 25 |
16,29 |
20,01 |
0,132 |
|
≥ 65 лет |
12 / 14 |
15,24 |
18,82 |
0,180 |
|
≥ 70 лет |
4 / 4 |
11,89 |
30,26 |
0,007 |
Отчётливо прослеживается преимущество режима фракционирования с дозой 3 Гр в большинстве возрастных категорий, начиная с 40 лет. Лишь у пациентов старше 60 и 65 лет различия не достоверны, что, скорее всего, связано с малочисленностью данных групп, однако тенденция к улучшению показателей выживаемости прослеживается явно. Графики выживаемости представлены на рис. 2.
Особенно любопытны результаты в возрасте ≥70 лет (n=8; все пациенты без мутации IDH1, с ИК≥70 перед началом ЛТ и адъювантным ТМЗ в последующем). Летальный исход зафиксирован через 28,4, 30,3, 59,2 и 62,1 мес., при этом им была проведена ЛТ с дозой 3 Гр за 18 фракций. Эти данные свидетельствуют о возможности радикальных подходов при использовании ги-пофракционного режима у пожилых пациентов. Однако малое число наблюдений не позволяет утверждать об этом категорично.
Опухоль-специфическая выживаемость в зависимости от режима фракционирования у пациентов старше 50 лет. При глиомах 4 степени злокачественности в возрастной группе ≥50 лет для режима фракционирования 3 Гр медиана опухоль-специфической выживаемости составила 28,22 мес. (n=47; 95% ДИ: 18,0-38,5), для режима 2 Гр – 17,2 мес. (n=47; 95% ДИ: 12,5-21,9; p=0,008).
При глиобластоме различия между двумя программами ЛТ близки к достоверным – медианы 21,7 мес. при гипофракционном курсе (n=61) и 19,0 мес. при стандартном фракционировании (n=60; p=0,068).
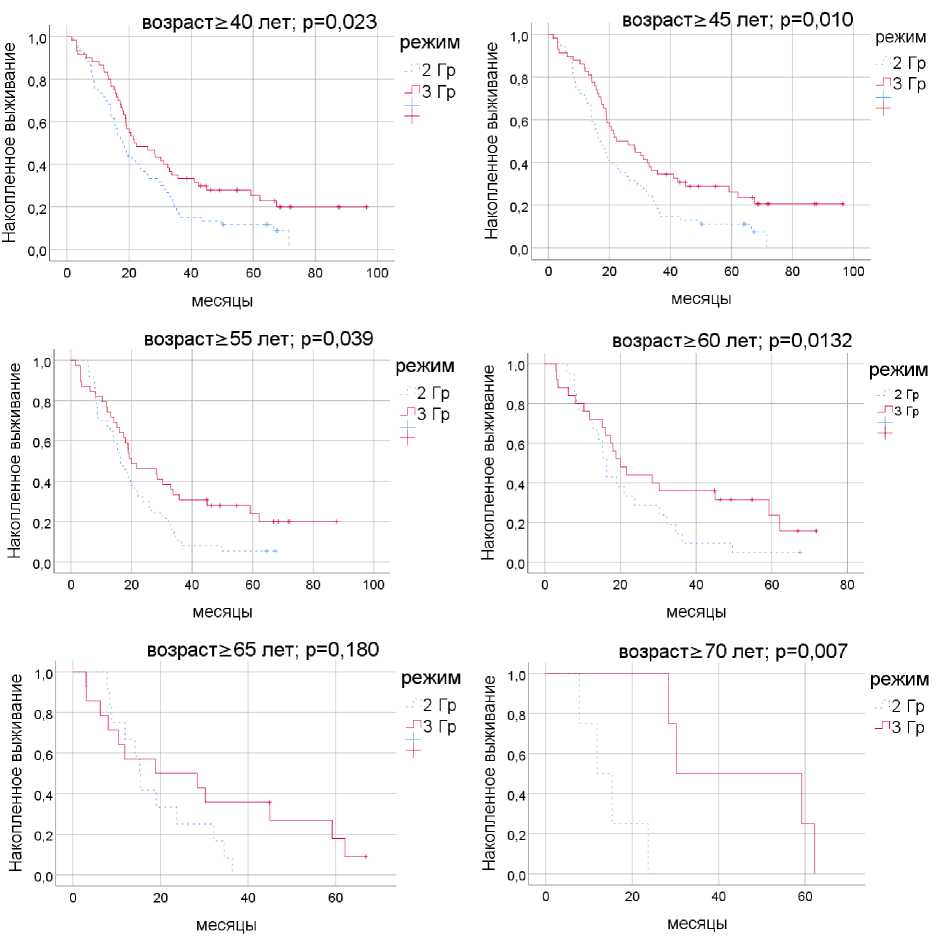
Рис. 2. Общая выживаемость для режимов фракционирования 3 и 2 Гр в разных возрастных группах.
Общая выживаемость в зависимости от режима фракционирования у молодых пациентов в возрасте моложе 50 лет
При глиомах 4 степени злокачественности в возрастной группе <50 лет для режима фракционирования 3 Гр медиана общей выживаемости составила 32,49 мес. (n=23; 95% ДИ: 7,1-57,9), для режима 2 Гр – 29,11 мес. (n=23; 95% ДИ: 17,6-40,6; p=0,717). Результаты представлены на рис. 3.
При глиобластоме статистических различий между двумя программами ЛТ нет – медианы 18,3 и 23,7 мес. соответственно (p=0,710). При фракционировании с дозой 3 Гр умерло 13 из 16 пациентов (81,2%), при стандартном фракционировании – 12 из 16 пациентов (75,0%).
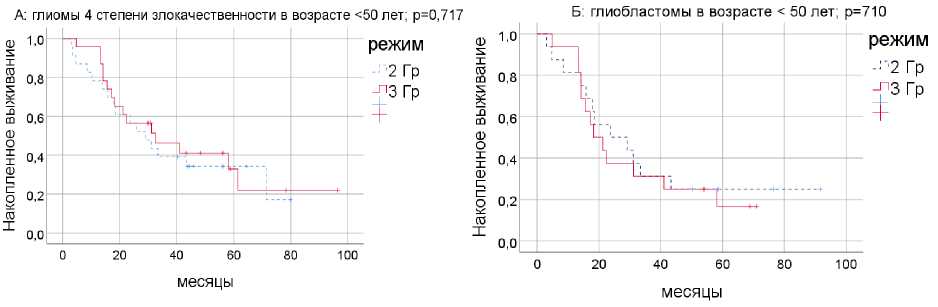
Рис. 3. Общая выживаемость для режимов фракционирования 3 и 2 Гр при глиомах 4 степени злокачественности (А) и при глиобластоме (Б) в возрастной категории <50 лет.
Для уточнения роли различных возрастных категорий на летальный исход при глиомах 4 степени злокачественности проведён дополнительный монофакторный анализ. Результаты представлены в табл. 2.
Преимуществ какого-либо режима фракционирования во всех возрастных категория для молодых пациентов не прослеживается.
Таблица 2
Влияние различных возрастных категорий на медиану выживаемости для режимов фракционирования 3 Гр и 2 Гр при глиомах 4 степени злокачественности у пациентов моложе 50 лет
|
Возраст |
Число больных 2 / 3 Гр |
2 Гр (медиана в мес.) |
3 Гр (медиана в мес.) |
Значимость (p) |
|
< 50 лет |
23 / 23 |
29,11 |
32,49 |
0,717 |
|
< 45 лет |
16 / 12 |
25,86 |
21,22 |
0,936 |
|
< 40 лет |
10 / 10 |
25,86 |
58,15 |
0,853 |
Опухоль-специфическая выживаемость в зависимости от режима фракционирования у пациентов моложе 50 лет. При глиомах 4 степени злокачественности в возрастной группе <50 лет для режима фракционирования 3 Гр медиана опухоль-специфической выживаемости составила 41,01 мес. (n=23; 95% ДИ: 7,1-74,9), для режима 2 Гр – 29,11 мес. (n=23; 95% ДИ: 17,6-40,6; p=0,351).
Обсуждение
Половина всех пациентов на момент верификации диагноза старше 65 лет, медиана выживаемости для пожилых пациентов с глиобластомой составляет менее 6 мес. Лучевую терапию до 60 Гр с параллельным и адъювантным применением ТМЗ следует рассматривать у пациентов в возрасте 65-70 лет с высоким функциональным статусом [10].
Учитывая баланс между короткой выживаемостью и качеством жизни, оптимальное ведение пациентов пожилого возраста с глиобластомой должно осуществляться индивидуально в соответствии с возрастом и функциональным статусом [10]. Рекомендации NCCN (National Comprehensive Cancer Network) для лиц старше 70 лет по использованию гипофракционных режимов (34 Гр за десять фракций или 40 Гр за 10 фракций), равноценных по показателям выживаемости со стандартным вариантом фракционирования (СОД 60 Гр), построены на двух работах III фазы [11, 12].
В последние годы всё больше публикаций о том, что пожилые пациенты с хорошим пред-и послеоперационным клиническим состоянием имеют не худшие результаты, чем молодые пациенты, если лечение проводится в соответствии со стандартами [13]. Огромное расхождение в прогнозах между молодыми и пожилыми пациентами с глиобластомой в значительной степени обусловлено выбором лечения, поскольку пожилым пациентам обычно назначали нестандартные схемы. Послеоперационная стандартная радио- и химиотерапия даёт значительные преимущества пациентам с глиобластомой всех возрастов [14].
В данном исследовании показано, что у пациентов старше 50 лет для глиом 4 степени злокачественности режим фракционирования с предписанной дозой 3 Гр имеет достоверные преимущества по сравнению со стандартной программой ЛТ. Более агрессивный режим ЛТ можно применять и в возрастном интервале старше 70 лет при хорошем функциональном состоянии пациента. При глиобластоме различия в выживаемости теряют свою достоверность, однако тенденция к улучшению показателей выживаемости для гипофракционного режима остаётся достаточно значимой.
У пациентов молодого возраста более жёсткие подходы с увеличением разовой дозы не приводят к улучшению результатов лечения. Режим фракционирования с дозой 2 Гр следует признать оптимальным при проведении ЛТ. Гипофракционный режим можно использовать при необходимости укорочения сроков лечения. Дальнейшее изучение вариантов фракционирования у этих пациентов не представляется перспективным.
Заключение
Выбор оптимального режима фракционирования в зависимости от возраста легко применим в клинической практике, поскольку оценить данный предиктор не составляет труда. Представленные в статье данные свидетельствуют о возможности использования гипофракционных режимов радиотерапии при глиомах 4 степени злокачественности. Лучевая терапия должна проводиться с достаточно высоким уровнем доз, а не по паллиативным программам, на которых построены рекомендации NCCN и RUSSCO 2022 г. для лиц с низким функциональным статусом и пожилых пациентов [11, 12, 15].
Список литературы Выбор режима фракционирования при глиомах 4 степени злокачественности в зависимости от возраста пациентов
- Curran W.J.Jr., Scott C.B., Horton J., Nelson J.S., Weinstein A.S., Fischbach A.J., Chang C.H., Rotman M., Asbell S.O., Krisch R.E., Nelson D.F. Recursive partitioning analysis of prognostic factors in three Radiation Therapy Oncology Group malignant glioma trials //J. Natl. Cancer Inst.1993. V. 85, N 9, P. 704-710.
- Li J., Wang M., Won M., Shaw E.G., Coughlin C., Curran W.J., Mehta M.P. Validation and simplification of the Radiation Therapy Oncology Group recursive partitioning analysis classification for glioblastoma //Int. J. Radiat. Oncol. Biol. Phys. 2011. V. 81, N 3, P. 623-630.
- Mirmanoff R.O., Gorlia T., Mason W., Van den Bent M.J., Kortmann R.-D., Fisher B., Reni M., Brandes A.A., Curschmann J., Villa S., Cairncross G., Allgeier A., Lacombe D., Stupp R. Radiotherapy and te-mozolomide for newly diagnosed glioblastoma: recursive partitioning analysis of the EORTC 26981/22981-NCIC CE3 phase III randomized trial //J. Clin. Oncol. 2006. V. 24, N 6. P. 2563-2569.
- Siker M.L., Wang M., Porter K., Nelson D.F., Curran W.J., Michalski J.M., Souhami L., Chakravarti A., Yung W.K.A., Delrowe J., Coughlin C.T., Mehta M.P. Age as an independent prognostic factor in patients with glioblastoma: a Radiation Therapy Oncology Group and American College of Surgeons National Cancer Data Base comparison //J. Neurooncol. 2011. V. 104, N 1. P. 351-356.
- Stupp R., Hegi M.E., Mason W.P., Bent M.J., Taphoorn M.J.B., Janzer R.C., Ludwin S.K., Allgeier A., Fisher B., Belanger K., Hau P., Brandes A.A., Gijtenbeek J., Marosi C., Vecht C.J., Mokhtari K., Wes-seling P., Villa S., Eisenhauer E., Gorlia T., Weller M., Lacombe D., Cairncross J.G., Mirimanoff R.-O. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial //Lancet Oncol. 2009. V. 10, N 5. P. 459-466.
- Измайлов Т.Р., Паньшин Г.А., Даценко П.В., Зотов В.К. Роль классификации RPA при лечении глиом высокой степени злокачественности //Вопросы онкологии. 2012. Т. 58, № 4. С. 521-526.
- Helseth E., Johannesen T.B., Langberg C.W., Lote K., Rønning P., Scheie D., Vik A., Meling T.R. Overall survival, prognostic factors, and repeated surgery in a consecutive series of 516 patients with glioblastoma multiforme //Acta Neurol. Scand. 2010. V. 122, N 3. P. 159-1567.
- Verlut C., Mouillet G., Magnin E., Buffet-Miny J., Viennet G., Cattin F., Billon-Grand N.C., Bonnet E., Servagi-Vernat S., Godard J., Billon-Grand R., Petit A., Moulin T., Cals L., Pivot X., Curtit E. Age, neu-rological status MRC scale, and postoperative morbidity are prognostic factors in patients with glioblastoma treated by chemoradiotherapy //Clin. Med. Insights. Oncol. 2016. V. 10. P. 77-82.
- Brown N.F., Ottaviani D., Tazare J., Gregson J., Kitchen N., Brandner S., Fersht N., Mulholland P. Sur-vival outcomes and prognostic factors in glioblastoma //Cancers (Basel). 2022. V. 14, N 13. P. 3161. DOI: 10.3390/cancers14133161.
- Arvold N.D., Reardon D.A. Treatment options and outcomes for glioblastoma in the elderly patient //Clin. Interv. Aging. 2014. V. 9. P. 357-367.
- Roa W., Brasher P.M.A., Bauman G., Anthes M., Bruera E., Chan A., Fisher B., Fulton D., Gulavita S., Hao C., Husain S., Murtha A., Petruk K., Stewart D., Tai P., Urtasun R., Cairncross J.G., Forsyth P. Abbreviated course of radiation therapy in older patients with glioblastoma multiforme: a prospective random-ized clinical trial //J. Clin. Oncol. 2004. V. 22, N 9, P. 1583-1588.
- Malmström A., Grønberg B.H., Marosi C., Stupp R., Frappaz D., Schultz H., Abacioglu U., Tavelin B., Lhermitte B., Hegi M.E., Rosell J. Temozolomide versus standard 6-week radiotherapy versus hypofraction-ated radiotherapy in patients older than 60 years with glioblastoma: the Nordic randomised, phase 3 trial //Lancet Oncol. 2012. V. 13, N 9. P. 916-926.
- Berger K., Turowski B., Felsberg J., Malzkorn B., Reifenberger G., Steiger H.-J., Budach W., Hauss-mann J., Knipps J., Rapp M., Hänggi D., Sabel M., Mijderwijk H.-J., Kamp M.A. Age-stratified clinical performance and survival of patients with IDH-wildtype glioblastoma homogeneously treated by radiotherapy with concomitant and maintenance temozolomide //J. Cancer Res. Clin. Oncol. 2021. V. 147, N 1. P. 253-262.
- Li G., Zhai Y., Wang Z., Wang Z., Huang R., Jiang H., Li R., Feng Y., Chang Y., Jiang T., Zhang W. Postoperative standard chemoradiotherapy benefits primary glioblastoma patients of all ages //Cancer Med. 2020. V. 9, N 6. P. 1955-1965.
- Улитин А.Ю., Желудкова О.Г., Иванов П.И., Кобяков Г.Л., Мацко М.В., Насхлеташвили Д.Р., Проценко С.А., Рыжова М.В. Практические рекомендации по лекарственному лечению первичных опухолей центральной нервной системы //Злокачественные опухоли: Практические рекомендации RUSSCO #3s2. 2022. Т. 12. С. 113-140.


