Выделение группы риска прогрессирования / рецидива у больных со спонтанным тромбозом глубоких вен нижних конечностей на терапии варфарином
Автор: Сошитова Н.П., Верхоломова Ф.Ю., Манукян И.Г., Крылов А.Ю., Шулутко А.М., Атауллаханов Ф.И., Серебрийский И.И.
Журнал: Московский хирургический журнал @mossj
Рубрика: Клинические исследования
Статья в выпуске: 5 (33), 2013 года.
Бесплатный доступ
Медицинский университет им. И. М.Сеченова После первого эпизода идиопатического тромбоза глубоких вен (ТГВ) риск развития рецидива в течение первых недель от начала проведения антикоагулянтной терапии может достигать 16%. Важной задачей является выявление больных из группы риска рецидива/прогрессирования тромбоза. В этой работе мы исследовали состояние свертывающей системы крови у 34 больных с идиопатическим ТГВ в течение первых 14 дней проведения антикоагулянтной терапии. Больные получали НФГ (с 1 по10 сутки) и варфарин (с 7 по 14 сутки) в фиксированных дозах. Эффект терапии варфарином оценивался с помощью МНО и теста тромбодинамики. На 13-й день терапии у части пациентов было выявлено отсутствие эффекта антикоагулянтной терапии, доля таких пациентов по данным МНО и теста тромбодинамики составила 24% и 44% соответственно. У части больных регистрировалась реализация отсутствия эффекта антикоагулянта в виде повышенного образования фибриновых сгустков, что привело к резкому повышению уровня D-димера - на 200-1600мкг/л у 21% больных. Значения МНО в группе с повышенным (>400мкг/л) и не повышенным (
Тромбоз глубоких вен, тест тромбодинамика
Короткий адрес: https://sciup.org/142211110
IDR: 142211110 | УДК: 616.005.6
Текст научной статьи Выделение группы риска прогрессирования / рецидива у больных со спонтанным тромбозом глубоких вен нижних конечностей на терапии варфарином
У пациентов после первого эпизода идиопатического тромбоза глубоких вен нижних конечностей (ТГВ) высок риск развития рецидива этого заболевания. Частота рецидивов максимальна в течение первых двух лет после первого эпизода тромбоза, со временем она постепенно уменьшается [1], но никогда не становится нулевой. Для профилактики прогрессирования/рецидива ТГВ пациентам проводится продленная терапия антикоагулянтными препаратами, и чаще всего для этого применяются антагонисты витамина К (АВК), например варфарин.
Несмотря на проведение подобного лечения, риск развития рецидива непосредственно на фоне терапии АВК, по данным различных источников, составляет от 4,5 до 16% в год [2–4], при этом он наиболее высок в течение первых 2–3 недель от начала терапии [3]. После прекращения терапии АВК риск развития рецидива вновь резко возрастает и достигает максимума в течение первых 6 месяцев, после чего постепенно снижается. Частота повторных тромбозов после отмены терапии может составлять до 20% в год [5].
Повышенный риск развития повторного тромбоза на фоне терапии антикоагулянтами чаще всего связывают с недостаточным эффектом терапии. У пациентов с МНО в диапазоне 1–2 риск развития рецидива, по данным различных исследователей, в 2,3–4,5 раза выше, чем у пациентов с МНО в целевом диапазоне 2–3 [6–7]. Однако не все случаи повторных тромбозов на терапии объясняются неадекватностью терапии, т.к. у пациентов с МНО в целевом диапазоне 2–3 также существует риск развития рецидива, который может достигать 7% в течение года [4]. В связи с вышесказанным, важной задачей является выделение среди больных с ТГВ группы риска развития повторного тромбоза. Одним из возможных вариантов выявления этой группы больных является использование лабораторных тестов оценки состояния гемостаза. Так, например, известно, что уровень D-димера, превышающий границу 250–500 мкг/л, является маркером повышенного риска развития рецидивов у больных с идиопатическим ТГВ после прекращения терапии – у таких больных риск повторного тромбоза в среднем в 2,6 раза выше, чем у больных с нормальным уровнем D-димера [8]. Существует ряд данных, свидетельствующих о наличии той же тенденции на фоне проведения антикоагулянтной терапии [9, 10].
Использование глобальных тестов свертывающей системы крови для выделения группы риска рецидива ТГВ потенциально может быть перспективным направлением. В отличие от классических «локальных» тестов, таких как АЧТВ, протромбин и фибриноген, глобальные тесты могут оценивать одновременно состояние и внутреннего и внешнего путей свертывания, а также характеризовать влияние на них всей совокупности внешних факторов, и таким образом характеризовать итоговое равновесное состояние свертывающей системы. В последнее время были получены данные о том, что для выделения группы риска рецидива ТГВ может использоваться тест генерации тромбина [11]. Однако эти данные носят пока единичный характер, относятся только к предсказанию рецидивирования после отмены терапии и нуждаются в подтверждении.
Тест тромбодинамика – новый глобальный тест оценки состояния плазменного звена свертывающей системы крови, в основе которого заложены имитация поврежденной сосудистой стенки и регистрация роста фибринового сгустка в пространстве. Ранее было показано, что этот тест чувствителен как к проявлениям прокоагулянтных изменений – ДВС-синдром [12], состояние после операции [13, 14], гиперкоагуляция при онкологических заболеваниях [15], так и к гипокоагуляции – терапия нефракционированным и низкомолекулярными гепаринами, гемофилии А и В [12–14, 16, 17]. Таким образом, потенциально тест может быть использован для оценки состояния свертывающей системы крови у больных на фоне антикоагулянтной терапии.
Целью данной работы было изучение состояния плазменного гемостаза у больных с идиопатическим ТГВ в течение первых 2-х недель антикоагулянтной терапии после установления диагноза венозного тромбоза, для оценки возможности выявления группы риска и прогнозивания развития рецидива/прогрессирования тромбоза на фоне антикоагулянтной терапии с помощью лабораторных тестов.
Материалы и методы
Пациенты
Исследование проводилось на базе городской клинической больницы №61 ДЗ г. Москвы. Были включены 34 больных со спонтанным ТГВ, средний возраст 57±15 лет, М/Ж 21:13. Диагноз спонтанного тромбоза устанавливался после выполнения обследования, которое включало в себя гастроскопию, колоноскопию, УЗИ брюшной полости, рентгенографию органов грудной клетки, клинический анализ крови, измерение уровня мочевины, креатинина, АлАТ, АсАТ и ЛДГ для исключения больных со вторичным ТГВ на фоне новообразований и/или сопутствующих воспалительных заболеваний. Также в исследование не включались больные с посттравматическим ТГВ и ТГВ послеоперационного периода.
Всем больным проводилась стандартная антикоагулянтная терапия, которая включала введение нефракциониро-ванного гепарина (B. Braun, Германия) в дозе 130–150 ЕД на кг массы тела 3 раза/сутки с 1 по 5 день; гепарин в дозе 130–150 Ед/кг 3 раза/сутки и варфарин (Nycomed Danmark Asp, Дания) в дозе 5 мг однократно с 6 по 10 день; с 11 суток терапия гепарином прекращалась, а терапия варфарином продолжалась в прежних дозах без изменений до 14 сут. С 14 суток выполнялась коррекция дозы варфарина под контролем МНО.
Протокол исследования включал в себя следующие контрольные точки:
-
1 точка – 1 сутки, после поступления больного в стационар, до начала проведения антикоагулятной терапии);
-
2 точка – 3–4 сутки, 3–4 день терапии гепарином, непосредственно перед очередной инъекцией гепарина;
-
3 точка – 10 сутки, 10 день терапии гепарином, 3 день терапии варфарином, непосредственно перед инъекцией гепарина;
-
4 точка – 13 сутки, 7 день терапии варфарином, 3 дня после прекращения терапии гепарином.
Лабораторные исследования
Объем лабораторных исследований системы гемостаза в контрольных точках: фибриноген, АЧТВ, МНО, D-димер (реагенты Insrtumentation Laboratory, США), выполнялись на автоматическом коагулометре ACL 9000 (Instrumentation Laboratory, США); тест тромбодинамика выполнялся на «Регистраторе Тромбодинамики Т-2» (Гемакор, Россия).
Тест тромбодинамика – новый глобальный тест свертывающей системы крови. Он основан на видеорегистрации роста фибринового сгустка от имитированной поврежденной стенки сосуда (рис. 1). Имитация поврежденной стенки реализована в виде пластиковой поверхности с нанесенным на нее монослоем тканевого фактора. После соприкосновения поверхности, имитирующей повреждение, с плазмой пациента, запускается рост фибринового сгустка, оценка которого позволяет характеризовать коагуляционный потенциал – в реальном времени и масштабе идет съемка процесса роста сгустка, после чего программное обеспечение, путем обработки видеофильма, рассчитывает численные параметры этого процесса.
Рост фибринового сгустка от поверхности с тканевым фактором характеризуется двумя основными параметрами:
-
1. Tlag – время задержки старта роста сгустка, вычисляется как время, необходимое для начала образования первых слоев фибрина.
-
2. Vs – скорость роста сгустка, которая характеризует динамику изменения размера фибринового сгустка во времени. Скорость роста увеличивается при наличии прокоагулянтных изменений в плазме больного, а под действием антикоагулянтов, тормозящих процесс оразования сугстка, уменьшается.
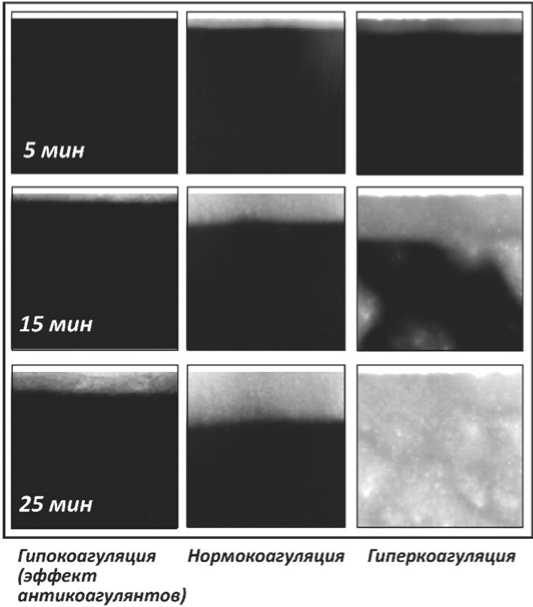
Рис. 1. Тест тромбодинамика.
Представлены снимки растущего от поверхности с иммобилизованным тканевым фактором (тонкая полоска сверху в верхнем ряду фотографий) фибринового сгустка (увеличивающаяся светлая область) на 5, 15 и 25 минутах теста. Приведены характерные примеры результатов теста у больного с гипокоагуляцией (эффект антикоагулянтной терапии, левый столбец фотографий), здорового добровольца (нормокоагуляция, средний столбец фотографий), и больного с гиперкоагуляцией (правый столбец фотографий)
Статистическая обработка результатов
Статистическая обработка данных проводилась в программе Statistica 10.0. Результаты представлены в виде значений медианы распределений, а также верхнего и нижнего квартилей Медиана (25%; 75%). Статистические сравнения данных проводились с помощью критериев Вилкоксона и Манна–Уитни в случаях сравнения парных и непарных наборов данных соответственно.
Результаты
Динамика показателей лабораторных тестов свертывания крови у больных с ТГВ на фоне терапии антикоагулянтами.
Данные состояния гемостаза у больных с ТГВ на терапии антикоагулянтами представлены в табл. 1
Концентрация фибриногена у большинства больных исходно была ближе к верхней границе референсного диапазона – 3,8 г/л, и достоверно не менялась в ходе наблюдения, что свидетельствует об относительно стабильном состоянии больных и отсутствии значимых воспалительных процессов, которые могли бы привести к повышению уровня этого вещества.
При поступлении в стационар медианы распределений тестов АЧТВ, МНО, Tlag и Vs теста тромбодинамики находились в границах соответствующих диапазонов референсных значений. Уровень D-димера был повышен до 828 мкг/л.
В ходе дальнейшего наблюдения динамика показателей лабораторных тестов свидетельствовала об относительно удовлетворительном эффекте проводимой антикоагулянтной терапии. Наличие антикоагулянтного эффекта гепарина подтверждалось статистически значимым увеличением АЧТВ до 37,1 сек., которое, хоть и не достигало 1,5–2 норм, однако, достоверно превышало границы референсных значений. Выраженный эффект гепарина также регистрировался в виде почти 3-кратного (до 8,0 мкм/мин) снижения скорости роста сгустка (Vs) теста тромбодинамика на 3 и 10 сутки гепаринотерапии.
Антикоагулянтный эффект варфарина регистрировался уже на 3 день терапии этим препаратом (точка 3), что подтверждалось статистически значимым увеличением медианы МНО до 1,7. К 7 суткам терапии варфарином (точка 4) еще значительнее увеличивалось МНО, медиана его значений даже превысила терапевтический диапазон 2–3 и составила 3,1, что потребовало уменьшения дозы варфарина у части больных, начиная с 14 суток. Несмотря на отмену гепарина, у больных в 4 точке продолжало оставаться удли-
Таблица 1
Показатели лабораторных тестов гемостаза у больных с ТГВ
|
Параметр (реф. диапазон) |
1 точка |
2 точка |
3 точка |
4 точка |
|
Фибриноген, (2–4) г/л |
3,8 (3,5; 4,7) |
3,9 (3,5; 4,4) |
4,1 (3,1; 4,8) |
3,8 (3,2; 4,7) |
|
АЧТВ, (25–33) сек. |
26,8 (24,2; 31,2) |
37,1(29,8;51,7)* |
36,5 (30,2; 46,0)* |
36,2 (31,9; 44,6)* |
|
МНО (0,8–1,2) |
1,0 (0,9; 1,1) |
1,0 (0,9; 1,0) |
1,7 (1,1;2,4)*,** |
3,1 (2,2; 4,5) *,**,*** |
|
D–димер, (0–250) мкг/л |
828 (517; 1102) |
499 (283; 649)* |
274 (97; 347)*,** |
219 (108; 313)*,** |
|
T lag, (0,5–1,8) мин. |
1,5 (0,9; 3) |
1,1 (0,9; 3) |
1,4 (1,0; 3,1) |
2,6 (1,8; 5,9) *,**,*** |
|
V, (20–30) мкм/мин |
25,2 (22,5; 27,8) |
8,0 (4,8; 10,3)* |
8,4 (4,2; 11,5)* |
18,2 (14,9;23,1)*,**,*** |
До начала терапии антикоагулянтами (1 точка), на 3–4 день терапии гепарином (2 точка), на 3й день терапии варфарином и 10й день терапии гепарином (3 точка), на 7 день терапии варфарином и 3 день после прекращения терапии гепарином (4 точка). Медиана (25%, 75%). *– достоверные различия с точкой 1, ** – с точкой 2, *** – с точкой 3.
ненным АЧТВ, что свидетельствовало о достаточно значимом ингибировании варфарином производства факторов II, IX и X, которые принадлежат к факторам внутреннего пути свертывания и могут влиять на такой тест, как АЧТВ, приводя к его удлинению. Тест тромбодинамика регистрировал эффект варфарина в виде статистически значимого увеличения время задержки старта роста сгустка Tlag, а также в виде сниженных по сравнению с референсным диапазоном значений скорости роста сгустка (Vs). Монотерапия варфа-рином приводила к менее выраженному ингибированию скорости роста сгустка, чем монотерапия гепарином и сочетанная терапия гепарин + варфарин (табл. 1).
Уровень D-димера, значительно повышенный исходно (максимально до 3440 мкг/л, медиана 828 мкг/л), на момент диагностики ТГВ, в дальнейшем демонстрировал постоянную достоверную тенденцию к снижению вплоть до значений внутри референсного диапазона к 13 дню терапии (4 точка).
Таким образом, можно утверждать, что антикоагулянтная терапия в среднем по группе была эффективной, и у больных на фоне регистрируемого эффекта антикоагулянтных препаратов (удлинение АЧТВ, увеличение МНО, снижение скорости роста сгустка) постепенно завершался процесса лизиса тромба, и не образовывались новые фибриновые отложения (снижение уровня D-димера до нормальных значений).
Больные с увеличенным риском развития рецидива тромбоза.
Несмотря на то, что при анализе всей группы больных в среднем регистрировался выраженный эффект проводимой терапии и завершался процесс лизиса старого тромба, из общей тенденции выделялись больные, у которых по данным тестов регистрировалось отсутствие эффекта антикоагулянтных препаратов, а также на фоне терапии появлялись данные о формировании новых фибриновых сгустков.
При среднем увеличении МНО к 7 дню варфариноте-рапии до 3,1, у 8 из 34 больных (24%) в 4-й точке значение
МНО было ниже 2, т.е. согласно данным этого теста эффект антикоагулянта у этой подгруппы больных был неудовлетворительным, и, следовательно, у них был повышен риск развития рецидива ТГВ.
Данные теста тромбодинамики также выявили отсутствие эффекта антикоагулянта у части больных через 7 дней от начала приема варфарина. Скорость роста сгустка регистрировала отсутствие эффекта (нормальная или даже повышенная скорость вместо пониженной) у 15 больных (44%), а время задержки роста сгустка было в диапазоне референсных значений (а не удлинено) у 9 больных (26%).
Как было показано выше, у большей части больных на фоне терапии антикоагулянтами уровень уровень D-димера снижался до референсных значений. Однако у 7 из 34 больных (21%) в точке 4, несмотря на нарастание эффекта варфарина по данным МНО, был зарегистрирован резкий подъем уровня D-димера в плазме более чем на 200–1500 мкг/л, в результате чего уровень D-димера у этих больных превысил границу 400 мкг/л. Эти данные свидетельствовали о произошедшем в организме больных формировании новых фибриновых отложений и, следовательно, об имевшем место недостаточном эффекте антикоагулянтной терапии и повышенном риске развития рецидива/прогрессирования тромбоза.
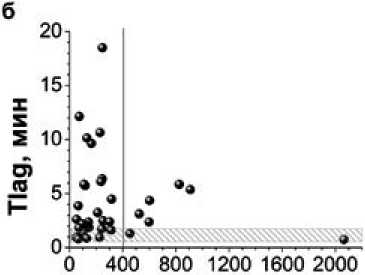
На рис. 2а приведена корреляция МНО и уровня D-димера в плазме на 7-й день терапии варфарином. Можно видеть, что из 7 больных с увеличенным уровнем D-димера у 3 больных не увеличено МНО (<2), что подтверждает отсутствие эффекта варфарина у этих больных. У остальных 4 больных МНО находится в целевом диапазоне и даже превышает его, т.е. по данным МНО терапия была достаточно эффективна. Таким образом, используя тест МНО как критерий эффективности варфаринотерапии, удается прогнозировать отсутсвие эффекта у 3-х из 7 больных, демонстрирующих повышенное фибринообразование.
Время задержки роста сгустка (Tlag) в тесте тромбоди-намика (рис. 2б) на 7 день приема варфарина было удлине- а
е
ө
400 800 ' 1200 1600'2000
D-димер, мкг/л
в
60ч
D-димер, мкг/л

0 400 800 1200 1600 2000
D-димер. мкг/л
Рис. 2. Корреляции МНО и параметров теста тромбодинамика Tlag и V с уровнем D-димера.
Представлены значения тестов в 4й точке (7 день терапии варфарином). Красным прямоугольником показан терапевтический диапазон для МНО. Серыми прямоугольниками обозначены референсные значения для параметров время задержки старта роста сгустка (Tlag) и скорость роста сгустка (V)
но у 5 из 7 больных с повышенными D-димерами, то есть в противоположность уровню D-димера, регистрировало достаточную эффективность терапии у большей части из этих больных. У оставшихся 2 пациентов Tlag было в пределах референсных значений, подтверждая отсутствие эффекта варфарина. Следовательно, этот параметр смог зарегистрировать повышенный риск образования новых фибриновых масс лишь у 2 из 7 больных этой группы.
На рис. 2в приведена корреляция скорости роста сгустка и уровня D-димера на 7 день варфаринотерапии. У всех пациентов, где был зафиксирован резкий подъем уровня D-димера, регистрировались увеличенные до диапазона референсных значений показатели скорости роста сгустка (у одного пациента скорость роста сгустка находилась в диапазоне субнормальных значений (18,5) при нижней границе нормы 20 мкм/мин). В то же время у тех больных, где ско- рость роста сгустка осталась в области гипокоагуляции (ниже референсных значений) после перехода на монотерапию варфарином, не было зафиксировано ни одного случая значимого повышения уровня D-димера.
На рис. 3 приведены индивидуальные зависимости D-димера (рис. 3а), МНО (рис. 3б) и скорости роста сгустка (Vs) (рис. 3в) от времени для 7 больных, которые продемонстрировали резкое повышение уровня D-димера на терапии варфарином. Эти графики наглядно иллюстрируют тот факт, что у 6 из 7 больных, лечение которых сопровождалось значимым повышением уровня D-димера (выше 400 мкг/л), скорость роста сгустка (Vs) после отмены гепарина и перехода на монотерапию вар-фарином вернулась в диапазон референсных значений, превысив нижнюю границу нормы, указывая на отсутствие эффекта антикоагулянта. У больного под номером 3 скачек скорости роста сгустка до нормальных значений (20,5 мкм/мин) произошел еще во время сочетанной терапии варфарином и гепарином (3 точка), после чего демонстрировал незначительные колебания в 4 точке до 18,5 мкм/мин. В этой же группе МНО демонстрировало отсутствие эффекта варфарина в виде не достижения целевого диапазона 2–3 только у 3 из 7 больных. У остальных 4 больных значения МНО были либо в целевом диапазоне, либо даже превышали его. Причем у 2-х из этих 4-х больных удовлетворительный эффект антикоагулянта (МНО≥1,9) регистрировался уже 3 днями ранее (на 3 день приема вар-фарина, 3 точка).
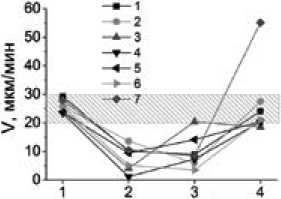
Полученные выводы подтверждаются данными статистического анализа. На рис. 4 приведено сравнение значений скорости роста сгустка (Vs) (рис. 4а) и МНО (рис. 4б) в группе с повышенным риском развития повторных тромбозов (подтвержденным увеличенным уровнем D-димера, выше 400 мкг/л) и у остальных больных. Значения скорости превышают нижнюю границу референсного диапазона – 21 (20; 28) мкм/мин и статистически значимо (p=0,03) выше в
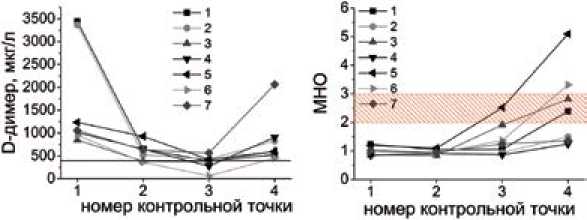
Рис. 3. Динамика параметров свертывания у 7 больных с резким повышением уровня D-димера во время проведения антикоагулянтной терапии. Номера контрольных точек – комментарий см. в тексте. Красным прямоугольником показан терапевтический диапазон для МНО, серым прямоугольником обозначен референсный диапазон скорости роста сгустка (Vs)
номер контрольной точки
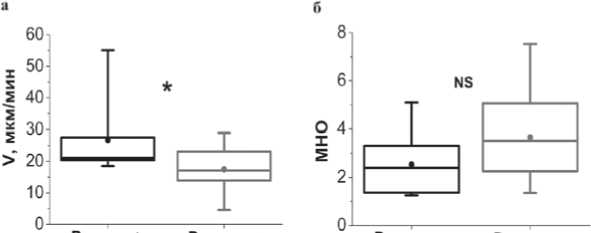
Рис. 4. Сравнение скоростей роста сгустка и МНО в группах с повышенным (>400 мкг/л) и не повышенным (<400 мкг/л) уровнями D-димера у больных со спонтанным ТГВ на 7 день терапии варфарином. Точка в центре – среднее, полоса внутри прямоугольника – медиана, верхняя и нижняя границы прямоугольника - 25% и 75% квартили, соответственно, т - минимальное и максимальное значения. * – p<0,05, NS – различия недостоверны
О-димер> О-димер<
400 мкг/л 400 нг/мл
О-димер> О-димер<
400 мкг/л 400 нг/мл
группе с повышенным уровнем D-димера, чем в группе, где такового повышения не наблюдалось, и где значения скорости остались ниже референсного диапазона – 17 (14; 23) мкм/ мин.
МНО в группах с повышенным выше 400 мкг/л уровнем D-димера – 2,4 (1,4; 3,3) и без такового – 3,5 (2,3; 5,1), статистически значимо не различались (р=0,1).
Обсуждение
Значения лабораторных тестов свертывающей системы крови в исследуемой группе больных на момент поступления в стационар, до начала терапии, находились в пределах референсных значений. Исключение составлял уровень D-димера, повышенный за счет активного процесса лизиса первичного тромба.
Во время терапии антикоагулянтами у группы больных ТГВ регистрировался удовлетворительный противосвертывающий эффект препаратов как по данным стандартных коагулологических тестов (удлинение АЧТВ, увеличение МНО), так и по данным нового глобального теста тромбо-динамика (снижение скорости роста сгустка, увеличение времени задержки старта роста сгустка). Одновременное постепенное снижение уровня D-димера до нормальных значений свидетельствовало о завершении процесса лизиса тромба и прекращении формирования новых фибриновых отложений. Таким образом, проводимая терапия в среднем по группе была успешной и приводила к ожидаемому эффекту.
Однако на фоне терапии варфарином из общей группы выделялись больные, у которых по данным лабораторных тестов (МНО, тромбодинамика) регистрировалось отсутствие эффекта антикоагулянтных препаратов, Недостаточный уровень ингибирования свертывания антикоагулянтными препаратами является одной из основных причин повышенного риска рецидива на терапии. Доля пациентов из исследуемой группы с отсутствием эффекта антикоагулянтной терапии варфарином через 7 дней от начала приема препарата по данным МНО и теста тромбодина-мика составила 24% и 44%, соответственно, т.о. на основании даных обоих тестов значимое количество пациентов можно было отнести к группе риска прогрессирования/ рецидивирования ТГВ.
У части больных были получены данные о формировании новых фибриновых сгустков – регистрировалось повышение уровня D-димера, и доля таких больных составила 21% от общего числа, получавших лечение. Повышенные значения D-димера постфактум свидетельствуют о предшествующем периоде неэффективной терапии, который в результате привел к увеличенному количеству образующегося фибрина. Однако этот тест выявляет не всю группу пациентов с недостаточным эффектом антикоагулянта, а только ту ее часть, у которой отсутствие эффекта терапии уже начало приводить к образованию фибриновых сгустков. Поэтому выделение группы риска рецидива ТГВ только по данным этого теста не может считаться максимально полным, но D-димер может быть использован в качестве проверочного теста для подтверждения недостаточного антикоагулянтного эффекта в группе с уже начавшимся микротромбированием.
Тесты МНО (широко используемый метод контроля терапии варфарином) и тромбодинамики, которые непосредственно регистрируют выраженность антикоагулянтного эффекта варфарина, могут применяться для выделения группы с отсутствием эффекта этого препарата и, как следствие – для выделения группы риска рецидива ТГВ. В работе была выполнена проверка чувствительности этих тестов в выявлении той части группы больных с отсутствием эффекта антикоагулянта, у которых уже началось повышенное образование фибрина. Для этого данные тестов МНО и тромбодинамики были сопоставлены с данными о повышении D-димера (рис. 2).
В нашем исследовании значения МНО в группе с повышенным (выше 400 мкг/л) и группе, где уровень D-димера не повысился, статистически не различались (рис. 4б) и находились в целевом диапазоне 2–3 и даже иногда превышали его. Это согласуется с данными других исследователей о том, что рецидивы тромбозов могут случаться у значимого числа больных (до 7%), имеющих МНО в целевом диапазоне [4].
Скорость роста сгустка была статистически значимо ниже в группе пациентов с уровнем D-димера, не претерпевшем повышения, чем в группе, где было зарегистрировано повышенине уровня D-димера (рис. 4а). Ни у одного из больных на терапии варфарином с пониженной скоростью роста сгустка в тесте тромбодинамика не наблюдалось повышения уровня D-димера.
Из 7 больных с повышенным уровнем D-димера МНО выявило неэффективность терапии у 3, время задержки роста сгустка – у 2, скорость роста сгустка – у 6 пациентов.
Были вычислены чувствительности тестов МНО, Tlag и Vs к выявлению группы риска рецидива ТГВ. В качестве критерия было использовано повышение D-димера, происходящее на терапии, если она была недостаточно эффективна. Чувствительность вычислялась как доля больных, у которых соответствующий тест выявил неэффективность терапии, из общего числа больных с повышенным уровнем D-димера. Чувствительность МНО в настоящем исследовании составила 43%, для скорости роста сгустка теста тромбодинамика (V) этот параметр составил 86%. Специфичность этих тестов (доля больных, у которых тест свидетельствовал об эффективности терапии, из общего числа больных без повышенного уровня D-димера) составила 81% и 63% соответственно. Чувствительность Tlag получилась наименьшей и составила всего 29%, специфичность – 74%.
Наибольшей чувствительностью для выявления группы риска рецидива ТГВ по полученным данным обладает скорость роста сгустка теста тромбодинамика. У 6 из 7 больных с повышенным уровнем D-димера на терапии варфарином она находилась в области референсных (20–30 мкм/мин) или даже повышенных значений, а у последнего из 7 – в области субнормальных значений (18,5 мкм/мин).
Открытым остается вопрос о целевом диапазоне значений скорости роста сгустка на терапии варфарином. В отсутствии этого диапазона мы взяли за границу между группами с эффективной и неэффективной терапией нижнюю границу референсного диапазона. Однако на самом деле эти границы могут не совпадать, и верхняя граница целевого диапазона в будущем может оказаться несколько ниже 20 мкм/мин. Уточнение границ целевого диапазона может в будущем улучшить чувствительность теста.
Таким образом, выявленная гипокоагуляция по данным скорости роста сгустка (Vs) в тесте тромбодинамика свидетельствует о низком риске недостаточной антикоагуляции, в то время как выявленная нормо- или гиперкоагуляция у пациентов на терапии варфарином, свидетельствующие об отсутствии эффекта антикоагулянта, являются маркером риска повышенного фибринообразования и, как следствие, высокого риска развития повторного тромбирования у таких больных. Приведенные данные подтверждают возможность использования теста тромбодинамика для выделения группы риска развития рецидива/прогрессирования венозного тромбоза при проведении терапии варфарином у больных со спонтанным ТГВ.
Список литературы Выделение группы риска прогрессирования / рецидива у больных со спонтанным тромбозом глубоких вен нижних конечностей на терапии варфарином
- Hass B., Pooley J., Harrington A.E., Clemens A., Feuring M. Treatment of venous thromboembolism effects of different therapeutic strategies on bleeding and recurrence rates and considerations for future anticoagulant management//Thromb J. 2012. Vol. 10. P. 24.
- Veeger N.J., Piersma-Wichers M., Tijssen J.G., Hillege H.L., van der M.J. Individual time within target range in patients treated with vitamin К antagonists: main determinant of quality of anticoagulation and predictor of clinical outcome. A retrospective study of 2300 consecutive patients with venous thromboembolism//Br. J. Haematol. 2005. Vol. 128. P. 513-519.
- Douketis J.D., Foster G.A., Crowther M.A., Prins M.H., Ginsberg J.S. Clinical risk factors and timing of recurrent venous thromboembolism during the initial 3 months of anticoagulant therapy//Arch. Intern. Med. 2000. Vol. 160. P. 3431-3436.
- Prandoni P., Lensing A.W., Piccioli A., Bernardi E., Simioni P., Girolami B., Marchiori A., Sabbion P., Prins M.H., Noventa F., Girolami A. Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis//Blood. 2002. Vol. 100. P. 3484-3488.
- Kearon C., Gent M., Hirsh J., Weitz J., Kovacs M.J., Anderson D.R., Turpie A.G., Green D., Ginsberg J.S., Wells P., MacKinnon B., Julian J.A. A comparison of three months of anticoagulation with extended anticoagulation for a first episode of idiopathic venous thromboembolism//N Engl. J. Med. 1999. Vol. 340. P. 901-907.
- Hutten B.A., Prins M.H., Gent M., Ginsberg J., Tijssen J.G., Buller H.R. Incidence of recurrent thromboembolic and bleeding complications among patients with venous thromboembolism in relation to both malignancy and achieved international normalized ratio: a retrospective analysis//J. Clin. Oncol. 2000.Vol. 18. P. 30783083.
- Kearon C., Ginsberg J.S., Kovacs M.J., Anderson D.R., Wells P., Julian J.A., MacKinnon B., Weitz J.I., Crowther M.A., Dolan S., Turpie A.G., Geerts W., Solymoss S., van N.P., Demers C., Kahn S.R., Kassis J., Rodger M., Hambleton J., Gent M. Comparison of low-intensity warfarin therapy with conventional-intensity warfarin therapy for long-term prevention of recurrent venous thromboembolism//N Engl. J. Med. 2003. Vol. 349. P. 631-639.
- Douketis J., Tosetto A., Marcucci M., Baglin T., Cushman M., Eichinger S., Palareti G., Poli D., Tait R.C., Iorio A. Patient-level meta-analysis: effect of measurement timing, threshold, and patient age on ability of D-dimer testing to assess recurrence risk after unprovoked venous thromboembolism//Ann. Intern. Med. 2010. Vol. 153. P. 523-531.
- Palareti G., Cosmi B., Legnani C., Tosetto A., Brusi C., Iorio A., Pengo V., Ghirarduzzi A., Pattacini C., Testa S., Lensing A.W., Tripodi A. D-dimer testing to determine the duration of anticoagulation therapy//N Engl. J. Med. 2006. Vol. 355. P. 1780-1789.
- Shrivastava S., Ridker P.M., Glynn R.J., Goldhaber S.Z., Moll S., Bounameaux H., Bauer K.A., Kessler C.M., Cushman M. D-dimer, factor VIII coagulant activity, low-intensity warfarin and the risk of recurrent venous thromboembolism//J. Thromb. Haemost. 2006. Vol. 4. P. 1208-1214.
- Hron G., Kollars M., Binder B.R., Eichinger S., Kyrle P.A. Identification of patients at low risk for recurrent venous thromboembolism by measuring thrombin generation//JAMA. 2006. Vol.296. P. 397-402.
- Soshitova N.P., Karamzin S.S., Balandina A.N., Fadeeva O.A., Kretchetova A.V., Galstian G.M., Panteleev M.A., Ataullakhanov F.I. Predicting prothrombotic tendencies in sepsis using spatial clot growth dynamics//Blood Coagul. Fibrinolysis. 2012. Vol. 23. P. 498-507.
- Poletaev A., Balandina A., Rabotinskiy S., Orel E., Ataullakhanov F. and Shulutko E.A. Global hemostasis assays in laboratory monitoring of low molecular weight heparin treatment in patients after surgery//ISTH. 2013. Ref Type: Abstract. Journal of Thrombosis and Haemostasis. 2013. Т. 11. № SUPPL. 2. С. 706.
- Serebriyskiy I., Taranenko I., Vuimo T., Surov S., Ovsepyan R., Ataullakhanov F. and Momot A. Time-and space-resolved imaging of coagulation as a method for monitoring the effectiveness of LMWH therapy after total hip replacement//ISTH. 2013. Ref Type: Abstract.
- Gracheva M., Urnova E., Mendeleeva L., Sinauridze E., Balandina A., Tarandovskiy I., Vasiliev S., Parovichnikova E., Savchenko V. and Ataullakhanov F. Conventional and new global haemostasis laboratory test reveal hypercoagulation in primary multiple myeloma patients//ISTH. 2013. Ref Type: Abstract.
- Ovanesov M.V., Krasotkina J.V., Ul'yanova L.I., Abushinova K.V., Plyushch O.P., Domogatskii S.P., Vorob'ev A.I., Ataullakhanov F.I. Hemophilia A and B are associated with abnormal spatial dynamics of clot growth//Biochim. Biophys. Acta. 2002. Vol. 1572. P. 45-57.
- Polokhov D., Soshitova N., Balandina A., Orel E., Vasiliev S., Gnedova A.L., Ataullakhanov F. and Galstian G. Laboratory monitoring of unfractionated heparin therapy//ISTH. 2013. Ref Type: Abstract.


