Выделение и идентификация возбудителя некробактериоза крупного рогатого скота при помощи бактериологических исследований и – ПЦР диагностики
Автор: Макаев Х.Н., Фаизов Т.Х., Потехина Р.М., Каримова А.З., Мухамметшин Н.А.
Статья в выпуске: 3 т.211, 2012 года.
Бесплатный доступ
Исследовали биологические образцы в мегакомплексах и обычных фермах, где регистрировали массовое заболевание крупного рогатого скота с признаками поражения дистальной конечности при помощи бактериологических исследований и – ПЦР диагностики.
Некробактериоз, крупный рогатый скот
Короткий адрес: https://sciup.org/14287657
IDR: 14287657 | УДК: 619:616.98:579.852.13:636.2
Текст научной статьи Выделение и идентификация возбудителя некробактериоза крупного рогатого скота при помощи бактериологических исследований и – ПЦР диагностики
Некробактериоз – инфекционное заболевание, сопровождающееся гнойно- некротическими процессами в основном в области пальца, но могут поражаться также слизистая оболочка ротовой полости, половых органов и кожа вымени. Заболевание наблюдается как у млекопитающих и птиц, так и у пресмыкающихся. Заболевание чаще регистрируется ранней весной и поздней осенью.
У всех сельскохозяйственных животных при данном заболевании поражается кожа пальцевой части конечности на волярной (плантарной) стороне.
Первичным агентом в возникновении данного заболевания является Fusobacterium necrophorum – грамотрицательная, полиморфная, неподвижная палочка, растущая в строго анаэробных условиях, не образующая спор и капсул. Болезнь причиняет экономический ущерб из-за снижения многих показателей, в том числе молочной продуктивности на 25-40%, интенсивности роста на 20-30%. Наиболее распространенным способом диагностики некробактериоза крупного рогатого скота является, бактериологический: микроскопия мазка, посев на среды Кита-Тароцции и на другие питательные среды в аэробных условиях.. Но на сегодняшний день бактериологическое исследование не дает достаточно точных результатов, так как из очагов поражения можно выделить не только Fusobacterium necrophorum, обладающий вирулентностью, но и другие патогенные: стафилококки, микрококки, кишечная палочка, в тоже время, в рубце животных могут находится и атипичные формы которые не вызывают заболевание, но по морфологическим признакам очень похожи с вирулентными типами, такие как: Fusobacterium pseudonecrophorum. Вследствие этого точно установить диагноз некробактериоз за короткие сроки не представляется возможным, потому что для выделения возбудителя и идентификации Fusobacterium necrophorum уходит от 10-16 суток.
На сегодняшний день наиболее чувствительными и специфичными признаны методы, основанные на выявлении фрагментов генома возбудителя в биологическом материале с помощью полимеразой цепной реакции. Данный метод позволяет обнаруживать возбудитель при очень низких его концентрациях и сократить сроки диагностических исследований в 10-15 раз в сравнении с бактериологическими методами.
Целью наших исследований являлось в сравнительном аспекте провести исследования по выделению и идентификации возбудителя (Fusobacterium necrophorum) некробактериоза крупного рогатого скота при помощи бактериологических исследований и – ПЦР диагностики при массовом проявлении заболевания дистальной части конечностей.
Материалы и методы. Для исследования биологические образцы брали в обычных фермах и мегакомплексах Республики Мордовии, Татарстана, где регистрировали массовое заболевание крупного рогатого скота с признаками поражения дистальной части конечностей. Пробы отбирали по клиническим показателям: хромота, язвы между пальцами с серым налетом и с характерным неприятным запахом, свищи в копытном роге с гнойным истечением или без него.
Материал отбирали из пораженных участков, после удаления омертвевших некротизированных тканей на границе здоровой и пораженной ткани размером 2 см × 1 см готовили мазки отпечатки, окрашивали по Грамму и микроскопировали.
На основании результатов микроскопии выбирали пробы, где находили морфологически сходные с возбудителем некробактериоза, бактерии и из них осуществляли посевы в среду Китта-Тароцци.
Для проведения ПЦР пробы измельчали в ступке со стерильным кварцевым песком с добавлением МПБ из расчета 1:10.
Полученную суспензию использовали для постановки ПЦР- анализа и параллельно ставили биопробу на мышах и кроликах. Полученную суспензию вводили по 0,2; 0,4; 0,6. Суспензию вводили подкожно белым мышам в корень хвоста, а кроликам в область основания ушной раковины.
Для контроля специфичности полимеразой цепной реакции использовали референтные депонированные штаммы Fusobacterium necrophorum № «8ТS630501», «12TK630501», выделенных от крупного рогатого скота.
Выделение геномной ДНК возбудителя из биологических образцов проводили в 2- вариантах: в первом – депротеинизацию проводили с помощью протеиназы к (10мг/мл) с экстракцией смесью фенолхлороформа (1:1) и осажденным этанолом, во втором – для депротеинизации применяли 10% раствор СТАВ.
Определение последовательности и синтеза олигонуклеотидных праймеров приводили по алгоритму выравнивания последовательностей ДНК транспозонов в программах Alignment Service V.4.0 и GENCNER, а для анализа праймеров по уровню свободной энергии использовали программу OLIGO 4.0. Химический синтез специфических и произвольных праймеров был осуществлен амидофосфитным методом на автоматическом синтезаторе ASM-102U.
Постановку полимеразой цепной реакции осуществляли на амплификаторах «Терцик» (Россия).
О результатах реакции судили по размеру синтезированного фрагмента к ДНК, мигрирующего в 0,8%-м геле агарозы при силе тока 3540мА в течение 30-40 мин. Маркером служила ДНК pUC 18. гидролизированная эндонуклеазой AluI. Документирование полученных результатов проводили с помощью цифровой фотокамеры, секвертирование ампликонов- по двум цепочкам ДНК, используя общепринятые методики Маниатис Т., Фрич Э. и др.
Результаты исследований. После посева полученной суспензии на среду Китта-Тароцци через 24-48 часов регистрировали появление мути и хлопьевидного осадка на дне пробирки. При микроскопии мазков окрашенных по Грамму в пробах обнаруживали тонкие нити и клубочки, что характерно для Fusobacterium necrophorum. При подкожном введении белым мышам и кроликам суспензии бактерий выращенных в среде Китта-Тароцци на 4-6 сутки образовался воспалительный очаг с некрозом тканей. При посеве материала из очага воспаления на среду Китта-Тароцци получали чистую культуру Fusobacterium necrophorum.
ПЦР проводили на наличие гена лейкоцидина, возбудителя некробактериоза, диагностической ПЦР тест системой для индикации ДНК Fusobacterium necrophorum – производства «НИВИ Сибири и Дальнего Востока» согласно методике производства ПЦР тест системы.
ПЦР ставили в два этапа с наружными и гнездовыми праймерами, в формате. Для установки диагноза при помощи ПЦР потребовалось 6 часов.
Вероятность диагностирования составляет 98%.
Выделение ДНК осуществлялась набором «ДНК сорб производства ЦНИИ Эпидемиологии РФ, согласно инструкции производителя.
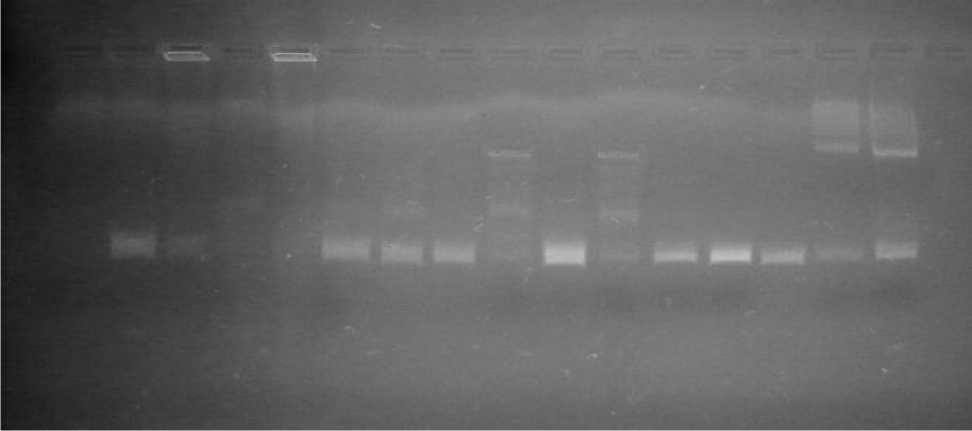
Анализ результатов проведенных исследований свидетельствует что в трэках 9 (проба №10), 11 (проба №12), 15 (шт. 8), 16 (шт. 12) наблюдается характерный паттерн. Это говорит о наличии в данных пробах ДНК возбудителя некробактериоза.
Результаты ПЦР- анализа проб патологического материала из Мордовии на наличие ДНК возбудителя некробактериоза
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Резюме
Исследовали биологические образцы в мегакомплексах и обычных фермах, где регистрировали массовое заболевание крупного рогатого скота с признаками поражения дистальной конечности при помощи бактериологических исследований и – ПЦР диагностики.
CATTLE NECROBACTERIOSIS PATHOGEN ISOLATION AND IDENTIFICATION USING BACTERIOLOGICAL STUDY AND PCR – DIAGNOSTICS
Makayev Kh.N., Fazilov T.Kh., Potekhina R.M., Karimova A.Z., Mukhametshin N.A.


