Выделение кислоты из отработанного травильного раствора методом диффузионного диализа с анионообменной мембраной
Автор: Козадерова О.А., Чернова В.Ю.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 3 (101) т.86, 2024 года.
Бесплатный доступ
При травлении стали образуются отходы - отработанные травильные растворы, содержащие свободные кислоты и соли металлов. Такие растворы необходимо перерабатывать или утилизировать. В статье показана возможность применения диализа для выделения соляной кислоты из такого раствора. Преимуществом этого мембранного метода являются компактность оборудования, возможность частичной регенерации компонентов сточной воды и организация замкнутого цикла потребления химических веществ на производстве, возможность комбинации с другими мембранными методами. Исследован процесс диффузионного диализа модельного раствора, содержащего соляную кислоту (1,5 моль/дм3) и хлорид железа (III) (0,25 моль/дм3). Эксперимент проведен в двухкамерном противоточном диализаторе с анионообменной мембраной МА-41 в режиме рецикла. Эффективность разделения компонентов раствора охарактеризована такими параметрами процесса, как потоки кислоты через мембрану, коэффициент разделения, коэффициент задержания соли. Процесс проведен в двух вариантах: при соотношениях объемов отдающего (питающего) и принимающего растворов равного 1:1 (первый вариант) и 2:1 (второй вариант). При диализе изучаемого модельного раствора получены следующие значения коэффициентов разделения соляная кислота/соль железа (III) для первого и второго вариантов соответственно: 27,2 и 19,2. Соотношение объемов отдающего и принимающего растворов, равное 2:1, позволяет получить раствор соляной кислоты заданной концентрации за меньшее время, чем при соотношении объемов отдающего и принимающего растворов, равном 1:1. Преимуществом первого варианта проведения эксперимента является возможность получения более чистого целевого продукта - раствора соляной кислоты (с меньшим содержанием соли железа (III)).
Соляная кислота, хлорид железа (iii), травильный раствор, диффузионный диализ, очистка
Короткий адрес: https://sciup.org/140308566
IDR: 140308566 | УДК: 66.081.62 | DOI: 10.20914/2310-1202-2024-3-217-222
Текст научной статьи Выделение кислоты из отработанного травильного раствора методом диффузионного диализа с анионообменной мембраной
Травление стали в растворах кислоты относится к химическим способам очистки металлов. Такие способы применяются при серийном и массовом производстве изделий из нержавеющих сталей с целью восстановления утраченных под воздействием температуры антикоррозионных свойств. Кроме химической очистки применяются электрохимическое травление, механическая и лазерная обработка [1].
Травление стали проводят обычно в растворах соляной и серной кислот. Преимуществом соляной кислоты по сравнению с серной является высокая скорость травления, небольшая относительно массы удаляемой окалины масса шлама, низкая плотность этого шлама, что облегчает его последующее удаление с поверхности изделия [2].
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
Кроме растворов соляной и серной кислот применяют травильные растворы других составов: раствор хлорида железа, плавиковая кислота – азотная кислота, бихромат калия – серная кислота, соляная кислота – уротропин, сульфат меди – серная кислота – желатин [3].
При травлении стали образуются отходы – отработанные травильные растворы, содержащие свободные кислоты и соли металлов. Тип и концентрация кислот и солей в таких отходах определяются применяемым травильным раствором, который выбирается в зависимости от вида обрабатываемой стали. Объем кислых сточных вод от промывки бунтов до и после операции травления в кислотном растворе, составляет более 3,5 м³ на одну тонну протравленного кислотой горячекатаного проката или проволоки [4].
Отработанный травильный раствор необходимо перерабатывать или утилизировать. Среди методов переработки травильных растворов выделяют ионообменную очистку, нейтрализацию, микробиологическую очистку, выпаривание, кристаллизацию, пирометаллургию, экстракцию и процессы мембранного разделения (диффузионный диализ, электродиализ, мембранную дистилляцию) [5–11].
Процесс ионообменной переработки отработанного травильного раствора состоит из двух этапов. Сначала через слой анионита пропускают отработанный травильный раствор (стадия удерживания кислоты), затем – разбавленный водный раствор кислоты (стадия вытеснения кислоты) [6]. Удерживание кислоты на анионите осуществляется за счет исключения сильно гидратированных ионных пар соли, которые в меньшей степени, чем молекулы или ионные пары кислоты, проникают в нанораз-мерные «поры» гелевого анионита. В работе [6] такой вариант разделения кислоты и соли на сильноосновном анионите АВ-17x8 в сульфатной форме продемонстрирован для реального отработанного травильного раствора промышленного предприятия черной металлургии (состав – более 200 г/дм3 сульфата железа и более 65 г/дм3 серной кислоты).
Пример комбинации метода нейтрализации и мембранного электролиза для конверсии отработанного кислого травильного раствора, образующегося в процессе травления изделий из титана соляной кислотой, описан в работе [7]. Процесс включает в себя нейтрализацию этого раствора щелочью, фильтрацию и сушку осадка гидроксида титана, а также электрохимическую переработку фильтрата, содержащего хлорид натрия, в электролизёре с ионообменными мембранами.
В последние годы проявляется интерес к микробиологической переработке сточных вод, содержащих тяжелые металлы. Обзор материала по этой теме можно найти в работе [8].
При диффузионном диализе с анионообменной мембраной ионы кислого отработанного раствора (питающего раствора) мигрируют через мембрану в приемную камеру, через которую прокачивается дистиллированная вода, под действием градиента концентрации. Фиксированные группы анионообменной мембраны заряжены положительно, в связи с этим анионы могут беспрепятственно мигрировать через мембрану, в то время как большинство катионов (коинов) отторгаются мембраной в силу Доннановского исключения. Однако, при диффузионном диализе миграция катионов через анионообменную мембрану из исходного раствора в принимающий необходима для поддержания электронейтральности растворов. Перенос катионов через анионообменную мембрану происходит в результате их увлечения анионами. Водородные ионы мигрируют через анионообменную мембрану легче, чем другие катионы, из-за небольшого размера, низкого заряда, высокой подвижности, особого механизма переноса в водных растворах. В результате при диффузионном диализе смешанного раствора «соль-кислота» можно получить пермеат, обогащенный кислотой, и ретентат, обогащенный солью.
Варианты применения диффузионного диализа можно найти как для разделения органических кислот/минеральных солей, так и для разделения неорганических кислот/минеральных солей [9–13]. В работе [11] рассмотрена возможность использования различных типов ионообменных мембран в диффузионном диализе для разделения серной кислоты и сульфата никеля. Изучен процесс диализного разделения реального раствора отходов гальванического производства следующего состава: 252,3 г/л серной кислоты, 20,9 г/л ионов никеля, небольшие количества ионов цинка, железа, меди.
Цель работы – оценка возможности выделения кислоты из раствора, содержащего соляную кислоту и соль – хлорид железа (III), методом диффузионного диализа с анионообменной мембраной МА-41 и получение основных характеристик этого процесса.
Материалы и методы
Объект исследования – раствор, моделирующий отработанный травильный раствор, следующего состава: соляная кислота 1,5 моль/дм3, хлорид железа (III) 0,25 моль/дм3. Железо способно к образованию хлоридных комплексов.
В изучаемом растворе большая доля Fе3+ (около 75%) представлена в виде [FеСl 2 ]+. Изучение диффузионного переноса соляной кислоты и соли железа (III) через анионообменную мембрану проводили с применением двухкамерного проточного диализатора (рисунок 1). Исследуемый раствор (питающий раствор, рисунок 1) подавали с помощью перистальтического насоса в режиме рецикла в одну из камер снизу вверх.
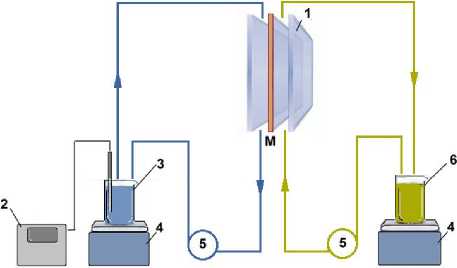
Рисунок 1. Схема установки для реализации периодического диализа: 1 – двухкамерная ячейка с анионообменной мембраной М; 2 – рН-метр; 3 – емкость с приемным раствором; 4 – магнитная мешалка; 5 – перистальтический насос; 6 – емкость с питающим раствором
Figure 1. Installation scheme for the implementation of periodic dialysis: 1 – two-chamber cell with an anion exchange membrane M; 2 – рН meter; 3 – container with a receiving solution; 4 – magnetic stirrer; 5 – peristaltic pump; 6 – container with a feeding solution
Через смежную камеру (приемную) в режиме рецикла подавали противотоком (сверху вниз) дистиллированную воду. Скорость потоков через камеры 20 см3/мин. Толщина камер 1 см. Рабочая площадь мембраны в ячейке 67 см2. С течением времени эксперимента в приемной камере происходило увеличение концентрации диффундирующих веществ. Рассматривали два варианта соотношения объемов отдающего (питающего) и принимающего растворов – 1:1 и 2:1. В первом случае максимально возможная концентрация соляной кислоты, которую теоретически можно получить в приемной камере, составляет 0,75 моль/дм3. Это соответствует степени извлечения кислоты 50%. Для второго варианта возможно получение кислоты более высокой концентрации. Однако в настоящей работе мы ограничились получением пермеата с одинаковой концентрацией по соляной кислоте для первого и второго вариантов.
Расчет критериев эффективности процесса – отношения концентраций Fе3+/Н+ в пермеате (r Fе3+/Н+ ), потоков кислоты (J i , моль·см-2/с), коэффициента задержания соли (R), а также коэффициента разделения (S) – проводили по формулам:
Камеры диализатора разделяла мембрана МА-41 [14]. Это гетерогенная сильноосновная анионообменная мембрана, представляющая собой композицию из полиэтилена и сополимера стирола и дивинилбензола с четвертичными аммониевыми группами. Толщина мембраны 0,046 см. Перед проведением экспериментов мембрану кондиционировали в соответствии с методикой [15], затем переводили в хлоридную ионную форму. После этого мембрану выдерживали в рабочем растворе не менее суток, после чего отмывали водой до отсутствия в промывных водах кислоты и железа.
Контроль изменения концентрации кислоты в пермеате осуществляли в течение эксперимента (метод прямой потенциометрии, измерение рН раствора), в пермеате и ретентате по окончании эксперимента (кислотно-основное титрование). Содержание железа (III) в пермеате и ретентате находили по окончании эксперимента (комплексонометрическое титрование: раствор Трилона Б в присутствии сульфосалициловой кислоты).
Результаты и обсуждение
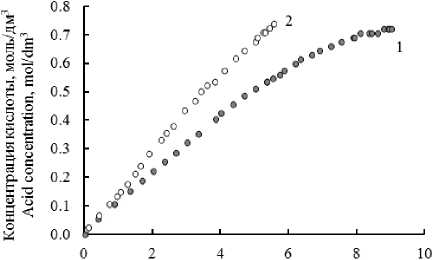
На рисунке 2 приведены кинетические кривые изменения концентрации соляной кислоты в принимающем растворе.
И для первого, и для второго вариантов эксперимента сначала наблюдается линейная зависимость концентрации от времени, затем прирост концентрации кислоты замедляется.
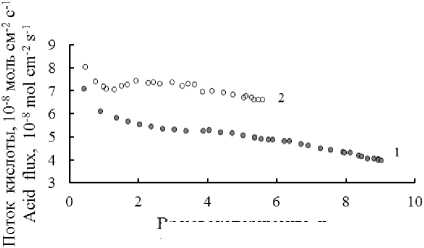
Рисунок 3 показывает изменение потоков кислоты через мембрану. При достижении времени эксперимента 3,5–4 ч наблюдается снижение потоков. Это время соответствует началу отклонения от линейной зависимости функции концентрации от времени (рисунок 1). Данный эффект связан с заметным уменьшением движущей силы процесса (градиента концентраций), что наиболее сильно проявляется для первого варианта эксперимента (для соотношения объемов отдаю-щий/принимающий раствор равного 1:1).
Время эксперимента, ч Experiment duration, h
Рисунок 2. Изменение концентрации соляной кислоты в камере пермеата для соотношения объемов отдающего и принимающего растворов 1:1 (кривая 1) и 2:1 (кривая 2) Figure 2. The change in the concentration of hydrochloric acid in the permeate chamber for different volume ratios of the giving and receiving solutions: 1:1 (curve 1) and 2:1 (curve 2)
Состав растворов до и после эксперимента приведен на рисунке 4. На основе их анализа найдены коэффициенты разделения кислота/соль и коэффициент задержания соли (таблица 1). Раствор кислоты, полученный при отношении объемов отдающего и принимающего растворов равного 1:1, содержит меньшее количество соли железа (III). Однако прирост концентрации кислоты в этом случае идет с меньшей скоростью (рисунок 1).
Время эксперимента, ч Experiment dura lion, h
Рисунок 3. Потоки кислоты через мембрану для соотношения объемов отдающего и принимающего растворов 1:1 (кривая 1) и 2:1 (кривая 2)
Figure 3. Acid fluxes through the membrane for different ratios of volumes of giving and receiving solutions: 1:1 (curve 1) and 2:1 (curve 2)
При соотношении объемов отдающего и принимающего растворов 2:1 можно получить раствор соляной кислоты заданной концентрации за время в 1,5 раз меньшее, чем при одинаковых объемах отдающего и принимающего растворов, но содержание соли железа (III) в этом растворе будет в 1,4 раза больше.
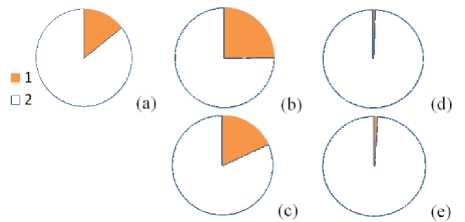
Рисунок 4. Мольное соотношение Fе3+ (1) и НСl (2) в исходном растворе (a), ретентате (b, c) и пермеате (d, e) при отношениях объемов отдающего и принимающего растворов 1:1 (b, d) и 2:1 (c, e) соответственно
Figure 4. Molar ratio of Fе3+ (1) and НСl (2) in the initial solution (a), retentate (b, c) and permeate (d, e) with volume ratios of giving and receiving solutions of 1:1 (b, d) and 2:1 (c, e), respectively
Сравнение полученных характеристик разделения кислоты и соли с характеристиками диализа, найденными для аналогичных систем [9, 16-19] показывает необходимость разработки усовершенствованных анионообменных мембран с более высокими коэффициентами разделения соляная кислота / хлорид железа (III). Это может быть достигнуто как путем изменения структурных свойств мембран, например, модифицированием объема или поверхности образцов, так и созданием более тонких ионообменных мембран, имеющих повышенную диффузионную проницаемость по кислоте. В свое время предприятие «Щекиноазот» выпускало опытную партию тонких гетерогенных ионообменных мембран, в том числе и МА-41 [20]. Привлекательным направлением применения этих мембран может быть именно вариант диализа, рассмотренный в настоящей статье.
Таблица 1.
Характеристики диализного разделения раствора, содержащего соляную кислоту (1,5 моль/дм3), хлорид железа (III) (0,25 моль/дм3) с анионообменной мембраной МА-41
Table 1.
Characteristics of dialysis separation of a solution containing hydrochloric acid (1.5 mol/dm3), iron (III) chloride (0.25 mol/dm3) with an anion exchange membrane MA-41
|
Показатели Раrаmеtеrs |
Отношение объемов отдающий раствор: принимающий раствор Volume ratio giving solution: receiving solution |
|
|
1:1 |
2:1 |
|
|
Отношение концентраций Fе3+/Н+ в пермеате (r Fе 3+ /Н +) Ratio of Fе3+/Н+ concentrations in permeate ( r f е 3 +/Н+) |
0,0061 |
0,0087 |
|
Коэффициент задержания соли, R, % Salt rejection coefficient, R, % |
98,2 |
97,4 |
|
Коэффициент разделения, S | Separation coefficient, S |
27,2 |
19,2 |
Заключение
Реализован диффузионный диализ модельного раствора, содержащего соляную кислоту (1,5 моль/дм3) и хлорид железа (III) (0,25 моль/дм3): режим рецикла, анионообменная мембрана МА-41. Проведена оценка характеристик диализа, позволяющих судить об эффективности процесса выделения кислоты из смешанного раствора (диффузионные потоки кислоты через мембрану, коэффициент задержания соли, коэффициент разделения кислота / соль, содержание соли в пермеате) и их зависимость от соотношения объемов отдающего и принимающего растворов (2:1 или 1:1 соответственно).
Применение отдающего раствора в объеме в два раза большим по сравнению с объемом принимающего раствора позволяет получить заданную концентрацию кислоты в приемной камере за меньшее время. Это связано с тем, что движущая сила процесса диализа (градиент концентраций) в данном случае падает гораздо медленнее. Однако содержание соли железа (III) в пермеате для такого варианта проведения процесса оказывается более высоким.
Дальнейшим развитием настоящего исследования может быть работа с более тонкими модифицированными образцами отечественных ионообменных мембран, которые позволят получить повышенные коэффициенты разделения минеральная кислота/соль.
Список литературы Выделение кислоты из отработанного травильного раствора методом диффузионного диализа с анионообменной мембраной
- Лаврентьев А.Ю., Какорин Д.Д., Дожделев А.М. Выбор способа очистки поверхности наплавленного металла в процессе аддитивного производства металлических изделий // Современные материалы, техника и технологии. 2023. № 3. С. 35-39.
- Михайловский И.А., Мумбаева А.А. Выбор способа удаления окалины с поверхности катанки при производстве углеродистой проволоки // Актуальные проблемы современной науки, техники и образования. 2017. Т. 2. С. 42-44.
- Астраумова В.Г., Пятанова П.А., Ложникова Т.В. Исследование скорости коррозии при химическом травлении стальных корпусов высокочастотных резонаторов // Техника радиосвязи 2023. № 1. С. 98-102.
- Филиппов А.А., Пачурин Г.В., Ребрушкин М.Н., Конюхова Н.С. Снижение комплексного воздействия опасных и вредных факторов в условиях производства стальной проволоки // XXI век. Техносферная безопасность. 2020. № 5(2) С. 222-232. https://doi.org/10.21285/2500-1582-2020-2-222-232
- Zhang C., Zhang W., Wang Y. Diffusion dialysis for acid recovery from acidic waste solutions: Anion exchange membranes and technology integration // Membranes. 2020. V. 10. №. 8. P. https://doi.org/doi:10.3390/membranes10080169
- Крачак А.Н., Груздева А.Н., Хамизов Р.Х., Долгоносов А.А. Переработка отработанного сульфатного травильного раствора методом удерживания кислоты на сильноосновном анионите // Сорбционные и хроматографические процессы. 2022. Т. 22. № 5. С. 684-693. https://doi.org/10.17308/sorpchrom.2022.22/10721
- Быковский Н.А., Кантор Е.А., Малкова М.А., Пучкова Л.Н., Фанакова Н.Н. Сточные воды производства изделий из титана - сырье для получения Ti(OH)4, NaOH и HCl // Экология и промышленность России. 2021. Т. 25. № 2. С. 8-11. https://doi.org/10.18412/1816-0395-2021-2-8-11
- Шипэй В., Лю T., Cяо С., Ло Ш. Достижения в области бактериальной ремедиации для очистки от тяжелых металлов: мини-обзор // Проблемы окружающей среды и природных ресурсов. 2022. № 11. С. 100-122.
- Jiuyang L., Junming H., Jing W., Junwei Y. et al. High-performance porous anion exchange membranes for efficient acid recovery from acidic wastewater by diffusion dialysis // Journal of Membrane Science. 2021. V. 624. P. 119116. https://doi.org/10.1016/j.memsci.2021.119116
- Ruiz-Aguirre A., Lopez J., Gueccia R., Randazzo S. et al. Diffusion dialysis for the treatment of H2 SO4-CuSO4 solutions from electroplating plants: Ions membrane transport characterization and modeling // Separation and Purification Technology. 2021. V. 266. P. 118215. https://doi.org/10.1016/j.seppur.2020.118215
- Loza S., Loza N., Kovalchuk N., Romanyuk N. et al. Comparative study of different ion-exchange membrane types in diffusion dialysis for the separation of sulfuric acid and nickel sulfate // Membranes. 2023. V. 13. №. 4. P. 396. https://doi.org/10.3390/membranes13040396
- Козадерова О.А., Калинина С.А., Моргачева Е.А., Нифталиев С.И. Cорбционные характеристики и диффузионная проницаемость анионообменной мембраны МА41 в растворах молочной кислоты // Сорбционные и хроматографические процессы. 2021. Т. 21. № 3. С. 317-325. https://doi.org/10.17308/sorpchrom.2021.21/3465
- Vasil'eva V., Goleva E., Pismenskaya N., Kozmai A. et al. Effect of surface profiling of a cation-exchange membrane on the phenylalanine and NaCl separation performances in diffusion dialysis // Separation and Purification Technology. 2019. V. 210. P. 48-59. https://doi.org/10.1016/j.seppur.2018.07.065
- ООО ИП «Щекиноазот». URL: http://azotom.ru/monopolyarnye-membrany
- Кононенко Н.А., Демина О.А., Лоза Н.А., Фалина И.В. и др. Мембранная электрохимия. Краснодар: Кубанский гос. ун-т, 2017. 290 с.
- Culcasi A., Gueccia R., Randazzo S., Cipollina A. et al. Design of a novel membrane-integrated waste acid recovery process from pickling solution // Journal of Cleaner Production. 2019. V. 236. P. 117623. https://doi.org/10.1016/j.jclepro.2019.117623
- Pal S., Mondal R., Guha S., Chatterjee U., Jewrajka S.K. Crosslinked terpolymer anion exchange membranes for selective ion separation and acid recovery // Journal of Membrane Science. 2020. V. 612. P. 118459. https://doi.org/10.1016/j.memsci.2020.118459
- Gueccia R., Randazzo S., Chillura Martino D., Cipollina A., Micale G. Experimental investigation and modeling of diffusion dialysis for HCl recovery from waste pickling solution // Journal of Environmental Management. 2019. V. 235. P. 202-212. https://doi.org/10.1016/j.jenvman.2019.01.028
- Irfan M., Bakangura E., Afsar N. Ul, Xu T. Augmenting acid recovery from different systems by novel Q-DAN anion exchange membranes via diffusion dialysis // Separation and Purification Technology. 2018. V. 201. P. 336-345. https://doi.org/10.1016/j.seppur.2018.02.042
- Гаршина Т.И., Козадёрова О.А., Шапошник В.А. физико-химические характеристики тонких ионообменных мембран // Сорбционные и хроматографические процессы. 2007. Т. 7. № 1. С. 148-151.


