Выделение, культивирование и характеристика примордиальных зародышевых клеток перепелов
Автор: Волкова Н.А., Багиров В.А., Томгорова Е.К., Ветох А.Н., Волкова Л.А., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Молекулярные и клеточные технологии
Статья в выпуске: 2 т.52, 2017 года.
Бесплатный доступ
Использование примордиальных зародышевых клеток (ПЗК) птицы для получения химерных и трансгенных особей рассматривается как альтернатива традиционным методам селекции и трансгенеза. Такой подход предусматривает введение донорских примордиальных зародышевых клеток в дорсальную аорту эмбрионов-реципиентов в период миграции этого типа клеток из крови в гонады. В случае колонизации донорскими ПЗК гонад эмбрионов-реципиентов возможна дальнейшая дифференцировка донорских клеток до зрелых половых клеток (как мужских, так и женских). При этом ключевой фактор, определяющий эффективность проводимых манипуляций, - использование чистой популяции зародышевых клеток. В этой связи остается актуальной разработка способов выделения и поддержания в культуре ПЗК - предшественников половых клеток. Целью наших исследований была оптимизация приемов получения и культивированию примордиальных зародышевых клеток перепелов ( Coturnix coturnix ). ПЗК выделяли из 5-6-суточных эмбрионов, применяя два методических подхода - механическую диссоциацию и ферментативную обработку. Механическую диссоциацию клеток проводили посредством измельчения эмбрионов с помощью пипетирования в среде DMEM в течение 5 мин. При ферментативной обработке эмбрионов в качестве протеолитического фермента использовали раствор трипсина (0,05; 0,10; 0,15 и 0,25 %). Для повышения доли ПЗК в получаемой суспензии эмбриональных клеток их разные типы разделяли по способности к адгезии. Морфологическую оценку свежевыделенной популяции эмбриональных клеток проводили визуально под фазово-контрастным микроскопом («Nikon», Япония). Для идентификации ПЗК в культуре применяли гистохимическое и иммуногистохимическое окрашивание. Установлено, что ферментативная обработка 0,05 % трипсином служит эффективным методом дезагрегации эмбрионов с сохранением жизнеспособности значительной доли (94 %) клеток. Разделение клеток разных типов с учетом их способности к адгезии позволило получать культуру ПЗК, максимально очищенную от других типов клеток. Единичные эмбриональные фибробласты, оставшиеся в клеточной суспензии ПЗК после отделения других клеток, при последующем культивировании служили фидерным слоем, на который прикреплялись ПЗК. Первичные собственные эмбриональные фибробласты оказались оптимальным фидерным слоем для краткосрочного культивирования ПЗК по сравнению с клетками ïåðåâèâàåìûõ ýìáðèîíàëüíûõ ôèáðîáëàñòîâ ìûøè ëèíèè STO и культивируемыми эмбриональными фибробластами. При использовании ростовой среды на основе DМЕМ с высоким содержанием глюкозы (4,5 г/л), дополненной фетальной сывороткой крови крупного рогатого скота (20 %), глутамином (2 мМ), 2-меркаптоэтанолом (10-6 мМ), LIF (leukemia inhibitory factor, 2 нг/мл), незаменимыми аминокислотами (MEM, 10 мM), антибиотиком гентамицином (50 мкг/мл), прикрепление ПЗК к фидерному слою наблюдали на 1-2-е сут культивирования с формированием колоний на 3-и-4-е сут. Наличие колоний ПЗК было подтверждено иммуногистохимически с помощью специфических первых антител к SSEA-1 (stage-specific embryonic antigen-1).
Примордиальные зародышевые клетки, перепела, эмбрионы
Короткий адрес: https://sciup.org/142214023
IDR: 142214023 | УДК: 639.122:591.39:57.086.83 | DOI: 10.15389/agrobiology.2017.2.261rus
Текст научной статьи Выделение, культивирование и характеристика примордиальных зародышевых клеток перепелов
Получение трансгенных и химерных особей с участием примордиальных зародышевых клеток (ПЗК) признано одним из перспективных направлений современной биотехнологии, которые обсуждаются как альтернатива традиционным методам селекции и модификации генома (1-5). Использование этого типа клеток в селекционных и биотехнологических программах открывает широкие возможности для направленного изменения генома и воссоздания ценных пород и линий, сохраняемых в условиях криобанков (6-12). Особенности биологии сельскохозяйственной птицы позволяют рассматривать ПЗК в качестве перспективного генетического материала. Развитие эмбрионов птиц вне организма самки значительно облегчает манипуляции, связанные с выделением ПЗК из эмбрионов-доно-
Работа выполнена при финансовой поддержке гранта РНФ ¹ 16-16-04104. При проведении исследований использовано оборудование ЦКП «Биоресурсы и биоинженерия сельскохозяйственных животных» ВИЖ им. академика Л.К. Эрнста.
ров и их трансплантацией в эмбрионы-реципиенты.
Примордиальные зародышевые клетки — это предшественники половых клеток. Они обладают свойством плюриопотентности, то есть в процессе эмбриогенеза могут дифференцироваться как в мужские, так и женские половые клетки, что значительно расширяет возможности реализации их потенциала при создании трансгенных и химерных особей с заданными свойствами. Технология получения таких особей предусматривает трансплантацию донорских клеток в гонады эмбрионов-реципиентов (13, 14). В последующем эти особи могут быть использованы как «биореакторы», которые продуцируют в половых органах зрелые донорские клетки (спермии, яйцеклетки), служащие генетическим материалом для получения потомков с заданными свойствами. При воссоздании пород и линий сельскохозяйственной птицы использование такого подхода более предпочтительно по сравнению с применением замороженно-оттаянных спермиев, поскольку дает возможность поддерживать генофондные стада за счет мужского и женского генетического материала.
Один из ключевых факторов, обеспечивающих результативность описанной технологии, — получение культуры ПЗК, максимально очищенной от других типов эмбриональных клеток. Значительная часть исследований, проводимых в этом направлении, выполнена на курах (15-20). Актуальным представляется выделение и характеристика ПЗК других видов сельскохозяйственной птицы.
В настоящем исследовании мы выделили ПЗК перепелов и дали их характеристику. Впервые было показано, что высокую чистоту культуры ПЗК перепелов обеспечивает предварительное удаление других типов клеток, в частности самой многочисленной популяции эмбриональных фибробластов. Оставшиеся в клеточной суспензии единичные фибробласты образуют фидерный слой, который обладает оптимальными свойствами для культивирования ПЗК по сравнению с другими типами фидерных слоев.
Цель работы заключалась в оптимизации приемов выделения и культивирования примордиальных зародышевых клеток перепелов в процессе поэтапной разработки технологии получения особей с заданными свойствами.
Методика. Примордиальные зародышевые клетки выделяли из 5-суточных эмбрионов перепелов ( Coturnix coturnix ) эстонской породы. Для дезагрегации эмбрионов применяли два методических подхода — механическую диссоциацию клеток и ферментативную обработку ткани.
Механическую диссоциацию клеток проводили посредством измельчения эмбрионов и последующего пипетирования в среде DМЕМ (Dulbecco’s Modified Eagle’s Medium) в течение 5 мин.
При ферментативной обработке эмбрионов в качестве протеолитического фермента использовали раствор трипсина (0,05; 0,10; 0,15 и 0,25 %). Эмбрионы перепелов переносили в физиологический раствор, дополненный антибиотиком-антимикотиком, и измельчали. Полученную суспензию клеток центрифугировали 5 мин при 200 g. К осадку добавляли подогретую до 37 ° С среду DMEM, пипетировали и для осаждения клеток центифуги-ровали. Супернатант сливали, к осадку добавляли раствор трипсина, прогретый до 37 ° С, и интенсивно пипетировали клетки в течение 5-10 мин.
Для повышения доли ПЗК в получаемой суспензии разные типы клеток разделяли по их способности к адгезии. Была поставлена серия экспериментов (в 3 повторах) с краткосрочным культивированием клеток. ПЗК идентифицировали посредством окраски на щелочную фосфатазу. На основании полученных результатов рассчитывали долю окрашен-262
ных клеток от общего числа исследованных.
В качестве ростовой среды для культивирования ПЗК использовали DMEM HG («Invitrogen», США) с содержанием глюкозы 4,5 г/л, дополненной фетальной сывороткой крови крупного рогатого скота (20 %), глутамином (2 мМ), 2-меркаптоэтанолом (10-6 мМ), LIF (leukemia inhibitory factor, 2 нг/мл), незаменимыми аминокислотами (MEM, Minimum Essential Medium, 10 мM), антибиотиком гентамицином (50 мкг/мл). Клетки снимали с субстрата с помощью 0,25 % раствора трипсина.
Для приготовления фидерных слоев клетки после достижения 90 % монослоя обрабатывали раствором митомицина С («Sigma», США) в конечной концентрации 30 мкг/мл в течение 3 ч, после чего трижды промывали раствором Хэнкса («ПанЭко», Россия) и использовали для культивирования ПЗК.
Морфологическую оценку свежевыделенной популяции эмбриональных клеток перепелов проводили визуально под фазово-контрастным микроскопом («Nikon», Япония).
Для идентификации ПЗК в культуре применяли гистохимическое и иммуногистохимическое окрашивание. Клетки фиксировали охлажденным до - 20 ° С метанолом в течение 10 мин. Иммуногистохимическое исследование проводили с авидин-биотиновой системой («Vector Laboratories», США) (21). В качестве первых антител использовали анти-SSEA-1 (stagespecific embryonic antigen-1). Комплекс антиген-антитело идентифицировали с помощью пероксидазы, выявляемой 3,3-диаминобензидин-тетрахло-ратом (ДАБ) («Vector Laboratories», США). Для окрашивания на щелочную фосфатазу применяли кит BCIP/NBT на основе 5-бром-4-хлор-3-ин-долилфосфата и нитросинего тетразолия («Vector Laboratories», США).
Результаты. После механической диссоциации эмбрионов перепелов в образце наблюдали как отдельные разобщенные клетки, так и их группы (рис. 1, А). В результате ферментативной обработки (см. рис. 1, Б) получили клеточную суспензию, состоящую преимущественно из обособленных клеток. Клеточные агрегаты практически отсутствовали. Единичные группы клеток были выявлены только при использовании трипсина в низкой концентрации (0,05 и 0,10 %). Их доля не превышала 0,2 %.
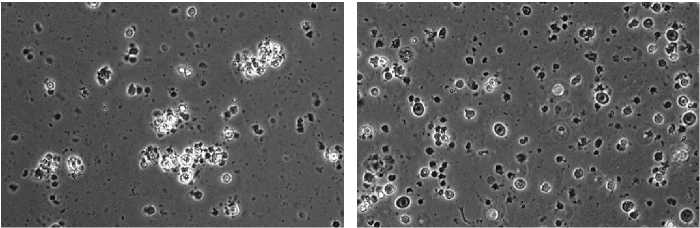
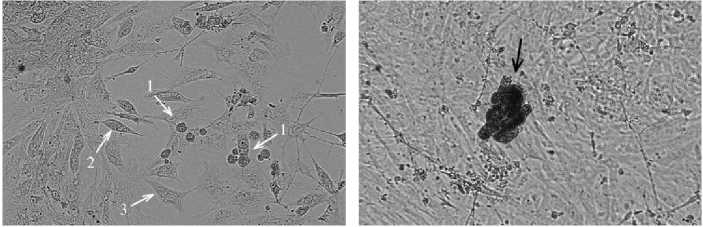
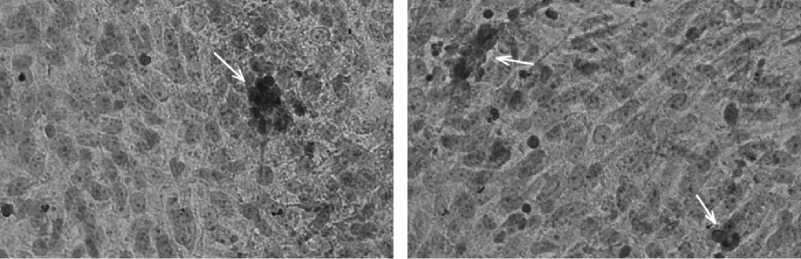
Рис. 1. Примордиальные зародышевые клетки (ПЗК), полученные из эмбрионов перепелов ( Coturnix coturnix ) эстонской породы, при разных способах диссоциации: А — суспензия эмбриональных клеток после механической обработки эмбрионов, видны небольшие конгломераты клеток (нативный препарат); Б — суспензия эмбриональных клеток при ферментативной обработке, видны обособленные клетки (нативный препарат); В — 2-суточная культура, видны ПЗК (1), фибробласты (2), эпителиоподобные клетки (3) (нативный препарат); Г — 6-суточная культура, гистохимическое окрашивание на наличие щелочной фосфатазы, стрелкой отмечена окрашенная колония ПЗК; Д — 4-суточная культура, иммуногистохимическое окрашивание на экспрессию SSEA-1 (stage-specific embryonic antigen-1), стрелкой отмечена окрашенная колония ПЗК; Е — 4-суточная культура, отсутствие специфического иммуногистохимического окрашивания на экспрессию SSEA-1 в контроле (без использования анти-SSEA-1), стрелкой отмечена колония ПЗК. Фазово-контрастная (А-Б) и световая (В-Е) микроскопия («Nikon», Япония), увеличение ½400.
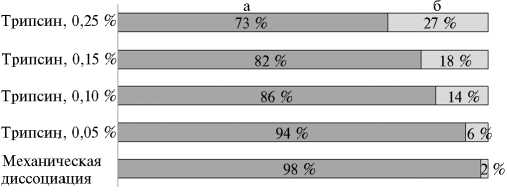
Рис. 2. Доля живых (а) и мертвых (б) примордиальных зародышевых клеток перепелов ( Coturnix coturnix ) эстонской породы, полученных из эмбрионов при механической диссоциации и трипсинизации.
Однако выход живых клеток оказался на 4-25 % (в зависимости от концентрации раствора трипсина) меньше, чем при механической диссоциации, что было связано с токсическим действием фермента на клетки (рис. 2).
Таким образом, в варианте с применением трипсини-зации максимального выхода живых клеток (94 %) удалось добиться при использовании минимальной
протестированной концентрации этого фермента (0,05 %), что позволяет рассматривать ее как оптимальную для получения обособленных эмбриональных клеток перепелов при сохранении высокой жизнеспособности клеточной суспензии.
Суспензию эмбриональных клеток, полученную в результате ферментативной обработки эмбрионов перепелов, высевали на культуральные чашки. В начале культивирования (1 ч) происходило прикрепление к пластику значительной части эмбриональных фибробластов. Через 24 ч эти клетки распластывались и начинали делиться. Основная часть ПЗК, которые имели вид округлых образований, находилась во взвешенном состоянии, и только некоторые прикреплялись к распластавшимся эмбриональным фибробластам, используя их в качестве фидерного слоя. На 1-е сут (см. рис., В) ПЗК прикреплялись к фидерному слою и приобретали шарообразную форму.
В полученной клеточной популяции было выявлено несколько типов клеток. Многочисленную группу составляли эмбриональные фибробласты, эпителиоподобные клетки и ПЗК. ПЗК характеризовались округ- лой формой, эпителиоподобные клетки имели неправильную форму и крупное ядро, фибробласты — веретенообразную форму (см. рис., В).
Для максимальной очистки популяции ПЗК использовали метод, основанный на неодинаковых адгезивных способностях разных типов клеток. Первичную культуру эмбриональных клеток перепелов культивировали в течение 1 ч, после чего отбирали супернатант с неприкрепивши-мися клетками, переносили в новые чашки Петри и продолжали культивирование. Эмбриональные фибробласты, присутствовавшие в суспензии после сбора культуральной среды, служили фидерным слоем, на который прикреплялись ПЗК. Через 1 ч вновь отбирали супернанант для дальнейшего культивирования. После 3-кратного отбора супернатанта долю ПЗК в суспензии удалось повысить до 79 %.
Выделенные ПЗК перепелов высевали на фидерные слои, которыми служили клетки линии STO (перевиваемые эмбриональные фибробласты мыши ), первичные эмбриональные фибробласты перепелов, эмбриональные фибробласты кур, или на чашки, покрытые 0,2 % желатином. Наилучшие результаты были получены при использовании первичных эмбриональных фибробластов перепелов (табл.).
|
Эффективность культивирования примордиальных зародышевых клеток (ПКЗ) перепелов ( Coturnix coturnix ) в зависимости от фидерного слоя |
||
|
Фидерный слой |
Прикрепление к фидерному слою |
Образование колоний |
|
Клеточная линия STO |
На 1-2-е сут |
На 4-5-е сут |
|
Эмбриональные фибробласты кур |
На 1-2-е сут |
На 4-е сут |
|
Первичные эмбриональные фибробласты перепелов |
На 1-2-е сут |
На 3-и сут |
|
П р и м еч а ни е. STO — клеточная линия перевиваемых эмбриональных фибробластов мыши. |
||
На 3-и-4-е сут в культуре формировались колонии ПЗК, наличие которых было подтверждено экспрессией в этих клетках маркеров стволовых клеток — щелочной фосфатазы (см. рис., Г) и белка SSEA-1 (см. рис., Д, Е).
Итак, у перепелов эффективность получения максимально однородной культуры первичных зародышевых клеток (ПЗК) зависит от метода их отделения от других клеток и используемого фидерного слоя. Разделение клеток по способности к адгезии позволяет максимально очистить культуру ПЗК от остальных клеток, в частности от эмбриональных фибробластов. Единичные эмбриональные фибробласты, оставшиеся после этого в клеточной суспензии, при последующем культивировании служат фидерным слоем, на который прикрепляются ПЗК. Культивирование ПЗК на фидерных слоях с использованием соответствующей ростовой среды позволяет получать колонии ПЗК на 3-и-4-е сут. Оптимальный фидерный слой для культивирования ПЗК перепелов формируется из собственных эмбриональных фибробластов.
Список литературы Выделение, культивирование и характеристика примордиальных зародышевых клеток перепелов
- Petitte J.N., Karagenc L., Ginsburg M. The origin of the avian germ line and transgenesis in birds. Poultry Sci., 1997, 76: 1084-1092 ( ) DOI: 10.1093/ps/76.8.1084
- Ginsburg M. Primordial germ cell development in avians. Poultry Sci., 1997, 76: 91-95 ( ) DOI: 10.1093/ps/76.1.91
- Naito M., Tajima A., Tagami T., Yasuda Y., Kuwana T. Preservation of chick primordial germ cells in liquid nitrogen and subsequent production of viable offspring. Journal of Reproduction and Fertility, 1994, 102: 321-325 ( ) DOI: 10.1530/jrf.0.1020321
- Naito M., Harumi T., Kuwana T. Long term in vitro culture of chicken primordial germ cells isolated from embryonic blood and incorporation into germline of recipient embryo. J. Poult. Sci., 2010, 47: 57-64 ( ) DOI: 10.2141/jpsa.009058
- Nakamura Y., Usui F., Miyahara D., Mori T., Ono T., Takeda K., Nirasawa K., Kagami H., Tagami T. Efficient system for preservation and regeneration of genetic resources in chicken: concurrent storage of primordial germ cells and live animals from early embryos of a rare indigenous fowl (Gifujidori). Reprod. Fert. Develop., 2010, 22: 1237-1246 ( ) DOI: 10.1071/RD10056
- Kuwana T., Kawashima T., Naito M., Yamashita H., Matsuzaki M., Takano T. Conservation of a threatened indigenous fowl (Kureko dori) using the germline chimeras transplanted from primordial germ cells. J. Poult. Sci., 2006, 43: 60-66 ( ) DOI: 10.2141/jpsa.43.60
- Park T.S., Hong Y.H., Kwon S.C., Lim J.M., Han J.Y. Birth of germline chimeras by transfer of chicken embryonic germ (EG) cells into recipient embryos. Mol. Reprod. Dev., 2003, 65: 389-395 ( ) DOI: 10.1002/mrd.10304
- Chojnacka-Puchta L., Kasperczyk K., Płucienniczak G., Sawicka D., Bednarczyk M. Primordial germ cells (PGCs) as a tool for creating transgenic chickens. Pol. J. Vet. Sci., 2012, 15(1): 181-188 ( ) DOI: 10.2478/v10181-011-0132-6
- Hong Y.H., Moon Y.K., Jeong D.K., Han J.Y. Improved transfection efficiency of chicken gonadal primordial germ cells for the production of transgenic poultry. Transgenic Res., 1998, 7(4): 247-252 ( ) DOI: 10.1023/A:1008861826681
- Han J.Y. Germ cells and transgenesis in chickens. Comparative Immunology, Microbiology and Infectious Diseases, 2009, 32: 61-80 ( ) DOI: 10.1016/j.cimid.2007.11.010
- Tyack S.G., Jenkins K.A., O’Neil T.E., Wise T.G., Morris K.R., Bruce M.P., McLeod S., Wade A.J., McKay J., Moore R.J., Schat K.A., Lowenthal J.W., Doran T.J. A new method for producing transgenic birds via direct in vivo transfection of primordial germ cells. Transgenic Res., 2013, 22(6): 1257-1264 ( ) DOI: 10.1007/s11248-013-9727-2
- D’Costa S., Pardue S.L., Petitte J.N. Comparative development of avian primordial germ cells and production of germ line chimeras. Avian Poult. Biol. Rev., 2001, 12(4): 151-168 ( ) DOI: 10.3184/147020601783698477
- Kang S.J., Choi J.W., Kim S.Y., Park K.J., Kim T.M., Lee Y.M., Kim H., Lim J.M., Han J.Y. Reproduction of wild birds via interspecies germ cell transplantation. Biol. Reprod., 2008, 79(5): 931-937 ( ) DOI: 10.1095/biolreprod.108.069989
- Wernery U., Liu C., Baskar V., Guerineche Z., Khazanehdari K.A., Saleem S., Kinne J., Wernery R., Griffin D.K., Chang I.K. Primordial germ cell-mediated chimera technology produces viable pure-line Houbara bustard offspring: potential for repopulating an endangered species. PLoS ONE, 2010, 5: e15824 ( ) DOI: 10.1371/journal.pone.0015824
- Yamamoto Y., Usui F., Nakamura Y., Ito Y., Tagami T., Nirasawa K., Matsubara Y., Ono T., Kagami H. A novel method to isolate primordial germ cells and its use for the generation of germlinechimeras in chicken. Biol. Reprod., 2007, 77(1): 115-119 ( ) DOI: 10.1095/biolreprod.107.061200
- Mozdziak P.E., Angerman-Stewart J., Rushton B., Pardue S.L., Petitte J.N. Isolation of chicken primordial germ cells using fluorescence-activated cell sorting. Poultry Sci., 2005, 84: 594-600 ( ) DOI: 10.1093/ps/84.4.594
- Oishi I. Improvement of transfection efficiency in cultured chicken primordial germ cells by percoll density gradient centrifugation. Biosci. Biotech. Bioch., 2010, 74(12): 2426-2430 ( ) DOI: 10.1271/bbb.100464
- van de Lavoir M.C., Diamond J.H., Leighton P.A., Mather-Love C., Heyer B.S., Bradshaw R., Kerchner A., Hooi L.T., Gessaro T.M., Swanberg S.E., Delany M.E., Etches R.J. Germline transmission of genetically modified primordial germ cells. Nature, 2006, 44: 766-769 ( ) DOI: 10.1038/nature04831
- Macdonald J., Glover J.D., Taylor L., Sang H.M., McGrew M.J. Characterisation and germline transmission of cultured avian primordial germ cells. PLoS One, 2010, 5: e15518 ( ) DOI: 10.1371/journal.pone.0015518
- Томгорова Е.К., Волкова Н.А., Волкова Л.А., Фисинин В.И., Зиновьева Н.А. Выделение и характеристика примордиальных зародышевых клеток кур. Сельскохозяйственная биология, 2012, 6: 61-65 ( ) DOI: 10.15389/agrobiology.2012.6.61rus
- Микроскопическая техника/Под ред. Д.С. Саркизова, Ю.П. Перова. М., 1996.


